Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Nutrición Hospitalaria
versión On-line ISSN 1699-5198versión impresa ISSN 0212-1611
Nutr. Hosp. vol.26 no.5 Madrid sep./oct. 2011
Efecto del consumo de la fibra dietética en la expresión cuantitativa del receptor de butirato GPR43 en colon de ratas
Effect of dietary fiber in the quantitative expression of butyrate receptor GPR43 in rats colon
L. Y. Corte Osorio1, H. E. Martínez Flores2 y R. Ortiz Alvarado2
1Estudiante del Programa Institucional de Maestría en Ciencias Biológicas. Universidad Michoacana de San Nicolás de Hidalgo.
2Facultad de Químico Farmacobiología. Universidad Michoacana de San Nicolás de Hidalgo. México.
Dirección para correspondencia
RESUMEN
Introducción: Los ácidos grasos de cadena corta (AGCC) acetato, propionato y butirato, son productos de fermentación de la fibra dietética (FD) en el intestino grueso. Recientemente, el butirato ha sido estudiado ya que es considerado indispensable para el mantenimiento de las funciones del colon y por su relación con la protección del cáncer colorrectal. Esto se atribuye a la capacidad de butirato de regular la expresión génica por mecanismos como la inhibición de la enzima histona deacetilasa. Se ha reportado que el receptor de AGCC, GPR43 está involucrado en el proceso de transducción de señales intracelulares una vez que se unen a ligandos como butirato para generar los efectos fisiológicos del butirato en los colonocitos.
Objetivo: Determinar si el consumo de FD de nopal (Opuntia ficus I) tiene influencia directa sobre la expresión cuantitativa del receptor específico de butirato GPR43.
Métodos: Ratas adultas Wistar se sometieron a cuatro diferentes dietas variando el contenido de FD en 0, 5, 15 y 25% de FD denopal, respectivamente.
Resultados y discusión: Los resultados mostraron un aumento significativo de la expresión relativa de GPR43 (93,1%) cuando se suministró a las ratas una dieta conteniendo 5% de FD de nopal, usando como gen de referencia β-actina. Los resultados de esta investigación aportarán nuevos datos a los estudios que determinan la relación de la dieta con la salud intestinal, con el fin de ampliar el conocimiento sobre los efectos del ácido butírico en las funciones colónicas.
Palabras clave: Fibra dietética. Butirato. Expresión del gen. GPR43.
ABSTRACT
Introduction: Short chain fatty acids (SCFA) acetate, propionate and butyrate are the major anions produced by the bacterial fermentation of dietary fiber (DF) in colon. Recently, butyrate has been recently studied because is important to maintain colonic functions and because it has been related with a protective effect in colorectal cancer, which is mainly, explained by its potential to regulate gene expression by inhibiting enzyme histonedeacetylase (HDAC). Several investigationsshown that SCFAreceptor GPR43 is involved insignal transduction mechanisms once they bind to ligands such as butyrate to generate different physiological effects in colonocytes.
Objective: Determine if dietary fiber consumption from nopal (Opuntia ficus I.) containing a ratio of soluble-insoluble fiber 40/60, has a direct influence on the quantitative expression of butyrate-specific receptor GPR43.
Methods: Wistar rats were fed with four different diets formulated at different concentrations of dietary fiber of 0, 5, 15 and 25% of dietary fiber from opuntia, respectively.
Results and discussion: The results shown an increase in the expression of GPR43 (93.1%) when rats was fed with a 5% fiber diet, using β-actin as a reference gene. The results of this investigation will contribute to determinate the relation of diet with intestinal health for the purpose of expanding the knowledge of butyric acid on colonic functions.
Key words: Dietary fiber. Butyrate. Gene expression. GPR43.
Introducción
En la última década, se le ha dado una importancia mayor al consumo de FD debido a que la población actual enfrenta un riesgo creciente de padecer enfermedades relacionadas con una alimentación deficiente, tales como diabetes, cáncer de colon, hipertensión, y otros desórdenes metabólicos. Los estudios relacionados con este tema afirman que la FD juega un papel preventivo y terapéutico importante contra estos padecimientos1,2,3.
Los mecanismos en que la FD aporta efectos benéficos a los individuos que la incluyen en su dieta se deben a sus propiedades fisicoquímicas de las cuales destacan las siguientes: capacidad de retención de agua y aceite, viscosidad y formación de geles, adsorción de macronutrientes y toxinas, tamaño de partícula, interacciones iónicas y fermentabilidad4.
Entre los anteriores, la fermentabilidad de la FD es uno de los factores más importantes, ya que se sabe también que los AGCC, resultantes de la fermentación de los carbohidratos indigeribles, son la principal fuente de energía de los colonocitos5, tienen influencia en el flujo sanguíneo del colon6, regulan la motilidad intestinal7, promueven el intercambio de iones como el bicarbonato y el calcio8 y desempeñan un papel de prevención, protección y tratamiento contra el cáncer de colon9.
Butirato
El butirato, producto final de la fermentación colónica, es una molécula altamente energética que es rápidamente absorbible y metabolizable. Roediger10 documentó que más del 70% del oxígeno consumido por los colonocitos del colon ascendente y descendente se produjo por la oxidación del butirato. Además, el butirato influye en diversas funciones celulares, se conoce su potencial anticarcinogénico dada su habilidad de influenciar la expresión de genes, la cual se atribuye a la inhibición de la enzima histona deacetilasa (HDAC)11. El butirato ejerce también efectos antiinflamatorios enel intestino debido a la supresión del factor nuclear Kappa B que regula la expresión de genes que codifican para citocinas proinflamatorias, así como quimiocinas y prostaglandinas12. Hay algunas evidencias de que el butirato modula el estrés oxidativo. En dos estudios, la preincubación de colonocitos de rata13 y de humano14 con butirato mostró una significativa reducción de daño al DNA inducido por peróxido de hidrógeno. Se ha mostrado que el butirato afecta positivamente varios componentes de la barrera de defensa colónica, resultando en una protección mejorada contra antígenos luminales. Un componente importante de esta barrera es la capa de moco que cubre el epitelio consistiendo principalmente de glicoproteínas de mucina. El gen MUC2, agente protector, es el que se expresa predominantemente en el colon y en diferentes estudios se ha probado que el butirato aumenta su expresión15. Por otra parte, la permeabilidad celular es un parámetro importante de la barrera de defensa intestinal. En un estudio16 se demostró que a concentración de 2 mM de butirato se induce un decremento en la permeabilidad de las líneas celulares Caco-2 y HT29 mientras que concentraciones de 8 mM incrementaron la permeabilidad de las células.
GPR43
Se considera que los efectos de los AGCC en el lumen intestinal son inducidos por la activación de receptores específicos en células epiteliales, pero los mecanismos por los cuales los AGCC intraluminales son detectados no se han reportado todavía. Diversos investigadores17,18 reportaron simultáneamente que los receptores de AGCC fueron identificados como receptores acoplados a proteínas G, específicamente GPR41 y GPR43. También se reportó que ambos receptores están acoplados con Gq y Gi/o, y su activación induce un incremento en la concentración de calcio intracelular y una disminución de adenosin monofosfato cíclico (cAMP) intracelular. GPR41 inicia su señalización principalmente acoplado a proteínas Gi/o y GPR43 está acoplado principalmente a proteínas Gq.
Como se mencionó, los AGCC son producidos por la fermentación de la FD en el lumen colónico. Por lo tanto, la presencia de FD en el lumen refleja la actividad de la flora bacteriana y los receptores de AGCC posiblemente monitorean las bacterias para defensa del huésped. De hecho, se ha reportado la expresión de GPR41 y GPR43 en células del sistema inmune, incluyendo células polimorfonucleares (GPR41 y GPR43), monocitos (GPR43), células dendríticas (GPR41)18 y mastocitos (GPR43)19. De éstas, las células polimorfonucleares, los monocitos y las células dendríticas son los fagocitos para antígenos no selectivos del sistema inmune innato.
Existe sin duda una gran variedad de alimentos ricos en FD, sin embargo, este estudio pone especial interés en el nopal (Opuntiaficus-indica) como fuente de FD en la alimentación de roedores de laboratorio (ratas Wistar). Se pensó en incluir al nopal por ser una especie endémica de México20 y por su contenido de FD tanto soluble como insoluble en una proporción de 40% soluble ± 60% insoluble. El contenido de fibra del nopal consta principalmente de lignina, celulosa, hemicelulosa, pectina y mucílagos.
Este estudio tuvo como objetivo evaluar la expresión cuantitativa del gen receptor a butirato en colonocitos de rata, después de que ratas de laboratorio fueran alimentadas con dietas conteniendo diferentes concentraciones de fibra fermentable.
Métodos
Caracterización de la fuente de fibra dietética
Se utilizó como fuente de FD en las dietas polvo de nopal secado al sol, por considerarse un alimento con la proporción adecuada de fibra soluble. Se realizo la determinación fibra dietética soluble, insoluble y total por el método de Prosky et al.21.
Distribución de los animales de experimentación
Para el experimento se utilizaron ratas de 8 semanas de nacidas y un peso aproximado de 196 g. Los grupos de ratas fueron asignados al azar para cada una de las dietas experimentales, seleccionándose al final del experimento 6 individuos por grupo. Los animales se mantuvieron en condiciones controladas de 12 h de luz artificial durante el día y 12 h de oscuridad por la noche, ambiente aislado de ruidos y alimento y agua suministrados ad libitum.
Formulación de las dietas
Con base en el contenido de FD de la muestra, se elaboraron las dietas experimentales conteniendo nopal como fuente de fibra, además de una dieta control: 1. Dieta sin fibra (Dieta 0, control); 2. Dieta con 5% de fibra dietética (Dieta A) 3. Dieta con 15% de fibra dietética (Dieta B); 4. Dieta con 25% de fibra dietética (Dieta C). Las dietas se elaboraron siguiendo las recomendaciones de la fórmula para roedores experimentales del American Institute of Nutrition, AIN-9322, en relación al contenido de proteínas, grasas, vitaminas y minerales. Las Dietas se muestran en la tabla I.
Disección de intestino grueso
Los animales se sacrificaron después de 16 días de tratamiento dietético con una administración de pentobarbital sódico a una concentración de 0,065 mg/ml y una dosis de 0,06 mg/g de peso, se disecó una parte del saco colónico, los tejidos se homogeneizaron en 800 ml de trizol y se almacenaron las muestras a -20 oC hasta su uso.
Extracción de RNA
La extracción de RNA de intestino se realizó utilizando el reactivo Trizol (Ácido Guanidínico Tiocianato-fenol-cloroformo de Gibco-BRL) de INVITROGEN siguiendo el método de Chomczynski y Sacchi23. La concentración de RNA se determinó espectrofotométricamente a 260 nm.
RT-PCR
A partir de RNAm obtenido de las muestras de colon de los animales de experimentación, se obtuvo el cDNA correspondiente al receptor GPR43, para su posterior tratamiento y amplificación específica. Los ensayos de RT-PCR se realizaron a 50 oC. Para llevar a cabo la retrotranscripción por 10 min, 95 oC para activar la polimerasa por 5 min, seguido por 40 ciclos que comenzaron a 90 oC para la desnaturalización por 50 seg, 61,5 oC para la alineación por 1 min y 71 oC para la extensión por 1 min. Finalizados los ciclos se dejó una última etapa de extensión a 72 oC por 8,5 min y al terminarlas muestras permanecieron a 4 oC.
Esta amplificación se usó como control, para verificar la expresión tejido especifico del RNAm GPR43.
RT-PCR cuantitativa
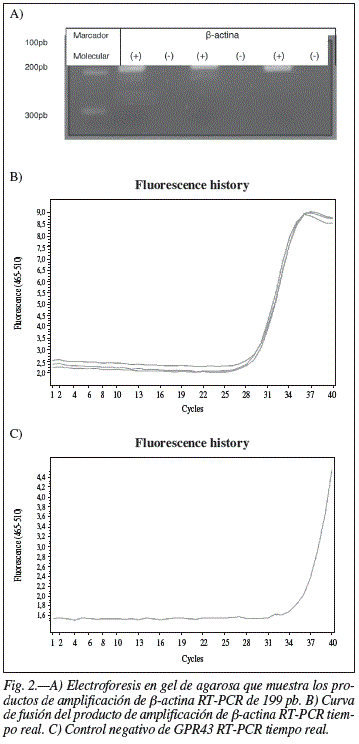
Posteriormente, se realizó la reacción de RT-PCR cuantitativa, para medir la expresión de los receptores en relación al gen de referencia. El gen constitutivo que se usó como control positivo fue β-actina. Los oligonucleótidos sugeridos para GPR43 y β-actina se muestran en la tabla II, con productos de amplificación de 66 pb y 199 pb, respectivamente.
Resultados
Según las determinaciones del análisis bromatológico realizado al polvo de nopal, se encontró que el contenido de fibra dietética total, fue de 49,01%, correspondiendo a la FS un valor de 20,39% FS y a la FI de 28,62%.
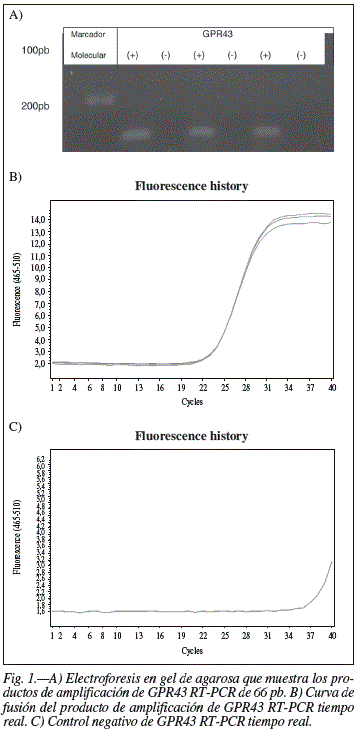
Los resultados de la RT-PCR convencional que se realizó para la identificación del gen GPR43 se muestran en la figura 1 en donde se aprecia el producto de amplificación del material genético extraído de los animales de experimentación sometidos a los diferentes tratamientos dietéticos (carriles 2, 4 y 6) con su respectivo control negativo (carriles 3, 5 y 7). En el gel de agarosa se observa una banda única y específica que representa un producto de 66 pares de bases, equivalente al lugar en el que se sitúa al lado el marcador molecular que se coloca en el carril 1.
Los resultados de la medición de la RT-PCR en tiempo real muestran (fig. 2) las curvas de fusión en donde se observa la fluorescencia que aumenta en proporción a la amplificación de la secuencia del gen GPR43 a lo largo los 40 ciclos de repetición que se programaron para la reacción. En B) se puede observar la gráfica correspondiente a una muestra de material genético de con tres repeticiones las cuales muestran el mismo comportamiento validando así la técnica de la reacción. Por otro lado, en C) se observa la gráfica que corresponde al control negativo en la cual no se aprecia amplificación antes del ciclo 35 por lo que se considera un resultado negativo adecuado.
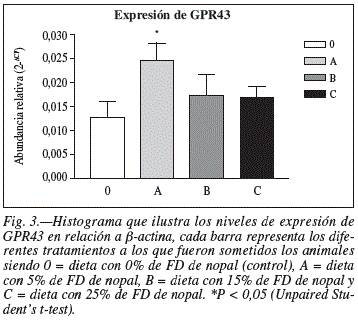
El gen del receptor GPR43 aumento considerablemente la expresión cuando se administro a los animales una dieta formulada con 5% de FD. El aumento del gen GPR43 fue de 93,1% con respecto a la dieta control. En Los animales de los grupos B y C, alimentados con un suplemento de FD del 15% y 25%, aumentaron la expresión del gen GPR43 en un 36,6% y 32,2%, respectivamente, con respecto a los animales alimentados conla dieta control.
Discusión
Se ha demostrado la presencia de GPR43 en diferentes tejidos, particularmente en depósitos de grasa, células inflamatorias y en el tracto gastrointestinal. Covington et al.24 detectaron niveles de expresión de este receptor particularmente elevados en cuatro depósitos de grasa específicos como son perirrenal, subcutáneo, mesentérico y parametrio, mientras el grupo de Karaki et al.25 reportó expresión en muestras de pared enteral de colon ascendente, y su localización en células enteroendócrinas L que contienen péptido YY (péptido tirosina-tirosina) y en mastocitos que contienen 5-HT (serotonina), lo cual sugiere que el receptor posee la capacidad de controlar el apetito por la liberación del péptidoYY, enviando una señal de saciedad, y que puede controlar la motilidad intestinal por los efectos de 5-HT/PYY. GPR43 también exhibe patrones de expresión robustos en otro tipo de células inmunológicas incluyendo células polimorfonucleares, monocitos, eosinófilos y linfocitos B24. Sin embargo, no existen reportes previos de que la expresión de GPR43 en el tracto gastrointestinal, específicamente en colon, pueda ser inducible, ya sea por factores dietéticos o de otro tipo.
En la figura 3 se observa un aumento significativo en abundancia relativa de la expresión de GPR43 de las dietas A, B y C en comparación con su expresión en la dieta 0, siendo este aumento de un 93,1%, 36,6% y 32,2%, respectivamente. Cabe señalar que la concentración de 5% de celulosa en la dieta de los roedores es el sugerido en un estudio realizado por Reeves et al.22 para mantener individuos bien alimentados aunque la celulosa utilizada por Reeves no es fermentable en la misma medida que la FD del nopal y por lo tanto produce una mínima cantidad de AGCC; la evidencia del aumento de expresión en el receptor GPR43 al administrarse una dieta conteniendo 5% de FD proveniente de nopal comparada con una dieta ausente de FD soluble demuestra la importancia del consumo de fibra de una manera equilibrada ya que en el caso de aumentar las cantidades de esta fracción dietética a contenidos de 15% y 25% de FD la expresión de GPR43 disminuyó en un 29,51% y 31,97%, respectivamente, en comparación con la dieta conteniendo 5% de FD de nopal. Los motivos de este decremento se pueden deber a los diferentes factores que involucra el metabolismo del intestino grueso en presencia de una alta cantidad de fibra.
Los efectos en el aumento de expresión del GPR43 cuando se administra una dieta con 5% de FD de nopal se pueden atribuir a la producción de butirato, no cuantificado en este estudio, por la fermentación bacteriana de los carbohidratos indigeribles, debido a que el butirato es un modulador de la estructura primaria de la cromatina dada su habilidad de inhibir la desacetilación de histonas, y consecuentemente su capacidad en la regulación de la expresión génica. Se ha documentado26 que en células epiteliales de diferentes grupos de ratas alimentadas con concentraciones variadas de FD, los niveles de acetilación de histonas y de proliferación celular parecen ser modulados por la concentración de ácido butírico, que está en equilibrio con su concentración fecal, encontrando una correlación positiva entre el de acetilación de histonas y la concentración de ácido butírico y una relación negativa entre la concentración de ácido butírico y la proliferación celular. Este grupo de investigadores afirma que las dietas que contienen cantidades moderadas de FD (5%) pueden tener efectos protectores en cuanto a proliferación celular, diferenciación y carcinogénesis, mientras que dietas libres de fibra o suplementadas con mucha fibra (10-20%) podrían tener potencial de promover carcinogénesis de colon26.
Por otro lado, se ha mostrado la capacidad de butirato de regular la expresión de genes de mucosa en cultivos celulares de colon de la línea celular HT29-C1.16E, en dos tipos de medios: rico en glucosa y libre de glucosa en el cual la principal fuente de energía fuebutirato15. En el medio rico en glucosa, butirato incrementó la expresión del gen MUC3 y MUC5B, inhibió la expresión del gen MUC5AC y no tuvo efectos sobre la expresión del gen MUC2; mientras que en el medio libre de glucosa, en el que butirato permaneció como la única fuente de energía disponible, todos los genes de mucosa se vieron incrementados en su expresión. Esto tiene trascendencia a nivel de protección por parte de la capa de mucosa en el intestino grueso. Zhou et al.27 documentaron el aumento de expresión de los genes que codifican para PYY y GLP-1 por medio de RT-PCR en tiempo real en dos métodos: in vivo con ratas alimentadas con una dieta de almidón resistente e in vitro con cultivos primarios de células epiteliales de ciego y colon de ratas después de ser incubados con butirato. En ambos estudios se observó aumento en la expresión de los genes atribuible a butirato. De este modo se confirma la capacidad de regulación de genes a nivel transcripcional de este metabolito.
Cabe señalar que los efectos observados en este estudio se aplican en relación a la FD proveniente de nopal, resaltando la relevancia de este producto y el potencial que como país se tiene de aprovechar este recurso natural que actualmente se tiene descuidado y poco estudiado20.
Conclusión
Se evidencio el efecto que tiene la concentración de FD en la dieta sobrela expresión del RNAm del receptor de AGCC, GPR43. Esto demuestra que el gen de los receptores puede ser inducible en cuanto su expresión por factores dietéticos, especialmente si se aumenta la concentración de butirato producido por la fermentación bacteriana de la fibra dietética. La fibra dietética de nopal promovió la expresión significativa del receptor de butirato GPR43 en colon de ratas alimentadas con una dieta conteniendo 5% de FD de nopal. Estos resultados contribuyen a explicar el mecanismo por el cual se han registrado mejores condiciones colónicas cuando se consumen cantidades apropiadas de fibra dietética.
Agradecimientos
Los autores agradecen al Consejo Nacional de Ciencia y Tecnología-CONACYT de México, por el apoyo económico a través de una beca a la estudiante Lucila Yazmín Corte Osorio para la realización de sus estudios de Maestría.
Referencias
1. Jacobasch G, Schmiedl D, Kruschewski M, Schmehl K. Dietary resistant starch and chronic inflammatory bowel diseases. Int J Colorectal Dis 1999; 14: 201-21. [ Links ]
2. Wollowski I, Rechkemmer G, Pool-Zobel BL. Protective role of probiotics and prebiotics in colon cancer. Am J Clin Nutr 2001;73:451-5. [ Links ]
3. Bauer-Marinovic M, Florian S, Mgler-Schmehl K, Glatt H, Jacobasch G. Dietary resistant starch type 3 prevents tumor induction by 1,2-dimefhylhydrazine and alters proliferation, apoptosis and dedifferentiation in rat colon. Carcinogenesis 2006; 27: 1849-59. [ Links ]
4. Martínez Flores HE, Figueroa JDC. La fibra dietética y su importancia en la salud humana. En Héctor E. Martínez Flores (eds.) Temas selectos en Alimentos, Nutrición y Salud. Morevallado Editores, Morelia, Mich., México. 2008; pp. 18-20. [ Links ]
5. Sakata T. Effects of short-chain fatty acids ontheproliferationof gut epithelialcells in vivo. En Cummings JH. Rombeau JL, Sakata T (eds.) Physiological and Clinical Aspects of Short-Chain Fatty Acids. Cambridge University Press Cambridge, UK. 1995; pp. 289-305. [ Links ]
6. Mortensen FY, Nielsen H, Aalkjaer C, Mulvany MJ, Hessov I. In vivo and in vitro effects of short-chain fatty acids on Intestinal blood circulation. Pharmacol Toxicol 1995; 75:181-5. [ Links ]
7. Ono S, Karakai SI, Kuwahara A. Short-chain fatty acids decrease the frecuency of spontaneous contractions of longitudinal muscleviaenteric nerves inrat distal colon. Jpn J Physiol 2004; 54:483-93. [ Links ]
8. Yajima T. Luminal propionate-induced secretory response in the rat distal colon in vitro. J Physiol 1998; 403: 559-75. [ Links ]
9. Fu H, Shi YQ, Mo SJ. Effect of short-chain fatty acids on the proliferation and differentiation of the human colonic adenocarcinoma cell line Caco-2. Chin J Dig Dis 2004; 5: 115-17. [ Links ]
10. Roediger WEW. Role of anaerobic bacteria in the metabolic welfare ofthe colonic mucosa in man. Gut 1980;5: 115-117. [ Links ]
11. Hinnebusch Brian F, Shufen Meng, James T Wu, Sonia Y Archer, Richard A Hodin. The Effects of Short-Chain Fatty Acids on Human Colon Cancer Cell Phenotype Are Associated with Histone Hyperacetylation. J Nutr 2002; 132: 1012-1017. [ Links ]
12. Andoh A, Fujiyama Y, Hata K, Takaya H, Shimada M, Bamba T. Counter-regulatory effect of sodium butyrate on tumor necrosis factor-alpha (TNF-alpha)-induced complement C3 and factor B biosynthesis in human intestinal epithelial cells. Clin Exp Inmunol 1999; 118: 23-9. [ Links ]
13. Abrahamse SL, Pool-Zobel BL, Rechkemmer G. Potential of short chain fatty acids to modulate the induction of DNA damage and changes in the intracellular calcium concentration by oxidative stress in isolated rat distal colon cells. Carcinogenesis 1999; 20: 629-34. [ Links ]
14. Rosignoli P, Fabiani R, De Bartolomeo A, Spinozzi F, Agea E, Pelli MA, Morozzi G. Protective activity of butyrate on hydrogen peroxide-induced DNA damage in isolated human colonocytes and HT29 tumor cells. Carcinogenesis 2001; 22:1675-80. [ Links ]
15. Gaudier E, Jarry A, Blottiére HM, De Coppet P, Buisine MP, Aubert JP, Laboisse C, Cherbut C, Hoebler C. Butyrate specifically modulates MUC gene expression in intestinal ephitelial goblet cells de prived of glucose. Am J Physiol Gastrointest Liver Physio 2004; 287: 1168-74. [ Links ]
16. Peng I, He Z, Chen W, Holzman IR, Lin J. Effects of butyrate on intestinal barrier function in a caco-2 cell monolayer model of intestinal barrier. Pediatr Res 2007; 61: 37-41 [ Links ]
17. Brown AJ, Goldsworthy SM, Barnes AA, Eilert MM, Tcheang L, Daniels D, Muir A, Wigglesworth MJ, Kinghorn I, Fraser NJ, Pike NB, Strum JC, Steplewski KM, Murdock PR, Holder JC, Marshall FH, Szekeres PG, Wilson S, Ignar DM, Foord SM, Wise A, Dowelld SJ. The orphan G protein-coupled receptors GPR41 and GPR43 are activated by propionate and other short chain carboxylic acids. J Biol Chem 2003; 278: 11312-11319. [ Links ]
18. Le Poul E, Loison C, Stuyf S, Springel JY, Lannoy V, Decobecq ME, Brezillon S, Dupriez V, Vassart G, Damme JV, Parmentier M, y Detheux M. Functional characterization of human receptors for short chain fatty acids and their role on polymorphonuclear cell activation. J Biol Chem 2003; 278: 25481-89. [ Links ]
19. Karaki SI, Mitsui R, Hayashi H, Kato I, Sugiya H, Iwanaga T, Furness J, Kuwahara A. Short chain fatty acid receptors, GPR43, is expressed by enteroendocrine cells and mucosal mast cells in rat intestine. Cell Tissue Res 2006; 324: 353-60. [ Links ]
20. Chavez Moreno CK, Tecante A, Casas A. The Opuntia (Cactaceae) and Dactylopius (Hemiptera: Dactylopiidae) in Mexico: a historical perspective of use, interaction and distribution. Biodivers Conserv 2009; 18: 3337-55. [ Links ]
21. Prosky L, Asp Nils-Georg, Scheizer FT, DeVries WJ, Furda I. Determination of insoluble, soluble and total dietary fiber in foods and food products: Interlaboratory Study. J Assoc Off Anal Chem 1998; 71:1017-1023. [ Links ]
22. Reeves GP, Nielsen HF, Fahey CG. AIN-93. Purified diets for laboratory rodents: final report of the American Institute of Nutrition ad hoc writing Committee on the Reformulation of the AIN-76A rodent diet. J Nutr 1993; 123: 1939-51. [ Links ]
23. Chomczynski P, Sacchi N. Single-step method of RNA isolation by acid guanidinium thiocyanate-phenol-chloroform extraction. Anal Biochem 1987; 162: 156-59. [ Links ]
24. Covington DK, Briscoe CA, Brown AJ, Jayawickreme CK. The G-protein-coupled receptor 40 family (GPR40-GPR43) and its role in nutrient sensing. Biochem Soc Trans 2006; 34: 770-73. [ Links ]
25. Karaki SI, Tazoe H, Hayashi H, Kashiwabara H, Tooyama K, Suzuki Y, Kuwahara A. Expression of the short-chain fatty acid receptor, GPR43, in the human colon. J Mol His 2008; 39: 135-42. [ Links ]
26. Boffa LC, Lupton JR, Mariani MR, Ceppi M, Newmark HL, Scalmati A, Lipkin M. Modulation of Colonic Epithelial Cell Proliferation, Histone Acetylation, and Luminal Short Chain Fatty Acids by Variation of Dietary Fiber (Wheat Bran) in Rats. Cancer Res 1992; 52: 5906-12. [ Links ]
27. Zhou J, Hegsted M, McCutcheon KL, Keenan MJ, Xi X, Raggio AM, Martin RJ. Peptide YY and proglucagon MRNA expression patterns and regulation in the gut. Obesity 2006; 14: 683-89. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Héctor Eduardo Martínez Flores.
Facultad de Químico Farmacobiología.
Universidad Michoacana de San Nicolás de Hidalgo.
Tzintzuntzan 173. Col. Matamoros.
58240 Morelia. Michoacán. México.
E-mail: hedu65@hotmail.com
Recibido: 10-X-2010.
Aceptado: 4-III-2011.