My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Nutrición Hospitalaria
On-line version ISSN 1699-5198Print version ISSN 0212-1611
Nutr. Hosp. vol.27 n.1 Madrid Jan./Feb. 2012
Eficacia de la glutamina parenteral en pacientes sometidos a trasplante autólogo de médula ósea
Efficacy of parenteral glutamine in patients undergoing bone marrow transplantation
J. G. Oliva García1, F. Pereyra-García Castro1, J. P. Suárez Llanos1, P. Ríos Rull2, J. Breña Atienza2 y J. E. Palacio Abizanda1
1Servicio de Endocrinología y Nutrición. 2Servicio de Hematología. Hospital Universitario Nuestra Señora de Candelaria. Tenerife. España.
Dirección para correspondencia
RESUMEN
Introducción: El Trasplante Autólogo de Médula Ósea (TASPE) conlleva un alto estrés metabólico. La glutamina es considerada se ha mostrado eficaz en estados catabólicos severos, aunque hay estudios contradictorios.
Objetivos: Valorar el efecto del tratamiento con nutrición parenteral (NP) suplementada con glutamina en el desarrollo de mucositis y en la estancia media hospitalaria en pacientes sometidos a TASPE.
Metodología: Estudio retrospectivo de pacientes con TASPE efectuados entre 2006 y 2009. En 2008 se introdujo de forma protocolizada la adición de 1 vial de L-alanil-L-glutamina (20 g) en las fórmulas de NP de dichos pacientes. Se seleccionaron aleatoriamente 13 historias a partir de dicha fecha (grupo glutamina) y 13 historias anteriores (grupo control) (n = 26). Se comparó el grado de mucositis y la estancia hospitalaria en los dos grupos. En el subgrupo de pacientes tratados con glutamina, se comparó la dosis de glutamina que recibieron los pacientes que desarrollaron algún grado mucositis con aquellos que no presentaron dicha complicación.
Resultados: Estancia media: 27,8 ± 7,4 días (grupo control) vs 20,3 ± 5,3 días (grupo glutamina) (p = 0,01). La gravedad de la mucositis fue menor en el grupo glutamina (p = 0,02). La dosis de L-alanail-L-glutamina ajustada por peso en los pacientes que no desarrollaron mucositis fue mayor que en los que la desarrollaron (0,32 vs 0,24 g/kg/día; p = 0,02).
Conclusiones: La suplementación con glutamina reduce el grado de mucositis y la estancia hospitalaria en pacientes sometidos a transplante autólogo de médula ósea. El grado de mucositis es menor en el subgrupo de pacientes que reciben dosis más elevadas de glutamina.
Palabras clave: Glutamina. Nutrición parenteral. Trasplante de médula ósea.
ABSTRACT
Introduction: Autologous bone marrow transplant (ABMT) represents a high metabolic stress. Glutamine has proven to be effective in severe catabolic states, although there are controversial studies.
Objectives: To assess the effect of parenteral nutrition (PN) therapy supplemented with glutamine on the occurrence of mucositis and mean hospital stay in patients submitted to ABMT.
Methods: Retrospective study of patients submitted to ABMT between 2006 and 2009. In 2008, one vial of L-alanyl-L-glutamine (20 g) was added by protocol to the PN formulations of these patients. Thirteen clinical charts since that date (glutamine group) and 13 previous charts (control group) were randomly selected (n = 26). We compared the degree of mucositis and hospital stay in both groups. In the subgroup of glutamine-treated patients, we compare the glutamine dose in the patients developing some degree of mucositis with that of those not having this complication.
Results: Mean hospital stay: 27.8 ± 7.4 days (control group) vs. 20.3 ± 5.3 days (glutamine group) (p = 0.01). The severity of mucositis was lower in the glutaminetreated group (p = 0.02). The weight-adjusted dose of L-alanyl-L-glutamine in the patients not developing mucositis was higher than in the other ones (0.32 vs. 0.24 g/kg/day; p = 0.02).
Conclusions: Glutamine supplementation reduces the degree of mucositis and hospital stay in patients submitted to autologous bone marrow transplantation. The degree of mucositis is lower in the subgroup of patients receiving higher doses of glutamine.
Key words: Glutamine. Parenteral nutrition. Bone marrow cell transplantation.
Abreviaturas
TASPE: Transplante autólogo de médula ósea.
NP: Nutrición parenteral.
IMC: Índice de masa corporal.
Introducción
El Trasplante Autólogo de Médula Ósea (TASPE), es un tratamiento utilizado en las neoplasias malignas hematológicas y tumores sólidos. La quimioterapia y/o radioterapia asociadas a que están sometidos estos pacientes, induce efectos secundarios, con un alto estrés metabólico. El status nutricional del paciente transplantado se va a ver afectado fundamentalmente por dos factores: 1) la pérdida de integridad del tubo digestivo (mucositis), con la consecuente alteración de la absorción de nutrientes y de la capacidad de ingerir alimentos; 2) la aplasia medular, que origina un aumento del riego de infecciones1.
La glutamina es considerada como un aminoácido condicionalmente esencial, debido a que en circunstancias de alto estrés metabólico las necesidades del mismo exceden la capacidad del organismo para producirla2. Es el aminoácido libre más abundante, actuando como elemento clave en el transporte de nitrógeno, la regulación de la síntesis proteica, la amoniogénesis renal (regulación del equilibrio ácido-base) y la neoglucogénesis hepática. Además, actúa como fuente de energía para células con alta tasa de replicación, como los enterocitos y las células del sistema inmune3-6. Estas características la convierten a priori en un elemento esencial en el soporte nutricional de los pacientes sometidos a TASPE. No obstante, los estudios publicados acerca de su eficacia muestran datos contradictorios7-12.
El presente estudio se efectuó con el propósito de valorar el efecto del soporte nutricional parenteral suplementado con glutamina en el desarrollo de mucositis y en la estancia media hospitalaria en pacientes sometidos a TASPE.
Material y métodos
Se efectúo un estudio longitudinal retrospectivo de casos y controles en el que se incluyeron pacientes sometidos a TASPE por causa diferente a la leucemia ingresados en el Hospital Universitario Nuestra Señora de Candelaria (Tenerife) entre 2006 y 2009 y que recibieron tratamiento con nutrición parenteral. El criterio de tratamiento nutricional fue el mismo para ambos grupos de tratamiento.
En enero/2008 se introdujo de forma protocolizada en nuestro centro hospitalario la adición de 1 vial de Lalanil-L-glutamina (Dipeptiven® 100 ml, 20 g) en todas las fórmulas de nutrición parenteral (NP) de pacientes sometidos a TASPE. Se seleccionaron aleatoriamente 13 historias clínicas a partir de dicha fecha (casos: grupo glutamina) y 13 historias con anterioridad a la misma (grupo control) (n = 26).
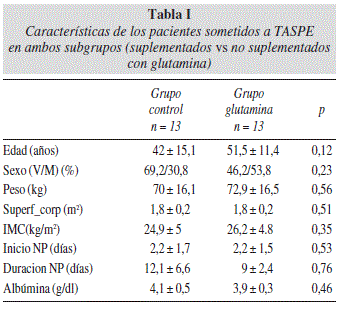
Se recogieron las siguientes variables: edad, sexo, fecha del transplante, patología de base, fecha de inicio de la nutrición parenteral, días de nutrición parenteral, peso, índice de masa corporal (IMC), superficie corporal, albúmina pre-transplante, grado de mucositis y estancia hospitalaria.
Se comparó el grado de mucositis en los dos subgrupos de pacientes (U de Mann-Whitney), así como la estancia hospitalaria (T-Student para muestras independientes). En el subgrupo de pacientes tratados con glutamina, se comparó el peso de los pacientes que desarrollaron algún grado mucositis con aquellos en los que no se presentó dicha complicación (T-Student para muestras independientes).Se consideró significativa una probabilidad mayor del 95% (p < 0,05).
Resultados
Se incluyeron un total de 26 pacientes (13 casos y 13 controles) tratados con NP en el periodo comprendido entre 2006 y 2009.
En el grupo de pacientes tratados con glutamina, los diagnósticos para la indicación de TASPE fueron: mieloma (n = 6) y linfoma (n = 7); siendo en el grupo control: mieloma (n = 3), linfoma (n = 8) y tumores sólidos (n = 2).
Los grupos no presentaban diferencias estadísticamente significativas entre ellos en cuanto a edad, sexo, peso, superficie corporal, IMC, albúmina, momento de inicio y duración de la nutrición parenteral (tabla I).
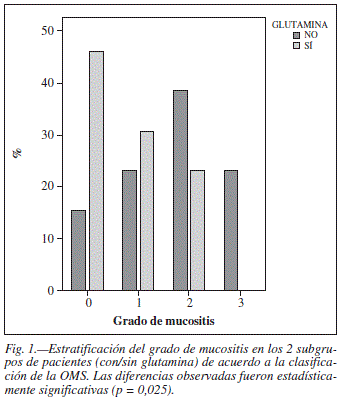
El grado de mucositis según la clasificación de la OMS fue significativamente menor en el grupo suplementado con glutamina (p = 0,02). Grado de mucositis: 0 (15,4% en los pacientes no suplementados con glutamina -grupo 1- y 46,2% en los transplantados que recibieron Dipetiven® -grupo 2-), 1 (23,1% en grupo 1 y 30,8% en grupo 2), 2 (38,5% en grupo 1 y 23,1% en grupo 2), 3 (23,1% en grupo 1 y 0% en grupo 2) (fig. 1).
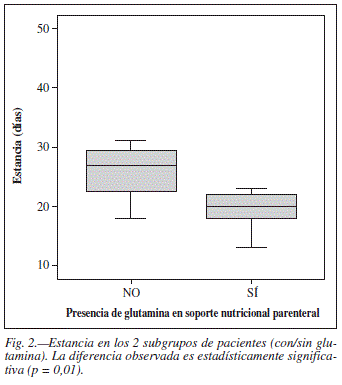
La estancia media fue de 27,8 ± 7,4 días en el grupo suplementado con glutamina y 20,3 ± 5,3 días en el grupo control, siendo esta diferencia estadísticamente significativa (p = 0,01) (fig. 2).
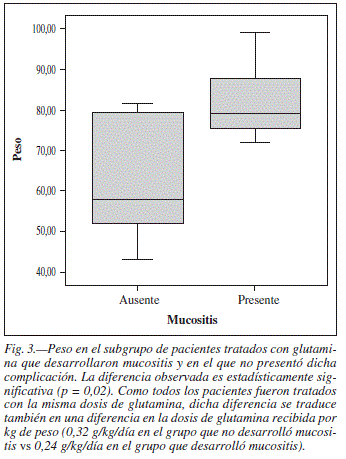
La dosis de glutamina por kg de peso en los pacientes que no desarrollaron mucositis fue mayor que en los pacientes que desarrollaron algún grado de mucositis, como pone de manifiesto la diferencia de peso en ambos subgrupos (61,9 ± 15,6 kg vs 82,3 ± 10,9 kg; p = 0,02) (fig. 3). Teniendo en cuenta que todos los pacientes recibieron la misma dosis de glutamina (20 g/día de L-alanil-L-glutamina), la diferencia de dosis de glutamina fue igualmente estadísticamente significativa (0,32 vs 0,24 g/kg/día de L-alanail-L-glutamina; p = 0,02).
Discusión
Las necesidades de glutamina aumentan en situaciones de estrés catabólico, de manera que en pacientes críticos hay una reducción de sus niveles circulantes. Además, hay una correlación inversa entre los niveles circulantes de dicho aminoácido y el pronóstico de los pacientes13.
Diferentes trabajos han evaluado la eficacia clínica de la adición de glutamina a las fórmulas de nutrición parenteral en pacientes sometidos a TASPE. Los efectos beneficiosos descritos incluyen una reducción significativa de la estancia y de los costes hospitalarios7,8, del número de infecciones8, del tiempo de recuperación de los linfocitos circulantes9 y de la puntuación obtenida en las escalas de estado de ánimo7. No obstante, en algún estudio10 la suplementación con glutamina se ha relacionado con efectos indeseables: mayor mortalidad, estancia más prolongada, aumento del gasto hospitalario, mucositis oral más grave y mayor duración del tratamiento con opioides. En otros estudios efectuados en nuestro entorno no se encontraron diferencias significativas en la estancia hospitalaria, ni en la presencia de complicaciones hepáticas o infecciosas en los pacientes suplementados con glutamina11.
En nuestro centro, la adición de dipéptidos de glutamina a las fórmulas de NP se realiza de forma habitual en el paciente sometido a TASPE desde el año 2008. Basándonos en los resultados contradictorios publicados en la literatura, realizamos un estudio retrospectivo con el objetivo de conocer los efectos de la glutamina en la evolución de dichos pacientes.
Según nuestros resultados, los pacientes suplementados con este aminoácido presentaban un menor grado de mucositis (p = 0,02) y una menor estancia hospitalaria (p = 0,01), cifrándose la diferencia media de estancia en 7,5 días, lo cual coincide con los datos obtenidos en el estudio de Muscaritoli et al.7. Además el beneficio clínico parece correlacionarse con la dosis de glutamina administrada, de manera que el grado de mucositis fue significativamente menor en el subgrupo de pacientes suplementados que recibió una dosis mayor de glutamina. Este dato apoya el que a nivel práctico se recomienden en el paciente crítico dosis de L-alanilglutamina superiores a 0,5 g/kg/día14.
Los resultados del estudio comportan ciertas reservas dado que no se trata de un estudio de intervención, que el número de pacientes es escaso y que los datos se han recogido de manera retrospectiva y en periodos de tiempo diferentes. No obstante, la complejidad de este tipo de pacientes obliga a la realización de estudios en circunstancias "no ideales", es decir, distintas de las establecidas en los ensayos clínicos y que reflejen la realidad de la práctica clínica diaria.
En conclusión, nuestros resultados muestran que la suplementación parenteral de glutamina en pacientes sometidos a TASPE se asocia a menor estancia hospitalaria y a menor grado de mucositis, siendo el beneficio clínico mayor con dosis superiores de glutamina (ajustadas en función del peso del paciente).
Referencias
1. Papadopoulou A, Lloyd DR, Williams MD, Darbyshire PJ, Booth IW. Gastrointestinal and nutritional sequelae of bone marrow transplantation. Arch Dis Child 1996; 75: 208-213. [ Links ]
2. Souba WW. Nutritional support. N Engl J Med 1997; 336: 41-8. [ Links ]
3. Meister, A. Metabolism of glutamine. Physiol 1956; 36: 103-127. [ Links ]
4. Phromphet-Charat V, Jackson PD, Dass and TC. Welbourne Ammonia partitioning between glutamine and urea: interorgan participation in metabolic acidosis. Kidney Int 1981; 20: 598-605. [ Links ]
5. Sies H, Häussinger D. Hepatic glutamine and ammonia metabolism. En: Glutamine metabolism in mammalian tissues (D. Häussinger and H. Sies, eds.). Berlin, 1984. Springer Velarg: 78-97. [ Links ]
6. Planas M, Schwartz S, Arbos MA, Farriol M. Plasma glutamine levels in septic patients. J Parenter Enteral Nutr 1993; 17: 299-300. [ Links ]
7. Muscaritoli M, Grieco G, Capria S, Iori AP, Fanelli FP. Nutritional and metabolic support in patients undergoing bone marrow transplantation. Am J Clin Nutr 2002; 75: 183-190. [ Links ]
8. Schloerb PR, Amare M. Total parenteral nutrition with glutamine in bone marrow transplantation and other clinical applications. JPEN 1993; 17: 407-413. [ Links ]
9. Ziegler RR, Lorraine S, Toung RD, Benfell K, Extinga M, Hortos K, Rancy B, Morrow F, Jacobs D, Smith RJ, Wilmore DW. Clinical and metabolic efficacy of glutamine-supplemented parenteral nutrition after bone marrow transplantation. Ann Intern Med 1992; 116: 821-828. [ Links ]
10. Pytlik R, Benes P, Patorkova M, Chocenska E, Gregora E, Prockazka B. Standardised parenteral alanyl-glutamine dipeptide supplementation is not beneficial in autologous transplant patients: a randomized, doublé-blind, placebo controlled study. Bone Marrow Transplant 2002; 30: 953-961. [ Links ]
11. Alonso Pérez L, Fernández Vázquez A, Valero Zanuy MA, Gomis Muñoz P, León Sanz M, Herreros de Tejada A. Parenteral nutrition supplemented with glutamine in patients undergoing bone marrow transplantation. Nutr Hosp 2010; 25: 49-52. [ Links ]
12. Gómez Candela C, Castillo R, de Cos AI, Iglesias C, Martín MC, Aguado MJ, Ojeda E. Effects of parenteral glutamine in patients submitted to bone marrow transplantation. Nutr Hosp 2006; 21: 13-21. [ Links ]
13. Plank LD, Hill GL. Similarity of changes in body composition in intensive care patients following severe sepsis or major blunt injury. Ann N Y Acad Sci 2000; 904: 592-602. [ Links ]
14. Bonet A, Grau T. La glutamina, un aminoácido casi indispensable en el paciente crítico. Med Intensiva 2007; 31: 402-6. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
José Gregorio Oliva García.
Hospital Universitario Ntra. Sra. de Candelaria.
Ctra. del Rosario, 145.
38010 Santa Cruz de Tenerife. Canarias. España.
E-mail: olivajg@gmail.com
Recibido: 4-X-2011.
Aceptado: 18-X-2011.