Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Nutrición Hospitalaria
versión On-line ISSN 1699-5198versión impresa ISSN 0212-1611
Nutr. Hosp. vol.27 no.5 Madrid sep./oct. 2012
https://dx.doi.org/10.3305/nh.2012.27.5.5901
Cruce duodenal; visión integral de una derivación biliopancreática en cirugía metabólica
Duodenal switch; a comprehensive view of a biliopancreatic diversion in metabolic surgery
S. Navarrete Aulestia
Profesor Titular. Universidad Central de Venezuela. Jefe de Servicio de Cirugía II. Hospital Universitario de Caracas. Jefe de Cátedra Clínica y Terapéutica Quirúrgica B. Escuela Luis Razetti. UCV. Caracas. Venezuela.
Dirección para correspondencia
RESUMEN
El Switch duodenal es una técnica de cirugía bariátrica que modifica la derivación biliopancreática de Scopinaro, descrita por los cirujanos Hess y Marceaux en 1988, apoyados en la descripción original que hizo De Meester para el tratamiento de la enfermedad por reflujo gastroesofágico recurrente.
Es una técnica compleja, probablemente la más laboriosa de todos los procedimientos bariátricos hasta ahora conocidos, que puede y deber ser hecha por laparoscopia y que consta de varios tiempos quirúrgicos. Implica la realización de una gastrectomía vertical con bujías de diferente calibre y de un bypass en Y de Roux al duodeno, con longitudes de las asas variables. La anastomosis duodenoileal es la más difícil y tiene diferentes técnicas. Debe acompañarse de cierre de las brechas y en la mayor parte de los casos de una apendicectomía y una colecistectomía. Se han registrado tiempos quirúrgicos, hospitalización, morbilidad y mortalidad mayores que en el bypass gástrico en Y de Roux.
Las complicaciones reportadas son de hasta un 24% de los casos, tempranas o tardías, éstas de índole metabólico fácilmente controlables, con lo que se logra un buen índice de satisfacción, con bajo porcentaje de revisión y una mortalidad no mayor al 1,5%.
Se logra una disminución del 70% del exceso de peso a largo plazo, con mejoría de todas las comorbilidades llegando al control metabólico de las dislipidemias y la diabetes alrededor de un 95%.
Dados los buenos resultados debería considerarse como una técnica de elección para el tratamiento del paciente obeso metabólicamente enfermo.
Palabras clave: Cruce duodenal. Laparoscopia. Cirugía bariátrica. Cirugía metabólica.
ABSTRACT
The duodenal switch is a technique of Bariatric Surgery that modifies the Scopinaro biliopancreatic diversion, described by Hess and Marceaux in 1988, supported by the original description that made De Meester for the treatment of gastroesophageal reflux recurrent disease.
It is a complex technique, probably the most laborious of all bariatric procedures until now known, which can and must be done by laparoscopy and consisting of several surgical steps. It involves the performance of a vertical gastrectomy with bougies of different diameter and a bypass Roux-en-Y into the duodenum, with different lengths limbs.
Duodenoileal anastomosis is the most difficult and different techniques are described. It must be accompanied by closure of the defects and in most of the cases of an appendectomy and cholecystectomy. There have been greater than the gastric bypass Roux-en-Y in operating time, hospitalization, morbidity and mortality.
Reported complications are up a 24% of the cases, early or late, these are metabolic one and easily controllable, so a good index of satisfaction with low percentage of review and no more than 1.5% mortality.
Achieved a decrease of 70% of excess weight in the long term, with improvement in all co-morbidities reaching around a 95% diabetes and metabolic control of the dyslipidemias.
Given the good results it should be seen as a technique of choice for the treatment of the obese patient with metabolical disorder.
Key words: Duodenal switch. Laparoscopy. Bariatric surgery. Metabolic surgery.
Historia
La palabra Switch duodenal: que significa cambiar, cambiar de canal, intercambia1 fue acuñada por primera vez en cirugía por el Dr. Tom De Meester en su trabajo experimental2 para tratar los casos de enfermedad por reflujo gastroesofágico recurrentes. En esa oportunidad plantea la posibilidad terapéutica de desconectar el duodeno proximal a 3 cm del píloro para evitar el reflujo biliar mediante la confección de una Y de Roux anastomosando el yeyuno al duodeno proximal con un asa biliopancreática de 25 cms y una alimentaria de 55 cm, para evitar asi el reflujo biliar. En esa oportunidad deja el estómago intacto apoyándose en unos trabajos experimentales descritos previamente por Mann en 19243 . Esta técnica por él descrita se sigue utilizando hoy en día. Inclusive Strignano4 la publica recientemente para el tratamiento de la enfermedad por reflujo gastroesofágico recurrente con buenos resultados. De manera que el switch duodenal tiene su origen en la desconexión del duodeno suprapapilar para evitar el reflujo biliar al estómago y al esófago y efectivamente cuando Douglas Hess5 describe su primer caso en marzo de 1988 en un paciente obeso operado previamente por esta causa que reganó peso. Lo hizo sobre una Bujía 40 Fr con una anastomosis duodenoileal usando engrapado quirúrgico circular cortante, en base a los conceptos desarrollados por el Dr Nicola Scopinaro6,7 de la derivación biliopancreática, quien preconiza el uso de una gastrectomía subtotal distal pero agregando un componente malabsortivo importante al dejar sólo entre 50 y 75 cm de canal común para la mezcla de los alimentos con líquido biliopancreático y provocar así la absorción de nutrientes. Este último mecanismo creado de esta manera sirvió de base para que el Dr. Hess5 realizara y describiera la primera derivación biliopancreática con un Switch duodenal, preservando entonces el concepto introducido previamente. Pero quien publica los primeros resultados con esta técnica es el Dr. Marceau8 en Quebec en el año 1993. Posteriormente en Europa se comienza a realizar la técnica siendo popularizada por el Dr. Aniceto Baltasar9-11, quien publica sus primeros trabajos en 1995 primero de manera abierta. En septiembre de 1999 Rabkin12 realiza el primer caso asistido por laparoscopia y al mes siguiente del mismo año Michael Gagner13 lo hace totalmente laparoscópico. A los pocos meses en mayo del 2000 Baltasar14,15 lo practica también por laparoscopia.
Técnica
Posición del paciente/equipo quirúrgico
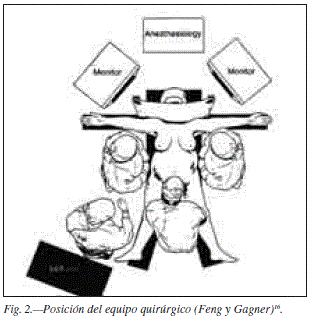
Pareciera que la posición del paciente en decúbito dorsal es la técnica más utilizada pero también pudiera realizarse con las piernas del paciente abiertas, de manera que el cirujano realiza parte de la operación entre las piernas del enfermo como lo reportan Feng y Gagner16, Baltasar14,15, Weiner17 y Praveen18 . Pudiendo cambiarse si se siente más cómodo a la izquierda del paciente para realizar el tiempo intestinal o a la derecha como Kasama19, quien realiza toda la operación desde el lado derecho del enfermo, teniendo claro que es un cruce duodenal corto. El grupo de Libanori20 en Brasil también cambia de posición durante la cirugía.

El número de trócares a utilizar está entre cinco y siete , variando de acuerdo a los grupos. Clásicamente se colocan seis, tres de ellos de 12 mm para la colocación del engrapado quirúrgico, todos por encima de una línea imaginaria que pase por la cicatriz umbilical (en la figura 2 está la posición del equipo más utilizada) y la colocación de los trócares según Gagner13,16 quien usa siete (fig. 3). Baltasar14,15 trabaja con cinco y Weiner17con seis.
Los tiempos quirúrgicos sugeridos para la cirugía deben ser reglados ya que es una cirugía compleja y requiere ser metódico y riguroso por lo que sugerimos lo publicado por Weiner17 (tabla I) para evitar errores por omisión. Nosotros seguimos los mismos tiempos para el cruce duodenal corto, con la excepción de la apendicectomía que no la hacemos de rutina21, al igual que Feng y Gagner16 Kasama19, Sovik22. Otros como Hess5, Marceau8, Weiner17, Baltasar9-11,14,15 y Rabkin12 si la realizan de rutina. La colecistectomía se practica cuando hay enfermedad vesicular litiásica13,16,17.
Siendo una cirugía con tan buenos resultados metabólicos23,24 y al mismo tiempo tan compleja se requiere rigurosidad para lograr buenos resultados, es decir pocas complicaciones.
Gastrectomía vertical y preparación del duodeno
Luego de hacer el neumoperitoneo y la colocación de los trócares se procede a realizar la Gastrectomía Vertical. Posterior a la disección de la Curvatura Mayor con la ligadura de los vasos gastroepiploicos con cualquier modalidad de energía: bipolar, Ligasure® o Ultrasonido9-11,14,15,19,21 hasta lograr obtener unos 4 cms de duodeno desde el píloro, se procede a confeccionar la Gastrectomía Vertical o Longitudinal, comenzando desde 3 cm del píloro como lo hacen Baltasar14,15 y Parikh25 hasta 6 cm como lo describen Ren y Gagner13 en su trabajo original, Praveen18 o Weiner17. Lo cierto es que pareciera que el antro es importante como mecanismo de bomba17,26 por lo que luce necesario dejarlo, no modificándose el vaciamiento gástrico27. La bujía que se utiliza para construir el tubo gástrico varía desde la 32 Fr14,15,25, que permite obtener una capacidad gástrica menor26, pasando por una 36 Fr18,19, 40 Fr5 16 o una 60 Fr13,16,21 y esto constituye el componente restrictivo de la cirugía. De esta manera se logran volúmenes que van desde 75 cc con la bujía 32Fr14,15,26, 100 cc con la bujía 40Fr5 hasta 160 cc aproximadamente con la bujía 60 Fr16,21. El engrapado quirúrgico utilizado para la sección gástrica debe ser más alto cerca del antro 3,8 mm (dorado) o 4,1 mm (verde), sobretodo en los dos primeros disparos, porque el tejido es más grueso y luego se continúa con grapas azules (3,5 mm). Hay diferencias en el manejo de la línea de grapas porque algunos cirujanos no hacen nada, otros invaginan totalmente como Baltasar14,15,19 otros parcialmente21, algunos como Ren13 colocan puntos en los cruces de la línea de engrapado y también hay quienes usan sellantes28, arguyendo que pudiese disminuir el sangrado posoperatorio29. Sin lugar a dudas que todas las variantes funcionan lo que se busca es la máxima seguridad para minimizar las complicaciones.
Anastomosis. Bypass duodenoileal
Tiempo infra y supramesocólico
La realización del tiempo inferior o inframesocólico implica movilizar al paciente desde la posición de Trendelenburg invertido a la de Trendelenburg ya que necesitamos exponer la válvula ileocecal para comenzar la medición del intestino delgado. Algunos cirujanos o grupos como Baltasar14,15 miden 75 cm de ileon desde el ciego, siempre, otros miden un poco más: 100 cm8,12,13,17,22,30,31,32 marcar allí y medir la longitud del asa alimentaria para luego seccionar el intestino delgado; sin embargo existen algunos que pudiesen usar un canal común menor, de 50 cm33. En este trabajo Dolan demuestra que es el canal común corto lo que produce las complicaciones metabólicas del Switch Duodenal y de la Derivación Biliopancreática de Scopinaro, por lo que el Dr. Hess34 padre de esta cirugía en una editorial publicada en Obesity Surgery propone que se mida de rutina el intestino, ya que él encuentra diferentes longitudes, que van desde 3,45 metros hasta 11,4 m por lo que sugiere utilizar valores porcentuales para el canal común, asi como también para la longitud del asa alimentaria. Para el primero propone utilizar como medida el 10% de la longitud del intestino resultando medidas de 50, 75 ó 100 cm, porque las mediciones se hacen de veinticinco en veinticinco centímetros. Para la longitud del asa alimentaria, quiere decir la longitud del intestino delgado que va desde la anastomosis enteroentérica hasta la anastomosis duodenoileal, propone utilizar el 40% de la medida intestinal total34 como también lo hace Keshishian35 quedando asas alimentarias que miden entre 250 y 350 cm aproximadamente, lo cual se corresponde con las grandes series de Marceau8, Baltasar14,15 y Weiner17. Otros cirujanos como Gagner16, Prachand30 y Rabkin12 utilizan 150 cm sistemáticamente al igual que Praveen18, que aunque no es un SD clásico porque su canal común es bastante más largo utiliza esta longitud del asa alimentaria. Si bien es cierto que para el Bypass gástrico en Y de Roux a mayor longitud de asas mayor pérdida de peso36 sobre todo en pacientes con IMC mayor que 50 kg/m2 37, no se mide de rutina la longitud total del intestino.
En relación con las dos anastomosis a realizar la enteroentérica y la duodeno ileal, vale la pena comentar que prácticamente todos los grupos8,13,14,18,21,25 hacen la primera láterolateral de 45 ó 60 mm con cargas blancas (2,5 mm) sólo Hess5 y Weiner17 la hacen término-lateral, excepcionalmente a mano17,22. El ascenso del asa alimentaria al compartimiento supramesocólico para confeccionar la anastomosis duodenoileal puede hacerse por vía antecólica14,17,25 o por vía retrocólica8,18,22,32 y cierran las brechas prácticamente todos los grupos5,8,13,14,17,30 tanto la intermesentérica y la del espacio de Petersen cuando es antecólica o la transmesocólica cuando se utiliza la vía posterior, con sutura continua no absorbible20,38. En este sentido Higa38 en su trabajo sobre "Que ha aprendido de las complicaciones luego de los primeros 1.040 casos" encuentra que cambiar la sutura absorbible por la no absorbible para el cierre de las brechas disminuye las hernias internas en un 50%. De manera que aun en cruces duodenales cortos19 pareciera mandatorio cerrarlas, aunque hay series donde no se cierran21,22 sin reportar hernias internas en un año de seguimiento. Antes de realizar la anastomosis supramesocólica entre el duodeno e ileon, cuando el ascenso del asa es antecólica, algunos autores abren el epiplón mayor19,21 para disminuir la tensión en el asa a anastomosar ya que éste, probablemente es el tiempo de la cirugía que mayor demanda técnica requiere y donde pudiesen presentarse las principales complicaciones, por ello el Dr. Weiner17 publica una serie muy interesante comparando tres grupos con diferentes maneras de hacerla, prefiriendo la confección totalmente a mano17,39 al igual que Baltasar15 y Kasama19, sin reportar diferencias importantes entre las tres técnicas. Esta anastomosis también puede hacerse con lineal cortante, engrapado azul (3,5 mm) de 45 mm de longitud, usualmente término-lateral. Existen diferentes autores13,16,21 que utilizan engrapado circular cortante para esta anastomosis apoyándose en la descripción original de la técnica que hace Hess5 para el Switch Duodenal y Wittgrove40,41 para el Bypass gástrico. Se prefiere la circular cortante No 25 ya que con la No21 se estenosa con frecuencia42 y el paso del anvil puede hacerse transoral13,14,16 o transgástrico21 antes de confeccionar la Gastrectomía Vertical.
En todas las series se dejan drenajes y casi todos cierran la aponeurosis de los puertos mayores que 5 mm.
Cuidados posoperatorios
Manejo de la dieta
La ingesta oral comienza desde el segundo día del postoperatorio. El régimen alimenticio es similar a una manga gástrica o bypass gástrico: cuatro etapas durante seis semanas, con un volumen progresivo desde 30 cc hasta alcanzar 150 cc, sin modificar la calidad de los alimentos. Empezamos con bebidas claras no calóricas líquidos, descafeinados y no carbonatados (tres días). Entonces progresamos a líquidos completos durante catorce días. Esta dieta contiene proteínas de alto valor biológico (25-30 g). A continuación, pasamos a la tercera fase, puré o suave (alimentos triturados), para las tres próximas semanas: 90, a 120 cc, cinco a siete veces al día y una meta de proteína de 60 gramos. Y la última etapa con tres comidas pequeñas y dos o tres bocados, consistente en no sólidos grasa ni azúcar bajas43.
Uso de antibióticos
Se utilizan Cefalosporinas de primera17 o segunda generación en esquemas clásicos de profilaxis o Sultamicilina21.
Profilaxis para trombosis venosa profunda
Se debe utilizar movilización precoz, en las primeras 6 horas17 medias de compresión neumática y heparinas de bajo peso molecular44
Mecanismos de acción del switch duodenal
Hay dos mecanismos de acción del SD (switch duodenal): un componente restrictivo y uno malabsortivo. El LRYGB (Roux-en-Y bypass gástrico) y la GV (gastrectomía vertical)45,46 se asociaron a una temprana y dramática mejora en control glicémico, que era evidente una semana después de la operación, antes de que ocurriera una pérdida de peso considerable. Pero la mejora en la homeostasis de glucosa después de la manga se esperaba que se produjera en una etapa posterior, asociándose a pérdida y calórico restricción de peso. ¿Qué mecanismo podría explicar esta reversión rápida y marcada del metabolismo de la glucosa? Una posibilidad es que los pacientes que consumen muy poca o ninguna comida en el período postoperatorio inmediato, dejando la producción de insulina y las células en reposo. El hambre sola se asocia con la mejora en el control glicémico en la diabetes tipo 2 y sabemos que una dieta hipocalórica y la pérdida de peso podría reducir la glucosa plasmática y mejorar la sensibilidad a la insulina en individuos obesos45,47,48. El consumo de energía se reduce notablemente al inducir un balance negativo de energía, una condición que mejora la tolerancia a la glucosa. De hecho, ese descanso hace que el gasto de energía49-51 se reduzca aproximadamente 14-16 kcal/kg/día o en promedio aproximadamente 125-250 kcal/día. Estos cambios al tercer mes podrían llegar a 244 kcal/día y esta restricción de energía conduce a la pérdida de peso52 y le da lugar a cambios hormonales, en grelina, leptina, niveles de GLP 1 y PYY53,54 pero son ligeramente diferentes después de la cirugía bariátrica55. Obviamente, la derivación del intestino proximal también puede reducir la absorción de glucosa, que podría, al menos en teoría, mejorar los niveles de glucosa postpandrial48,56.
Pero la Gastrectomía Vertical(Gv) hecha con cualquier tamaño de calibrador no sólo funciona restringiendo el aporte de calorías y cambiando el patrón energético y la tasa metabólica. Hoy se sabe que al realizar una extirpación vertical del 75% del estómago y con ello el fundus gástrico disminuye notablemente la grelina57, que se produce fundamentalmente allí y otra parte en el intestino delgado58,59. Es una hormona orexigénica, que estimula el apetito y aumenta la ingesta en humanos60. Existen varios estudios59-64 que miden la grelina total, resaltando que existe una forma activa, acetilada y una no activa (no acetilada) y ésta no activa los receptores secretagogos de la hormona de crecimiento65. Existen estudios experimentales en animales66,67 y clínicos68-71 que aportan datos de cambios hormonales intestinales importantes de la gastrectomía vertical. Los primeros66 hechos en ratas Goto-Kakizaki donde evidencian que la GV produce mejoría de la diabetes mellitus tipo 2 vía reducción de la grelina, que ella interviene directamente en la homeostasis de la glucosa68 y que es independiente de la pérdida de peso66 y los segundos arrojan datos de disminución de la grelina69, elevación de GLP 1, PYY70, mejoría de la resistencia periférica a la Insulina en los primeros quince días independientemente de la pérdida de peso71 y de la glicemia con resolución de la diabetes mellitus tipo 2 hasta en un 84% de los casos72-74.
De manera que la sola realización de la Gastrectomía Vertical en el Switch Duodenal permite disminuir el peso y controlar los problemas metabólicos precozmente.
Ahora bien, existen otros mecanismos que se describen con esta intervención quirúrgica y que permiten contribuir al control de la glicemia y al de la dislipidemia. Una de ellas es la Teoría del intestino anterior (FOREGUT) planteada por Rubino48, básicamente sostiene que la exclusión del duodeno y el yeyuno proximal del tránsito de nutrientes, posiblemente impide la secreción de una supuesta señal que promueve la resistencia a la insulina que conlleva a una Diabetes Mellitus tipo 2 (Factor de Rubino?). El bypass duodenojejunal al eludir esta región evita la estimulación de las células que producen el factor desconocido con efecto antiincretínico48,56. Pero también es bien conocida la Teoría del Intestino Posterior (HINDGUT) que sostiene que el control de la diabetes mellitus tipo 2 es el resultado de la entrega expedita de quimo nutrientes al intestino distal, que dispara una señal fisiológica para mejorar el metabolismo de la glucosa. Un mediador candidato potencial de este efecto es el GLP-1 y otros péptidos del intestinal distal. Esta hormona incretínica es secretada por las células L del intestino distal en respuesta a nutrientes intestinales. Ella estimula la secreción de insulina y ejerce una acción proliferativa y antiapoptótica sobre las células β pancreáticas75-78.
Recientemente se ha descrito un nuevo mecanismo que tienen que ver con la neoglucogénesis intestinal publicado por un grupo francés. La reorganización de la anatomía del intestino superior conlleva un efecto beneficioso sobre la homeostasis de glucosa y la ingesta de alimentos que implican gluconeogénesis intestinal, independiente de los niveles de GLP 1 o cambio de peso. Se considera una vía sensitiva hepatoportal importante79.
Sin lugar a dudas que estos mecanismos ayudan al control hormonal intestinal que conlleva los cambios metabólicos que se observan después de esta cirugía pero como lo describió el Dr Scopinaro6,7,80,81 creador del concepto de la Derivación Biliopancreática es la malabasorción intestinal que se genera al crear un canal común tan corto, llevando la bilis y el líquido pancreático a 50 cm de la válvula ileocecal, la que permite mantener la pérdida de peso y el control metabólico que se aprecia con el switch duodenal, ya que dejan de absorberse una cantidad importante de grasas: colesterol, triglicéridos, ácidos grasos, inclusive vitaminas liposolubles al igual que proteínas, sin alterar la circulación enterohepática de las sales biliares. Esto conlleva a una excreción aumentada de grasas con las evacuaciones superior a los 40 g/ diarios82 cuando el canal común es inferior a los 75 cm y también de desnutrición protéica33.
Resultados
Antecedentes
En la revisión de Buchwald83 publicada en el 2009 encuentra que la derivación biliopancreática y el cruce duodenal representan sólo el 0,9% y 0,8% respectivamente del total de la cirugía bariátrica realizada en el 2008 en todo el mundo y que hasta el año 2006 cuando se relaciona con la diabetes mellitus tipo 2 sube al 6,4% del total de la cirugía practicada. El 83% se practica abierta y sólo se reportan 604 casos laparoscópicos (17%), quiere decir el 1,1% del total de la serie24. En relación con el cruce duodenal sólo se realizan 0,6% laparoscópicos de un total de 344.221 casos por lo que significan unos 2.065 casos al año83. De manera que si lo comparamos con la banda gástrica: 42,3% o el bypass gástrico 39,75% es bastante más infrecuente como técnica quirúrgica para el tratamiento de la obesidad mórbida a pesar de que resulta la técnica quirúrgica que logra mejores resultados tanto para el control del peso23,24 asi como también de la diabetes mellitus y la dislipidemia23,24 lográndose reducción de 18,72 puntos en el IMC, luego de un año de seguimiento y pérdida de hasta un 73,72% del exceso de peso24. en pacientes que tienen un IMC promedio de 50,46. Sin embargo vale la pena discriminar los resultados según los rangos de IMC, porque parecieran diferentes los resultados según los rangos.
Cambios antropométricos
Pacientes con IMC > 50 kg/m2
Las grandes series como la de Hess84 y Marceau85 quienes además son los desarrolladores de la técnica, lo hacen para pacientes con IMC > 50 kg/m2 asi tenemos que reportan promedios de IMC preoperatorios de 50,9 y el segundo 51,5 al igual que otras series tanto en Europa como la de Baltasar86 en España 51,56 , Weiner17 en Alemania de 55,5 o más recientemente Sovik22 en Noruega de 55,25, quien presenta un interesante estudio prospectivo comparándolo con el bypass gástrico, como en América, Prachand30 reporta un índice promedio que alcanza prácticamente los sesenta: 58,8 ± 6,7 kg/m2, Parikh25 de 57 y Rabkin12 50. Los resultados logrados por estos grupos en relación a la pérdida porcentual del exceso de peso al cabo de dos años, varía desde 69,4%86, 73%85 hasta un 74%32. En series prospectivas al cabo de un año reportan 74,8%22 y uno esperaría mayor descenso, porque éste se presenta al cabo de dos años24. Lo cierto es que para pacientes con IMC > 50 kg/m2 los mejores resultados al cabo de dos años para perder peso se logran con el SD24.
Pacientes con IMC entre 40 y 50 kg/m2
Son pocas las series que presentan resultados en este rango de IMC, pero los resultados parecieran ser todavía mejores. Asi tenemos que Praveen18 en un estudio prospectivo, randomizado llevado a cabo en la India, comparando la Gastrectomía Vertical con Bypass duodenoyeyunal (Cruce duodenal corto) porque utiliza asas más cortas, la biliopancréatica de 50 cm y el asa alimentaria que varía entre 75 y 150 cm de acuerdo al IMC preoperatorio vs Bypass Gástrico en Y de Roux logra resultados extraordinarios de pérdida de hasta un 81,94% del exceso de peso al cabo de un año y todavía mejores los presentados por Kasama19 en 21 pacientes con IMC promedio preoperatorio de 41 kg/m2 informa que logra que los pacientes lleguen a perder el 96% del exceso de peso al cabo de 18 meses de seguimiento. Inclusive Praveen18 logra valores de IMC < 30 kg/m cifras no alcanzadas en otras series22,30,32,84-86, que no llegan a valores inferiores a 30. A pesar de que el IMC promedio preoperatorio de su serie es de 48,28 kg/m2 bastante cercano a 50. Es probable que los resultados de esta técnica a pesar de trabajar con asas más cortas18,19 de mejores resultados en pacientes asiáticos, ya que fueron hechas en la India18 y Japón19, respectivamente.
Pacientes con IMC < 40 kg/m2
Existen pocos pacientes obesos (IMC < 40) o no, operados con esta técnica. Kasama tiene algunos dentro de su serie19 y ya conversamos sobre sus resultados. Navarrete21 en pacientes diabéticos con 30 kg/m2 informa de pérdida del 100% del exceso de peso, con IMC preoperatorio de 27,2, logrando llegar hasta un IMC de 23,2 kg/m2 pero es un cruce duodenal corto como el de Kasama y Praveen para pacientes diabéticos no obesos. De modo que ante estos resultados antropométricos tan importantes y atractivos nos gustaría revisar un poco que pasa con los resultados metabólicos, especialmente con el tema de la Diabetes mellitus tipo 2.
Cambios metabólicos. Diabetes mellitus
Sin lugar a dudas que después de revisar los meta-análisis del Dr. Buchwald del 200423 y especialmente el del 200924 no cabe la menor duda que esta cirugía: la derivación bilio-pancreática con switch o cruce duodenal produce los mejores resultados metabólicos, particularmente en relación con la respuesta del paciente obeso diabético a la cirugía. En estas revisiones se habla de una remisión de la enfermedad desde 95,9%24 hasta un 97,9%23 en 282 pacientes (15,3% de la serie). Se habla de remisión cuando el paciente no toma medicación y mantiene valores de glicemia por debajo de 100 mg/dl y Hb A1C < 6%24. Cabe resaltar que en el segundo trabajo24 la cifra sube a un 30,1% de la población operada con esta técnica (753 casos de los 2.502 reportados). Es interesante destacar que hay trabajos como el de Hess84 donde se reporta una incidencia de diabetes bastante menor, de un 10%, que menciona un 100% de remisión mantenida durante 5 años. Lo cierto es que en todas las series la respuesta de remisión va desde un 75%18, 78%85 hasta un 82,5% de Kasama19. Queremos resaltar estas dos series, las de Praveen y Kasama porque tienen los mejores resultados en pérdida de peso sin embargo la tasa de remisión de la diabetes es menor que en otros trabajos de occidente23,84,86 probablemente por las diferencias genéticas en el manejo de la glicemia, por ello el consenso en Asia es operar con IMC menores en presencia de comorbilidades como la diabetes87. En todo caso siempre hay una respuesta a la diabetes que es mayor que con cualquier otra técnica24 incluyendo el bypass gástrico (80%). Lo mismo puede decirse que ocurre con la dislipidemia, ya que se reporta una mejoría absoluta de la misma tanto las simples como las mixtas19,21,23,24, , en el peor de los casos hay una respuesta favorable que alcanza el 80%18.
De manera que no cabe duda que desde el punto de vista metabólico es una excelente cirugía.
Nos queda por analizar las complicaciones de esta cirugía tanto tempranas como tardías.
Complicaciones
La morbilidad del switch duodenal está alrededor de un 10% en las mejores series17. En general está entre un 15 y un 20%. Marceau85 reporta 16,3%, Baltasar86 también 16% y Buchwald88 refiere desde un 14% cuando el IMC < 50 y puede subir hasta un 24% en mayores que 50 kg/m2. En este sentido debe mencionarse que Regan y Gagner89 proponen realizar la Gastrectomía Vertical como primer tiempo en pacientes con IMC > 60 kg/m2 ya que encontraban mayores complicaciones severas en estos pacientes16, lo cual permitió describir la gastrectomía vertical como técnica única para el tratamiento de la obesidad mórbida, sugiriendo para estos pacientes hacerlo en dos tiempos74,90,91. Primero una gastrectomía vertical y luego un bypass gástrico89, un switch duodenal completo, un bypass duodenoyeyunal o una regastrectomía92,95.
Complicaciones quirúrgicas tempranas
- Infección del sitio quirúrgico.
- Fuga en línea de grapas: gástrica o duodenal.
- Fuga de anastomosis: enteroentérica, duodenoileal.
- Estenosis de la anastomosis duodenal.
- Absceso intraabdominal.
- Hernias internas.
- Sepsis.
- Sangrado intraabdominal.
- Hemorragia digestiva superior e inferior.
- Pancreatitis aguda.
- Lesión esplénica/esplenectomía.
Complicaciones médicas
- Trombosis venosa profunda.
- Embolismo pulmonar.
- Neumonía.
- Síndrome de respuesta inflamatoria sistémica.
- Problemas cardiovasculares.
- Infarto del miocardio, arritmias, accidentes cerebro-vasculares.
Las complicaciones quirúrgicas más frecuentes dependen de si la cirugía se hizo abierta o por laparoscopia. Obviamente, como es sabido, la complicación más frecuente cuando es por laparotomía es la infección de la herida operatoria que puede ser > 20% y su secuela la hernia incisional o eventración que puede llegar hasta un 24,5%96, otras series abiertas reportan valores muy inferiores al 5%85. Esto no ocurre cuando es laparoscópica que está alrededor del 5% (4,76%17, 4,8%25). El absceso intraabdominal no secundario a fuga puede estar alrededor del 6,8% en series laparoscópicas22. Ahora bien las complicaciones quirúrgicas mayores más temidas son el sangrado y las diferentes condiciones de fuga, ya sean de la gastrectomía o del muñón duodenal o de las dos anastomosis. La primera, o sea, el sangrado intraabdominal puede oscilar entre 2,4%25 y 3,4%22 llegando inclusive a ser de un 10%21 en series pequeñas. En series más grandes como la de Hess96 es menor al 1%. Esta complicación usualmente no requiere reintervención y se puede manejar médicamente21,22,25,96. La otra complicación mayor como es la fuga tiene diferentes consideraciones, dependiendo de donde ocurra. Si es en la línea de grapas de la gastrectomía vertical, usualmente en el ángulo de His puede manejarse desde drenaje simple con o sin colocación de prótesis97,98, reintervención para reparar19, uso de gastrostomía en fugas distales99 o una gastrectomía total100 y no pareciera depender del reforzamiento o no de la línea de grapas101. El otro problema importante es la fuga de la anastomosis duodenoileal, que es la más temida y la más frecuente llegando inclusive a un 1,9% en algunas series17, Buchwald88 reporta 1,6% y Marceau85 menos del 1%. El problema es el impacto en la mortalidad por la sepsis que ella desencadena. A pesar que la mortalidad reportada por Marceau85 es del 1,6% llegando a bajar a 1,1% en su revisión de más de 1400 casos102, el 40% de esa mortalidad es debida a fuga de la anastomosis, por ello se debe hacer hincapié en ella, con una buena exposición y evitando la tensión, que son dos factores que contribuyen a ello. Esto se logra con la ligadura de la arteria gástrica derecha, como muy bien refiere Marchesini en una carta al editor escrita en 2007103. Resalta en ésta la irrigación que se logra a través de la submucosa a partir de la arteria gástrica izquierda citando sus trabajos sobre vascularización gástrica. Nos parece una estrategia adecuada para lograr una buena anastomosis ya sea por laparoscopia21 o abierta.
Las otras complicaciones quirúrgicas o médicas ya mencionadas se resuelven convencionalmente. Inclusive la estenosis de la anastomosis duodenal que va desde un 1,5%12 hasta un 10%104 responde a la dilatación con balones neumáticos19. Debe resaltarse el peso que adquiere el tromboembolismo pulmonar como causa de muerte en las grandes series, que si bien no es tan frecuente 0,5%96 puede llegar a constituir el 60% de las causas por muerte médica85.
De manera que la mortalidad del switch duodenal puede ir del 0% como citan Rabkin12 , Buchwald88 y Weiner17, hasta un 7,6% en una serie pequeña por laparoscopia de Kim y Gagner30, 1,9% en series más grandes como reporta Marceau en 199885 y baja a un 1,1% en el 2007102. Hess84 informa de 0,57%, Dolan33 0,7% Baltasar 0,8%86, Anthone32 1,4%.
Complicaciones tardías
Ellas son básicamente las derivadas de la malabsorción nutricional pudiendo presentarse también complicaciones quirúrgicas tardías por hernias internas104 con obstrucción intestinal: 0,91% que puede alcanzar un 6%102.
Marcadores nutricionales
En un trabajo muy interesante Rabkin105 habla sobre marcadores nutricionales en el switch duodenal antes de hablar de déficit nutricional. Es importante recalcarlo, a pesar de ser una cirugía con un alto componente malabsortivo ya que muchos de estos pacientes vienen desnutridos a la cirugía106. En su opinión deben evaluarse los aspectos relativos a las proteínas, metabolismo del calcio: calcio, vitamina D, y PTH, evaluación hematológica: hemoglobina, hierro sérico, ferritina, ácido fólico, vitamina B12, función hepática: ALT, AST, fosfatasas alacalinas y bilirrubina asi como también otras vitaminas liposolubles: A, E y K, concluyendo en su trabajo que sólo se afectan ligeramente la PTH y la hemoglobina105, inclusive menciona mejoría de los niveles de Vitamina B12 y ácido fólico. Sin embargo otros autores con series numerosas como Marceau85 presentan otros hallazgos con disminución de calcio en 8% de los pacientes, así como también de la vitamina A en 5% de la serie, 6% de descenso en los pacientes de los valores de hemoglobina y un 17% de elevación de la PTH en el total de la casuística85,102. Hallazgos similares refiere Anthone32 y Vázquez Prado107 y ya lo menciona éste en su trabajo, que esos cambios dependen de la longitud del canal comun34, cuando es de 50 cm similar a la técnica de Scopinaro los cambios nutricionales son similares33, independientemente de los cambios estacionales de algunas vitaminas liposolubles108, por lo que Marceaux recomienda102 administrar: Hierro:300 mg , Calcio: 500 mg, Vitamina D: 50.000 Ud, Vitamina A: 20.000 Ud y un multivitamínico diariamente y en el consenso del año 2008 de la AACE/ASMBS109 sugieren tratamiento preventivo, asi como controles periódicos cada tres meses el primer año y dependiendo de las comorbilidades cambiará los siguientes años y dadas estas características malabsortivas del Cruce Duodenal sugieren además realizar algunas determinaciones sanguíneas preoperatorias diferentes para otras cirugías bariátricas109. Por último debe destacarse que la función hepática no se altera mayormente85,102,105,107 y por el contrario hay series que reportan mejoría de la esteatosis hepática no alcohólica110,111.
Calidad de vida
Existen pocos trabajos que evalúen la calidad de vida de estos pacientes, sobretodo a largo plazo y Marceaux85 diseñó un cuestionario que fue respondido por el 93% de los pacientes donde evalúan aceptación, vida social, higiene personal, caminar, subir escaleras, confianza en si mismo, relación marital y sexual, así como también el cambio en el apetito, vómitos, problemas abdominales, el tipo y características de las evacuaciones, mal olor de ellas. Concluye que hay un grado de satisfacción de 3,6/5102, estando el 95% de los pacientes satisfechos. Es importante destacar que pudiese presentarse casos de malnutrición importante que obliguen a realizar una cirugía de Revisión y así Marceaux85 refiere un 0,1% anual y Hess84 3,7% en los primeros 1.000 casos. Casi siempre la causa es la desnutrición severa que no puede ser manejada médicamente.
Futuro
Dados los buenos resultados de esta cirugía para el control de exceso de peso así como de las comorbilidades23,24, siendo la que hasta ahora permite lograr los mejores, debería considerarse como una técnica de elección para el tratamiento de esta enfermedad. Probablemente el desarrollo tecnológico progresivo va a permitir que las desventajas asociadas a su complejidad técnica sean superadas disminuyendo los costos, las complicaciones y la mortalidad para hacerla más competitiva en relación al Bypass gástrico en Y de Roux.
Referencias
1. Word Reference Dictionary English-Spanish Dictionary 2012. http://www.wordreference.com/ [ Links ]
2. DeMeester T, Fuchs K, Ball Ch et al. Experimental and Clinical Results with Proximal End-to-End Duodenojejunostomy for Pathologic Duodenogastric Reflux. Ann Surg 1987; 206 (4): 414-424. [ Links ]
3. Mann FC, Williamson CS. The experimental production of peptic ulcer. Ann Surg 1923; 77: 409-422. [ Links ]
4. Strignano P, Collard JM, Michel JM et al. Duodenal Switch Operation for Pathologic Transpyloric Duodenogastric Reflux. Ann Surg 2007; 245 (2): 247-253. [ Links ]
5. Hess DS. Bilio-pancreatic bypass with a duodenal switch procedure. Obes Surg 1994; 4: 106 (abstract 12). [ Links ]
6. Scopinaro N, Gianetta E, Civalleri D et al. Biliopancreatic bypass for obesity: initial experience in man. Br J Surg 1979; 66: 618-20. [ Links ]
7. Scopinaro N, Adami GF, Marinari GM, Gianetta E, Traverso E, Friedman D, et al. Bilio-pancreatic diversion. World J Surg 1998; 22 (9): 936-46. [ Links ]
8. Marceau I', Biron S, Bourque RA et al. Bilio-pancreatic diversion with a new type of gastrectomy. Obes Surg 1993; 3: 39-45. [ Links ]
9. Baltasar A, Bou R, Cipagauta LA et al. Hybrid bariatric surgery: Bilio-pancreatic diversion and duodenal switch. Preliminary experience. Obes Surg 1995; 5: 419-23. [ Links ]
10. Baltasa A, del Río J, Bengochea M, Escrivá C et al. Cirugía híbrida bariátrica: Cruce duodenal en la derivación bilio-pancreática. Cir Esp 1996; 59: 483-486. [ Links ]
11. Baltasar A, del Río J, Escrivá C et al. Preliminary results of the duodenal switch. Obes Surg 1997; 7: 500-504. [ Links ]
12. Rabkin R, Rabkin J, Metcalf B et al. Laparoscopic Technique for Performing Duodenal Switch. Obes Surg 2003; 13: 263-268. [ Links ]
13. Ren CJ, Patterson E, Gagner M. Early results of laparoscopic biliopancreatic diversion with duodenal switch: a case series of 40 consecutive patients. Obes Surg 2000; 10: 514-23. [ Links ]
14. Baltasa A, Bou R, Miró J, Pérez N. Cruce duodenal por laparoscopia en el Tratamiento de la Obesidad mórbida: técnica y estudio preliminar. Cir Esp Agosto 2001; 70 (2): 102-104. [ Links ]
15. Baltasar A, Bou R, Miro J, Bengochea M, Serta C, Pérez N. Laparoscopic bilio pancreatic diversión with duodenal switch: technique and initial experience. Obes Surg 2002; 12 (2): 245-8. [ Links ]
16. Feng J, Gagner M. Laparoscopic Biliopancreatic Diversion with Duodenal Switch. Seminars in Laparoscopic Surgery 2002; 9 (2): 125-129. [ Links ]
17. Weiner R, Blanco-Engert R, Weiner S, et al. Laparoscopic Biliopancreatic Diversion with Duodenal Switch: Three Different Duodeno-ileal Anastomotic Techniques and Initial Experience. Obes Surg 2004; 14: 334-340. [ Links ]
18. Praveen Raj P, Kumaravel R, Chandramaliteeswaran C, et al. Is Laparoscopic Duodenojejunal Bypass with Sleeve an Effective Alternative to Roux en Y gastric Bypass in Morbidly Obese Patients:Preliminary Results of a Randomized Trial. Obes Surg 2012; 22 (3): 422-426. [ Links ]
19. Kasama K, Tagaya N, Kanehira E et al. Laparoscopic sleeve gastrectomy with duodenojejunal bypass: technique and preliminary results. Obes Surg 2009; 19: 1341-5. [ Links ]
20. Libanori HT. Derivaçâo Biliopancreática com Gastrectomía Longitudinal e Preservaçâo Pilórica (Duodenal Switch). Einstein 2006 (Suppl. 1): S91-S96. [ Links ]
21. Navarrete SA, Leyba JL, Llopis SN. Laparoscopic sleeve gastrectomy with duodenojejunal bypass for the treatment of type 2 diabetes in non-obese patients: technique and preliminary results. Obes Surg 2011; 21 (5): 663-7. [ Links ]
22. Sovik T, Taha O, Aasheim ET. Randomized Clinical Trial of laparoscopic gastric bypass versus laparoscopic duodenal switch for superobesity. Br J Surg 2010; 97: 160-166. [ Links ]
23. Buchwald H, Avidor Y, Braunwald E et al. Bariatric surgery: a systematic review and meta-analysis. JAMA 2004; 292: 1724-37. [ Links ]
24. Buchwald H, Estok R, Fahrbach K, Banel D, Jensen MD, Pories WJ, Bantle JP, Sledge I. Weight and Type 2 Diabetes after Bariatric Surgery: Systematic Review and Meta-analysis. Am J Med 2009; 122: 248-256. [ Links ]
25. Parikh MS, Shen R, Weiner M, Siegel N, Ren CJ. Laparoscopic bariatric surgery in super-obese patients (BMI > 50) is safe and effective: a review of 332 patients. Obes Surg 2005; 15: 858-863. [ Links ]
26. Weiner R, Weiner S, Pomhoff I, et al. Laparoscopic Sleeve Gastrectomy. Influence of Sleeve Size and Resected Gastric Volume. Obes Surg 2007; 17: 1297-1305. [ Links ]
27. Bernstine H, Tzioni-Yehoshua R, Grosher D, et al. Gastric Emptying is not Affected by Sleeve Gastrectomy -Scintigraphic Evaluation of Gastric Emptying- after Sleeve Gastrectomy without Removal of the Gastric Antrum. Obes Surg 2009; 19:293-298. [ Links ]
28. Dapri G, Cadiére GB, Himpens J. Reinforcing the Staple Line During Laparoscopic Sleeve Gastrectomy. Prospective Randomized Clinical Study Comparing Three Different Techniques. Obes Surg 2010; 20: 462-467. [ Links ]
29. Consten E, Gagner M, Pomp A et al. Decreased Bleeding after Laparoscopic Sleeve Gastrectomy with or without Duodenal Switch for Morbid Obesity using a Stapled Butressed Absorbable Polymer Membrane. Obes Surg 2004; 14: 1360-1366. [ Links ]
30. Prachand VN, Davee RT, Alverdy JC. Duodenal switch provides superior weight loss in the super-obese (BMI > 50 kg/m2) compared with gastric bypass. Ann Surg 2006; 244:611-619. [ Links ]
31. Kim WW, Gagner M, Kini S, Inabnet WB, Quinn T, Herron D, et al. Laparoscopic vs. open biliopancreatic diversion with duodenal switch: a comparative study. J Gastrointest Surg 2003; 7(4): 552-7. [ Links ]
32. Anthone GJ, Lord RV, DeMeester TR, Crookes PF. The duodenal switch operation for the treatment of morbid obesity. Ann Surg 2003; 238 (4): 618-27. [ Links ]
33. Dolan K, Hatzifotis M, Newbury L, Lowe N, Fielding G. A clinical and nutritional comparison of biliopancreatic diversion with and without duodenal switch. Ann Surg 2004; 240 (1): 51-6. [ Links ]
34. Hess DS. Limb measurements in duodenal switch. Obes Surg 2003; 13 (6): 966. [ Links ]
35. Keshishian A, Zahriya k, Hartoonian T, et al. Duodenal Switch is a Safe Operation for Patients Who Have Failed Other Bariatric Operations. Obes Surg 2004; 14: 1187-1192. [ Links ]
36. Lee S, Sahagian KG, Schriver JP. Relationship between varying Roux limb lengths and weight loss in gastric bypass. Curr Surg 2006; 63: 259-63. [ Links ]
37. Orci L, Chilcott M, Huber O. Short versus long Roux-en-Y gastric Bypass Surgery for the Treatment of Morbid and Super Obesity a Systematic Review of the Literature. Obes Surg 2011; 21: 797-801. [ Links ]
38. Higa KD, Boone KB, Ho T. Complications of the laparoscopic Roux en Y gastric bypass: 1,040 patients-what have we learned? Obes Surg 2000; 10 (6): 509-13. [ Links ]
39. Weiner R. Duodenal Switch. In: García Caballero M, Tinahones F, Cohen R, editors. Diabetes Surgery. Primera ed. Madrid: Mc Graw Hill/Interamericana de España, S.L., 2010, pp. 247-56. [ Links ]
40. Wittgrove AC, Clark GW, Temblay LJ. Laparoscopic gastric bypass, Roux en-Y: preliminary report of 5 cases. Obes Surg 1994; 4: 352-7. [ Links ]
41. Wittgrove AC, Clark GW. Laparoscopic gastric bypass, Roux en Y-500 patients: technique and results, with 3-60 month follow up. Obes Surg 2000; 10 (3): 233-9. [ Links ]
42. Leyba JL, Navarrete Ll S, Navarrete A S, et al. Laparoscopic Gastric Bypass for morbidity obesity: prospective study with gastro-jejunum anastomosis techniques. JSLS 2008; 12: 385-388. [ Links ]
43. Navarrete S. Laparoscopic Sleeve Gastrectomy with Duodenojejunal Bypass for the Treatment of Diabetes Mellitus Type 2 in Non-obese Patients: Technique. Short Duodenal Switch in Metabolic Surgery. In: García Caballero M, Tinahones F, Cohen R, editors. Diabetes Surgery. Primera ed. Madrid: Mc Graw Hill/Interamericana de España, S.L., 2010, pp. 259-68. [ Links ]
44. Consensus Statement. Prevention and Treatment of Venous Thromboembolism Internacional Consensus Statement. Internacional Angiology. Vol. 25. No 2. 2006. [ Links ]
45. Peterli R, Wölnerhanssen B, Peters T, Devaux N, Kern B, Christoffel-Courtin C, Drewe J, et al. Improvement in glucose metabolism after bariatric surgery: comparison of Laparoscopic Roux-en-Y Gastric Bypass and Laparoscopic Sleeve Gastrectomy. Ann Surg 2009, 250 (2): 234-241. [ Links ]
46. Schauer P, Kashyap S, Wolski K, et al. Bariatric Surgery vs Intensive Medical Therapy in Obese Patients with Diabetes. N Engl J Med 2012 en prensa. [ Links ]
47. Williamson DF, Thompson TJ, Thun M, et al. Intentional weight loss and mortality among overweight individuals with diabetes. Diabetes Care 2000; 23: 1499-1504. [ Links ]
48. Rubino F, Marescaux J. Effect of duodenal-jejunal exclusion in a non-obese animal model of type 2 diabetes: a new perspective for an old disease. Ann Surg 2004; 239: 1-11. [ Links ]
49. Doucet E, St Pierre S, Almerás N et al. Changes in energy expenditure and substrate oxidation resulting from weight loss in obese men and women: is there an important contribution of leptin? J Clin Endocrinol Metabol 2000; 85: 1550-1556. [ Links ]
50. Doucet E, St Pierre S, Almeräs N, et al. Evidence for the existence of adaptive thermogenesis during weight loss. Br J Nutr 2001; 85: 715-723. [ Links ]
51. Leibel RL, Rosenbaum M, Hirsch J. Changes in energy expenditure resulting from altered body weight. N Engl J Med 1995; 332: 621-628. [ Links ]
52. De Castro C, de Lima M MI, Rasera IJ, et al. Effects of Roux-en-Y gastric bypass on resting energy expenditure in women. Obes Surg 2008; 18: 1376-1380. [ Links ]
53. Adam TC; Jocken J, Westerterp-Platenga MS. Decreased glucagon-like peptide 1 release after weight loss in overweight/obese subjects. Obes Res 2005; 13: 710-716. [ Links ]
54. Adam TC; Lejeune MP, Westerterp-Platenga MS. Nutrient-stimulated glucagon-like peptide 1 release after body-weight loss and weight maintenance in human subjects. Br J Nutr 2006; 95: 160-167. [ Links ]
55. Laferrere B, Teixeira J, McGinty J, et al. Effect of weight loss by gastric bypass surgery versus hypocaloric diet on glucose and incretin levels in patients with type 2 diabetes. J Clin Endocrinol Metab 2008; 93: 2479-2485. [ Links ]
56. Rubino F, Forgione A, Cummings D, et al. The Mechanism of Diabetes Control After Gastrointestinal Surgery Reveals a Role of the Proximal Small Intestine in the Pathophysiology of Type 2 Diabetes. Ann Surg 2006; 244 (5): 741-749. [ Links ]
57. Frühbeck G, Diez-Caballero A, Gil MJ, et al. The Decrease in Plasma Ghrelin Concentrations Following Bariatric Surgery Dependes on the Functional Integrity of the Fundus. Obes Surg 2004; 14: 606-12. [ Links ]
58. Cummings DE, Overduin J. Gastrointestinal regulation of food intake. J Clin Invest 2007; 117: 13-23. [ Links ]
59. Saliba J, Wattacheril J, Abumrad N. Endocrine and metabolic response to gastric bypass. Current Opinion in Clinical Nutrition & Metabolic Care 2009; 12: 515-521. [ Links ]
60. Wren AM, Seal LJ, Cohen MA, et al. Ghrelin enhances appetite and increases food intake in humans. J Clin Endocrinol Metab 2001; 86: 5992. [ Links ]
61. Cummings DE, Foster-Schubert KE, Overduin J. Ghrelin and energy balance: focus on current controversies. Curr Drug Targets 2005; 6: 153-169. [ Links ]
62. Prince AC, Brooks SJ, Stahl D, Treasure J. Systematic review and meta-analysis of the baseline concentrations and physiologic responses of gut hormones to food in eating disorders. Am J Clin Nutr 2009; 89: 755-765. [ Links ]
63. Vetter ML, Cardillo S, Rickels MR, Yqbal N. Narrative review: effect of bariatric surgery on type 2 diabetes mellitus. Ann Intern Med 2009; 150: 94-103. [ Links ]
64. Roth CL, Reinehr T, Schernthaner GH, et al. Ghrelin and obestatin levels in severely obese women before and after weight loss after Roux-en-Y gastric bypass surgery. Obes Surg 2009; 19: 29-35. [ Links ]
65. Hosoda H, Kojima M, Matsuo H, Kangawa H. Ghrelin and desacyl ghrelin: two major forms of rat ghrelin peptide in gastrointestinal tissue. Biochem Biphys Res Commun 2000; 279: 909-913. [ Links ]
66. Li F, Zhang G, Liang J, et al. Sleeve Gastrectomy Provides a Better Control of Diabetes by Decreasing Ghrelin in the Diabetic Goto-Kakizaki Rats. J Gastrointest Surg 2009; 13: 2302-2308. [ Links ]
67. Dezaki K, Sone H, Yada T. Ghrelin is a phisiological regulator of insulin release in pancreatic islets and glucose homeostasis. Pharmacology & Therapeutics 2008; 118: 239-249. [ Links ]
68. Delhanty P, Van der Lely AJ. Ghrelin and Glucose Homeostasis. Peptides 2011; 32 (11): 2309-18. [ Links ]
69. Cohen R, Uzzan B, Bihan H, et al. Ghrelin Levels and Sleeve Gastrectomy in Super-SuperObesity. Obes Surg 2005; 15: 1501-1502. [ Links ]
70. Karamanakos SN, Vagenas K, Kalfarentzos F, Alexandrides TK. Weight loss, appetite suppression, and changes in fasting and postprandial ghrelin and peptide-YY levels after Roux-en-Y gastric bypass and sleeve gastrectomy: a prospective, double blind study. Ann Surg 2008; 247: 401-7. [ Links ]
71. Rizello M, Abbatini F, Casell G, et al. Early Posoperative Insulin Resistance Changes After Sleeve Gastrectomy. Obes Surg 2010; 20: 50-55. [ Links ]
72. Vidal J, Ibarzabal A, Nicolau J, et al. Short Term Effects of Sleeve Gastrectomy on Type2 Diabetes mellitus in Severely Obese Subjects. Obes Surg 2007; 17: 1069-74. [ Links ]
73. Vidal J, Ibarzabal A, Romero F, et al. Type2 Diabetes mellitus and The Metabolic Syndrome Following Sleeve Gastrectomy in Severely Obese Subjects. Obes Surg. 2008: 18:1077-82 [ Links ]
74. Silecchia G, Boru Cr, Pecchia A, et al. Effectiveness of laparoscopic Sleeve Gastrectomy (First Stage of Biliopancreatic Diversion with duodenal switch) on co-morbidities in Super-Obese High Risk Patients. Obes Surg 2006; 16: 1138-44. [ Links ]
75. Mason EE: The mechanism of surgical treatment of type 2 diabetes. Obes Surg 2005; 15: 459-461. [ Links ]
76. Patrili A; Facchiano E; Sanna, et al. The enteroinsular axis and the recovery from type 2 diabetes after bariatric surgery. Obes Surg 2004; 14: 840-848. [ Links ]
77. Mason EE. Ileal Transposition and enteroglucagon/GLP1 in obesity (and diabetic) surgery. Obes Surg 1999; 9: 223-228. [ Links ]
78. Cummings DE, Overduin J, Foster-Schubert KE. Gastric bypass for the obesity: mechanism of weight loss and diabetes resolution. J Clin Endocrin Metab 2004; 89: 2608-2615. [ Links ]
79. Troy S, Soty M, Ribeiro L, et al. Intestinal Gluconeogenesis is a key factor for early metabolic changes after gastric bypass but not after gastric lap-band in mice. Cell Matabolism 2008; 8:201-211. [ Links ]
80. Scopinaro N, Gianetta E, Civalleri D, et al. Two years of Clinical Experience with biliopancreatic bypass for obesity. Am J Clin Nutr 1980; 33: 506-14. [ Links ]
81. Scopinaro N, Gianetta, Adami GF, et al. Biliopancreatic diversion for obesity at eighteen years. Surgery 1996; 119: 261-269. [ Links ]
82. Vásquez C, Morejón E, Muñoz C, et al. Repercusión nutricional de la Cirugía bariátrica según la técnica de Scopinaro: análisis de 40 casos. Nutr Hosp 2003; 18: 189-193. [ Links ]
83. Buchwald H, Oien D. Metabolic/Bariatric Surgery Worldwide 2008. Obes Surg 2009. [ Links ]
84. Hess DS, Hess DW, Oakley RS. The Biliopancreatic Diversion with Duodenal Switch. Obes Surg 2005; 15: 408-416. [ Links ]
85. Marceau P, Hould F-S, Simard S, et al. Biliopancreatic Diversion with Duodenal Switch. World J. Surg 1998; 22: 947-954. [ Links ]
86. Baltasar A. Cruce Duodenal manual y Gastrectomía Tubular por Laparoscopia. Cir Andal 2005; 16: 204-208. [ Links ]
87. Lee WJ, Wang W. Bariatric surgery: Asia-pacific perspective. Obes Surg 2005; 15: 751-757. [ Links ]
88. Buchwald H, Kellogg TA, Leslie DB, et al. Duodenal Switch Operative mortality and morbidity are not impacted by body mass index. Ann Surg 2008; 248: 541-548. [ Links ]
89. Regan JP, Inabnet WB, Gagner M, Pomp A. Early experience with two-stage laparoscopic Roux-en-Y gastric bypass as an alternative in the super-super obese patient. Obes Surg 2003; 13: 861-4. [ Links ]
90. Cottam D, Qureshi FG, Mattar SG, et al. Laparoscopic sleeve gastrectomy as an initial weight-loss procedure for high-risk patients with morbid obesity. Surg Endosc 2006; 20: 859-63. [ Links ]
91. Hamoui N, Anthone GJ, Kaufman HS, Crookes PF. Sleeve gastrectomy in the high-risk patient. Obes Surg 2006; 16: 1445-9. [ Links ]
92. Gagner M. Laparoscopic Sleeve Gastrectomy with Duodenojejunal Bypass for Severe Obesity and/or Type 2 Diabetes May Not Require Duodenojejunal Bypass Initially. Letter to the Editor. Obes Surg 2010; 20: 1323-4. [ Links ]
93. Gagner M, Deitel M, Kalberer TL, Erickson AL, Crosby RD. The Second International Consensus Summit for Sleeve Gastrectomy, March 19-21, 2009. Surg Obes Relat Dis 2009; 5 (4):476-85. [ Links ]
94. Dapri G, Cadiere GB, Himpens J. Laparoscopic Repeat Sleeve Gastrectomy vs Duodenal Switch after Isolated Sleeve Gastrectomy for Obesity. SOARD 2011; 7: 38-44. [ Links ]
95. Baltasar A, Serra C, Pérez N, et al. Laparoscopic Sleeve Gastrectomy: A Multipurpose Bariatric Operation. Obes Surg 2005; 15: 1124-28. [ Links ]
96. Hess DS, Hess DW. Biliopancreatic Diversion with a Duodenal Switch. Obes Surg 1998; 8: 267-282. [ Links ]
97. Casella G, Soricelli E, Rizzello M, et al. Nonsurgical Treatment of Staple Line Leaks after Laparoscopic Sleeve gastrectomy. Obes Surg 2009; 19: 821-26. [ Links ]
98. Thaler K. Treatment of Leaks and Other Bariatric Complications with Endoluminal Stents. J Gastrointest Surg 2009; 13:1567-69. [ Links ]
99. Court I, Wilson A, Benotti P, et al. T-Tube Gastrostomy as a Novel Approach for Distal Staple Line Disruption after Sleeve gastrectomy for Morbid Obesity: Case Report and Review of the Literature. Obes Surg 2010; 20: 519-22. [ Links ]
100. Serra C, Baltasar A, Pérez N, et al. Total Gastrectomy for Complications of the Duodenal Switch, with Reversal. Obes Surg 2006;1082-86. [ Links ]
101. Chen B, Kiriakopoulos A, Tsakayannis D, et al. Reinforcement Does Not Necessarily Reduce the Rate of Staple Line Leaks After Sleeve Gastrectomy. A Review of the Literature and Clinical Experience. Obes Surg 2009; 19: 166-72. [ Links ]
102. Marceau P, Biron S, Hould F-S, et al. Duodenal Switch: Long-Term Results. Obes Surg 2007; 17: 1421-1430. [ Links ]
103. Marchesini JB. A Safer and Simpler Technique for The Duodenal Switch. Correspondence to the Editor. Obes Surg 2007; 17: 1136. [ Links ]
104. Mitchell M, Carabetta J, Shah R, et al. Duodenal Switch Gastric Bypass Surgery for Morbid Obesity: Imaging of Postsurgical Anatomy and Posoperative gastrointestinal Complications. AJR 2009; 193: 1576-80. [ Links ]
105. Rabkin R, Rabkin J, Metcalf B, et al. Nutritional Markers following Duodenal Switch for Morbid Obesity. Obes Surg 2004; 14: 1-7. [ Links ]
106. Schweiger Ch,Weiss R, Berry E, et al. Nutritional Deficiencies in Bariatric Surgery Candidates. Obes Surg 2010; 20: 193-97. [ Links ]
107. Vázquez Prado A, García Fadrique A, Montalvá Orón EM. Evolución de los parámetros sanguíneos tras cirugía de la obesidad mórbida mediante la técnica del cruce duodenal. Nutr Hosp 2008; 23: 449-457. [ Links ]
108. Granado-Lorencio F, Simal-Antón A, Blanco-Navarro I, et al. Depletion of Serum Carotenoid and Other Fat-Soluble Vitamin Concentrations following Obesity Surgery. Obes Surg 2011;21:1605-11. [ Links ]
109. AACE/TOS/ASMBS Bariatric Surgery Guidelines. Endocr Pract 2008; 14 (Suppl. 1): 1-83. [ Links ]
110. Baltasar A, Serra C, Pérez N, et al. Clinical Hepatic Impairment after the Duodenal Switch. Obes Surg 2004; 14: 77-83. [ Links ]
111. Keshishian A, Zahriya K, Willes EB. Duodenal switch has no detrimental effects on hepatic function and improves hepatic steatohepatitis after 6 months. Obes Surg 2005; 15: 1418-1423. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Salvador Navarrete Aulestia.
Profesor Titular. Universidad Central de Venezuela.
Jefe de Servicio de Cirugía II. Hospital Universitario de Caracas.
Jefe de Cátedra Clínica y Terapéutica Quirúrgica B.
Escuela Luis Razetti. UCV. Caracas. Venezuela.
C/ Ramón Margalef 6A, 4.oB Arroyo de la Encomienda.
47195 Valladolid. España.
E-mail: jimo0610@gmail.com
Recibido: 12-IV-2012.
Aceptado: 15-IV-2012.