Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Nutrición Hospitalaria
versión On-line ISSN 1699-5198versión impresa ISSN 0212-1611
Nutr. Hosp. vol.27 no.6 Madrid nov./dic. 2012
https://dx.doi.org/10.3305/nh.2012.27.6.6017
Importancia del género Alternaria como productor de micotoxinas y agente causal de enfermedades humanas
The importance of genus Alternaria in mycotoxins production and human diseases
M. Á. Pavón Moreno, I. González Alonso, R. Martín de Santos y T. García Lacarra
Departamento de Nutrición, Bromatología y Tecnología de los Alimentos. Facultad de Veterinaria. Universidad Complutense de Madrid. Madrid. España.
Este trabajo ha sido financiado por el Ministerio de Ciencia e Innovación (proyecto AGL2006-07659) y por la Comunidad de Madrid (proyecto Vigilancia Sanitaria 2009/AGR-1489).
Dirección para correspondencia
RESUMEN
Alternaría es un género fúngico muy común, donde se incluyen numerosas especies saprofitas, endofíticas y patógenas ampliamente distribuidas en el suelo y la materia orgánica en descomposición. Incluye especies patógenas que pueden invadir los cultivos vegetales antes y después de la recolección y es responsable de considerables pérdidas económicas, debido a que reduce el rendimiento de las cosechas y produce alteraciones en los vegetales durante su almacenamiento. Las especies del género Alternaría sintetizan más de 70 metabolitos secundarios tóxicos para las plantas (fitotoxinas), algunos de los cuales afectan también a personas y animales, por lo que se consideran micotoxinas. La exposición a las toxinas de Alternaría spp. se ha relacionado con la aparición de efectos adversos para la salud en personas y animales y, en muchos casos, se ha demostrado que tienen capacidad genotóxica, mutagénica, carcinogénica y citotóxica. Las micotoxinas de Alternaría spp. se han aislado de frutas (manzana, pera, melón, albaricoque, uvas, uvas pasas, fresa, aceituna, cítricos e higos desecados), hortalizas (tomate, pimiento y zanahoria) y tubérculos (patata), así como de numerosos alimentos procesados elaborados con materias primas contaminadas (zumos, conservas, salsas, etc.). Además, determinadas especies de Alternaría están implicadas en infecciones y alergias humanas, hasta el punto de que Alternaría se considera uno de los principales géneros fúngicos causantes de alergias.
Palabras clave: Micotoxinas. Alternaría spp. Toxicidad. Alimentos. Enfermedad humana.
ABSTRACT
Alternaría is a cosmopolitan fungal genus that includes saprophytic, endophytic and pathogenic species, widely distributed in soil and organic matter in decomposition. Plant pathogenic species affect cereals, vegetables and fruit crops in the field and during storage. Alternaría spp. contamination is responsible for some of the world's most devastating plant diseases, causing serious reduction of crop yields and considerable economic losses. Alternaría species produce more than 70 secondary metabolites which are toxic to plants, and some of these phytotoxins have been chemically characterised and reported to act as mycotoxins to humans and animals. Exposure to Alternaría spp. toxins has been linked to a variety of adverse effects on human and animal health, including genotoxic, mutagenic, carcinogenic and cytotoxic effects. Alternaría spp. mycotoxins have been isolated from fruits (apple, pear, melon, apricot, grapes, raisins, strawberry, olive, citrus fruits and dried figs), vegetables (tomato, pepper and carrot) and tubers (potato), as well as from several processed foodstuffs manufactured with damaged raw materials (juices, preserves, sauces, etc.). Moreover, Alternaría spp. are frequently associated with allergic reactions in sensitized individuals.
Key words: Mycotoxins. Alternaría spp. Toxicity. Food. Human disease.
Abreviaturas
ALT: Altenueno.
AOH: Alternariol.
AME: Alternariol monometil éter.
TeA: Ácido tenuazónico.
ATX: Altertoxina.
SEE: Síndrome del Edificio Enfermo.
Introducción
Los mohos son microorganismos cuya presencia en los alimentos puede tener consecuencias diversas y en ocasiones son de gran utilidad en la industria alimentaria. Determinadas especies de géneros fúngicos como Aspergillus, Penicillium, Rhizopus, Mucor o Geotrichum participan en la maduración de quesos, productos cárnicos crudos madurados y alimentos orientales a base de soja y cereales. Además, se emplean para la producción de metabolitos usados como aditivos en diferentes tipos de alimentos como zumos, licores o productos lácteos1. Sin embargo, también tienen consecuencias negativas, ya que la contaminación fúngica es una de las principales causas de alteración de los alimentos y la presencia de determinadas especies de géneros como Fusarium, Penicillium, Aspergillus o Alternaria constituye una amenaza para la salud de los consumidores debido a la producción de compuestos tóxicos para el ser humano (micotoxinas).
Las autoridades sanitarias europeas han establecido niveles máximos permitidos de determinadas micotoxinas como las aflatoxinas B1, B2, G1, G2 y M1, ocratoxina A, patulina, deoxinivalenol, zearalenona y fumonisinas B1 y B2, y toxinas T-2 y HT-2 en los alimentos2,3,4,5. Sin embargo, son cada vez más frecuentes los casos de productos hortofrutícolas y sus derivados en los que se demuestra la presencia de especies del género Alternaria, muchas de ellas productoras de micotoxinas como el altenueno (ALT), alternariol (AOH), alternariol monometil éter (AME), ácido tenuazónico (TeA) y altertoxinas (ATX). Este aumento en la incidencia de alimentos contaminados con Alternaria spp. y/o sus micotoxinas, causa especial preocupación por la repercusión que puede tener su presencia en la salud de los consumidores, debido a su elevado poder toxicológico6,7. Además, determinadas especies de Alternaria también se encuentran relacionadas con la aparición de infecciones y alergias en personas8,9.
Micotoxinas producidas por el género Alternaría
Las micotoxinas son metabolitos secundarios de bajo peso molecular (Pm < 700 kDa) producidos por determinadas especies fúngicas al final de la fase exponencial de crecimiento y durante la fase estacionaria. La ingestión, inhalación o absorción cutánea de estos compuestos provoca efectos adversos en la salud de animales y personas. Las micotoxinas pueden contaminar los alimentos, los piensos o las materias primas utilizadas para su elaboración, originando un grupo de enfermedades o trastornos, denominados micotoxicosis1,10,11.
Las especies del género Alternaria sintetizan más de 70 metabolitos secundarios tóxicos para las plantas (fitotoxinas), pero solo una pequeña parte de ellos se han caracterizado químicamente e identificado como compuestos tóxicos para personas y animales, por lo que se consideran micotoxinas (tabla I)7,12,13. Atendiendo a sus efectos sobre las plantas, las toxinas de Alternaria spp. se agrupan en toxinas no específicas de hospedador y toxinas específicas de hospedador. Las toxinas no específicas de hospedador afectan a una a una amplia variedad de especies vegetales, aunque en muchos casos su modo de acción no se ha identificado. Sin embargo, si se ha determinado la actividad fitotóxica de toxinas como el zinniol, el TeA y la tentoxina. El TeA inhibe la síntesis proteica, mientras que el zinniol afecta a la permeabilización de la membrana y la tentoxina inhibe la fosforilación debido a que se une a la cloroplasto ATP sintetasa14. Además, algunas de estas toxinas no específicas como el AOH, AME, ALT, TeA y ATX se han relacionado con la aparición de enfermedades en personas y animales13.
Las toxinas específicas de hospedador afectan a un menor número de especies vegetales. Por lo general, causan alteraciones severas en determinadas plantas donde se desarrolla la especie de Alternaria productora de estas toxinas. Aunque se han determinado los mecanismos de acción de algunas toxinas específicas de hospedador, como las AAL toxinas, ya que desempeñan un papel crucial en la patogenicidad de la especie que colonizan, todavía existen pocos estudios sobre su toxicidad en animales12.
El estudio de la síntesis de micotoxinas se realiza mediante el cultivo de las especies productoras en condiciones y medios de cultivo óptimos. Sin embargo, para que se produzcan las micotoxinas, además de la presencia de la especie productora, influyen las condiciones ambientales y la composición del sustrato. En la tabla I se muestran las especies productoras de las principales toxinas de Alternaria spp. descritas. Toxinas como el AOH, AME, ALT, TeA, ATX, TEN o altenusina pueden sintetizarlas diferentes especies del género15,16. Por el contrario, otras toxinas como el altersolanol, la macrosporina o el zinniol, solo las producen las especies del grupo de A. porri, al que pertenecen A. porri, A. dauci, A. solani y A. cucumerina17,18, mientras que las especies englobadas en el grupo de A. infectoria son las únicas productoras de infectopironas y novaezelandinas19,20. Por último, existen toxinas que solo las sintetizan determinadas cepas patógenas. En ese grupo se incluyen las AAL toxinas (A. alternata f. sp. lycopersici), AS toxina (A. alternata patotipo del girasol), AF toxina (A. alternata f. sp. fragariae), ACR toxina (A. alternata patotipo del limón rugoso) y ACTG toxina (A. alternata patotipo de las mandarinas). La AK toxina y la AM toxina se han detectado en peras y manzanas contaminadas con cepas patógenas de A. gaisen y A. mali, respectivamente14,21,22. Sin embargo, no todas las cepas pertenecientes a estos grupos producen siempre dichas toxinas, ya que la síntesis está determinada por las condiciones ambientales en que se desarrolla el moho.
Las especies de Alternaria pueden producir micotoxinas en intervalos de temperatura muy amplios, pero siempre con actividades de agua superiores a 0,90. Young et al.23 determinaron que la máxima producción de TeA en semillas de algodón inoculadas con A. tenuissima tiene lugar a 20 oC y con un 31,3% de humedad del grano. Magan y Lacey24 identificaron una producción máxima de AOH, AME y ALT en granos de trigo contaminados con A. alternata a 23 oC y 0,98 aw, mientras que en pulpa de tomate contaminada con varias especies de Alternaria, las condiciones óptimas para la producción de AOH, AME y TeA identificadas por Pose et al.25 fueron de 21 oC/0,934 aw, 33 oC/0,934 aw y 21 oC/0,982 aw, respectivamente. Por último, Oviedo y et al.26, observaron máximos de producción de AOH y AME a 0,98 aw, aunque la temperatura óptima dependía de la cepa de A. alternata que inoculaban en granos de soja irradiados.
Diversos estudios demuestran que la composición del sustrato en el que se desarrolla el moho influye en la producción de micotoxinas. En este sentido, aunque no existen datos sobre su influencia en la síntesis de micotoxinas de Alternaria spp., se ha descrito el efecto estimulante de determinados aminoácidos, ácidos grasos o metales como el zinc en la producción de aflatoxinas27. También se ha observado el efecto inhibidor de determinados compuestos fenólicos en la producción de varias micotoxinas28,29.
Propiedades físicas y químicas de las micotoxinas de Alternaria spp.
Las toxinas de Alternaria spp. se clasifican en cinco grupos atendiendo a sus estructuras químicas:
- Dibenzo-α-pironas: AOH, AME y ALT.
- Perileno quinonas: ATX-I, -II, -III.
- Ácidos tetrámicos: TeA.
- AAL toxinas: AAL-TA1, AAL-TA2, AAL-TB1, AAL-TB2.
- Otras estructuras: TEN.
En la tabla II se muestran las propiedades bioquímicas de las principales toxinas de Alternaria spp. Estas micotoxinas se aislaron, caracterizaron e identificaron entre los años 1953 y 19867. El estudio de las rutas de biosíntesis y el metabolismo del AOH, AME y ALT, demostró que se pueden conjugar con otras moléculas más polares como la glucosa, aminoácidos y sulfatos, presentes en los sustratos vegetales donde se producen. La formación de conjugados en los alimentos dificulta el desarrollo de métodos analíticos para su detección, debido a los cambios de polaridad que presentan respecto a las micotoxinas precursoras30,31,32. En cuanto al metabolismo de las toxinas, la hidroxilación del AOH, AME y el ALT y su conjugación con el ácido glucurónico y sulfatos se ha demostrado en estudios in vitro. Sin embargo, no se dispone de datos suficientes sobre la absorción, la distribución y excreción de las toxinas de Alternaria spp. en personas y animales.
Toxicidad de las micotoxinas producidas por Alternaria spp.
La exposición a las toxinas de Alternaria spp. se ha relacionado con la aparición de una gran variedad de efectos adversos en la salud de personas y animales. Determinados cultivos de Alternaria spp. son tóxicos en ratas, embriones de pollo y cultivos celulares humanos, y también son teratogénicos y fetotóxicos en ratones33,34,35,36. Además, los extractos de cultivos de A. alternata son mutagénicos en varios sistemas in vitro y cancerígenos en ratas alimentadas con piensos contaminados37,38,39,40. Por otra parte, Liu et al.41 relacionaron el consumo de alimentos contaminados con A. alternata con una elevada incidencia de cáncer de esófago. Los efectos tóxicos que los cultivos de Alternaria spp. producen en los diferentes modelos in vitro e in vivo son muy variables, ya que dependen del tipo de micotoxinas sintetizadas (tabla III).
Dibenzo-α-pironas
AOH y AME son mutagénicos, genotóxicos, carcinogénicos y citotóxicos en cultivos celulares animales y bacterianos. Presentan una actividad mutagénica elevada tanto en cultivos de Bacillus subtilis42, como de Escherichia coli43,44, y baja en cultivos de Salmonella Typhimurium40,45. Los estudios de genotoxicidad demuestran que el AOH tiene mayor actividad que el AME38,46,47,48,49. En cuanto al poder carcinogénico de estas micotoxinas, no existen estudios exhaustivos en animales. Sin embargo, en ratones alimentados con 50-100 mg de AME por kg de peso durante 10 meses, se desarrollaron alteraciones precancerosas en la mucosa esofágica50. Por otra parte, los estudios de toxicidad del ALT en larvas de camarón (Artemia salina) en salmuera, pusieron de manifiesto que las dosis letales medias de ALT (313 g/mL) son muy superiores a las del TeA (13 mg/mL) y AOH (200 mg/mL)51.
Ácido tenuazónico
La toxicidad del TeA se ha demostrado en plantas, embriones de pollo y en otras especies animales52. En perros, la ingesta de dosis diarias de 10 mg/kg de peso, provocó la aparición de hemorragias en diversos órganos. En las aves domésticas, una dosis de 10 mg/kg en el pienso disminuyó tanto la eficiencia alimenticia como la ganancia de peso e incrementó las hemorragias internas en las canales. Sin embargo, no se ha demostrado efecto mutagénico del TeA en cultivos bacterianos39,40. Al igual que con el AME, los ratones que consumieron pienso contaminado con TeA durante 10 meses, desarrollaron alteraciones en la mucosa esofágica, pero en este caso, la dosis diaria fue de 25 mg/kg50. Además, el consumo de sorgo contaminado con TeA, se ha relacionado con la aparición de un desorden hematológico en personas conocido como Onyalai7,53.
Altertoxinas
Las ATXs presentan actividad mutagénica en el test de Ames40,54,55,56. La actividad mutagénica de las ATXs (ATX-I, II, III) en ratones es superior a la del AOH y AME, siendo la ATX-III la de mayor actividad39,57. El potencial mutagénico de la ATX-III es 10 veces inferior al de la aflatoxina B1, que es la micotoxina con mayor actividad mutagénica en la especie humana55,56. También se ha demostrado que la ATX-I y la ATX-III son genotóxicas en cultivos celulares de ratón58.
Presencia de micotoxinas de Alternaria spp. en alimentos y piensos
Las toxinas de Alternaria spp. se aíslan con frecuencia de una gran variedad de productos vegetales frescos y procesados (tabla IV). La presencia de micotoxinas de Alternaria spp. en cereales es muy común, debido al almacenamiento de los granos en condiciones favorables para el crecimiento del moho. En este sentido, se ha detectado AOH, AME, ALT, TeA o TEN en granos de trigo, cebada, avena, centeno, arroz y maíz. El procesado de los granos de cereales no evita la presencia de micotoxinas, como lo demuestra el hecho de que las muestras de cereales de desayuno, harina, pasta o cerveza analizadas por diversos investigadores, contenían AOH, AME o TeA13,52,59,60,61,62. También se ha detectado la presencia de AME en papillas infantiles y TeA en alimentos infantiles que contenían cereales en su composición, lo cual causa especial preocupación, ya que estos alimentos son la base fundamental de la alimentación en las primeras etapas de la vida13.
En semillas oleaginosas como la colza, girasol, sésamo y linaza también se ha determinado la presencia de AOH y AME. En las semillas de colza y linaza se ha detectado además ALT y en las de girasol y sésamo TeA. La TEN solo se ha aislado a partir de semillas de girasol y la ATX-I de semillas de sésamo. Por otra parte, las mismas toxinas que contaminaban las semillas se detectaron en las muestras de aceite de semillas de girasol y sésamo13,63,64. Asimismo, se ha encontrado AOH y AME en legumbres como las lentejas y la soja65,66.
En numerosas frutas (manzana, pera, melón, albaricoque, uvas, uvas pasas, fresa, aceituna, cítricos e higos desecados), hortalizas (tomate, pimiento y zanahoria) y tubérculos (patata) se ha puesto de manifiesto la presencia de AOH, AME, ALT, TeA y TEN6,61,67,68,69,70,71. El consumo directo de frutas y hortalizas con putrefacción fúngica visible es improbable. Sin embargo, no es infrecuente aislar toxinas de Alternaria spp. a partir de alimentos procesados como salsas de tomate, ketchup, tomates desecados, conservas, mermeladas, vino o zumos de frutas (manzana, tomate, uva, naranja)70,72,73,74,75,76,77,78. La presencia de micotoxinas en alimentos procesados puede ser consecuencia de la utilización de materias primas con alteraciones fúngicas cuyos síntomas afectan solo a la parte interna, como ocurre en la putrefacción de las manzanas y los cítricos. Además, aunque se eliminen las zonas visiblemente alteradas, las toxinas de Alternaria spp. se pueden transferir a los tejidos circundantes79. Por otra parte, las industrias transformadoras no siempre disponen de métodos eficientes para detectar y eliminar completamente las materias primas afectadas con algún grado de alteración fúngica.
La presencia de micotoxinas de Alternaria spp. también se ha investigado en piensos. En este sentido, se han detectado cantidades elevadas de AOH, AME, ALT, ATX-I, TeA, TEN y AAL toxinas, en granos de cereales y semillas oleaginosas destinadas a la alimentación animal. Por lo general, las muestras que contenían mayores cantidades de micotoxinas tenían contaminaciones visibles de Alternaria spp., posiblemente debido a las condiciones de almacenamiento de los granos y semillas en las granjas, donde la elevada temperatura y humedad favorecen el crecimiento de determinadas especies de Alternaria y la producción de micotoxinas61,65,80,81,82.
Exposición humana a las micotoxinas de Alternaria spp.
La Autoridad Europea de Seguridad Alimentaria ha publicado recientemente los resultados de un estudio nutricional realizado para evaluar la exposición diaria a AOH, AME, TeA y TEN en los grupos de población comprendidos entre los 18 y 63 años13. En este estudio se determinó que los niveles diarios de ingesta eran de 1,9-39 ng/kg de peso para el AOH, 0,8-4,1 ng/kg de peso para el AME, 36-141 ng/kg de peso para el TeA y 0,01-1 ng/kg de peso para la TEN. Aunque la exposición a las micotoxinas de Alternaria spp. no se ha estudiado en la población infantil, se estima que su ingesta es dos o tres veces mayor que en la población adulta. Las estimaciones realizadas en este estudio se han establecido teniendo en cuenta únicamente alimentos de origen vegetal, puesto que no se ha demostrado la presencia de micotoxinas de Alternaria spp. en alimentos de origen animal.
Control y prevención de micotoxinas en alimentos
La contaminación de los alimentos con micotoxinas se produce de manera natural y su concentración puede aumentar como resultado de las condiciones ambientales o de operaciones inadecuadas de recolección, almacenamiento y elaboración de los productos alimentarios. Por ello, es necesario disponer de programas de control que eviten la contaminación con mohos toxigénicos. Asimismo, se deben aplicar medidas preventivas que minimicen el desarrollo fúngico en los alimentos, tales como el almacenamiento en condiciones idóneas de temperatura, humedad relativa y atmósfera. En este sentido, las autoridades oficiales de control de los alimentos están estableciendo programas preventivos y procedimientos para minimizar los riesgos asociados a la contaminación de los alimentos con micotoxinas. Dentro de estos programas se incluyen las buenas prácticas agrícolas (GAP: "Good Agricultural Practice") e industriales (GMP: "Good Manufacturing Practice") y la aplicación del sistema de Análisis de Peligros y Puntos de Control Crítico (APPCC).
El sistema APPCC identifica y evalúa, mediante un enfoque estructurado y sistemático, los peligros que hay que controlar para garantizar la inocuidad de los alimentos desde la granja hasta la mesa. Para llevar a cabo la aplicación efectiva del sistema APPCC con relación a los peligros derivados de la presencia de mohos toxigénicos en los alimentos, es necesario disponer de técnicas rápidas para la detección de mohos productores de micotoxinas tanto en materias primas como en alimentos elaborados. Esto permitiría adoptar las medidas necesarias para apartar de la cadena alimentaria los productos que puedan suponer un riesgo para la salud del consumidor, impidiendo de esta forma la presencia de micotoxinas en los alimentos elaborados. En este sentido es necesario contar con herramientas capaces de detectar de una forma rápida y precoz la presencia de Alternaria spp. en alimentos, debido especialmente a que no existe una normativa que regule los niveles máximos permitidos de las micotoxinas de Alternaria en alimentos.
El género Alternaria como agente causal de enfermedades humanas
Aunque el género Alternaria incluye principalmente especies patógenas de plantas, algunas especies también se encuentran relacionadas con la aparición de infecciones humanas. A. alternata y A. tenuissima producen la alternariosis cutánea, que se manifiesta con lesiones únicas o múltiples en forma de placas pardorojizas papulonodulares, pustulosas o ulcerocostrosas, localizadas en superficies corporales expuestas, siendo rara la diseminación sistémica. La alternariosis cutánea se considera una infección oportunista que aparece en personas inmunodeficientes, debido a que padecen síndrome de inmunodeficiencia adquirida (VIH), síndrome de Cushing, algún proceso tumoral, o que han recibido trasplantes de órganos9,83,84. Además, A. alternata y A. infectoria se han relacionado con la aparición de queratomicosis y endoftalmitis en personas que han sufrido un traumatismo o cirugía ocular85,86,87.
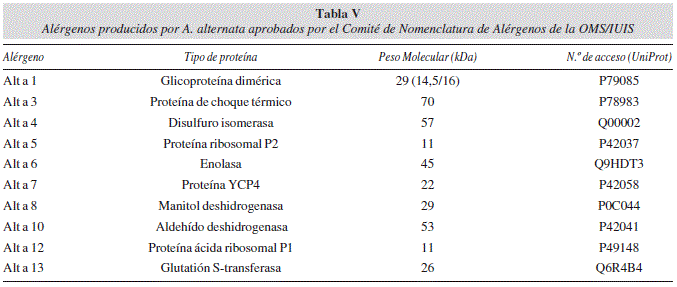
La incidencia de Alternaria spp. en infecciones humanas no es muy elevada, ya que solo ocurre en casos de personas inmunodeficientes. Sin embargo, Alternaria es, junto con Cladosporium, uno de los principales géneros fúngicos causantes de alergias8. La incidencia de personas sensibilizadas frente a alérgenos fúngicos alcanza hasta el 30% de los pacientes analizados, aunque depende en gran medida de las condiciones geográficas y climáticas. A. alternata es la principal especie productora de alérgenos del género, causando reacciones cutáneas positivas en el 70% de los pacientes alérgicos a antígenos fúngicos88. La fracción alergénica producida por A. alternata es muy heterogénea. El Comité de Nomenclatura de Alérgenos de la OMS/IUIS ha secuenciado y aprobado diez alérgenos de esta especie (tabla V)89,90,91,92. El principal alérgeno es el Alt a 1, al que reconocen los anticuerpos IgE de más del 90% de los pacientes alérgicos a A. alternata. La respuesta alérgica es mayor frente a las esporas fúngicas que frente a los restos micelares u otras células fúngicas. En el caso de Alternaria spp., la respuesta alérgica se presenta clínicamente como reacciones asmáticas de tipo inmediato mediadas por IgE91.
La abundancia relativa de conidios de A. alternata en el aire y su presencia en las casas con humedades convierte a este microorganismo en una fuente alergénica importante. La exposición a esporas fúngicas se diferencia de la exposición al polen en que las cantidades de esporas fúngicas por metro cúbico son mayores que las de granos de polen. Además, la exposición es más duradera, puesto que puede durar meses, mientras que la exposición a pólenes suele durar semanas. Esta exposición intensa y prolongada a A. alternata se asemeja a la exposición a restos epidérmicos de animales o a los ácaros del polvo y contribuye a la cronicidad y severidad del asma en las personas sensibilizadas frente a Alternaria spp.93. Por otro lado, la presencia de esporas de Alternaria spp. en el interior de los edificios se ha identificado como uno de los factores causantes del Síndrome del Edificio Enfermo (SEE). Se denomina así al conjunto de síntomas diversos que presentan los ocupantes de un edificio, y cuyas causas radican en el propio edificio94,95. La sintomatología relacionada con el SEE es muy variada, pudiendo llegar a ser compleja, ya que suele ser el resultado de la combinación de distintos efectos. Los síntomas más significativos incluyen:
- Irritaciones de ojos, nariz y garganta.
- Sequedad de la piel.
- Síntomas generales: dolor de cabeza, fatiga mental, y pérdida de capacidad de memoria a corto plazo.
Conclusiones
Muchas especies del género Alternaria producen micotoxinas, aunque solo se ha demostrado la producción natural en alimentos y piensos del TeA, AOH, AME, ALT, TEN, ATX-I y toxinas AAL. En estudios realizados in vitro, se ha demostrado la capacidad genotóxica, mutagénica, carcinogénica y citotóxica del AOH, AME, ATX o TeA. Por el contrario, no existen datos relevantes sobre la genotoxicidad y carcinogenicidad en estudios in vivo, aunque si se han demostrado alteraciones precancerosas en la mucosa esofágica de ratones. Actualmente, la UE no tiene establecidos límites máximos para ninguna de las micotoxinas de Alternaria spp. aisladas en alimentos. Sin embargo, teniendo en cuenta los datos sobre toxicidad y la creciente presencia de estas toxinas en alimentos, determinados organismos de la UE como el Instituto Federal de Evaluación de Riesgos de Alemania96, el Comité de Científicos Alimentarios de la República Checa97 y la Autoridad Europea de Seguridad Alimentaria13, consideran necesario realizar nuevos estudios sobre la toxicidad de las micotoxinas producidas por Alternaria spp. y su presencia en alimentos, con el fin de disponer de datos objetivos que permitan evaluar la situación actual con vistas a establecer límites máximos permitidos. Por último conviene señalar que, además de su importancia como productor de micotoxinas, el género Alternaria es uno de los principales mohos causantes de alergias y se encuentra implicado en la aparición de infecciones en personas inmunodeficientes.
Referencias
1. Soriano JM. Micotoxinas en alimentos. Díaz de Santos, Madrid; 2007. [ Links ]
2. Comisión Europea. Reglamento (CE) no 1881/2006 de la Comisión de 19 de diciembre de 2006 por el que se fija el contenido máximo de determinados contaminantes en los productos alimenticios. Diario Oficial de la Unión Europea 2007; L364: 5. [ Links ]
3. Comisión Europea. Reglamento (CE) no 1126/2007 de la Comisión de 28 de septiembre de 2007 que modifica el Reglamento (CE) no 1881/2006 por el que se fija el contenido máximo de determinados contaminantes en los productos alimenticios por lo que se refiere a las toxinas de Fusarium en el maíz y los productos del maíz. Diario Oficial de la Unión Europea 2007; L255: 14-17. [ Links ]
4. Comisión Europea. Reglamento (CE) no 105/2010 de la Comisión de 5 de febrero de 2010, que modifica el Reglamento (CE) no 1881/2006, por el que se fija el contenido máximo de determinados contaminantes en los productos alimenticios por lo que se refiere a la ocratoxina A. Diario Oficial de la Unión Europea 2010; L35: 7-8. [ Links ]
5. Comisión Europea. Reglamento (CE) no 165/2010 de la Comisión de 26 de febrero de 2010, que modifica, en lo que respecta a las aflatoxinas, el Reglamento (CE) no 1881/2006 por el que se fija el contenido máximo de determinados contaminantes en los productos alimenticios. Diario Oficial de la Unión Europea 2010; L50: 8-12. [ Links ]
6. Bottalico A, Logrieco A. Toxigenic Alternaria species of economic importance. En: Sinha KK, Bhatnagar D (eds). Mycotoxins in agriculture and food safety. Marcel Dekker Inc, New York, USA, 1998; 65-108. [ Links ]
7. Ostry V. Alternaria mycotoxins: An overview of chemical characterization, producers, toxicity, analysis and occurrence in foodstuffs. World Mycotoxin J 2008; 1: 175-188. [ Links ]
8. D'Amato G, Chatzigeorgiou G, Corsico R, Gioulekas D, Jaeger L, Jaeger S, et al. Evaluation of the prevalence of prick skin test positively to Alternaria and Cladosporium in patients with suspected respiratory allergy. Allergy 1997; 52: 711-716. [ Links ]
9. Mateu-Puchades A, Marquina-Vila A, Ferrando-Roca F, Neus M. Cutaneous alternariosis in renal transplant recipient. J Am Acad Dermatol 2010; 62: AB86. [ Links ]
10. Bennett JW, Klich M. Mycotoxins. Clin Microbiol Rev 2003; 16: 497-516. [ Links ]
11. Frisvad JC, Thrane U, Samson RA. Mycotoxin producers. En: Dijksterhuis J, Samson RA (eds). Food mycology: a multifaceted approach to fungi and food. CRC Press; Boca Raton, USA; 2007. [ Links ]
12. Barkai-Golan R. Alternaria mycotoxins. En: Barkai-Golan R, Nachman P (eds.). Mycotoxins in fruits and vegetables. Academic Press, San Diego, CA, USA, 2008; 185-203. [ Links ]
13. European Food Safety Authority (EFSA). Scientific Opinion on the risks for animal and public health related to the presence of Alternaria toxins in feed and food. EFSA J 2011; 9 (10):2407. [ Links ]
14. Thomma B. Alternaria spp.: from general saprophyte to specific parasite. Mol Plant Pathol 2003; 4: 225-236. [ Links ]
15. Andersen B, Kroger E, Roberts RG. Chemical and morphological segregation of Alternaria alternata, A. gaisen and A. longipes. Mycol Res 2001; 105: 291-299. [ Links ]
16. Andersen B, Kroger E, Roberts RG. Chemical and morphological segregation of Alternaria arborescens, A. infectoria, and A. tenuissima species-groups. Mycol Res 2002; 106: 170-182. [ Links ]
17. Andersen B, Dongo A, Pryor BM. Secondary metabolite profiling of Alternaria dauci, A. porri, A. solani, and A. tomatophila. Mycol Res 2008; 112: 241-250. [ Links ]
18. Phuwapraisirisan P, Rangsan J, Siripong P, Tip-pyang S. New antitumour fungal metabolites from Alternaria porri. Nat Prod Res 2009; 23: 1063-1071. [ Links ]
19. Andersen B, Sorensen JL, Nielsen KF, van den Ende BG, de Hoog S. A polyphasic approach to the taxonomy of the Alternaria infectoria species-group. Fungal Genet Biol 2009; 46: 642-656. [ Links ]
20. Christensen KB, van Klink JW, Weavers RT, Larsen TO, Andersen B, Phipps RK. Novel chemotaxonomic markers for the Alternaria infectoria species-group. J Agric Food Chem 2005; 53: 431-9435. [ Links ]
21. Montemurro N, Visconti A. Alternaria metabolites -Chemical and biological data. En: Chelkowski J, Visconti A (eds.). Alternaria: biology, plant diseases and metabolites. Elsevier, Amsterdam, the Netherlands, 1992; 449-557. [ Links ]
22. Xu L, Du L. Direct detection and quantification of Alternaria alternata lycopersici toxins using high-performance liquid chromatography-evaporative light-scattering detection. J Microbiol Methods 2006; 64: 398-405. [ Links ]
23. Young AB, Davis ND, Diener UL. The effect of temperature and moisture an tenuazonic acid production by Alternaria tenuissima. Phytopathology 1980; 70: 607-609. [ Links ]
24. Magan N, Lacey J. Effect of water activity and temperature on mycotoxin production by Alternaria alternata in culture and wheat grain. Appl Environ Microbiol 1984; 47: 1113-1117. [ Links ]
25. Pose G, Patriarca A, Kyanko V, Pardo A, Fernández V. Water activity and temperature effects on mycotoxin production by Alternaria alternata on a synthetic tomato medium. Int J Food Microbiol 2010; 142; 348-353. [ Links ]
26. Oviedo MS, Ramirez ML, Barros GG, Chulze SN. Influence of water activity and temperature on growth and mycotoxin production by Alternaria alternata on irradiated soya beans. Int J Food Microbiol 2011; 149: 127-132. [ Links ]
27. Venkitasubramanian TA. Biosynthesis of aflatoxin and its control. En: Rodricks JV, Hesseltine CW, Mehlman MA (eds). Mycotoxins in human and animal health. Pathotox, Park Forest South, Illinois, USA; 1997; 83-98. [ Links ]
28. Dambolena JS, Zygadlo JA, Rubinstein HR. Antifumonisin activity of natural phenolic compounds. A structure-property-activity relationship study. Int J Food Microbiol 2011; 145:140-146. [ Links ]
29. Mahoney N, Molyneux RJ, Kim JH, Campbell BC, Waiss AC, Hagerman AE. Aflatoxigenesis induced in Aspergillus flavus by oxidative stress and reduction by phenolic antioxidants from tree nuts. World Mycotoxin J 2010; 3: 49-57. [ Links ]
30. Altemöller M, Podlech J, Fenske D. Total synthesis of altenuene and isoaltenuene. European J Org Chem 2006; 7: 1678-1684. [ Links ]
31. Berthiller F, Dall'Asta C, Schuhmacher R, Lemmens M, Adam G, Krska R. Masked mycotoxins: determination of a deoxynivalenol glucoside in artificially and naturally contaminated wheat by liquid chromatography-tandem mass spectography. J Agric Food Chem 2005; 53: 3421-3425. [ Links ]
32. Koch K, Podlech J, Pfeiffer E, Metzler M. Total sintesis of alternariol. J Org Chem 2005; 70: 3275-3276. [ Links ]
33. Griffin GF, Chu FS. Toxicity of the Alternaria metabolites alternariol, alternariol monomethyl ether, altenuene and tenuazonic acid in the chicken embryo assay. Appl Environ Microbiol 1983; 46: 1420-1422. [ Links ]
34. Harvan DJ, Pero RW. The structure and toxicity of the Alternaria metabolites. En: Rodricks JV (ed). Advances in chemistry series 149: Mycotoxins and other fungal related food problems. American Chemical Society, Washington, D.C., USA, 1976; 344-355. [ Links ]
35. Pero RW, Posner H, Blois M, Harvan D, Spalding JW. Toxicity of metabolites produced by the "Alternaria". Environ Health Perspect 1973; 4: 87-94. [ Links ]
36. Sauer DB, Seitz LM, Burroughs R, Mohr HE, West JL, Milleret RJ, Anthony HD. Toxicity of Alternaria metabolites found in weathered sorghum grain at harvest. J Agric Food Chem 1978; 26: 1380-1383. [ Links ]
37. Combina M, Dalcero A, Varsavsky E, Torres A, Etcheverry M, Rodriguez M, Gonzalez H. Effect of heat treatments on stability of alternariol, alternariol monomethyl ether and tenuazonic acid in sunflower flour. Mycotoxin Res 1999; 15: 33-38. [ Links ]
38. Liu GT, Qian YZ, Zhang P, Dong ZM, Shi ZY, Zhen YZ et al. Relationships between Alternaria alternata and oesophageal cancer. En: O'Neill IK, Chen J, Bartsch H (eds). Relevance to human cancer of N-nitroso compounds, tobacco smoke and mycotoxins. International Agency for Research on Cancer, Lyon, France, 1991; 258-262. [ Links ]
39. Schrader TJ, Cherry W, Soper K, Langlois I, Vijay HM. Examination of Alternaria alternata mutagenicity and effects of nitrosylation using the Ames Salmonella test. Teratog Carcinog Mutagen 2001; 21: 261-274. [ Links ]
40. Scott PM, Stoltz DR. Mutagens produced by Alternaria alternata. Mutat Res 1980; 78: 33-40. [ Links ]
41. Liu G, Qian Y, Zhang P, Dong W, Qi Y, Guo H. Etiological role of Alternaria alternata in human oesophageal cancer. Chin Med J 1992; 105: 394-400. [ Links ]
42. Kada T, Sadaie Y, Sakamoto Y. Bacillus subtilis repair test. En: Kilbey BJ, Legator M, Nichols W, Ramel C (eds). Handbook of mutagenicity test procedures, 2nd ed. Elsevier, Amsterdam, the Netherlands, 1984; 13-31. [ Links ]
43. An Y, Zhao T, Miao J, Liu G, Zheng Y, Xu Y, Van Etten RL. Isolation, identification, and mutagenicity of alternariol monomethyl ether. J Agric Food Chem 1989; 37: 1341-1343. [ Links ]
44. Zhen YZ, Xu YM, Liu GT, Miao J, Xing YD, Zheng QL, et al. Mutagenicity of Alternaria alternata and Penicillium cyclopium isolated from grains in an area of high incidence of oesophageal cancer - Linxian China. En: O'Neill IK, Chen J, Bartsch H (eds). Relevance to human cancer of N-nitroso compounds, tobacco smoke and mycotoxins. International Agency for Research on Cancer, Lyon, France, 1991; 253-257. [ Links ]
45. Davis VM, Stack ME. Evaluation of alternariol and alternariol methyl ether for mutagenic activity in Salmonella typhimurium. Appl Environ Microbiol 1994; 60: 3901-3902. [ Links ]
46. Lehmann L, Wagner J, Metzler M. Estrogenic and clastogenic potential of the mycotoxin alternariol in cultured mammalian cells. Food Chem Toxicol 2006; 44, 398-408. [ Links ]
47. Marko D. Mechanisms of the genotoxic effect of Alternaria toxins. En: Gesellschaft fur Mykotoxin Forschung. Proceedings of the 29th mycotoxin workshop. Stuttgart-Fellbach, Germany, 2007; 48. [ Links ]
48. Pfeiffer E, Eschbach S, Metzler M. Alternaria toxins: DNA strand-breaking activity in mammalian cells in vitro. Mycotoxin Res 2007; 23: 152-157. [ Links ]
49. Xu DS, King TQ, Ma JQ. The inhibitory effect of extracts from Fructus lycii and Rhizoma polygonati on in vitro DNA breakage by Alternariol. Biomed Environ Sci 1996; 9: 67-70. [ Links ]
50. Yekeler H, Bitmis K, Ozcelik N, Doymaz MZ, Calta M. Analysis of toxic effects of Alternaria toxins on oesophagus of mice by light and electron microscopy. Toxicol Pathol 2001; 29:492-497. [ Links ]
51. Panigrahi S, Dallin S. Toxicity of the Alternaria spp metabolites, tenuazonic acid, alternariol, altertoxin-I, and alternariol monomethyl ether to brine shrimp - (Artemia salina L) larvae. J Sci Food Agric 1994; 66: 493-496. [ Links ]
52. Azcarate MP, Patriarca A, Terminiello L, Fernández V. Alternaria toxins in wheat during the 2004 to 2005 Argentinean harvest. J Food Prot 2008; 71: 1262-1265. [ Links ]
53. Logrieco A, Bottalico A, Mulé M, Moretti A, Perrone G. Epidemiology of toxigenic fungi and their associated mycotoxins for some Mediterranean crops. Eur J Plant Pathol 2003; 109:645-667. [ Links ]
54. Schrader TJ, Cherry W, Soper K, Langlois I. Further examination of the effects of nitrosylation on Alternaria alternate mycotoxin mutagenicity in vitro. Mutat Res Genet Toxicol Environ Mutagen 2006; 606: 61-71. [ Links ]
55. Stack ME, Mazzola EP, Page SW, Pohland AE, Highet RJ, Tempesta MS, Chorley DG. Mutagenic perylenequinones metabolites of Alternaria alternata: altertoxins I, II and III. J Nat Prod 1986; 49: 866-871. [ Links ]
56. Stack ME, Prival MJ. Mutagenicity of the Alternaria metabolites altertoxins I, II, and III. Appl Environ Microbiol 1986; 4: 718-722. [ Links ]
57. Chelkowski J, Visconti A. Alternaria. Biology, plant diseases and metabolites. Elsevier, Amsterdam, the Netherlands, 1992. [ Links ]
58. Osborne LC, Jones VI, Peeler JT, Larkin EP. Transformation of C3H/10T1/2 cells and induction of EBV-early antigen in Raji cells by altertoxins I and III. Toxicol In Vitro 1988; 2: 97-102. [ Links ]
59. Abd El-Aal SS. Effects of gamma radiation, temperature and water activity on the production of Alternaria mycotoxins. Egypt J Microbiol 1997; 32: 379-396. [ Links ]
60. Aresta A, Cioffi N, Palmisano F, Zambonin CG. Simultaneous determination of ochratoxin A and cyclopiazonic, mycophenolic, and tenuazonic acids in cornflakes by solid-phase microextraction coupled to high-performance liquid chromatography. J Agric Food Chem 2003; 51: 5232-5237. [ Links ]
61. Asam S, Konitzer K, Rychlik M. Precise determination of the Alternaria mycotoxins alternariol and alternariol monomethyl ether in cereal, fruit and vegetable products using stable isotope dilution assays. Mycotoxin Res 2010; 27: 23-28. [ Links ]
62. Siegel D, Merkel S, Koch M, Nehls I. Quantification of the Alternaria mycotoxin tenuazonic acid in beer. Food Chem 2010; 120: 902-906. [ Links ]
63. Kralova J, Hajslová J, Poustka J, Hochman M, Bjelková M, Odstrilová L. Occurrence of Alternaria toxins in fibre flax, linseed, and peas grown in organic and conventional farms: monitoring pilot study. Czech J Food Sci 2006; 24: 288-296. [ Links ]
64. Skarkova J, Ostry V, Prochazkova I. Planar chromatographic determination of Alternaria toxins in selected foodstuffs. Proceedings of the International Symposium on Planar Separations, Planar Chromatography, Milestones in Instrumental TLC, Siofok, Hungary, 2005. [ Links ]
65. Barros GG, Oviedo MS, Ramirez ML, Chulze SN. Safety aspects in soybean food and feed chains: fungal and mycotoxins contamination. En: Tzi-Bun N (ed). Soybean: Biochemistry, Chemistry and Physiology. InTech, Croatia, 2011; 7-20. [ Links ]
66. Ostry V, Skarkova J, Ruprich J. Occurrence of Alternaria mycotoxins and Alternaria spp. En: lentils and human health. 26. Abstract of the Mykotoxin-Workshop, 2004. [ Links ]
67. Asam S, Konitzer K, Schieberle P, Rychlik M. Stable isotope dilution assays of alternariol and alternariol monomethyl ether in beverages. J Agric Food Chem 2009; 57: 5152-5160. [ Links ]
68. da Motta S, Soares LMV. Survey of Brazilian tomato products for alternariol, alternariol monomethyl ether, tenuazonic acid and cyclopiazonic acid. Food Addit Contam 2001; 18: 630-634. [ Links ]
69. Logrieco A, Bottalico A, Solfrizzo M, Mule G. Incidence of Alternaria species in grains from Mediterranean countries and their ability to produce mycotoxins. Mycologia 1990; 82: 501-505. [ Links ]
70. Pavón MA, Luna A, de la Cruz S, González I, Martín R, García T. PCR-based assay for the detection of Alternaria species and correlation with HPLC determination of altenuene, alternariol and alternariol monomethyl ether production in tomato products. Food Control 2012; 25: 45-52. [ Links ]
71. Terminiello L, Patriarca A, Pose G, Fernández V. Occurrence of alternariol, alternariol monomethyl ether and tenuazonic acid in Argentinean tomato puree. Mycotoxin Res 2006; 22:236-240. [ Links ]
72. Ackermann Y, Curtui V, Dietrich R, Gross M, Latif H, Märtlbauer E, Usleber, E. Widespread occurrence of low levels of alternariol in apple and tomato products, as determined by comparative immunochemical assessment using monoclonal and polyclonal antibodies. J Agric Food Chem 2011; 59: 6360-6368. [ Links ]
73. Delgado T, Gómez-Cordovés C. Natural occurrence of alternariol and alternariol methyl ether in Spanish apple juice concentrates. J Chromatogr A 1998; 815: 93-97. [ Links ]
74. Logrieco A, Moretti A, Solfrizzo M. Alternaria toxins and plant diseases: an overview of origin, occurrence and risks. World Mycotoxin J 2009; 2: 129-140. [ Links ]
75. Magnani RF, De Souza GD, Rodrigues-Filho E. Analysis of alternariol and alternariol monomethyl ether on flavedo and albedo tissues of tangerines (Citrus reticulata) with symptoms of Alternaria brown spot. J Agric Food Chem 2007; 55: 4980-4986. [ Links ]
76. Noser J, Schneider P, Rother M, Schmutz H. Determination of six Alternaria toxins with UPLC-MS/MS and their occurrence in tomatoes and tomato products from the Swiss market. Mycotoxin Res 2011; 27: 265-271. [ Links ]
77. Scott PM, Lawrence GA, Lau BPY. Analysis of wines, grape juices and cranberry juices for Alternaria toxins. Mycotoxin Res 2006; 22: 142-147. [ Links ]
78. Solfrizzo M, de Girolamo A, Vitti C, Visconti A, van den Bulk R. Liquid chromatographic determination of Alternaria toxins in carrot. J AOAC Int 2004; 87: 101-106. [ Links ]
79. Robiglio AL, López SE. Mycotoxin Production by Alternaria alternata strains isolated from Red Delicious apples in Argentina. Int J Food Microbiol 1995; 24: 413-417. [ Links ]
80. Häggblom P, Stepinska A, Solyakov A. Alternaria mycotoxins in Swedish feed grain. En: Gesellschaft fur Mycotoxin Forschung. Proceedings of the 29th mycotoxin workshop, Stuttgart-Fellbach, Germany, 2007; 35. [ Links ]
81. Mansfield MA, Archibald DD, Jones AD, Kuldau GA. Relationship of sphinganine analog mycotoxin contamination in maize silage of seasonal weather conditions and to agronomic and ensiling practices. Phytopathology 2007; 97: 504-511. [ Links ]
82. Nawaz S, Scudamore KA, Rainbird SC. Mycotoxins in ingredients of animal feeding stuffs: I. Determination of Alternaria mycotoxins in oilseed rape meal and sunflower seed meal. Food Addit Contam 1997; 14: 249-262. [ Links ]
83. Romano C, Valenti L, Miracco C, Alessandrini C, Paccagnini E, Faggi E, Difonzo EM. Two cases of cutaneous phaeohy-phomycosis by Alternaria alternata and Alternaria tenuissima. Mycopathologia 1997; 137: 65-74. [ Links ]
84. Vieira R, Veloso J, Afonso A, Rodrigues A. Cutaneous alternariosis in a liver transplant recipient. Rev Iberoam Micol 2006; 23:107-109. [ Links ]
85. Ferrer C, Montero J, Alio JL, Abad JL, Ruiz-Moreno JM, Colomm F. Rapid Molecular Diagnosis of Posttraumatic Keratitis and Endophthalmitis Caused by Alternaria infectoria. J Clin Microbiol 2003; 41: 3358-3360. [ Links ]
86. Ferrer C, Munoz G, Alio JL, Abad JL, Colomm. Polymerase chain reaction diagnosis in fungal keratitis caused by Alternaria alternata. Am J Ophthalmol 2002; 133: 398-399. [ Links ]
87. Pastor FJ, Guarro J. Alternaria infections: laboratory diagnosis and relevant clinical features. Clin Microbiol Infect 2008; 14: 734-746. [ Links ]
88. Asturias JA, Ibarrola I, Ferrer A, Andreu C, López-Pascual E, Quiralte J, et al. Diagnosis of Alternaria alternata sensitization with natural and recombinant Alt a 1 allergens. J Allergy Clin Immunol 2005; 115: 1210-1217. [ Links ]
89. Achatz G, Oberkofler H, Lechenauer E, Simon B, Unger A, Kandler D, et al. Molecular characterization of Alternaria alternata and Cladosporium herbarum allergens. Adv Exp Med Biol 1996; 409: 157-161. [ Links ]
90. Breitenbach M, Simon-Nobbe B. The allergens of Cladosporium herbarum and Alternaria alternata. Chem Immunol 2002; 81: 48-72. [ Links ]
91. de Vouge MW, Thaker AJ, Zhang L, Muradia G, Rode, Vijay HM. Molecular cloning of Ig-E binding fragments of Alternaria alternata allergens. Int Arch Allergy Immunol 1998; 116: 261-268. [ Links ]
92. Vijay HM, Kurupp VP. Fungal allergens. En: Lokey RF, Bukantz SC (eds). Allergens and Allergen Immunotherapy, 3rd ed. Marcel Dekker Inc., New York, USA, 2003; 223-250. [ Links ]
93. Sánchez H, Bush RK. A review of Alternaria alternata sensitivity. Rev Iberoam Micol 2001; 18: 56-59. [ Links ]
94. Roussel S, Reboux G, Bellanger A, Sornin S, Grenouillet F, Dalphin J, et al. Characteristics of dwellings contaminated by moulds. J Environ Monit 2008; 10: 724-729. [ Links ]
95. Takigawa T, Wang B, Sakano N, Wang D, Ogino K, Kishi R. A longitudinal study of environmental risk factors for subjective symptoms associated with sick building syndrome in new dwellings. Sci Total Environ 2009; 407: 5223-5228. [ Links ]
96. Instituto Federal de Evaluación de Riesgos de Alemania (BfR). Alternaria-Toxine in Lebensmitteln 2003; 2. [ Links ]
97. Comité de Científicos Alimentarios de la República Checa (CSCF) 2008. Disponible en: http://www.chpr.szu.cz. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Teresa García Lacarra.
Departamento de Nutrición, Bromatología y Tecnología de los Alimentos.
Facultad de Veterinaria. Universidad Complutense de Madrid.
28040 Madrid. España.
E-mail: tgarcia@vet.ucm.es
Recibido: 17-V-2012.
1.a Revisión: 22-VI-2012.
Aceptado: 17-VII-2012.