Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Nutrición Hospitalaria
versión On-line ISSN 1699-5198versión impresa ISSN 0212-1611
Nutr. Hosp. vol.27 no.6 Madrid nov./dic. 2012
https://dx.doi.org/10.3305/nh.2012.27.6.6023
Propuesta de perfil de ácidos grasos omega 3 en nutrición enteral
Proposed profile of omega 3 fatty acids in enteral nutrition
A. Sanz París1, A. Marí Sanchis2, K. García Malpartida3 y M.a del C. García Gómez4
1Unidad de Nutrición. Hospital Universitario Miguel Servet. Zaragoza.
2Sección de Nutrición Clínica y Dietética. Complejo Hospitalario de Navarra. Pamplona.
3Unidad de Nutrición. Hospital Universitario La Fe. Valencia.
4Unidad de Nutrición. Hospital Marqués de Valdecilla. Santander. España.
Dirección para correspondencia
RESUMEN
Revisamos las recomendaciones internacionales de ingesta oral de ácidos grasos n-3.y su contenido en las fórmulas de nutrición enteral. Sus acciones metabólicas dependen de su metabolización a EPA y DHA. La actividad de las 5D y 6D desaturasas, que catalizan este proceso, aumenta con el ejercicio, insulina, estrógenos de mujer fértil y proliferadores peroxisómicos, mientras que disminuye con el ayuno, déficit de proteínas y oligoelementos, edad > 30 años, sedentarismo, tabaco, alcohol, colesterol, ácidos grasos trans y saturados, insulinopenia y hormonas de estrés (adrenalina y glucocorticoides). La mayoría de las guías recomiendan 20-35% de la energía total en forma de grasas, repartidas en saturadas 7-10%, poliinsaturadas 6-10% y monoinsutaradas en España 20%. El de AG n-3 es de 0,5-2 g/día o bien 0,5-2% de la ingesta calórica total, con un límite superior de 3 g/día. El de AG n-6 es del 2,5-10% del aporte calórico total y el cociente recomendado n-6/n-3 no está bien definido pero la mayoría recomienan 5/1. El contenido en EPA y DHA, debe ser de al menos los 500 mg diarios. Por último, la ratio EPA/DHA en la mayoría es de 2/1. Las fórmulas de nutrición estándar presentan un contenido en grasas adecuado, pero la mayoría de los productos que contienen EPA y DHA exceden el límite de los 3 g/día. De los productos hiperproteicos y/o concentrados por vía oral sólo un producto de este grupo contiene EPA y DHA. Las del anciano frágil no todas aportan EPA y DHA y las que los contienen, su concentración puede ser incluso excesiva y en una relación poco parecida a la del aceite de pescado.
Palabras clave: Ácidos grasos omega 3. EPA. DHA. Nutrición enteral.
ABSTRACT
We review the international recommendations on oral intake of n-3 fatty acids and their content in the enteral nutrition formulas. Their metabolic actions depend on their metabolization to EPA and DHA. The activity of desaturases catalyzing this process increases with exercise, insulin, estrogens in the fertile women, and peroxisomal proliferators, whereas it decreases with fasting, protein and oligoelements deficiencies, age < 30 years, sedentary lifestyle, cigarette smoking, alcohol, cholesterol, trans and saturated fatty acids, insulin deficiency, and stress hormones (adrenalin and glucocorticoids). Most of the guidelines recommend that 20-35% of the total energy comes from fat, being 7-10% saturated fats, 6-10% polyunsaturated, and 20% monounsaturated, in Spain. The recommendation for n-3 FA is 0.5-2 g/day or 0.5-2% of total caloric intake, with an upper limit of 3 g/day. For n-6 FA, 2.5-10% of total caloric intake, the n-6/n-3 ratio not being well established although most of the guidelines recommend 5:1. The EPA and DHA content should be at least 500 mg per day. Finally, the EPA/DHA ratio is 2:1 in most of them. Standard nutrition formulas present an appropriate fat content, although most of the products containing EPA and DHA exceed the limit of 3 g/day. Among the products with hyperprotein and/or concentrated, only of them contains EPA y DHA. Not all the formulas used for the frail elderly contain EPA or DHA, and in those containing them their concentration may be excessive and with a proportion very dissimilar to that of fish oil.
Key words: Omega 3 fatty acids. EPA. DHA. Enteral nutrition.
Abreviaturas
AG: Ácidos grasos.
AGPI: AG poliinsaturados.
n-3: Omega 3.
n-6: Omega 6.
EPA: Ácido eicosapentaenoico.
DHA: Ácido docosahexaenoico.
LA: Ácido linoleico.
ALA: Ácido linolénico.
DHGL: Ácido dihomo-γ-linoleico.
DPA n-6: Ácido docosapentanoico.
DEHP:di-(2-etilhexil)ftalato.
COX: Ciclooxigenasa.
LOX: Lipooxigenasa.
CYP: Citocromo P450.
PG H2: Prostaglandina H2.
TX A2: Tromboxano A2.
HETEs: Ácidos hidroxieicosatetranoicos.
EETs: Epoxieicosatrienoicos.
AHA: American Heart Association.
DRI: Recomendaciones diarias de ingesta.
FNB-IOM: Food and Nutrition Board of the American Institute of Medicine.
GISSI: Gruppo Italiano per lo Studio della Sopravivenza nell'Infarto miocardio.
AGMI: Grasas monoinsaturadas.
Introducción
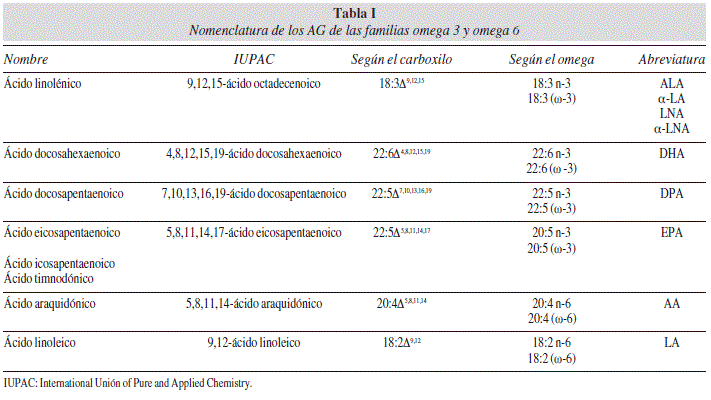
Los ácidos grasos (AG) son moléculas de naturaleza lipídica que presentan un grupo carboxilo terminal unido a una cadena hidrocarbonada. Pueden clasificarse de distintas maneras en función del número de átomos de carbono de su cadena o en función del número de dobles enlaces que presenten. De entre todos ellos, es bien conocido que los AG poliinsaturados, (AGPI) es decir, aquellos que contienen dos o más dobles enlaces en su cadena, juegan un papel importante dentro de nuestro organismo. Son dos las principales familias de AGPI: los omega 3 (n-3) y los omega 6 (n-6). Aunque se trata de familias estructural y funcionalmente diferentes, ambas tienen vías metabólicas muy interrelacionadas, como revisaremos posteriormente. En esta revisión nos centraremos en los AG n-3. En la tabla I reseñamos la nomenclatura que nos podemos encontrar de estos AG en la bibliografía.
El organismo humano sintetiza numerosos AG denominados no esenciales, pero hay otros que deben ser incorporados por medio de la dieta, ya que el cuerpo no es capaz de sintetizarlos, por lo que se conocen como esenciales. George y Mildred Burr, en 1929, observaron que la alimentación de ratas con una dieta carente en grasas producía un crecimiento muy pobre de los animales, dermatitis grave, perdida de pelaje, emanciación y a veces la muerte. No fue hasta 1963 cuando Hansen y sus colaboradores demostraron en humanos la clara necesidad del aporte de ciertos AG en la dieta1.
Los AG n-6 y n-3 son muy importantes para mantener la estructura de las membranas celulares, facilitar la absorción de vitaminas liposolubles y regular el metabolismo del colesterol, lo cual hace que tengan una función primordial en el desarrollo del sistema nervioso y visual. Además en los últimos años ha aumentado el interés científico en relación a su capacidad de producir eicosanoides (prostaglandinas, prostaciclinas, leucotrienos y tromboxanos) y la regulación de múltiples procesos celulares, entre ellos el control de la homeostasis vascular, coagulación sanguínea y fenómenos inflamatorios2.
El interés por el estudio de los AG n-3 surgió a partir de los años 70 tras la observación de Bang y Dyberg quienes detectaron en la población esquimal de Groenlandia una baja mortalidad por enfermedad cardiovascular a pesar de una dieta rica en grasas. Los autores propusieron la dieta rica en n-3 proveniente de una fuente marina (pescados, focas y ballenas) como causa de este hallazgo3.
Desde entonces, numerosos estudios experimentales, epidemiológicos y de intervención han demostrado que la ingesta de una dieta rica en AG n-3 reduce la mortalidad coronaria y la muerte súbita cardíaca y que en las zonas geográficas donde estos AG predominan en la dieta la incidencia de enfermedad cardiovascular disminuye. Se ha demostrado que los AG n-3 reducen las concentraciones plasmáticas de triglicéridos, tienen propiedades antiarrítmicas, antiaterogénicas, antitrombóticas y antiinflamatorias4.
Ciertas enfermedades crónicas de base inflamatoria podrían entonces ser susceptibles de ser tratadas con AG n-3. Destacaríamos patologías como enfermedad de Crohn, colitis ulcerosa, pancreatitis aguda, artritis reumatoide traumas de origen múltiple, asma, fibrosis quística, enfermedad de Alzheimer y neuropatía por inmunoglobulina A, entre otras5.
Por otra parte, la importancia del aumento del cociente n-6/n-3 ha sido estudiado repetidamente en los últimos años. En la sociedad industrializada se observa un incremento del consumo de hidratos de carbono refinados, grasas saturadas, AG n-6 y grasas trans, mientras que ha disminuido la de AG n-3, hidratos de carbono de absorción lenta y fibra. Esto ha hecho que mientras que la ratio n-6/n-3 en los países industrializados es de 15-20/1, la de los animales salvajes y la que suponemos de los hombres prehistóricos es de 1/16. Este cambio en el esquema de AG consumidos ha dado lugar al aumento de la prevalencia de enfermedades crónicas como aterosclerosis, hipertensión arterial esencial, obesidad, diabetes mellitus, artritis y algunas enfermedades autoinmunes, así como diferentes tipos de cánceres, como el de mama, colon y próstata7.
La posible utilidad clínica de este tipo de AG en gran cantidad de patologías ha hecho que aumentara el interés por la composición de estos nutrientes en las fórmulas de nutrición enteral específicas8. El siguiente paso será el valorar el cociente n-6/n-3 más que la composición total de AG n-3 a la luz de los últimos estudios. Y por último, en un tercer paso se ha revisado el aporte de EPA y DHA en estos productos de nutrición enteral.
Todas estas consideraciones nos llevan a estudiar el metabolismo de estos AG n-3, para conocer sus metabolitos intermedios y los mediadores inmunitarios de los que son sustratos, además de las interacciones existentes de los enzimas que participan en el paso de un metabolito a otro. Esta será la primera parte de nuestra revisión.
En la segunda parte revisaremos las recomendaciones dietéticas de las diferentes sociedades científicas. Estas nos podrán servir de referencia para proponer un perfil de AG n-3 para las fórmulas de nutrición enteral, dada la escasez de estudios y ausencia de consenso sobre los niveles óptimos de estos nutrientes en las fórmulas de nutrición enteral, nos obliga a basarnos en las recomendaciones en la dieta oral.
Enzimas y factores que inciden en el metabolismo de LA y ALA
Tanto el ácido linoleico (LA) como el ácido linolénico (ALA) son AG esenciales, es decir, el ser humano no es capaz de sintetizarlos por sí mismo. Una vez ingeridos, pueden metabolizarse dando lugar a otros ácidos grasos con mayor grado de instauración y mayor tamaño de cadena: los llamados AGPI de cadena larga.
Así, el LA es precursor del AA mientras que el ALA lo es del EPA. Estos AG compiten por los enzimas encargados del proceso de desaturación (las desaturasas D5 y D6) y por las encargadas de alargar la cadena hidrocarbonada (las elongasas). El mayor nivel de competición enzimática se produce a nivel del AA y del EPA. Aunque las dos vías de síntesis de AGPI de cadena larga utilizan las mismas enzimas, no hay reacciones cruzadas entre ambas.
Se sabe que esta conversión enzimática es bastante ineficaz, principalmente en lo que se refiere a la producción de DHA9. En concreto, se estima que la eficacia de conversión de ALA a EPA es 0,2%, a DPA n-3 del 0,13% y a DHA del 0,05%10.
El LA, a través de la D6 desaturasa, da lugar al ácido-γ-linoléico, que a través de una elongasa produce el ácido dihomo-γ-linoleico (DHGL). Éste se desatura por la acción de la D5 desaturasa para formar AA. El AA, mediante distintas reacciones enzimáticas de elongación, desaturación y un último paso de β oxidación, se convierte en ácido docosapentanoico (DPA n-6).
Por su parte, el ALA, a través de la D6 desaturasa, da lugar al ácido estearidónico (18:4), que por acción de la elongasa se transforma en el ácido eicosatetraenoico (20:4). Éste, a su vez, por la acción de la D5 desaturasa, produce EPA (20:5). El EPA, mediante una elongasa, se transforma en ácido docosapentanoico (DPA, 22:5), que mediante varias reacciones enzimáticas dará lugar al ácido docosahexanoico (DHA, 22:6). El DHA, por oxidación perixosomal, se vuelve a reducir hasta EPA. Todas estas reacciones enzimáticas tienen lugar en el reticulo endoplásmico a excepción de la última reacción de formación del DHA que se produce en el peroxisoma.
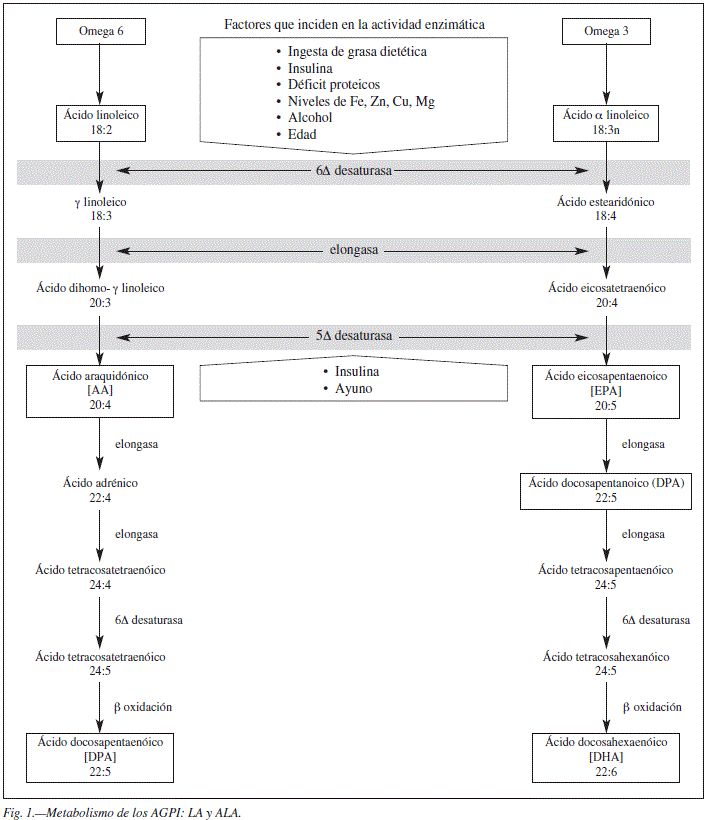
La ingesta de ALA aumenta los niveles de EPA y DPA n-3. Sin embargo, influye mínimamente en los de DHA. Además, si esta ingesta de ALA está aumentada de forma crónica, existe un aumento de la conversión a EPA, con un aumento de los niveles de EPA en plasma y en los depositos celulares. Sin embargo, el grado de conversión a DHA es insuficiente para aumentar la concentración de este AG y los niveles de DHA pueden llegar a disminuir11. La figura 1 resume el metabolismo de LA y ALA.
Estos AG n-3, principalmente el DHA, se incorporan en los fosfolípidos de las membranas celulares como componentes estructurales, formando parte de tejidos como la retina, el cerebro o los espermatozoides, por lo que son esenciales en el desarrollo de una óptima función visual, reproductora y cerebral. La cantidad de AGPI en las membranas celulares (principalmente el AA y DHA) se mantiene gracias a un mecanismo de retroalimentación que tiene la propia ruta metabólica5. Cuando el EPA se produce como metabolito del ALA, da lugar a DHA. Sin embargo, cuando el EPA procede de la dieta, termina produciendo eicosanoides. Estos eicosanoidos antagonizan la acción de los eicosanoides derivados de AA. Además también tienen efecto en la reducción de los valores de triglicéridos, colesterol, vasodilatación y efectos antitrombóticos.
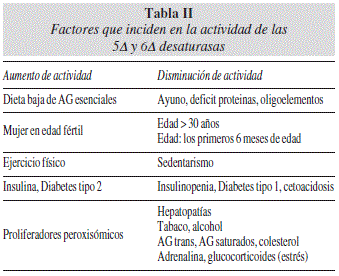
La D6 desaturasa constituye el primer paso limitante de la ruta metabólica12. Su actividad, junto con la de la D5 desaturasa y la producción de AGPI de cadena larga, se encuentra regulada por múltiples factores5,13 Es interesante estudiar estos factores ya que se ha descrito que la actividad de las desaturasas se ha asociado al desarrollo de enfermedad cardiometabólica, como el infarto agudo de miocardio14 o el síndrome metabólico15. En otro artículo de Warensjo et al.16 se cuantifica el riesgo de desarrollar sobrepeso según modificaciones de la actividad enzimática: se detectó que por cada desviación estándar de incremento de la actividad de la D9 y la D6, el riesgo de desarrollar sobrepeso se aumentaba en un 60%. Por el contrario, cada desviación estándar de incremento de la actividad de la D5 reducía el riesgo de sobrepeso en un 30%.
Cabe resaltar la dificultad para calcular la actividad de las desaturasas en humanos, por lo que en múltiples estudios se calcula la actividad estimada de estas enzimas utilizando una ratio entre producto AG/y su precursor. La actividad estimada de la D5 desaturasa se expresa generalmente como el ratio entre AA/DHGL mientras que la actividad estimada de la D6 desaturasa se expresa como ácido-γ-linoléico/LA.
Entre los factores que afectan a la actividad de estas enzimas destacan los siguientes:
La ingesta de grasa dietética
Es bien conocido el efecto que produce en el desarrollo de eventos cardiovasculares y endocrino-metabólicos tanto la cantidad como sobre todo la calidad de las grasas que ingerimos diariamente. Pero a su vez, esta grasa dietética influye de forma significativa en la actividad enzimática. Ya Garg et al.17 en los años 80 apuntaban la disminución de esta actividad en dietas ricas en grasas y posteriormente Huang et al.18 con la ingesta de colesterol. Diferentes estudios indican que la actividad de la D6 desaturasa se induce por dietas bajas en ácidos grasos esenciales mientras que disminuye con dietas ricas en aceites vegetales o marinos19.
Por otro lado, el aumento de la ingesta de AG trans y un aumento de AG n-6 también reducen esta actividad, como lo hace el propio DHA. Sin embargo, cuando se suplementa con AG n3 se detecta una reducción en la actividad de la Δ6 desaturasa y un aumento de la Δ5 asociado a un aumento de EPA y DHA plasmático20.
En un estudio de intervención publicado por Warensjö E. et al.21 se observó un aumento de la actividad estimada de la Δ6 desaturasa y una baja actividad estimada de Δ5 desaturasa en aquel grupo de individuos que seguían una dieta rica en AG saturados comparados con aquellos que seguían una dieta rica en AG insaturados. Este cambio en la actividad enzimática se ha vinculado al desarrollo de síndrome metabólico15. La síntesis de AG n-3 a partir del ALA es más efectiva cuando la ingesta es rica en AG saturados y pobre en LA. Este autor fue el primero en mostrar el cambio en la actividad estimada de las desaturasas según la calidad de la grasa ingerida.
En general inhiben la acción de ambas desaturasas las grasas saturadas, el colesterol y las grasas trans22,23. La ingesta de los AG n-3 y n-6 producen un mecanismo de contrarregulación de las desaturasas hepáticas24.
Factores endocrinos
En pacientes diabéticos se ha detectado un descenso en la actividad de la Δ5 desaturasa25 y de la Δ6 desaturasa25. Sin embargo se encuentran diferencias según el tipo de diabetes desarrollada.
En concreto, varios autores han detectado este descenso en la actividad enzimática (de la 5Δ desaturasa particularmente) en pacientes diabéticos tipo 1 y la restauración de esta actividad con el inicio de la insulinoterapia26,27. Además en estos pacientes cuando se detecta un mal control metabólico, por ejemplo cuando el paciente se encuentra en estados de cetosis, esta disminución se mantiene28. Sin embargo, estos hallazgos descritos en pacientes con diabetes mellitus tipo 1 son opuestos a los que se detectan en pacientes con diabetes tipo 2. En ellos, esta actividad desaturasa aumenta29 y tras el inicio de la insulinzación no se altera su actividad20. También se ha descrito que la actividad de la 5 desaturasa se correlaciona de forma positiva con los valores de la hemoglobina glicosilada en situaciones de mal control metabólico, pero no se correlaciona cuando se da un buen control metabolico29.
El interés de estudiar la actividad de estas desaturasas viene definido por su posible papel en el desarrollo de insulino-resistencia tanto en los estudios realizados en humanos como en animales30. Recientemente se ha detectado en varios estudios prospectivos una fuerte asociación inversa de la actividad estimada de la 5Δ desaturasa con respecto al riesgo de desarrollo de diabetes y una asociación directa de la 6Δ desaturasa. Es decir, a mayor actividad estimada de la 5Δ desaturasa menor riesgo de diabetes, mientras que un aumento de la actividad de la 6Δ desaturasa se asocia a un aumento manifiesto del riesgo31.
Otras hormonas implicadas en el control del estrés, con efecto opuesto a la insulina, como son la adrenalina y glucocorticoides, han demostrado inhibir la acción de ambas desaturasas22.
Factores nutricionales
Los déficits de algunos oligoelementos como el hierro, zinc, cobre o magnesio, que pueden observarse en situaciones de desnutrición, disminuyen la actividad de la Δ6 desaturasa y secundariamente la formación de AGPI de cadena larga25 . Piridoxina, zinc, ácido nicotinico y magnesio son co-factores de la acción de la Δ6 desaturasa, por lo que sus déficits se asocian a una disminución de su actividad.
El ayuno total, la ingesta proteica deficitaria y la dieta rica en glucosa reducen la actividad de las desaturasas, mientras que la restricción calórica parcial la estimula23.
Factores tóxicos
Los estudios experimentales in vitro realizados en microsomas hepáticos de ratas alimentadas con etanol en los años 80 describieron la disminución de la actividad de la Δ6 y 5 desaturasa32. Posteriormente Nakamura et al.33 también corroboraron estos resultados in vitro en cerdos alimentados durante meses con una ingesta rica en grasas y alcohol.
La aportación posterior de Narce et al.34 describió la actividad enzimática in vivo en cultivos celulares hepáticos de ratas a distintas concentraciones de etanol: a mayor concentración de alcohol la actividad enzimática disminuía, pero aumentaba con concentraciones de alcohol mínimas. Además de alterar la acción de las desaturasas, el consumo de alcohol disminuye las concentraciones tisulares de AGPI de cadera larga35.
Otro factor que influye en esta actividad enzimática es el tabaco36. En el estudio de Marangoni et al.37 realizado in vitro con células epiteliales de la glándula mamaria que estaban expuestas al humo del tabaco se detectó una inhibición de la conversión de ALA en AG n-3 y un bloqueo de acción enzimática de la 5Δ desaturasa.
Factores constitucionales
La edad puede afectar también a las desaturasas, de hecho se sabe que esta actividad disminuye a partir de la tercera década de la vida manteniéndose esta disminución en la ancianidad. De ahí la importancia de incorporar en la dieta de nuestros mayores la ingesta de pescados grasos como fuente de AGPi. Por otro lado, la acción enzimática se encuentra disminuida durante los primeros 6 meses de vida. Por ejemplo, en niños prematuros o con bajo peso al nacer, esta menor actividad de la Δ6 desaturasa, puede conllevar un riesgo para la síntesis de AG, con el consecuente compromiso en el desarrollo de una óptima función neurológica. De ahí la importancia de la lactancia materna que aporta estos AG o de la ingesta de formulaciones lácteas para los prematuros enriquecidas en estos AG.
En cuanto al sexo también podemos encontrar diferencias tanto en la ruta de desaturación/elongación como en la proporción de ALA que se dirige a ser oxidado. Los estrógenos parece que incrementan la actividad de esta ruta y además producen un aumento de conversión de ALA con el consecuente incremento de EPA y DHA. También se detecta en mujeres una mayor tasa de conversión de DPA n-3 a DHA. Se sabe que la concentración de DHA es mayor en mujeres comparado con hombres. Parece ser que la razón de este hallazgo se debe a un aumento de la expresión hepática de 5Δ y 6Δ desaturasa en mujeres en edad fértil que les confiere mayor capacidad de sintetizar DHA a partir del ALA dietético38. Este estudio corroboraría la hipótesis sobre la regulación hormonal de la síntesis de AGPI. Otra diferencia entre hombres y mujeres es la menor proporción de ALA destinada a la oxidación en mujeres en comparación de hombres de la misma edad39.
Proliferadores peroxisómicos
Los proliferadores peroxisómicos son aquellos agentes o sustancias que tienen la capacidad de proliferar, no sólo los peroxisomas sino también otras organelas celulares como las mitocondrias o el reticulo endoplásmico. Algunos fármacos se incluyen dentro de esta definición. Distintos estudios en los años 80 describían el aumento de la actividad enzimática de algunos enzimas hepáticos implicados en la biosíntesis de fosfolípidos tras la administración de estas moléculas40.
Estas sustancias son inductores de la actividad de la D6 desaturasa. Los primeros que describieron el efecto de los fibratos (incluidos dentro de los proliferadores peroxisomicos) como inductores de esta actividad enzimática fueron Kawashima et al.41 El tiadenol y el DEHP (di-(2-etilhexil)ftalato), que son estructuralmente diferentes al fibrato ácido clofibrico, son también capaces de incrementar esta actividad enzimática41. Y por último destacar como potente inductor el Wy 14,643, otro proliferador peroxisómico y PPAR alfa ligando42.
Otros factores
Se ha descrito que los virus oncogénicos y la radiación inhiben la Δ6 desaturasa. Esta situación tiene interés especial en los pacientes oncológicos.
Cabe destacar que, dado que estas reacciones enzimáticas tienen lugar en el hígado (que es el órgano con mayor actividad Δ5 y Δ6 desaturasa), todas las patologías que conllevan alteración en la función hepática pueden afectar a la actividad enzimática. De hecho, en pacientes cirróticos se ha constatado un descenso en los niveles de EPA y AA43.
Por último, hay que destacar la influencia de la actividad física en la actividad enzimática. Andersson et al describieron cómo los pacientes más activos físicamente mostraban mayor actividad de la Δ5 desaturasa que los más sedentarios. Entre todos los sujetos estudiados no se encontraron diferencias en cuanto al aporte graso de su dieta44.
En condiciones fisiológicas, la Δ6 desaturasa tiene mas afinidad por el ALA que por el LA. Pero, como en nuestra alimentación hay mayor cantidad de LA que de ALA45, la vía del ALA se activa poco y por tanto la producción de EPA y DHA es escasa. Esto hace que las concentraciones plasmáticas y tisulares de los AGPI de cadena larga, de la familia n6 son mayores que los de la familia n-3. De hecho, el porcentaje de ALA presente en los lípidos tisulares y en plasma supone el 0,5% de todos los AG46.
En conclusión, nos encontramos con diferentes situaciones en las que parece existir una disminución de la actividad las desaturasas (tabla II). Por mucho ALA que administremos, su metabolización a EPA y DHA es escasa, porque su conversión es ineficaz, y además porque el aumento crónico de ALA disminuye los niveles de DHA. El consumo de pescado aporta AG n-3, pero también es rico en EPA y DHA, por lo que no depende de su transformación a partir del precursor. Además, las propiedades antiinflamatorias, antitrombóticas y reductoras del nivel de colesterol, es decir de protección cardiovascular, proceden del EPA dietético y no del EPA producido a partir del ALA, que dará lugar al DHA.
La ingesta de AG n-3 disminuye la actividad de la Δ6 desaturasa (la primera enzima limitante) por lo que se podría pensar que aumentar la ingesta de AG n-3 no conseguiría aumentar los niveles de EPA y DHA. Sin embargo esta ingesta de AG n-3 estimula la actividad de la Δ5 desaturasa (la segunda enzima), por lo que el efecto final parece ser de aumento de producción de EPA y DHA. Van der Meij47 observa que después de 4-7 días de la administración de AG n-3 mediante nutrición enteral se consigue la incorporación de EPA (y en algunos casos de DHA) en el plasma, las membranas celulares de las células sanguíneas y de los tejidos mucosos, aunque no llega a determinar la duración de este cambio tras suspender la administración de AG n-3. Burdge es el autor que mejor ha estudiado estos efectos e indica que la ingesta de ALA aumenta los niveles de EPA y DPA n-3, pero influye mínimamente en los de DHA11.
Mediadores de la respuesta inmune
Los eicosanoides son moléculas con 20 átomos de carbono que actúan modulando la función renal47, vascular48 y la inflamación49 de forma paracrina o autocrina. Se incluyen en este grupo las prostaglandinas, prostaciclinas, los leucotrienos y tromboxanos entre otras moléculas. Las prostaglandinas se producen en la mayoría de los tejidos, las prostaciclinas en el endotelio vascular, los leucotrienos principalmente en los leucocitos y por último los tromboxanos en las plaquetas. Estos mediadores de la respuesta inmune derivan principalmente del metabolismo del AA y del EPA. De hecho, la principal función del AA es la de ser precursor de la síntesis de estas moléculas.
Las células inflamatorias humanas presentan grandes cantidades de AA y pequeñas de AG de la familia n-3. La proporción de ambas familias varía según el tipo celular. La presencia de mayor cantidad de AA en las membranas celulares hace que pueda ser metabolizado dando lugar a sustancias potencialmente inflamatorias. Sin embargo, esta proporción se puede modificar a través de la administración oral de EPA y DHA. Es decir, que aumentando el aporte de EPA dietético, se puede reducir la proporción de AA de las membranas celulares y aumentar la de EPA, disminuyendo así la producción de los metabolitos lipídicos nocivos50. Esto se conoce como la función inmunomoduladora de los AG n-3, dado que el cambio en la composición grasa de las células inflamatorias modifica su función.
Eicosanoides derivados del metabolismo del AA
El AA de las membranas celulares, a través de la activación de las fosfolipasas y en especial de las fosfolipasa A2, es capaz de ser liberado a plasma. Así, se convierte en sustrato para las rutas enzimáticas, de entre las que destacan tres: Ciclooxigenasa (COX), Lipooxigenasa (LOX) y citocromo P450 (CYP). Los eicosanoides que derivan de la ruta de la COX tienen mayor actividad biológica que aquellos que lo hacen de la LOX.
Eicosanoides de la ruta COX
Las prostaglandinas, los tromboxanos y las prostaciclinas son las principales sustancias que se derivan de esta ruta enzimática. Tras un primer paso de conversión en prostaglandina H2 (PG H2) por la acción del enzima COX, se producirán PG de la serie 2, entre las que se incluyen PGD2, PGE2, PG I2, (que es una prostaciclina), PGF 2μ y tromboxano A2 (TX A2). Mientras que las PG D2, E2I2 son vasodilatadores, el TX A2 es un potente vasoconstrictor e inductor de la agregación plaquetaria. Además del poder vasodilatador de la prostaciclina PG I2, esta molécula es capaz de inhibir la agregación plaquetar y la activación de los leucocitos. Estas prostaciclinas son antagonistas fisiológicos de los tromboxanos. El balance que existe entre estos dos grupos de moléculas con efectos fisiológicos antagónicos es clave para el mantenimiento de la homeostasis vascular.
Eicosanoides de la ruta LOX
Por la ruta de la LOX se generarán los leucotrienos y los ácidos hidroxieicosatetranoicos (HETEs) principalmente. El enzima LOX se clasifica según la localización del grupo hidroperóxido; así, encontramos la 5-LOX, 8-LOX, 12-LOX y 15-LOX51. Por la activación de la 5-LOX se producirán los leucotrienos (LT) de la serie 4, destacando el LT B4 que facilita la quimiotaxis y la adhesión celular. El efecto de estos mediadores es claramente inflamatorio. Por la vía de la 12-LOX se generarán los HETEs. Y por último, a través de la 15-LOX se producirán unas moléculas con propiedades antiinflamatorias conocidas como lipoxinas, entre las que destacan la A4 y B4 con efectos vasodilatadores, inhibidores de la quimiotaxis de los neutrófilos y estimulador de la adherencia de los monocitos. Estas moléculas tienen un papel clave en el control y resolución del proceso inflamatorio.
Eicosanoides de la ruta CYP 450
Entre los eicosanoides derivados de esta ruta se encuentran los ácidos epoxieicosatrienoicos (EETs) y los HETEs. Destacan los EETs por su actividad antinflamatoria y angiogénica. Estas sustancias, productos de un proceso de epoxigenación, desempeñan un papel decisivo en la regulación de la función renal y cardiovascular, por ello son diana terapéutica para enfermedades como la hipertensión arterial o el ictus.
Eicosanoides derivados del metabolismo del EPA
El enzima COX-2
Convierte el EPA en las PG y TX de las series 1 y 3. Destaca entre ellos el TX A3 que es un débil agente plaquetario y vasoconstrictor, con poca actividad biológica. También por la acción de la COX se producirá en las células endoteliales la prostaciclina I3, agente vasodilatador y antiagregante plaquetario.
Por la acción de LOX
Se formaran en los leucocitos los LT de la serie 5. De entre ellos hay que destacar el LT-B5, que presenta efecto antiinflamatorio e inhibidor de la adhesión celular. Todos estos mediadores son significativamente menos inflamatorios, es decir tienen menor actividad biológica.
La epoxigenación
La epoxigenación del EPA da lugar a unas sustancias denominadas resolvinas, en concreto la resolvina E1, con propiedades antiinflamatorias, que después describiremos.
Eicosanoides derivados de otros AGPI
Además de los eicosanoides que derivan del AA y del EPA también pueden producirse otros mediadores lipídicos a partir de otros AGPI como son el DHGL o el DHA
El DHGL, que es una sustancia intermediaria en el metabolismo del AA como explicamos anteriormente, es fuente de producción de sustancias con propiedades antinflamatorias. Destacan algunas PG y TX de la serie 1 que inhiben la producción de coágulos.
A partir del DHA también se producen moléculas con propiedades antinflamatorias denominadas resolvinas o docosanoides. Se encuentran presentes en la sangre, en los leucocitos y en el tejido encefálico. Podemos destacar la resolvina D1 y la protectina D1. Estas sustancias se han visto involucradas en la protección de algunos tejidos como el sistema nervioso, pulmón o hígado así como en la resolución del proceso inflamatorio. La figura 2 ilustra esta cascada de producción de eicosanoides.
Recomendaciones dietéticas internacionales de ácidos grasos esenciales
La escasez de estudios y ausencia de consenso sobre los niveles óptimos de estos nutrientes en las fórmulas de nutrición enteral, nos obliga a basarnos en las recomendaciones en la dieta oral. En el apartado siguiente revisaremos las recomendaciones dietéticas de las diferentes sociedades científicas. Éstas nos podrán servir de referencia para las fórmulas de nutrición enteral.
Las recomendaciones dietéticas de los AGPI es un tema a debate, no habiéndose establecido todavía unos niveles máximos de ingesta de AG n-6 y n-3. Además las cantidades a recomendar van a depender de las diferentes enfermedades. No existe tampoco acuerdo sobre la mejor proporción de aporte de DHA y de EPA, si es mejor darlos de forma separada o combinada y si existen otros AG n-3 de cadena larga que pueden tener un efecto beneficioso. Otras razones que dificultan establecer claras guías en cuanto a las recomendaciones de los AG n-3 son la gran variabilidad interindividual en cuanto a su metabolismo, basado en determinantes genéticos, sexo, edad y enfermedad de base. Por lo tanto los requerimientos para sus efectos fisiológicos necesitarían ser ajustados de forma individual52.
Las recomendaciones de las sociedades científicas sobre la ingesta de grasa y AG en particular, se han hecho tanto para personas sanas como para la prevención y el tratamiento de enfermedades crónicas. Se recomienda generalmente una disminución en la ingesta de grasa saturada y AG trans, con una ingesta total de grasa que oscile entre un 20-25% a un 35% del total del aporte energético53. Aunque en una revisión reciente de Aranceta et al.54. Se considera que no hay una recomendación estándar, que varía según países y sólo las recomendaciones más recientes establecen la importancia de un adecuado aporte de AG n-3.
Las primeras recomendaciones se basaban en estudios en los que relacionaban los efectos beneficiosos de los AG n-3 con el consumo de pescado, pero no con el propio n-3 directamente55. En posteriores estudios se utilizan sólo AG n-3, demostrando que estos AG son los mas importantes para la prevención primaria cardiovascular de todos los nutrientes que aporta el pescado56-58.
Otra forma de enfocar las recomendaciones de ingesta de AG n-3 es el cociente n-6/n-3. El aporte de AG a través de la dieta ha ido evolucionando, siendo totalmente diferente el contenido y la relación de n-6/n-3 en nuestros días comparado con la de los primeros humanos. La dieta de los cazadores-recolectores de la era paleolítica era abundante en carnes magras, peces, vegetales verdes y frutas, con un bajo aporte de grasas totales (20%) y de grasa saturada (< 6%), y prácticamente sin grasa saturada y la relación entre los AG n-6 y n-3 consumidos era 1/1. La carne de los peces y otros productos marinos les aportaban AG n-3 y los vegetales verdes LA y ALA.
El comienzo de la agricultura, aunque modificó el perfil nutricional del hombre, ya que se incorporaron los cereales a la alimentación, no produjo grandes cambios en la disponibilidad y la cantidad de AG y la cantidad de la grasa total de la dieta. Fueron los desarrollos tecnológicos de los últimos 100-150 años los que verdaderamente han contribuido a un cambio en las tendencias de consumo de las grasas y a un cambio radical en la relación de consumo n-6/n-3.
La dieta actual de los países occidentales se caracteriza por una elevada relación n-6/n-3, que puede llegar a ser 15-20/1, debido al consumo elevado de n-6 y la disminución en la dieta de n-3. Esta desproporción afecta más a los países occidentales que a los orientales (relación n-6/n-3 en torno a 12/1) ya que en estos el consumo de pescado y productos del mar ricos en EPA y DHA es mayor59.
El cociente n6/n3 idóneo está todavía por definir. En los pacientes con asma un cociente 10/1 se asoció a una mayor inflamación, mientras que un cociente 5/1 tuvo efectos beneficiosos. En la prevención secundaria de enfermedad cardiovascular, un cociente de 4/1 se asoció a un descenso del 70% en la mortalidad total. Este mismo cociente no fue suficiente para reducir la proliferación celular en el cáncer colorrectal y se necesitó un cociente 2.5/1. En pacientes con artritis reumatoide un cociente de 2-3/1 redujo el componente inflamatorio60. Todas estas discrepancias indican que el cociente óptimo varía según la enfermedad a la que nos refiramos ya que son enfermedades crónicas, multigénicas y multifactoriales. Además, es posible que la dosis terapéutica de AG n-3 dependa de la gravedad de la enfermedad y de la predisposición genética del individuo61.
En los últimos 70 años se han desarrollado procesos como la hidrogenización de los aceites vegetales para conservar y manejar mejor los aceites vegetales y animales. Esto implica sin embargo una disminución del aporte de los AG esenciales y un aumento de la producción de AG trans, con efectos muy perjudiciales sobre la salud. Además, cada vez se consumen más cereales con AG n-6 y se dispone de más aceites vegetales (maíz, girasol, soja) ricos en LA y de productos hidrogenados, mientras que el consumo de productos marinos cada vez es menor7.
No debemos olvidar las reflexiones del consenso publicado en 2009 por la American Heart Association (AHA)62. Reconoce que en muchas ocasiones, se recomienda disminuir la ingesta de n-6 en la dieta como estrategia para mejorar la relación n-6/n-3 y, en consecuencia, disminuir el riesgo cardiovascular. Sin embargo, según la revisión de la literatura científica realizada por la AHA, dicha estrategia no sólo podría ser poco efectiva, sino que además podría tener efectos contrarios a los esperados en la salud cardiovascular, ya que la ingesta de n-6 (5-10% de la energía total de la dieta) ha demostrado tener un efecto cardiovascular protector.
En conclusión, podríamos decir, que aumentar el consumo de n-3 parece ser la mejor estrategia a seguir para obtener una relación n-6/n-3 adecuadas63,52. Para conseguirlo habría que aumentar la ingesta de pescado a 2-3 raciones a la semana, o en ciertos casos valorar el uso de suplementos.
Por otra parte, ingestas elevadas de AG n-3 pueden causar un sangrado excesivo en ciertos individuos. La Sociedad Americana de Dietistas recomienda que aquellos pacientes que tomen más de 3 g/día de AG n-3 de cadena larga debieran ser seguidos por un médico64. La FDA65 ha establecido como "generalmente considerado como seguro" niveles de 3 g/día de AGPI de cadena larga. Se han establecido las mismas recomendaciones por otras organizaciones como la Australia and New Zealand National Health and Medical Research Council66.
También existe una gran preocupación en relación con la presencia de ciertos contaminantes en el pescado como son dioxinas, mercurio y otras sustancias, aunque diferentes estudios67 han mostrado que los beneficios de la ingesta habitual de pescado exceden los riesgos potenciales. Para poblaciones especiales como niños, mujeres embarazadas o que planeen un embarazo, los beneficios de una ingesta moderada de pescado, salvo ciertas especies como pez espada, tiburón, caballa gigante y lofolátilo siguen siendo mayores que los riesgos.
Respecto a las recomendaciones de EPA, hasta hace pocos años, las recomendaciones diarias de ingesta (DRI) se habían centrado en el ALA, con menciones indirectas al aporte de AGPI de cadena larga, el EPA y DHA. En el año 2002 el Food and Nutrition Board of the American Institute of Medicine (FNB-IOM)68 emitió un informe en el que se comunicaba que no existían datos científicos suficientes para establecer ingestas adecuadas ni ingestas de referencia para EPA o DHA. Posteriormente han surgido nuevas evidencias que justifican la reevaluación de las recomendaciones de EPA y DHA y sus repercusiones sobre la salud. La FAO/ WHO establece que hay una evidencia insuficiente para establecer una ingesta mínima de EPA o DHA, por lo que recomiendan que ambos sean consumidos69.
Otro problema es definir el cociente más beneficioso de EPA/DHA. Ambos metabolitos son químicamente diferentes y podrían tener efectos diferentes sobre el riesgo cardiovascular70. La naturaleza nos muestra que el cociente en el pescado se inclina a favor de DHA. Sin embargo, en el Gruppo Italiano per lo Studio della Sopravivenza nell'Infarto miocardio (GISSI) la dieta utilizada era más rica en EPA y sus efectos cardioprotectores fueron evidentes56,58. Ratios de EPA/DHA de 1/2 a 2/1 parecen ser beneficiosos. Además, tenemos experiencia con otros nutrientes en que el efecto terapéutico no lo conseguimos con un nutriente aislado, por lo que la mayoría de las recomendaciones internacionales no separan estos dos nutrientes.
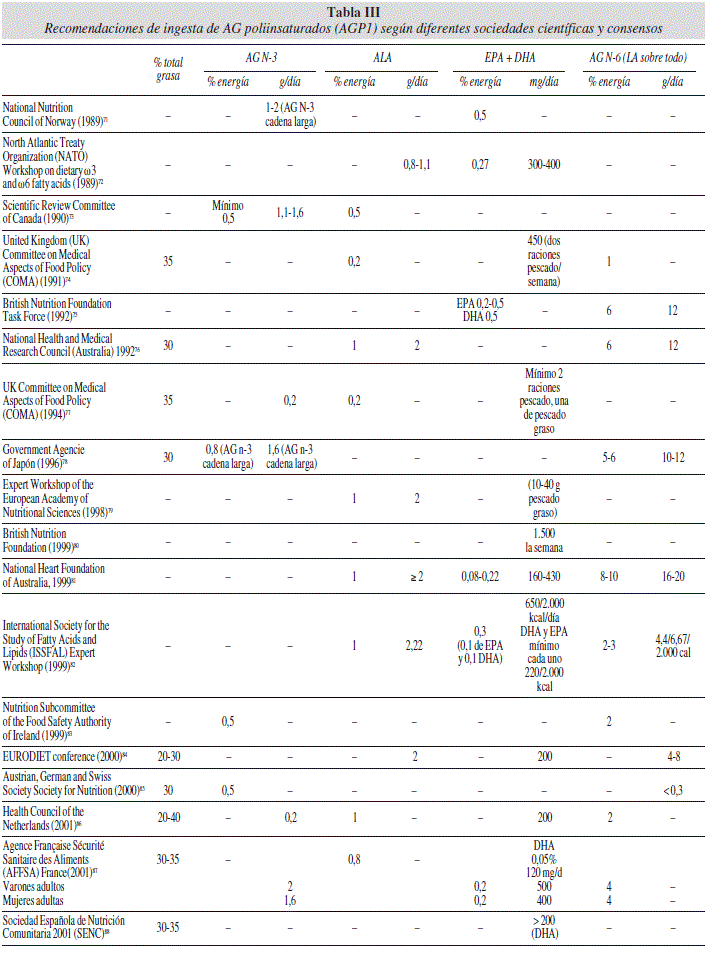
En la tabla III71-109 presentamos cronológicamente las recomendaciones de ingesta de AGPI para la población general de las diferentes sociedades científicas. Este orden nos parece importante porque estas recomendaciones van variando con los años a la luz de nuevos estudios y múltiples revisiones. Un gran número de países han publicado sus Recomendaciones de Ingesta y Guías o han adoptado aquellas sugeridas por organismos internacionales o por otros países. Existe una gran disparidad entre los diferentes países y en las ingestas recomendadas para el total de la grasa y los AG. Además, no existe una metodología estandarizada para definir estos valores. Recientemente se ha publicado una revisión sistemática de las ingestas dietéticas recomendadas para la grasa y los AG54.
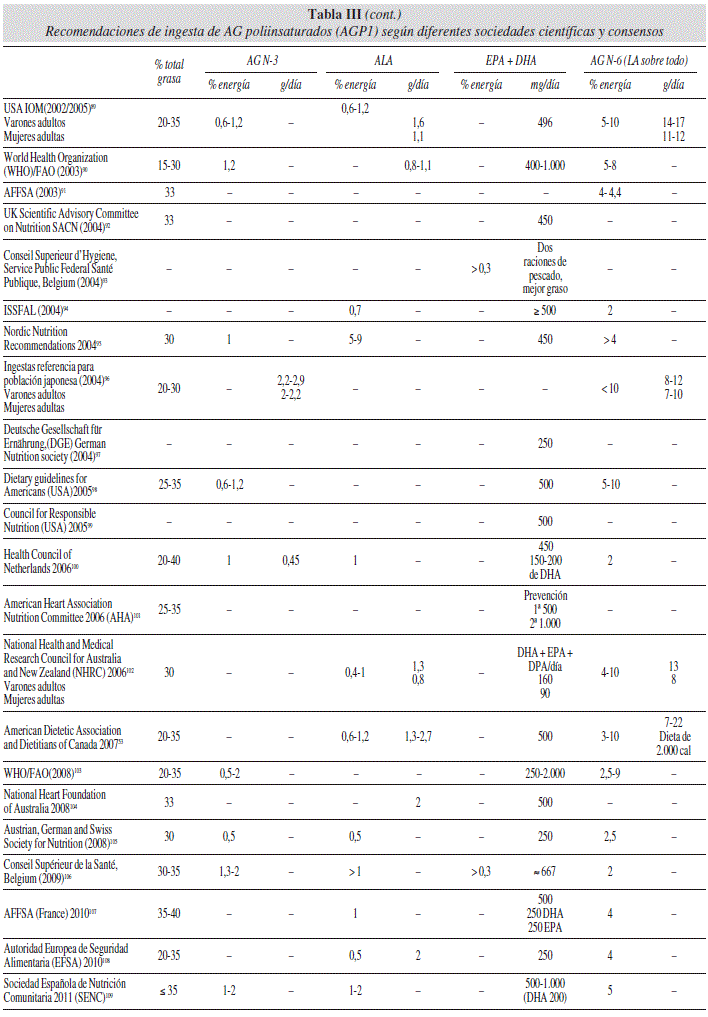
En las últimas recomendaciones internacionales, en la población general, parece haber un cierto consenso con 400-500 mg/día, que serían los niveles mínimos de aporte de EPA + DHA. Esto equivale aproximadamente a dos raciones a la semana de pescado, preferiblemente azul. Respecto al aporte de AG n-6 y n-3 no hay tanto consenso y las recomendaciones son muy dispares. Se podría decir que en general la mayoría coinciden con las de la FAO/WHO de 2008104 en recomendar el 2,5-10% del aporte calórico total en forma de AG n-6 y un 1-2% de n-3, lo que haría un cociente de 5/1. El límite inferior del 2,5% se establece para prevenir el déficit de ácidos grasos esenciales, mientras que el rango superior estaría indicado para reducir los niveles plasmáticos de LDL y triglicéridos. Este cociente está lejos del 12/1 o mayor de las dietas típicas de la dieta en la sociedad occidental industrializada. Debemos recordar que el cociente n-6/n-3 eficaz en patologías ha sido desde 5/1 en asma hasta 2,5/1 en cáncer colorrectal60.
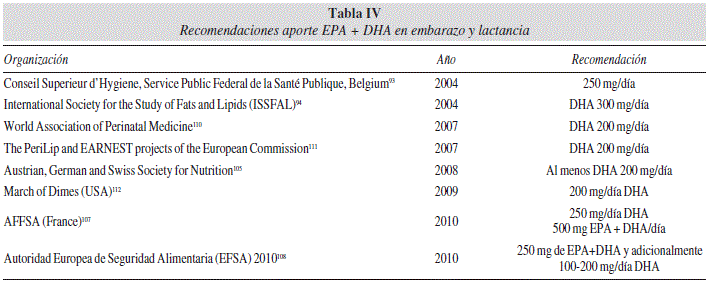
En mujeres embarazadas y lactantes, para un optimo desarrollo fetal la ingesta mínima de EPA + DHA sería de 300 mg/día, de los cuales al menos 200 mg deben ser de DHA (tabla IV). El DHA tiene un papel esencial en el desarrollo del cerebro y la retina durante la etapa fetal y los dos primeros años de vida. Estos hallazgos apoyan la necesidad de recomendaciones para una adecuada ingesta en embarazadas, lactancia y niños hasta dos años. El DHA debería considerarse condicionalmente esencial durante las etapas iniciales del desarrollo, dado que la formación de DHA a partir de ALA es muy limitada y muy variable (1-5%)54.
Respecto a los pacientes con enfermedades cardiovasculares, en los últimos años hay cada vez más conocimiento acerca de la relación entre la ingesta de AG n-3 y la reducción del riesgo cardiovascular (tabla V). Las recomendaciones de las diferentes sociedades coinciden en que las personas adultas han de consumir pescado al menos dos veces por semana. En el caso de pacientes con enfermedad coronaria, las recomendaciones de consumo son de 1 gramo diario de EPA + DHA procedente de aceites de pescado o suplementos. En el caso de pacientes con hipertrigliceridemia se recomienda el suplemento de 2 a 4 gramos diarios de EPA + DHA a fin de disminuir en un 20-40% los niveles de triglicéridos del plasma.
Fuentes alimentarias de AG n-3 y n-6
Sabemos que los AG esenciales deben ser obligatoriamente ingeridos a través de los alimentos para la producción de AGPI de cadena larga de la serie n-6 y n-3. Los AG n-6 derivan del LA, ampliamente distribuido en las plantas, salvo en el coco, cacao y la palma. Se encuentran sobre todo en los aceites de semillas vegetales como el maíz, girasol, cártamo, onagra, calabaza, cacahuete germen de trigo y soja. Es precursor del AA sintetizado en los mamíferos, y por lo tanto, presente en los alimentos de origen animal. Los AG n-3 derivan del ALA, que predomina en nueces, cloroplastos de las plantas de hoja verde oscuro y en los aceites vegetales de semillas de soja, lino, colza, linaza, grosella y otras frutas rojas. A partir de este último se sintetizan EPA y DHA, que también pueden ser ingeridos a través de la dieta con el consumo de pescados azules. En la tabla VI se reseñan los alimentos más ricos de estos AG115.
Menos de un 0,2% del ALA se convierte en el organismo en EPA y sólo el 0,05% en DHA. Por ello para que estos dos AG alcancen concentraciones adecuadas deben ser aportados al organismo de forma regular y en cantidades suficientes con una dieta rica en productos marinos. La procedencia fundamental de estos ácidos es de algas microscópicas, plancton y crustáceos planctónicos, que están en la base de la cadena alimentaria.
Existen importantes diferencias en el contenido de EPA y DHA no sólo entre las distintas especies (máximo en el salmón y la caballa), sino dentro de una misma especie. La diferente composición lipídica va a depender de su hábitat, según varíen factores como la temperatura, la profundidad y la salinidad del agua, del momento de la captura y de si son animales salvajes o proceden de piscifactoría. El contenido de grasa total y AG n-3 es mayor en pescados de agua fría. También hay diferencias en las concentraciones de AG n-3 según la forma de preparación del pescado. En los pescados fritos (de restaurantes o de comida rápida) disminuye el contenido de AG n-3 y aumenta el cociente n-6/n-3 y el contenido en AG trans. Por todo esto, en la mayoría de las recomendaciones internacionales insisten en la ingesta de pescado más que en unas dosis precisas de AG n-31.
Nuevas fuentes de AG n-3
Un estudio epidemiológico reciente sitúa la baja ingesta de AG n-3 en el octavo puesto de causas prevenibles de mortalidad en Estados Unidos116. Por esto, cada vez hay más interés en buscar nuevas fuentes de n-3, especialmente los de cadena larga. Esto se debe al el problema de suministro de pescado, aparición de contaminantes, pérdida de la biodiversidad de especies que en un futuro afectará a toda la población mundial, etc...117.
La biotecnología está desarrollando nuevos aceites enriquecidos en AG n-3 que pueden usarse en las comidas o como suplementos. A partir de algunas cepas bacterianas y microalgas que están en la microbiota intestinal de los peces de agua salada se obtienen aceites ricos en EPA y especialmente en DHA117.
Se han alimentado también gallinas, pollos y cerdos con aceites marinos para incrementar así el contenido en DHA de la carne y de los huevos. La manipulación genética también ha contribuido a aumentar el aporte de n-3 en diferentes alimentos, como es el caso de nuevas cepas de semillas que pueden sintetizar DHA a partir de ALA118.
Otra opción para aumentar el consumo de AG n-3 en la dieta es incorporarlos en alimentos de consumo habitual, desarrollando alimentos funcionales ricos en n-3. Estos productos enriquecidos en n-3 hacen que sea más fácil alcanzar las recomendaciones de estos AG. La tecnología moderna de alimentos hace posible hoy en día que una gran cantidad de alimentos puedan enriquecerse en AG n-3 y, de hecho, existe en todo el mundo una gran variedad de productos alimenticios enriquecidos. Algunos ejemplos de estos alimentos que se comercializan en la casi totalidad de los países de Europa son el pan y los productos de panadería, margarinas, grasas untables, huevos y derivados, pastas, salsas, zumos y bebidas no alcohólicas, carnes, productos lácteos y leche119.
Sin embargo, este aporte puede ser de tan solo un 30%, existiendo grandes diferencias entre productos. Estos AG son muy susceptibles a la oxidación y reaccionan muy rápidamente cuando se exponen a condiciones o agentes oxidantes como el oxígeno del aire. Por esta razón, los aceites de pescado se adicionan a los alimentos con vitamina E y otros antioxidantes para prevenir la oxidación que, de lo contrario, produciría enranciamientos, malos olores e inestabilidad. Además, la producción de alimentos enriquecidos con AG n-3 es técnicamente difícil y requiere de métodos especiales para producir un aceite de pescado adecuado, apropiado para la adición a alimentos, sin olor ni sabor a pescado115.
Debido a las dificultades para cubrir las ingestas recomendadas de AG n-3 han aparecido suplementos alimenticios que tratan de satisfacer los requerimientos nutritivos de estos AG. Al igual que ocurre con ciertos alimentos, en la suplementación existe gran variación en cuanto a su composición y concentración de EPA y DHA. En los últimos años se ha aprobado la administración de AG n-3 como fármaco de administración vía oral. En España existe una formulación galénica que proporciona 840 mg de AG n-3 (465 mg de EPA y 375 mg de DHA). Está autorizado para su utilización en prevención secundaria tras infarto de miocardio en combinación con tratamientos de referencia y en hipertrigliceridemia endógena como suplemento a dieta cuando hay una respuesta inadecuada a medidas dietéticas4.
Los AG n-3 pueden entonces considerarse tanto como nutrientes esenciales, suplementos dietéticos o principios activos de fármacos, dependiendo de su nivel de ingesta y el motivo por el que se administren120.
Composición en AG n-3 de las fórmulas de nutrición enteral comercializadas en España
La composición de estos AG n-3, así como su ratio n-6/n-3 es muy variable de unas fórmulas de nutrición enteral a otras. La clasificación de estas fórmulas se basa en si son completas o no, si son poliméricas, peptídicas o elementales, su riqueza y calidad de las proteínas, su concentración calórica y su contenido en fibra, pero no en la cantidad y calidad de las grasas que contienen121.
Las fórmulas estándar aportan un 15-16% del valor calórico total en forma de proteínas, un 48-55% en carbohidratos y un 30-35% en grasas. La composición de estas grasas es muy heterogénea, siendo aún más irregular el contenido en n-3, n-6, EPA y DHA mucho más. En la tabla VII mostramos algunos productos de nutrición estándar ordenados por su contenido en EPA+DHA. Los productos que no aportan EPA ni DHA los hemos ordenado por el cociente n-6/n-3. En la primera fila destacamos la composición recomendada, según las guías internacionales para la dieta oral.
En la mayoría de estas guías54 se recomienda la ingesta de un 20-35% de la energía total en forma de grasas, aunque algunas lo aumentan al 40% en personas con peso adecuado. El aporte de grasas saturadas, suele estar reducido al 10% o incluso al 7% de la energía total por la American Heart Association101. En 100 cc de nutrición estándar obtenemos 100 kcal, por lo que el 7-10% de estas calorías corresponderían a 0,77-1,1 g de grasas saturadas. Respecto a las grasas monoinsaturadas (AGMI) en España su consumo se ha cifrado en torno al 20% del aporte energético total109. En 100 cc de fórmula estándar serían 20 kcal, que corresponden a 2,2 g de AGMI. Por último, la ingesta recomendada de grasas AGPI es de 6-10% (0,66 a 1,1 g de AGPI en 100 cc de fórmula estándar). En la tabla VII podemos observar que la mayoría de las fórmulas de nutrición estándar cumplen estos criterios.
El objetivo principal de nuestro estudio es analizar el contenido de AG n-3, n-6, así como de EPA y DHA de las fórmulas de nutrición enteral, así como establecer unas posibles recomendaciones. Para ello hemos calculado para un consumo medio de 1.500 cc/día, dado que es la dosis más habitual.
El aporte de AG n-3 recomendado para la población general es de 0,5-2 g/día87,100 o bien 0,5-2% de la ingesta calórica total, con un límite superior de 3 g/día por el riesgo de hemorragias64, disminución en la producción de citoquinas y aumento de la peroxidación lipídica122. Para un aporte de 1.500 cc de nutrición enteral estándar, con 1.500 kcal, la cantidad recomendada de 0.5-2% de la ingesta calórica procedente de AG n-3, corresponde a 7,5-30 kcal, esto es 0,83-3,3 g/día. En la tabla VII podemos observar que algunos de los productos que contienen EPA y DHA exceden el límite de los 3 g/día, excepto Dienat G, Nutrison y T Diet Plus Standard.
Respecto al aporte recomendable de AG n-6, la mayoría coinciden con las guías de la FAO/WHO de 2008104 que recomiendan el 2,5-10% del aporte calórico total en forma de AG n-6. Para un aporte de 1.500 kcal/día, esto corresponde a 37,5-150 kcal en forma de AG n-6, o lo que es lo mismo, 4,16-16,6 g/día. En el caso de este nutriente, todos los productos están dentro de los márgenes recomendados.
El cociente n-6/n-3 no está bien definido pero la mayoría coinciden con las guías de la FAO/WHO de 2008104 que recomiendan un cociente de 5/1. El cociente n-6/n-3 de las fórmulas de nutrición enteral varía mucho, pero la mayoría están en el entorno del 2/1 al 5/1 recomendado, excepto en los que el aporte de AG n-3 es muy escaso.
De la revisión sobre el metabolismo de los AG n-3 que hemos realizado al principio de este trabajo se deduce que es más importante el aporte de EPA y DHA de forma directa que el de sus precursores por varias razones:
1) La ingesta aumentada de ALA disminuye los niveles de DHA y además el EPA producido como metabolito de ALA se convierte a DHA y no tiene los efectos conocidos del EPA dietético.
2) Las bajas cifras de eficacia en la conversión enzimática de ALA a sus metabolitos (de ALA a EPA es 0,2%, a DPA n-3 del 0,13% y a DHA del 0,05%).
3) La formación de DHA a partir de ALA es muy limitada y variable (1-5%) por eso se recomienda la ingesta directa de DHA procedente de los alimentos, principalmente con la ingesta de pescado azules.
4) La conversión de AG n-3 a EPA y DHA es limitada y depende de factores genéticos y ambientales, por lo que su aporte directo es muy importante en determinadas situaciones.
Por todo lo anterior, cada vez hay más fórmulas estándar que contiene estos metabolitos. Para un consumo de 1.500 cc de fórmula de nutrición al día, los que contienen EPA y DHA, todos aportan al menos los 500 mg diarios mínimos recomendados, pero un número no desdeñable de nutriciones enterales estándar no los contienen. Dentro de los que contienen más cantidad de EPA + DHA (los primeros en la tabla VII), es de destacar que los cuatro primeros son fórmulas pediátricas, y es el recientemente aparecido Dienat G es la fórmula para adultos que mas aporta EPA + DHA siendo una dieta estándar.
Por último, la ratio EPA/DHA en la mayoría es de 2/1, como se recomienda en la dieta basada en alimentos, pero en algunos el aporte de DHA es muy escaso o inexistente. Este déficit de DHA es muy importante, por su función antiinflamatoria que deriva de las resolvinas D1 o neuroprotectinas explicadas anteriormente y por el papel que desempeña este AG en el desarrollo del cerebro y retina fetales hasta los dos años de vida y posteriormente en el mantenimiento de una correcta función neurológica, visual y reproductora. Este es el motivo por el que debería considerarse condicionalmente esencial durante el embarazo, lactancia y dos años después del nacimiento del recién nacido. Por otra parte, al EPA se le atribuyen propiedades antitrombóticas, vasodilatadoras, de descenso del colesterol plasmático y de participación en el desarrollo de una óptima función neurológica entre otras. Aunque no es seguro que estas funciones de los AG n-3 que se atribuyen a los AG EPA o a DHA sea tan específicas o que se deriven de la sinergia de ambas.
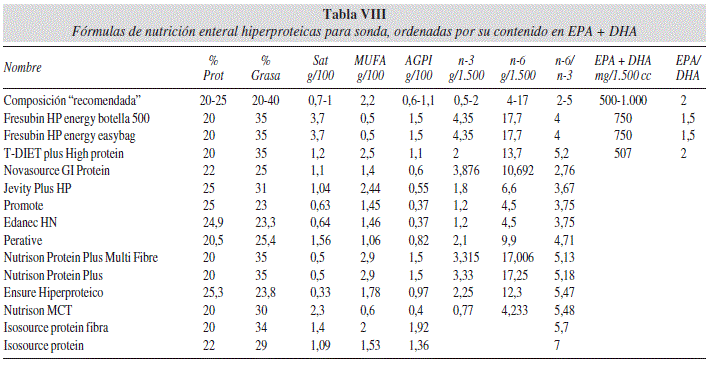
Los productos hiperproteicospor sonda aportan desde el 20 al 25% del valor calórico total en forma de proteínas. En la tabla VIII mostramos los principales productos ordenados por su aporte en EPA y DHA. El aporte de grasas es muy heterogéneo, pudiendo corresponder del 23 al 40% del valor calórico total. Para un consumo mínimo de 1.500 cc/día el aporte de AG n-3 puede variar de 4,35 g a otros que no declaran contenerlos, aunque en general están muy cerca del rango recomendado. El aporte de AG n-6 también es muy variable de unos a otros, pero dentro de los límites recomendables. El cociente n 6/n 3 entre 2/1 y 5/1 aparece en la mayoría, excepto en el último que está mas alejado. El problema viene por el contenido en EPA y DHA, que es inexistente en la mayoría de los productos. Esta composición tan deficitaria en algunos productos de nutrición enteral es preocupante porque en ocasiones se utilizan estas fórmulas en pacientes con altos requerimientos de proteínas, como el paciente crítico, en el que están indicados los aportes de EPA y DHA.
Los productos hiperproteicos y/o concentrados por vía oral aportan entre un 18 y un 30% de su valor calórico total en forma de proteínas, por lo que se suelen usar en pacientes con muy escasa ingesta proteica. Este prototipo de paciente no suele ser capaz de comer la parte proteica de las comidas, por lo que es de suponer que ingerirá poco pescado. Con este planteamiento clínico llama la atención que sólo un producto con esta presentación contenga EPA y DHA.
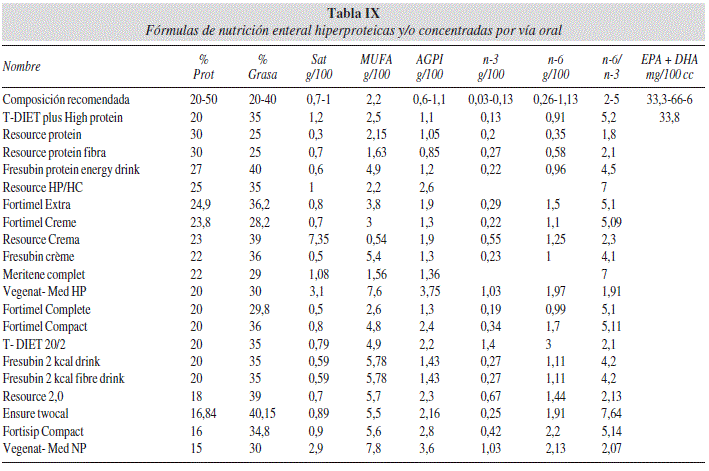
En la tabla IX ordenamos las fórmulas de nutrición enteral primero por su contenido en EPA + DHA y luego de manera decreciente según su aporte proteico. Las cantidades de AG n-3, n-6, EPA y DHA las expresamos por 100 cc porque el consumo diario de estos productos es muy variable, ya que se toma para complementar la ingesta de alimentos deficitaria. En este contexto es ya muy difícil valorar si el paciente que toma estos productos sigue una dieta deficitaria o no y sólo podemos compararlos entre sí pero no respecto a la ingesta diaria recomendable.
El único producto de esta familia que contiene EPA y DHA es T-Diet plus High Protein. El resto no los contienen, por lo que existe poca posibilidad de discusión. Solo se puede agregar que el cociente n-6/n-3 está dentro de los límites recomendados en la mayoría.
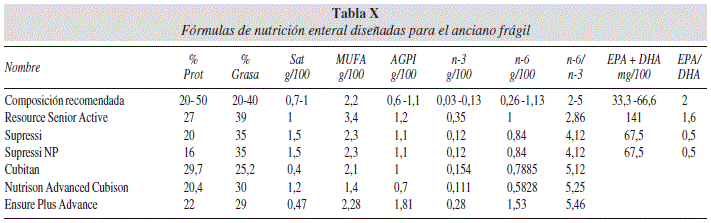
En los últimos años se han comercializado un grupo de fórmulas de nutrición enteral especialmente indicadas para el paciente anciano frágil. En la tabla X presentamos estas fórmulas ordenadas por su contenido en EPA y DHA. Estos productos están especialmente enriquecidos con vitamina D, calcio, zinc, selenio, ácido fólico y vitamina B1, pero no todos aportan EPA y DHA.
De los que aportan EPA y DHA, alguno los contienen en dosis muy altas y con un cociente EPA/DHA muy reducido en DHA. No debemos olvidar que el uso de este tipo de cocientes es muy teórico y de dudosa utilidad clínica porque desconocemos las acciones individuales de uno y otro así como sus interacciones.
Conclusión
Las fórmulas de nutrición estándar presentan un contenido en grasas adecuado, pero en la mayoría de los productos que contienen EPA y DHA exceden el límite de los 3 g/día, excepto Dienat G, Nutrison y T Diet Plus Standard. En cambio, el contenido de AG n-6 está dentro de los márgenes recomendados. El cociente n-6/n-3 de las fórmulas de nutrición enteral varía mucho, pero la mayoría están en el entorno del 2/1 a 5/1 recomendado, excepto en los que el aporte de AG n-3 es muy escaso. De los que contienen EPA y DHA, todos aportan al menos los 500 mg diarios mínimos recomendados, pero un número no desdeñable de nutriciones enterales estándar no los contienen. Por último, la ratio EPA/DHA en la mayoría es de 2/1, como se recomienda en la dieta basada en alimentos, pero en algunos el aporte de DHA es muy escaso o inexistente.
En la mayoría de las fórmulas hiperproteicas por sonda el contenido en EPA y DHA es inexistente. Muchos de los pacientes que reciben este tipo de fórmulas se encuentran en una situación crítica, con patología con un importante componente inflamatorio que podrían beneficiarse del aporte de EPA y DHA en la nutrición enteral recibida.
Los productos hiperproteicos y/o concentrados por vía oral se suelen usar en pacientes con muy escasa ingesta proteica, por lo que es de suponer que ingerirá poco pescado, pero solo un producto de este grupo (T-Diet plus High Protein) contiene EPA y DHA.
Por último, las nuevas fórmulas para el anciano frágil no todas aportan EPA y DHA. Además, las que los contienen, su concentración puede ser incluso excesiva y en una relación poco parecida a la del aceite de pescado.
Agradecimientos
Querríamos expresar nuestro más sincero agradecimiento a todas las casas comerciales que nos han facilitado la composición de sus productos de nutrición enteral. En especial a Dña. Pilar Sánchez Vera por su ayuda técnica en la coordinación del grupo.
Referencias
1. Gil A. Funciones y metabolismo de los ácidos grasos esenciales y de sus derivados activos. Tratado de Nutrición 2010; 1: 305-320. [ Links ]
2. Kelley DS. Modulation of human immune and inflammatory responses by dietary fatty acids. Nutrition 2001; 17: 669-73. [ Links ]
3. Bang HO, Dyerberg J, Nielsen AB. Plasma lipid and lipoprotein pattern in Greenlandic West-coast Eskimos. Lancet 1971; 1: 1143-5. [ Links ]
4. Caballero R, Gómez R, Núñez L, Vaquero M, Tamargo J, Delpón E. Pharmacology of omega 3 polyinsaturated fatty acids. Rev Esp Cardiol 2006; 6 (Suppl. D): 3-19. [ Links ]
5. Mesa García MD, Aguilera García CM, Gil Hernández A. Importance of lipids in the nutritional treatment of inflammatory diseases. Nutr Hosp 2006; 21 (Suppl. 2): 30-43. [ Links ]
6. Eaton SB, Konner M. Paleolithic nutrition. A consideration of its nature and current implications. New Engl J Med 1985; 312: 283-9. [ Links ]
7. Gómez Candela C, Bermejo López LM, Loria Kohen V. Importance of a balaced omega 6/omega 3 ratio for the maintenance of health: nutritional recommendations. Nutr Hosp 2011; 26:323-9. [ Links ]
8. Pérez de la Cruz AJ, Abilés J, Pérez Abud R. Perspectives in the design and development of new products for enteral nutrition. Nutr Hosp 2006; 21 (Suppl. 2): 100-10. [ Links ]
9. Qi K, Hall M, Deckelbaum RJ. Long-chain polyunsaturated fatty acid accretion in brain. Curr Opin Clin Nutr Metab Care 2002; 5: 133-8. [ Links ]
10. Pawlosky RJ, Hibbein JR., Novotny JA, Salem N Jr. Physiological compartmental analysis of alpha-linolenic acid metabolism in adult humans. J Lipid Res 2001; 42: 1257-65. [ Links ]
11. Burdge GC, Calder PC. Conversion of alpha-linolenic acid to longer-chain polyunsaturated fatty acids in human adults. Reprod Nutr Dev 2005; 45: 581-97. [ Links ]
12. Sprecher H. Biochemistry of essential fatty acids. Prog Lipid Res 1981; 20: 13-22. [ Links ]
13. Nakamura MT, Nara TY, Essential fatty acid synthesis and its regulation in mammals. Prostaglandins Leukot Essent Fatty Acids 2003; 68: 145-50. [ Links ]
14. Óhrvall M, Berglund L, Salminen I, Lithell H, Aro A, Vessby B. The serum cholesterol ester fatty acid composition but not the serum concentration of alpha tocopherol predicts the development of myocardial infarction in 50- year-old men: 19 years follow-up. Atherosclerosis 1996; 127: 65-71. [ Links ]
15. Warensjö E, Risérus U, Vessby B. Fatty acid composition of serum lipids predicts the development of the metabolic syndrome in men. Diabetologia 2005; 48: 1999-2005. [ Links ]
16. Warensjö E, Öhrvall M, Vessby B. Fatty acid composition and estimated desaturase activities are associated with obesity and lifestyle variables in men and women. Nutr Metab Cardiovasc Dis 2006; 16: 128-36. [ Links ]
17. Garg ML, Snoswell AM, Sabine JR. Influence of dietary cholesterol on desaturase enzymes of rat liver microsomes. Prog Lipid Res 1986; 25: 639-44. [ Links ]
18. Huang YS, Mills DE, Ward RP, Simmons VA, Horrobin DF. Stress modulates cholesterol-induced changes in plasma and liver fatty acid composition in rats fed n-6 fatty acid-rich oils. Proc Soc Exp Biol Med 1990; 195: 136-41. [ Links ]
19. Cho HP, Nakamura MT, Clarke SD. Cloning, expression, and nutritional regulation of the mammalian Delta-6 desaturase. J Biol Chem 1999; 274: 471-7. [ Links ]
20. Vessby B, Gustafsson I-B, Tengblad S, Boberg M, Andersson A. Desaturation and elongation of Fatty acids and insulin action. Ann NY Acad Sci 2002; 967: 183-95. [ Links ]
21. Warensjö E, Risérus U, Gustafsson IB, Mohsen R, Cederholm T, Vessby B. Effects of saturated and unsaturated fatty acids on estimated desaturase activities during a controlled dietary intervention. Nutr Metab Cardiovasc Dis 2008; 18: 683-90. [ Links ]
22. Mozaffarian D, Pischon T, Hankinson SE, Rifai N, Joshipura K, Willett WC, Rimm EB. Dietary intake of trans fatty acids and systemic inflammation in women. Am J Clin Nutr 2004; 79:606-12. [ Links ]
23. Brenner RR. Nutritional and hormonal factors influencing desaturation of essential fatty acids. Prog Lipid Res 1981; 20:41-7. [ Links ]
24. Nakamura MT, Nara TY. Structure, function, and dietary regulation of delta 6, delta 5, and delta 9 desaturases. Annu Rev Nutr 2004; 24: 345-76. [ Links ]
25. Cho HP, Nakamura MT, Clarke SD. Cloning, expression, and nutritional regulation of the mammalian delta 5 desaturase. J Biol Chem 1999; 274 (1): 471-7. [ Links ]
26. Tilvis RS, Miettinen TA. Fatty acid composition of serum lipids, erytrocytes, and platelets in insulin-dependent diabetic women. J Clin Endocrinol Metab 1985; 61: 741-5. [ Links ]
27. El Bustani S, Causse JE, Descomps B, Monnier L,Mendy F, Craster de Paulet A. Direct in vivo characterization of delta 5 desaturase activity in humans by deuterium labeling: effect of insulin. Metabolism 1989; 38: 315-21. [ Links ]
28. Bassi A, Avogaro A, Crepaldi C, Pavan P, Zambon S, Marin R, et al. Short-term diabetic ketosis alters n-6 polyunsaturated fatty acid content in plasma phospholipids. J Clin Endocrinol Metab 1996; 81: 1650-3. [ Links ]
29. Sartore G, Lapolla A, Reitano R, Zambon S, Romanato G, Marin R, et al. Desaturase activities and metabolic control in type 2 diabetes. Prostaglandins Leukot Essent Fatty Acids 2008; 79: 55-8. [ Links ]
30. Das UN. A defect in the activity of Delta 6 and Delta 5 desaturases may be a factor predisposing to the development of insulin resistance syndrome. Prostaglandins Leukot Essent Fatty Acids 2005; 72: 343-50. [ Links ]
31. Kröger J, Schulze MB. Recent insights into the relation of D5 desaturase and D6 desaturase activity to the development of type 2 diabetes. Current opin lipidol 2012; 23 (1): 4-10. [ Links ]
32. Nervi AM, Pelufo RO, Brenner RR, Leikin AI. Effect of etanol administration on fatty acid desaturation. Lipids 1980; 15: 263-8. [ Links ]
33. Nakamura MT, Tang AB, Villanueva J, Halsted CH, Phinney SD. Reduction of delta 6 and delta 5 desaturase activities but not delta 9 desaturase in micropigs chronically fed ethanol. J Clin Invest 1994; 93: 450-4. [ Links ]
34. Narce M, Poisson JP, Bellenger J, Bellenger S. Effect of ethanol on polyunsaturated fatty acid biosynthesis in hepatocytes from spontaneously hypertensive rats. Alcohol Clin Exp Res 2001; 25: 1231-7. [ Links ]
35. Pawlosky RJ, Salem N Jr. Perspectives on alcohol consumption: liver polyunsaturated fatty acids and essential fatty acid metabolism. Alcohol 2004; 34: 27-33. [ Links ]
36. Agostoni C, Riva E, Giovannini M, Pinto F, Colombo C, Risé P, Galli C, Marangoni, F. Maternal smoking habits are associated with differences in infants' long-chain polyunsaturated fatty acids in whole blood: a case-control study. Arch Dis Child 2008; 93: 414-8. [ Links ]
37. Marangoni F, Colombo C, De Angelis L, Gambaro V, Agostoni C, Giovannini M, et al. Cigarette Smoke Negatively and Dose-Dependently Affects the Biosynthetic Pathway of the n-3 Polyunsaturated Fatty Acid Series in Human Mammary Epithelial Cells. Lipids 2004; 39: 633-7. [ Links ]
38. Extier A , Langelier B, Perruchot MH, Guesnet P, Van Veldhoven PP, Lavialle M, et al. Gender affects liver desaturase expression in a rat model of n-3 fatty acid repletion. J Nutr Biochem 2010; 21: 180-7. [ Links ]
39. Burdge GC, Wootton SA. Conversion of alpha-linolenic acid to eicosapentaenoic, docosapentaenoic and docosahexaenoic acids in young women. Br J Nutr 2002; 88: 411-20. [ Links ]
40. Li Y, Nara TY, Nakamura MT. Peroxisome proliferator-activated receptor alpha is required for feedback regulation of highly unsaturated fatty acid synthesis. J Lipid Res 2005; 46:2432-40. [ Links ]
41. Kawashima Y, Musoh K, Kozuka H. Peroxisome proliferators enhance linoleic acid metabolism in rat liver. Increased biosynthesis of omega 6 polyunsaturated fatty acids. J Biol Chem 1990; 265: 9170-5. [ Links ]
42. Nakamura MT, Cho HP, Xu J, Tang Z, Clarke SD. Metabolism and functions of highly unsaturated fatty acids: an update. Lipids 2001; 36: 961-4. [ Links ]
43. Fats and fatty acids in human nutrition. Report of an expert consultation. FAO Food Nutr Pap 2010; 91: 1-166. [ Links ]
44. Andersson A, Sjödin A, Hedman A, Olsson R, Vessby B. Fatty acid profile of skeletal muscle phospholipids in trained and untrained young men. Am J Physiol Endocrinol Metab 2000; 279: E744-51. [ Links ]
45. Lands B. A critique of paradoxes in current advice on dietary lipids. Prog Lipid Res 2008; 47: 77-106. [ Links ]
46. Burdge GC, Calder PC. Conversion of a-linolenic acid to longer-chain polyunsaturated fatty acids in human adults. Reprod Nutr Dev 2005; 45: 581-597. [ Links ]
47. van der Meij BS, van Bokhorst-de van der Schueren MA, Langius JA, Brouwer IA, van Leeuwen PA. N-3 PUFAs in cancer, surgery, and critical care: a systematic review on clinical effects, incorporation, and washout of oral or enteral compared with parenteral supplementation. Am J Clin Nutr 2011; 94 (5):1248-65. [ Links ]
48. Imig JD. Eicosanoids and renal vascular function in diseases. Clin Sci 2006; 111: 21-34. [ Links ]
49. Feletou M, Huang Y, Vanhoutte PM. Vasoconstrictor prostanoids. Pflugers Arch 2010; 459: 941-50. [ Links ]
50. Dobrian AD, Lieb DC, Cole BK, Taylor-Fishwick DA, Chakrabarti SK, Nadler JL. Functional and pathological roles of the 12- and 15-lipoxygenases. Prog Lipid Res 2011; 50: 115-3. [ Links ]
51. Mochizuki N, Kwon YG. 15-lipoxynase-1 in vasculature: expanding roles in angiogenesis. Circ Res 2008; 102: 143-5. [ Links ]
52. Calder PC. Dietary modifications of inflammation with lipids. Proc Nutr Soc 2002; 61: 345-358. [ Links ]
53. Molendi-Coste O, Legry V, Leclercq IA. Why and how meet n-3 PUFA Dietary Recommendations? Gastroenterol Res Pract 2011; 2011: 364040. Epub 2010 Dec 8. [ Links ]
54. Kris-Etherton PM, Innis S. Position of the American Dietetic Association and Dietitians of Canada: Dietary Fatty Acids. J Am Diet Assoc 2007; 107 (9): 1599-1611. [ Links ]
55. Aranceta J, Perez-Rodrigo C. Recommended dietary reference intakes, nutritional goals and dietary guidelines for fat and fatty acids: a systematic review. Br J Nutr 2012; 107: S8-S22. [ Links ]
56. Burr ML, Fehily AM, Gilbert JF, Rogers S, Holliday RM, Sweetnam PM, et al. Effects of changes in fat, fish, and fibre intakes on death and myocardial reinfarction: diet and reinfarction trial (DART). Lancet 1989; 2: 757-61. [ Links ]
57. Gruppo Italiano per lo Studio della Sopravvivenza nell'Infarto miocardico. Dietary supplementation with n-3 polyunsaturated fatty acids and vitamin E after myocardial infarction: results of the GISSIPrevenzione trial. Lancet 1999; 354: 447-55. [ Links ]
58. Yokoyama M, Origasa H, Matsuzaki M, Matsuzawa Y, Saito Y, Ishikawa Y, et al. Effects of eicosapentaenoic acid on major coronary events in hypercholesterolaemic patients (JELIS): a randomised open-label, blinded endpoint analysis. Lancet 2007; 369: 1090-8. [ Links ]
59. GISSI-HF Investigators, Tavazzi L, Maggioni AP, Marchioli R, Barlera S, Franzosi MG et al. Effect of n-3 polyunsaturated fatty acids in patients with chronic heart failure (the GISSI-HF trial): a randomised, double-blind, placebo-controlled trial. Lancet 2008; 372: 1223-30. [ Links ]
60. Simopoulos AP. Omega-6/omega-3 essential fatty acids: biological effects. World Rev Nutr Diet 2009; 99: 1-16. [ Links ]
61. Simopoulos AP. The importante of the Omega-6/omega-3 Fatty Acid Ratio in Cardiovascular Disease and other cronic diseases. Exp Biol Med 2008; 233 (6): 674-88. [ Links ]
62. Simopoulos AP. The omega 6/omega 3 fatty acid ratio, genetic variation and cardiovascular disease. Asia Pac J Clin Nutr 2008; 17 (S1): 131-134. [ Links ]
63. Harris WS, Mozaffarian D, Rimm E, Kris-Etherton P, Rudel LL, Appel LJ, et al. Omega-6 fatty acids and risk for cardiovascular disease: a science advisory from the American Heart Association Nutrition Subcommittee of the Council on Nutrition, Physical Activity, and Metabolism; Council on Cardiovascular Nursing; and Council on Epidemiology and Prevention. Circulation 2009; 119: 902-7. [ Links ]
64. Rueda F, Domingo JC, Macha N. Efectos de los ácidos grasos omega 3 y otros suplementos alimenticios en procesos patológicos relacionados con la tercera edad. Rev Esp Nutr Hum Diet 2011; 15 (1): 20-29. [ Links ]
65. Kris-Etherton P, Hill A. N-3 Fatty Acids: Food or Supplements? J Am Diet Assoc 2008; 108 (7): 1125-1130. [ Links ]
66. Food and Drug Administration. Department of Health and Human Services, US Food and Drug Administration. Substances Affirmed as Generally Recognized as Safe: Menhaden Oil. Federal Register. June 5, 1997, as amended 2005; 70 (55): 14530-14532. [ Links ]
67. Australia and New Zealand National Health and Medical Research Council. Nutrient reference values for Australia and New Zealand including recommended dietary intakes. reference no: N35, N36, N37. 2006. Omega-3 Centre Web site. http://www.omega-3centre.com/official_recomendations.html. Accessed March 24, 2008. [ Links ]
68. Mozaffarian D, Rimm EB. Fish intake, contaminants, and human health: evaluating the risks and the benefits. JAMA 2006 18; 296 (15): 1885-99. [ Links ]
69. USA. Food and Nutrition Board. Dietary Reference Intakes for Energy, Carbohydrate, Fibre, Fat, Fatty Acids, Cholesterol, Protein, and Amino Acids. Institute of Medicine. National Academy Press. Washington, D.C. 2002-2005. [ Links ]
70. Tunstall-Pedoe H. Preventing Chronic Diseases. A Vital Investment: WHO Global Report. Geneva: World Health Organization 2006. pp. 200. CHF 30-00. ISBN 92 4 1563001. Also published on http://www.who.int/chp/chronic_disease_report/en/Int J Epidemiol [ Links ]
71. Mori TA, Woodman RJ. The independent effects of eicosapentaenoic acid and docosahexaenoic acid on cardiovascular risk factors in humans. Curr Opin Clin Nutr Metab Care 2006; 9: 95-104. [ Links ]
72. Norwegian Recommended Dietary Allowances. Oslo, Norway: National Nutrition Council; 1989. [ Links ]
73. Simopolous A. Summary of the NATO Advanced Research Workshop on Dietary w3 and w6 Fatty Acids: Biological Effects and Nutritional Essentiality. J Nutr 1989; 119 (4): 521-528. [ Links ]
74. Health and Welfare Canada: "Nutrition Recommendations: The Report of the Scientific Review Committee". Ottawa: Canadian Government Publishing Centre, Supplies and Services Canada; 1990. [ Links ]
75. UK Committee on Medical Aspects of Food Policy (COMA) (DoH, 1991) Dietary reference values for food energy and nutrients for the United Kingdom. Report of the Panel on Dietary Reference Values of the Committee on Medical Aspects of Food Policy. Rep Health Soc Subj (Lond) 1991; 41: 1-210. [ Links ]
76. British Nutrition Foundation. Unsaturated Fatty Acids: Nutritional and Physiological Significance. The Report of the British Nutrition Foundation's Task Force. London: British Nutrition Foundation;1992. [ Links ]
77. National Health and Medical Research Council (NHMRC) Report of the NHMRC Working Party: The Role of Polyunsaturated Fats in the Australian Diet, Australian Government Publishing Service, Canberra; 1992. [ Links ]
78. Department of Health. Nutritional Aspects of Cardiovascular Disease. Report of the Cardiovascular Review Group of the Committee on Medical Aspects of Food Policy. Report on Health and Social Subjects 46. London: HMSO;1994. [ Links ]
79. Sugano, M. Characteristics of Fats in Japanese Diets and Current Recommendations. Lipids 1996; 31 (Suppl.): 283-286. [ Links ]
80. De Deckere EA, Korver O, Verschuren PM, Katan MB. Health aspects of fish and n-3 polyunsaturated fatty acids from plant and marine origin. Eur J Clin Nutr 1998; 52: 749-753. [ Links ]
81. British Nutrition Foundation Conference to draw attention to the briefing paper on "n-3 Fatty acids and Health", London: BNF; 1999. [ Links ]
82. National Heart Foundation of Australia. A Review of the Relationship Between Dietary Fat and Cardiovascular Disease. Aust J Nutr Diet 1999; 56 (Suppl. 4): 5-22. [ Links ]
83. Simopoulos AP, Leaf A, Salem N, Jr. Workshop statement on the essentiality of and recommended dietary intakes for Omega-6 and Omega-3 fatty acids. Prostaglandins Leukot Essent Fatty Acids 2000; 63: 119-121 Disponible online: www.issfal.org/statements/adequate-intakes-recommendation-table. [ Links ]
84. Nutrition Sub-committee of the Food Safety Authority of Ireland: Recommended Dietary Allowances for Ireland. Food Safety Authority of Ireland (ed.): Dublin, 1999. [ Links ]
85. Ferroluzzi A, James WPT. European diet and public health: The continuing challenge. Public Health Nutr 2001; 4: 275-292. [ Links ]
86. D-A-CH (Deutsche Gesellschaft für Ernährung - Österreichische Gesellschaft für Ernährung - Schweizerische Gesellschaft für Ernährungsforschung - Schweizerische Vereinigung für Ernährung), Referenzwerte für die Nährstoffzufuhr. Umschau Braus Verlag, Frankfurt am Main, 2000. (publicación en alemán). German Nutrition Society (DGE), Austrian Nutrition Society (ÖGE), Swiss Society for Nutrition Research (SGE), Swiss Nutrition Association (SVE). D-A-CH Reference Values for Nutrient intake. Umschau Braus GmbH. German Nutrition Society (DGE), Frankfurt, 2002. (publicación en inglés). [ Links ]
87. Health Council of the Netherlands (2001). Dietary reference intakes: energy, proteins, fats, and digestible carbohydrates. The Hague: Health Council of the Netherlands; publication no. 2001/19.;2001. Disponible online: http://www.gezondheidsraad.nl/en/publications/dietary-reference-intakes-energy-proteins-fats-and-digestible-carbohydrates#a-downloads [ Links ]
88. Martin A. Apports nutritionnels conseillés pour la population Française. AFSSA (Agence Française de Sécurité Sanitaire des Aliments). Tec et Doc, Lavoisier, ed. 3o, París; 2001. [ Links ]
89. Sociedad Española de Nutrición Comunitaria (SENC). Guías alimentarias para la población española. SENC, Madrid; 2001. [ Links ]
90. Institutes of Medicine (IOM) (2002/2005) Panel on Macronutrients, Panel on the Definition of Dietary Fiber, Subcommittee on Upper Reference Levels of Nutrients, Subcommittee on Interpretation and Uses of Dietary Reference Intakes, and the Standing Committee on the Scientific Evaluation of Dietary Reference Intakes. DRI Dietary reference intakes for Energy, Carbohydrate, Fiber, Fat, Fatty Acids, Cholesterol, Protein, and Amino Acids. Washington, DC: The National Academies Press. [ Links ]
91. World Health Organization Diet, Nutrition and the Prevention of Chronic Diseases Joint WHO/FAO Expert Consultation. Technical report series 916. Geneve: WHO; 2003. [ Links ]
92. Agence Française de Securité Sanitaire des Aliments. Acides gras de la famille omega 3 et systeme cardiovasculaire: interet nutritionnel et allegations. (Fatty acids, omega 3 family and the cardiovascular system: nutritional interest and allegations), AFSSA; 2003. [ Links ]
93. SACN (Scientific Advisory Committee on Nutrition). Advice on fish consumption: benefits and risks. London; 2004. Disponible on line en: http://www.sacn.gov.uk/pdfs/fics_sacn_advice_fish.pdf [ Links ]
94. Brasseur D, Delzenne N, Henderickx H., Huyghebaert A, Kornitzer M. 2004. Recommandations et allegations concernant les acides gras omega-3. Brussels: Conseil Superieur D'Hygiene; 2004. SHC 7945. Disponible online en: www.health.fgov.be/csh_hgr. [ Links ]
95. ISSFAL, International Society for the Study of Fatty Acids and Lipids. Report of the Sub-Committee on Recommendations for intake of polyunsaturated fatty acids in healthy adults. ISSFAL: Brighton, UK; 2004. [ Links ]
96. Becker W, Lyhne N, Pedersen AN, Aro A. Fogelholm M. Horsdottir I, et al. Nordic Nutrition Recommendations 2004-integrating nutrition and physical activity. Scand J Nutr 2004; 48: 178-187. [ Links ]
97. Dietary reference intakes for japanese (2005) (The report from the scientific committee of "dietary reference intakes for japanese - recommended dietary allowance") Ministry of health, Labour and Welfare, Tokyo, Japan; October 2004. [ Links ]
98. Deutsche Gesellschaft für Ernährung (German Nutrition Society) Nutrition Report Bonn: DGE, 2005. [ Links ]
99. U.S. Department of Health and Human Services & U.S. Department of Agriculture. Dietary Guidelines for Americans, 6th ed. Washington, DC: U.S. Government Printing Office; 2005. [ Links ]
100. Council for Responsible Nutrition. White Paper. Long Chain Omega-3 Fatty Acids in Human Health. Heart Health: The Role of EPA, DHA and ALA. Washington DC; 2005: 1-6. [ Links ]
101. Health Council of the Netherlands (2006). Guidelines for a healthy diet. The Hague: Health Council of the Netherlands; publication no. 2006/21E. (cited 2008 July 22). Disponible online: www.gr.nl/samenvatting.php?ID1/41481. [ Links ]
102. American Heart Association Nutrition Committee, Lichtenstein AH, Appel LJ, Brands M, Carnetho M, Daniels S, et al. Diet and lifestyle recommendations revision 2006: a scientific statement from the American Heart Association Nutrition Committee. Circulation 2006; 114 (1): 82-96. [ Links ]
103. National Health and Medical Research Council. Nutrient Reference Values for Australia and New Zealand Including Recommended Dietary Intakes, 2006. Disponible online: www.nhmrc.gov.au/publications/synopses/_files/n35.pdf [ Links ]
104. FAO-WHO (2010) Fats and Fatty Acids in Human Nutrition. Rome: FAO Food and nutrition paper # 91. Report of an expert consultation. Geneva, November 10-14, 2008. [ Links ]
105. National Heart Foundation of Australia. Position statement on Fish, fish oils, n-3 polyunsaturated fatty acids and cardiovascular health. Presented at AIFST conference, 2008. Disponible online: http://www.heartfoundation.org.au/SiteCollection-Documents/Fish-position-statement.pdf [ Links ]
106. D-A-CH, Deutsche Gesellschaft für Ernährung, Österreichische Gesellschaft für Ernährung, Schweizerische Gesellschaft für Ernährungsforschung, Schweizerische Vereinigung für Ernährung: Referenzwerte für die Nährstoffzufuhr, Umschau/ Braus Verlag, Frankfurt, 2008. [ Links ]
107. Conseil Supérieur de la Santé. Recommandations nutritionnelles pour la Belgique, Révision 2009. Publication Du Conseil Superieur De La Sante No 8309. Bruxelles; 28 October 2009. [ Links ]
108. AFFSA. Avis de l'Agence française de sécurité sanitaire des aliments relatif à l'actualisation des apports nutritionnels conseillés pour les acides gras. France; 2010. Disponible online: www.afssa.fr [ Links ]
109. EFSA Panel on Dietetic Products, Nutrition, and Allergies (NDA) (2010) Scientific Opinion on Dietary Reference Values for fats, including saturated fatty acids, polyunsaturated fatty acids, monounsaturated fatty acids, trans fatty acids, and cholesterol. The EFSA Journal 8, 1461. Disponible online: www.efsa.europa.eu [ Links ]
110. Aranceta J, Serra Majem Ll, Grupo Colaborativo para la actualización de los Objetivos Nutricionales para la Población Española. Objetivos Nutricionales para la Población Española 2011. Consenso de la Sociedad Española de Nutrición Comunitaria (SENC). Rev Esp Nutr Comunitaria 2011; 17: 178-199. [ Links ]
111. Koletzko B, Lien E, Agostoni C, Böhles H, Campoy C, Cetin I, et al. World Association of Perinatal Medicine Dietary Guidelines Working Group. The roles of long-chain polyunsaturated fatty acids in pregnancy, lactation and infancy: review of current knowledge and consensus recommendations. J Perinat Med 2008; 36: 5-14. [ Links ]
112. Koletzko B, Cetin I, Brenna J. Consensus statement- Dietary fat intakes for pregnant and lactating women. Brit J Nutr 2007; 98:873-877. [ Links ]
113. March of Dimes. Omega-3 Fatty Acids During Pregnancy. March of Dimes 2009. Disponible online: www.marchofdimes.com/pnhec/159_/55030.asp [ Links ]
114. Kris-Etherton PM, Harris WS, Appel LJ: AHA Nutrition Committee. American Heart Association: Omega-3 fatty acids and cardiovascular disease: new recommendations from the American Heart Association. Arterioscler Thromb Vasc Biol 2003; 23: 151-2. [ Links ]
115. Harris WS, Mozaffarian D, Rimm E, Kris-Etherton P, Rudel LL, Appel LJ, et al. Omega-6 Fatty Acids and Risk for Cardiovascular Disease: A Science Advisory From the American Heart Association Nutrition Subcommittee of the Council on Nutrition, Physical Activity, and Metabolism; Council on Cardiovascular Nursing; and Council on Epidemiology and Prevention. Circulation .2009; 119: 902-907. [ Links ]
116. Carrero JJ, Martín-Bautista E, Baró L, Fonollá J, Jiménez J, Boza JJ, et al. Efectos cardiovasculares de los ácidos grasos omega-3 y alternativas para incrementar su ingesta. Nutr Hosp 2005; 20: 63-69. [ Links ]
117. Danaei G, Ding EL, Mozaffarian D, Taylor B, Rehm J, Murray CJ, et al. The preventable causes of death in the United States: comparative risk assessment of dietary, lifestyle, and metabolic risk factors. PLoS Med 2009; 6 (4): e1000058. Epub 2009 Apr 28. [ Links ]
118. Garg ML, Wood LG, Singh H, Moughan PJ. Means of Delivering Recommended Levels of Long Chain n-3 Polyunsaturated Fatty Acids in Human Diets. J Food Sci 2006; 71: 66-71. [ Links ]
119. Valenzuela A, Sanhueza J, Nieto S. Docosahexaenoic acid (DHA), essentiality and requirements: why and how to provide supplementation. Grasas y aceites 2006; 57: 229-237. [ Links ]
120. Trautwein E. N-3 fatty acids-physiological and technical aspects for their use in food. Eur J Lipid Sci Technol 2001; 103:45-55. [ Links ]
121. Gillies PJ, Harris WS, Kris-Etherton PM. Omega-3 Fatty Acids in Food and Pharma: The Enabling Role of Biotechnology. Curr Atheroscler Rep 2011; 13: 467-73. [ Links ]
122. Álvarez Hernández J, Peláez Torres N, Muñoz Jiménez A. Utilización clínica de la Nutrición Enteral. Nutr Hosp 2006; 21 (Suppl. 2): 87-99. [ Links ]
123. Elmadfa I and Kornsteiner M. Fats and Fatty Acid Requirements for Adults. Ann Nutr Metab 2009; 55: 56-75. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Alejandro Sanz Paría.
Consultas Externas de Nutrición.
Hospital Universitario Miguel Servet de Zaragoza.
C/ Padre Arrupe, s/n (antes Cardenal Gomá).
50003 Zaragoza.
E-mail: asanzp@salud.aragon.es
Recibido: 24-VI-2012.
Aceptado: 15-VII-2012.