Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Nutrición Hospitalaria
versión On-line ISSN 1699-5198versión impresa ISSN 0212-1611
Nutr. Hosp. vol.28 no.6 Madrid nov./dic. 2013
https://dx.doi.org/10.3305/nh.2013.28.6.6912
ORIGINAL / Obesidad
Asociación del polimorfismo 3'UTR+62G>A en resistina con resistencia a la insulina, adiposidad y el índice adiponectina-resistina en población mexicana
Association of resistin gene 3'UTR+62G>A polymorphism with insulin resistance, adiposity and the adiponectin-resistin index in mexican population
Efraín Chavarria-Ávila1, Sandra Luz Ruíz Quezada6, Milton-Omar Guzmán-Ornelas1, Jorge Castro-Albarrán3,4, María Elena Aguilar Aldrete1,5, Mónica Vásquez-Del Mercado1,2 y Rosa-Elena Navarro-Hernández1-3
1Doctorado en Ciencias Biomédicas. Centro Universitario de Ciencias de la Salud. Universidad de Guadalajara. Jalisco. México.
2Departamento de Biología Molecular y Genómica. Centro Universitario de Ciencias de la Salud. Universidad de Guadalajara. Jalisco. México.
3Maestría en Nutrición Humana. Universidad de Guadalajara. Jalisco. México.
4H. M. I. E.L.M., Secretaría de Salud Jalisco. Guadalajara. Jalisco. México.
5Departamento de Salud Pública. Centro Universitario de Ciencias de la Salud. Universidad de Guadalajara. Jalisco. México.
6Departamento de Farmacobiología. Centro Universitario de Ciencias Exactas e Ingenierías. Universidad de Guadalajara- Jalisco. México.
Este trabajo se realizó con el apoyo del fondo institucional COECyTJal-Universidad de Guadalajara. Registro No. PS-2009-552 aprobado a Rosa Elena Navarro Hernández.
Dirección para correspondencia
RESUMEN
Introducción: La resistencia a la insulina (RI) se caracteriza por susceptibilidad genética, incremento en la adiposidad y distribución irregular de grasa corporal, con alteración en la producción de adipocinas.
Objetivo: Investigar la asociación del polimorfismo 3'UTR+62G>A en resistina con RI, índice adiponectina-resistina (ARindex), adiposidad y marcadores inmuno-metabólicos.
Métodos: En un estudio transversal a 260 mestizos-mexicanos, clasificados con peso normal, exceso de peso, sin y con RI, se les evaluó: composición corporal, distribución de masa grasa y marcadores inmuno-metabólicos. Los alelos del polimorfismo 3'UTR+62G>A en resistina se identificaron por PCR-RFLP. La concentración sérica de insulina, adiponectina total y resistina se midieron por la técnica de ELISA.
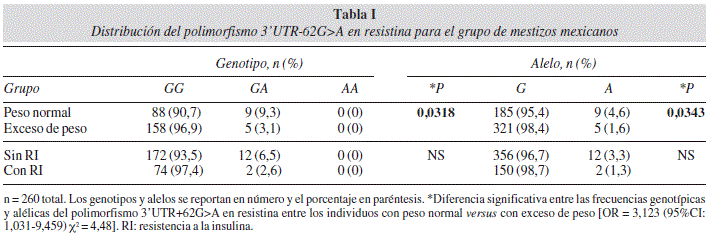
Resultados: Las frecuencias del alelo +62G para los individuos con peso normal y exceso de peso, fueron (95.4% y 98.4%, respectivamente) P= 0.0343. Los portadores del genotipo GA con peso normal mostraron valores menores del ARindex, adiposidad y marcadores inmuno-metabólicos comparados con los portadores del genotipo GG. Se observó diferencia entre los individuos sin y con RI en el ARindex (P = 0.002), concentración sérica de adiponectina (P = 0.002) y resistina (P = 0.033): 1.102 ± 0.03, 5.167 ± 0.36 μg/mL y 8.827 ± 0.42 ng/mL versus 1.336 ± 0.07, 3.577 ± 0.34 μg/mL y 10.480 ± 0.65 ng/mL, respectivamente. Los marcadores inmuno-metabólicos, reserva y distribución de grasa corporal correlacionan con ARindex 0.262 a 0.414), P < 0.05.
Conclusiones: Nuestros datos sugieren asociación del polimorfismo 3'UTR+62G>A en los individuos mestizos-mexicanos con exceso de peso. El alelo +62A se asoció con incremento de adiponectina total, valores menores del ARindex, concentración de resistina, marcadores metabólicos y reserva de grasa corporal. El ARindex puede ser un indicador temprano de RI.
Palabras clave: Resistencia a la insulina. Adiposidad. Adiponectina. Resistina. Polimorfismo 3UTR-62G>A en resistina.
ABSTRACT
Introduction: Insulin resistance (IR) is a disease with genetic susceptibility characterized by the increase in storage and irregular body fat distribution, and impaired production of adipokines.
Objective: The objective was to investigate the relationship between 3'UTR+62G>A RETN gene polymorphism, with adiponectin-resistin index (ARindex), adiposity, and inmuno-metabolic markers.
Methods: In this cross-sectional study, 260 individuals characterized as Mexican-Mestizo and classified in lean and overweight, and IR and without-IR, were included. Anthropometrics, body composition, body fat distribution and inflammation and metabolic markers were measured by routine methods, RETN 3'UTR+62G>A alleles were identified by PCR-RFLP and soluble insulin, total adiponectin and resistin were measured by ELISA methods.
Results: The +62G allele frequencies for lean and overweight individuals were different P = 0.0343 (95.4% and 98.4%, respectively). The lean GA genotype carriers showed significant low measures of ARindex, adiposity, and inmuno-metabolic markers, than the GG genotype carriers. We found differences between individuals with IR and without-IR: in ARindex (P = 0.002), adiponectin (P = 0.002) and resistin levels (P = 0.033): 1.102 ± 0.03, 5.167 ± 0.36 μg/mL and 8.827 ± 0.42 ng/mL versus 1.336 ± 0.07, 3.577 ± 0.34 μg/mL and 10.480 ± 0.65 ng/mL. Showed correlations with inflammation markers, distribution and body fat storage (r = 0.262 to 0.414), P < 0.05.
Conclusions: The present data suggest that in a Mexican-mestizo population the RETN +62G>A polymorphism is associated with overweight. The presence of the +62A allele was associated with increase of total adiponectin, ARindex, resistin levels, metabolic markers and body fat storage. ARindex can be an early indicator of insulin resistance.
Key words: Insulin resistance. Adiposity. Adiponectin. Resistin. Polymorphism RETN3'UTR+62G>A.
Abreviaturas
ADN: ácido desoxirribonucleico.
ARindex: índice adiponectina-resistina.
CLAMP: pinza euglicémica hiper-insulinémica.
DM2: diabetes mellitus tipo 2.
dNTPs: cuatro desoxiribonucleótidos: dATP, dCTP, dGTP y dTTP.
ECV: enfermedad cardiovascular.
ELISA: Ensayo por inmuno-absorción ligado a enzimas, del inglés Enzyme-Linked ImmunoSorbent Assay.
HAS: hipertensión arterial sistémica.
HDLc: colesterol de lipoproteínas de alta densidad.
HOMA-IR: modelo de evaluación de la homeostasis de resistencia a la insulina.
ICC: índice cintura/cadera.
IMC: índice de masa corporal.
LDLc: colesterol de lipoproteínas de baja densidad.
OMS: Organización Mundial de la Salud.
PCR: reacción en cadena de la polimerasa del, inglés polymerase chain reaction.
QUICKI: índice de sensibilidad a la insulina.
R/A: relación resistina/adiponectina.
RETN: gen de resistina.
RFLP: polimorfismo en la longitud de los fragmentos de restricción, del inglés restriction fragment length polymorphism.
RI: resistencia a la insulina.
SM: síndrome metabólico.
ST4: suma de 4 panículos adiposos.
VLDLc: colesterol de lipoproteínas de muy baja densidad.
VSG: velocidad de sedimentación globular.
Introducción
La resistencia a la insulina (RI) es una enfermedad sistémica con factor multigénico y alteración del perfil inmuno-metabólico1,2, en México, aún no existen datos oficiales de su prevalencia, sin embargo, es considerada enfermedad emergente y un problema de salud pública, con relación al aumento en la prevalencia de enfermedades crónico-degenerativas3.
La identificación de individuos con RI se realiza con diferentes índices (CLAMP4 aceptado como el estándar de oro, HOMA-IR5 y QUICKI6), los cuales se integran con la medición de concentraciones séricas de glucosa e insulina basales.
La RI se manifiesta como una enfermedad compleja de origen multifactorial, en la que interaccionan factores ambientales, genéticos y estilo de vida7,8. El grado de contribución de cada factor aún no se ha establecido. La etapa pre-mórbida que favorece el desarrollo de RI es el exceso de peso y la obesidad abdominal, con un aumento progresivo de la grasa corporal.
En este escenario, se describe que el exceso de peso es un indicador clínico y es consecuencia directa del estado de insulino-resistencia, de la misma forma, la obesidad abdominal se asocia consistentemente con un aumento del riesgo de desarrollar comorbilidades como: síndrome metabólico (SM), hipertensión arterial sistémica (HAS), diabetes mellitus tipo 2 (DM2), ateroesclerosis, y enfermedad cardiovascular (ECV)8,9.
Los indicadores más utilizados para identificar el exceso de peso y obesidad abdominal son el índice de masa corporal (IMC) y la circunferencia de cintura, respectivamente, de acuerdo con los criterios de la Organización Mundial de la Salud (OMS)10. Sin embargo, se ha propuesto el diseño de otros indicadores antropométricos que reflejen con mayor sensibilidad y especificidad un posible estado de insulino-resistencia en los individuos con exceso de peso, para lo cual en este estudio incluimos la evaluación del área abdominal total11 y el índice cintura/estatura12,13.
Por otra parte, en el contexto del proceso patogénico de RI, se presentan inflamación subclínica crónica de grado bajo, dislipidemias, acumulación excesiva e irregular de tejido adiposo y desregulación en la función secretora de adipocinas por el tejido adiposo blanco9,14.
En el tejido adiposo blanco se produce resistina (pro-inflamatoria) que contribuye significativamente al desarrollo de RI y en mayor proporción adiponectina (anti-inflamatoria), ambas adipocinas de naturaleza funcional antagónica y modificaciones postraduccionales similares9,14. Adiponectina es una proteína multi-funcional con efectos de sensibilización a la insulina y propiedades anti-aterogénicas a través de la unión a sus receptores adipoR1 y adipoR29,14,15, mientras que, para resistina el receptor y efecto fisiológico de unión al receptor aún no se han definido9,14,16.
En el proceso patogénico de RI instalado en el organismo se presenta una concurrencia de hipoadiponectinemia con correlación inversamente proporcional a la adiposidad, e hiperresistinemia con correlación directamente proporcional a la adiposidad, por lo que se especula que inciden en el mecanismo que regula el metabolismo de glucosa y homeostasis lipídica9.
Los niveles de adiponectina y resistina y su asociación con marcadores metabólicos y de inflamación pueden ser utilizados para definir el estatus inmuno-metabólico en individuos con RI, calculando el índice adiponectina-resistina (ARindex) propuesto por Lau y cols., 201117 y la relación proporcional en la producción sérica de resistina y adiponectina (R/A).
Por otra parte, en el desarrollo de RI se ha implicado un componente genético importante a través de la expresión de genes de susceptibilidad1,16. En el gen de resistina (RETN)16 se identificó el polimorfismo 3'UTR+62G>A (rs3745368) el cual se ha asociado con HAS18 y DM2 con resultados controversiales18,19, sin embargo, la consecuencia funcional no se ha determinado. La presencia del polimorfismo podría estar relacionada con la tasa de trascripción del gen de resistina modificando los niveles solubles de resistina16 por lo que se sugiere que el polimorfismo puede influir en la severidad y/o susceptibilidad para el desarrollo de RI19.
Objetivos
Los objetivos de este estudio fueron determinar la asociación del polimorfismo 3'UTR+62G>A en el gen de resistina en población mestiza-mexicana del occidente de México con RI y la asociación del estatus inmuno-metabólico con adiposidad, a través de la aplicación de nuevos indicadores, el ARindex, la relación R/A y dos parámetros antropométricos escasamente explorados, área abdominal total e índice cintura/estatura.
Métodos
Sujetos de estudio
En este estudio transversal para investigar la distribución del polimorfismo en la población del occidente de México se determinó con la fórmula de Fleiss20 una muestra representativa de 260 individuos, los cuales cumplieron los siguientes criterios: 1) con edades de 20 a 69 años, 2) originarios del occidente de México, 3) caracterizados como mestizos-mexicanos de acuerdo a la definición del Instituto Nacional de Antropología e Historia de México, (i.e. cada individuo y sus ascendientes por tres generaciones nacidos en territorio mexicano y con apellidos de origen español), 4) sin parentesco de consanguinidad entre ellos, y 5) que firmaron un consentimiento informado para participar en el estudio, para cumplir así con lo establecido en la declaración de Helsinki21 y en los comités de ética y bioseguridad Institucionales (Universidad de Guadalajara).
A los individuos participantes se les incluyó en uno de dos grupos de estudio establecidos de acuerdo a dos clasificaciones reconocidas, A) por IMC con los criterios de la OMS10 en dos categorías: peso normal de 18,5 a 24,9 kg/m2 y exceso de peso: IMC > 25,0 kg/m2; y B) por los criterios de Stern22 en dos categorías: sin resistencia la insulina, (sin RI: IMC < 27,5 kg/m2 y HOMA-IR < 3,6) y con resistencia a la insulina, (con RI, IMC > 27,5 kg/m2 y HOMA-IR > 3,6).
Todos los participantes fueronindividuos clínicamente sanos, sin diagnóstico o tratamiento para alguna enfermedad y con peso estable en las últimas tres semanas, confirmado de acuerdo a historia clínica realizada por un médico; los individuos que al momento del estudio presentaron enfermedades infecciosas, HAS, DM2 y/o otras enfermedades crónico-degenerativas no se incluyeron.
Criterios para la inclusión de los participantes a los grupos de estudio y obtención de muestras sanguíneas
A los individuos participantes en el estudio se les realizó: historia clínica [que incluyó la medición de signos vitales: presión arterial (siguiendo las recomendaciones internacionales23), frecuencia cardiaca, frecuencia respiratoria, y temperatura corporal; antecedentes heredo-familiares de HAS, DM2 y exploración física], pruebas de laboratorio de rutina: biometría hemática, química sanguínea, examen general de orina. Se les indicó ayuno por 12 horas durante la noche, previo a la toma de muestra, y posteriormente, por punción venosa en el brazo, se obtuvieron muestras de sangre en tubos del sistema vacutainer® (BD Diagnostic Systems Montenegro 1402, (C1427AND) Buenos Aires-Argentina), con anticoagulante EDTA-K3 1 mg/mL (del que se obtuvo ADN genómico), y sin anticoagulante, este una vez que coaguló a temperatura ambiente se centrifugó a 1509 RCF (Rotanta 460R, Andreas Hettich GmbH & Co. KG.) por 10 min. Se separó el suero en alícuotas con inhibidor de proteasas (GE Healthcare Bio-Sciences Corp. 800 Centennial Av.Piscataway, NJ 08855-1327. USA), y se almacenó a -80oC hasta su análisis, en un periodo no mayor de tres meses.
Clasificación por IMC y medición de adiposidad en el grupo de estudio
Se realizó una evaluación antropométrica y de composición corporal que incluyó medición de: estatura (con el estadímetro Seca 214 GmbH & Co. KG. Hamburgo, Alemania con 1mm de precisión), circunferencias de medio brazo, cintura y cadera (cm) con cinta de fibra de vidrio (GULICK® length 0-180 cm precisión ±1mm; USA), de acuerdo a la técnica de Lukaski24, peso (kg), masa muscular total (kg), reserva total de tejido adiposo: masa grasa total (kg), porcentaje de grasa (%) (con el sistema TANITA TBF304® Tokio, JPN, con 0,01 kg de precisión, método de impedancia bioeléctrica); y la distribución de grasa subcutánea mediante la medición de los panículos adiposos: bicipital, tricipital, subescapular y suprailíaco (mm) los cuales se midieron del lado derecho del cuerpo con plicómetro Harpenden (Modelo HSB-BI: abertura de 80 mm y precisión de of ± 0,2 mm, a presión constante de 10 g/mm2; Baty International. Victoria Road, Burgess Hill, West Sussex., RH15 9LR, UK), de acuerdo a la técnica de Durnnin25 y Lukaski24, y se obtuvo la suma de los cuatro panículos adiposos (ST4) como indicador de tejido adiposo subcutáneo. Adicionalmente, se calcularon los índices de obesidad y adiposidad: IMC, índice cintura/cadera (ICC) e índice cintura/estatura siguiendo los procedimientos recomendados en las guías para medición de indicadores antropométricos10 y se realizó una estimación del área abdominal total (cm2), por el método de Garaulet11.
Caracterización de resistencia a la insulina en el grupo de estudio y niveles de marcadores de inflamación y metabólicos
Se midieron los niveles de velocidad de sedimentación globular (VSG, mm/h)por elmétodo de Wintrobe (sedisystem tube. BD Diagnostic Systems Montenegro 1402, (C1427AND) Buenos Aires-Argentina), número leucocitos totales L yplaquetas L (Celldyne 3700 Abbott DiagnosticsTM. Abbott Park, Illinois, USA), glucosa sérica basal, perfil de lípidos (mg/dL) [triglicéridos, colesterol total, HDLc, LDLc (colesterol de lipoproteinas de alta y baja densidad, respectivamente] y proteína C reactiva de alta sensibilidad (mg/L), con límite de detección de 0,15 mg/L, (Random Access Analyzer Clinical Chemistry-Turbidimetry A25 Immunochemistry Biosystems Barcelona. Esp). Por la técnica de ELISA se determinaron las concentraciones séricas de insulina basal (límite de detección 0,399 μIU/mL. Human Immunoassay ALPCO Diagnostics, 26G Keewaydin Drive Salem, NH 03079) adiponectina total (límite de detección 1 ng/mL) y resistina (límite de detección de 0.1 ng/mL; ELISA, R&D Systems Inc., Minneapolis, MN, USA). Se calcularon el colesterol de lipoproteínas de muy baja densidad (VLDLc) por la fórmula de Friedewald26 y los índices: HOMA-IR, con la ecuación HOMA-IR = [(glucosa basal mg/dL) x (insulina basal mUI/L)/405]; el índice adiponectina-resistina (ARindex) con el método recomendado por Lau, 201117, con la ecuación ARindex = [1 + log10(R0) - log10(A0)], donde R0 y A0 son las concentraciones séricas de resistina y adiponectina, respectivamente; y R/A = resistina/adiponectina total.
Identificación del polimorfismo 3'UTR+62G>A en el gen de resistina
Se identificaron los alelos del polimorfismo 3'UTR+62G>A en RETN, por la técnica de PCR-RFLP. Brevemente, el ADN genómico se extrajo de acuerdo al método modificado de Miller27 y fue almacenado a -20oC hasta que se realizó el análisis molecular. Un fragmento de 259 pares de bases (pb), se amplificó por reacción en cadena de la polimerasa (PCR)18,19 con los iniciadores F:5'-AGAGTCCACGCTCCTGTGTT-3', R:5'-TCATCATCATCATCTCCAGGTT-3', a una temperatura de alineamiento de 58oC, para la mezcla de reacción de 25 μL (con 100 ng de ADN genómico, 2 nM de cada iniciador, 0,20 mM de cada dNTP, 2,5 mM de MgCl2, 0,25 U de Taq polimerasa con solución amortiguadora a 1X, Invitrogen®); los fragmentos amplificados fueron digeridos con la enzima de restricción Bse RI (New England Biolabs© Inc., Ipswich, MA. USA)18,19. Se realizó electroforesis a voltaje constante de 80 volts en geles de agarosa al 3% teñidos con 0,1 μg de bromuro de etidio, para identificar el alelo +62G se observó un fragmento de 259 pb y para el alelo +62A se observaron fragmentos de 238 y 21 pb. Como control de calidad, se utilizó un blanco de reacción y como controles se usaron muestras previamente confirmadas para cada genotipo. Adicionalmente todas las muestras fueron repetidas en diferentes experimentos obteniendo una reproducibilidad del 100%.
Análisis estadístico
El análisis de las variables se realizó con los paquetes estadísticos PASW Statics v18.0 [SPSS Inc., Chicago, IL, USA], SigmaStat 3.0. Se calculó el equilibrio de Hardy-Weinberg [http://ihg.gsf.de/cgibin/hw/hwa1.pl]. Los resultados se presentan en promedio ± desviación estándar o error estándar de la media. La distribución de las variables fue analizada con la prueba de normalidad de Kolmogorov-Smirnov. Las mediciones de la distribución y almacenamiento de grasa corporal, niveles de adipocinas, marcadores de inflamación y metabólicos se realizaron con la prueba t de Student o U de Mann-Whitney para muestras independientes, entre los grupos de estudio y portadores de los diferentes genotipos. Los datos de los niveles de adipocinas, insulina basal, así como marcadores de inflamación y metabólicos se sometieron a la prueba de correlación de Pearson o Spearman. Para determinar la diferencia para la distribución de los genotipos en los grupos de estudio se analizó en tablas de contingencia con Χ2 o prueba exacta de Fisher, una P < 0,05 se consideró significativa.
Resultados
En este grupo de mestizos-mexicanos del occidente de México se determinó la distribución del polimorfismo 3'UTR+62G>A en el gen de resistina, con los siguientes hallazgos: una heterocigocidad del 5.4%, la distribución de los genotipos observados y esperados se encontró en equilibrio (F = 0,03371, P = 0,6475); acorde con la ley de segregación de los alelos descrita por Hardy-Weinberg. Las frecuencias génicas y alélicas fue diferente entre los individuos clasificados como peso normal y exceso de peso, mientras que al clasificarlos sin y con RI no encontramos diferencia (Tabla I).
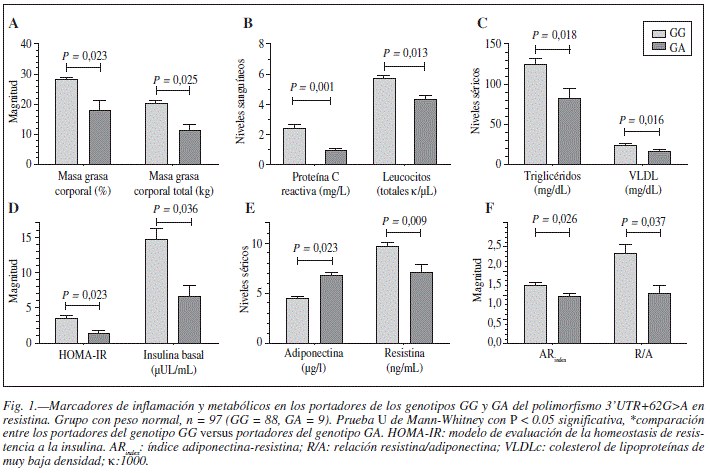
Por otro lado, en los individuos portadores del genotipo GA versus los portadores del genotipo GG, todos clasificados con peso normal y sin RI, se observaron diferencias en los siguientes parámetros: menor magnitud en el índice HOMA-IR (Fig. 1D), masa grasa corporal (Fig. 1A), el ARindex, relación R/A (Fig. 1F) y menores niveles de marcadores de inflamación (Fig. 1B), insulina basal (Fig. 1D), resistina (Fig. 1E), triglicéridos y VLDLc (Fig. 1C), mientras que los niveles de adiponectina total se observaron incrementados (Fig. 1E).
En este estudio encontramos una frecuencia de 62,7% de exceso de peso y de 28,5% de resistencia a la insulina en los 260 individuos (93 hombres y 167 mujeres).
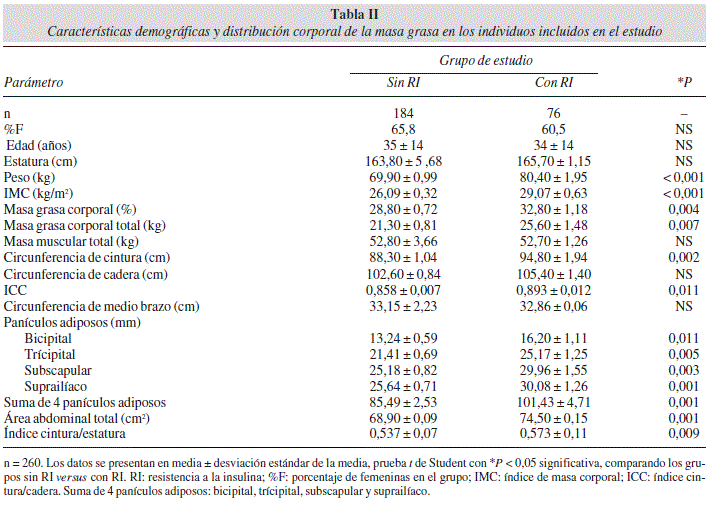
La evaluación antropométrica mostró que los individuos que integraron el grupo con RI, a diferencia de los individuos que integraron el grupo sin RI, presentaron mayor magnitud de área abdominal total, índice cintura/estatura, IMC, adiposidad, proporción de grasa corporal, obesidad abdominal, y una acumulación mayor de grasa subcutánea representada por cuatro panículos adiposos (Tabla II).
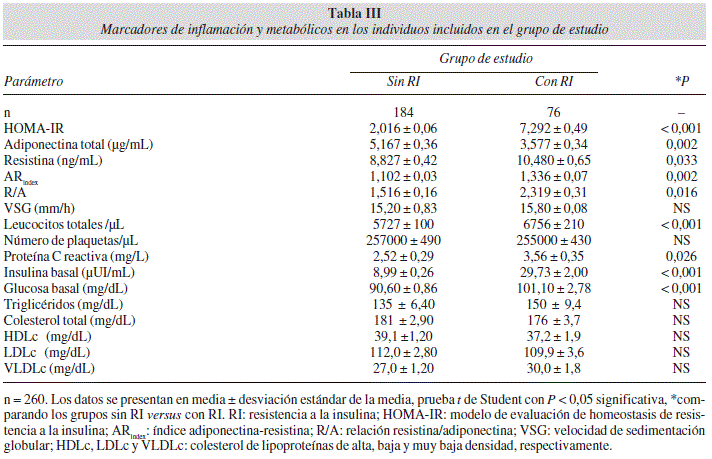
En los individuos con RI a diferencia de los individuos sin RI se observaron los siguientes resultados: inflamación subclínica de grado bajo, representada por un número mayor de leucocitos totales e incremento de proteína C reactiva sérica y un aumento significativo en la concentración sérica de resistina, el ARindex y en la relación R/A, paralelo a la disminución en los niveles de adiponectina total, mientras que en el perfil de lípidos no se observó diferencia (Tabla III).
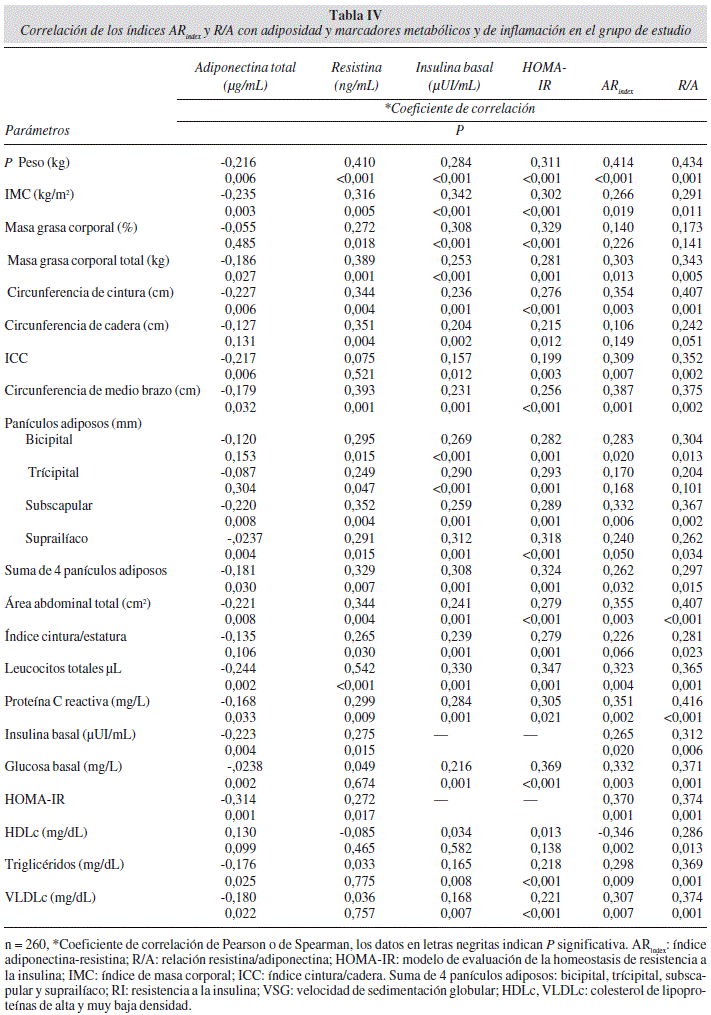
En el análisis de correlación determinamos que las concentraciones séricas de adiponectina total, resistina e insulina, así como la magnitud de HOMA-IR, el ARindex y la relación R/A correlacionan de forma importante con la distribución y reserva de grasa corporal, obesidad abdominal, adiposidad y con marcadores de inflamación y metabólicos. El área abdominal total y el índice cintura/estatura correlacionaron con los niveles de resistina, insulina y con las magnitudes de HOMA-IR, el ARindex y relación R/A (Tabla IV).
Discusión
En este estudio investigamos la distribución del polimorfismo 3'UTR+62G>A en el gen de resistina en población mestiza-mexicana del occidente de México, con la hipótesis de la probable asociación con RI y el estatus inmuno-metabólico. En el mismo sentido incluimos la aplicación de nuevos indicadores para RI: el ARindex, la relación R/A y su asociación con adiposidad, representada por dos parámetros antropométricos escasamente explorados, área abdominal total e índice cintura/estatura.
En el marco genético de resistina, la asociación del polimorfismo 3'UTR+62G>A con las enfermedades se ha reportado con resultados controversiales, en poblaciones de chinos19 y alemanes18 se encontró asociación para el alelo A con HAS pero no con DM2. En nuestra población este polimorfismo no se ha reportado previamente.
Entre los hallazgos relevantes observados en este estudio fueron la asociación del exceso de peso con la distribución del polimorfismo y la diferencia encontrada en los niveles de resistina entre los portadores del genotipo GA y los portadores del genotipo GG, con una menor contribución del alelo A en la producción sérica de resistina.
La importancia del componente genético en los niveles séricos de resistina, radica en que la presencia del polimorfismo 3'UTR+62G>A podría estar relacionada con la tasa de trascripción del gen. Con base en los hallazgos en este estudio y lo reportado previamente, por Menzaghi y Pantsulaia que reportan que, el 70% de la variabilidad en los niveles de resistina se explican por factores genéticos, y que existe un efecto genético aditivo en el que el 66% de la variación fenotípica se explica por factores genéticos16, sugerimos la posibilidad de un efecto del polimorfismo 3'UTR+62G>A en la producción de resistina soluble.
Otras diferencias observadas en este estudio entre los portadores y no portadores del alelo A, en los individuos con peso normal, fueron valores menores para el índice HOMA-IR, masa grasa corporal, el ARindex, y relación R/A y menores niveles de marcadores de inflamación y metabólicos, mientras que los niveles de adiponectina total se observaron incrementados.
Para estos hallazgos, podemos sugerir que existe un posible estatus de transición entre el incremento en la adiposidad y las manifestaciones clínicas de RI, que están mediadas en cierto grado por los niveles de producción celular de resistina y la variabilidad genética en el gen de resistina, que a su vez influye en la modulación del mecanismo fisiopatogénico de RI, con principal aporte por el estado de inflamación subclínica crónica de grado bajo y la desregulación en la producción de insulina.
En otro contexto, en los individuos incluidos en este estudio la prevalencia de exceso de peso encontrada (62,7%) fue menor a la reportada para la población mexicana (73% en mujeres y 69,4% en hombres)3, sin embargo, para RI, bajo los criterios propuestos, no existen reportes oficiales de prevalencia en población mexicana.
La prevalencia de exceso de peso en México es de las más altas entre los países y se ha documentado que se incrementa en un menor tiempo, a este fenómeno se le atribuye que existe un porcentaje elevado de la población con factores de riesgo para desarrollar exceso de peso3, entre los que destacan factores genéticos. La importancia de conocer estos datos epidemiológicos radica en que el exceso de peso es el estado pre-mórbido para RI, la cual es reconocida como una comorbilidad asociada a SM, DM2, ECV y HAS, entre otras7,8.
Previos reportes y estudios en modelos animales de obesidad han demostrado que el exceso de peso corporal es un factor de predisposición para el desarrollo de RI, con base en estos hallazgos, se ha establecido que la patogénesis de RI está relacionada con una acumulación progresiva de grasa corporal y con mayor frecuencia con obesidad abdominal en los individuos28. En este grupo de estudio los individuos clasificados con RI presentaron, exceso de peso, mayor proporción de grasa corporal, incremento en la adiposidad y obesidad abdominal representada por el ICC y circunferencia de cintura, datos que concuerdan con lo reportado previamente en diferentes estudios29-31.
Adicionalmente, evaluamos el área abdominal total e índice cintura/estatura, encontrando mayor magnitud en los individuos con RI, acumulación irregular de la grasa corporal y correlación con los niveles de adipo-nectina total, resistina, insulina basal y HOMA-IR; así como con el ARindex y la relación R/A. La medición del área abdominal total propuesta por Garaulet, y cols.11, representa la cantidad de grasa abdominal estimada en dos dimensiones y el índice cintura/estatura fue propuesto por Heymsfield y cols., 201112 como indicador para evaluar la distribución central de la grasa y el riesgo cardio-metabólico.
En este contexto, las medidas antropométricas más ampliamente utilizadas son el IMC y el ICC, su asociación con otros parámetros antropométricos y biomarcadores se han reportado con resultados divergentes, consecuentemente, existe la necesidad de desarrollar una medición que represente mayor precisión y sea más conveniente clínicamente13, que además, incluya criterios cuantitativos que definan obesidad abdominal y RI subyacente, hasta la fecha estos criterios no han sido claramente definidos y aplicados.
Similarmente, los marcadores metabólicos y de inflamación fueron diferentes entre los individuos clasificados sin y con exceso de peso (datos no mostrados), y entre los individuos sin y con RI (con excepción del perfil de lípidos), estas diferencias han sido reportadas consistentemente en estudios previos, lo que demuestra que el incremento de tejido adiposo favorece mecanismos patogénicos que desregulan el metabolismo de la glucosa, producción de insulina, proteínas proinflamatorias y adipocinas estrechamente relacionadas con la función secretora del tejido adiposo blanco2,9,14.
En este sentido, medimos la concentración sérica de adiponectina y resistina y aplicamos los índices ARindex17, y relación R/A y observamos una concentración mayor de resistina y en el ARindex y en la relación R/A mayor magnitud en los individuos con RI comparados con los individuos sin RI, mientras que la concentración sérica de adiponectina total fue menor, así como una correlación negativa de la concentración sérica de adiponectina total con el peso corporal, adiposidad y marcadores metabólicos, mientras que la concentración sérica de resistina correlaciona positivamente.
Lo que se explica con base en lo reportado previamente donde se ha demostrado que la producción de adiponectina disminuye cuando el tejido adiposo blanco se incrementa15. De la misma forma, los niveles de adipocinas proinflamatorias como resistina se incrementan29,30, por lo que se postula que adiponectina y resistina tienen un mecanismo de regulación que converge en la activación de AMPK con efectos opuestos, esto es, en condiciones fisiológicas, niveles menores de resistina, pueden activar AMPK y en consecuencia disminuir la expresión de genes involucrados en la gluconeogenesis9,32. Sin embargo, datos controversiales mantienen en especulación esta postura por algunos investigadores14.
En este estudio observamos una relación directa en el incremento del ARindex y la relación R/A, paralela al incremento en la adiposidad en los individuos con RI; aunque estas adipocinas han sido consideradas independientemente biomarcadores en obesidad, no se han definido puntos de corte como indicador diferencial entre peso normal, exceso de peso y RI.
Por otro lado, el proceso inflamatorio en RI, es un signo clínico subyacente que en el curso de la enfermedad, se identifica por un incremento en los niveles de reactantes de fase aguda, así como por una desregulación en la producción de adipocinas32. En este contexto, existe abundante evidencia con base en estudios de modelos animales y en humanos28, en los que se demuestra la importancia del papel del tejido adiposo blanco en el mantenimiento de una respuesta inflamatoria relacionada con el desarrollo de RI33.
Adicionalmente, se ha demostrado que los niveles de proteína C reactiva se asocian con índices de obesidad34, en este estudio, encontramos que los niveles de proteína C reactiva y número de leucocitos totales se incrementaron paralelamente con el incremento en la adiposidad, los niveles de insulina y glucosa basales y que correlacionan positivamente con la concentración sérica de resistina, insulina y HOMA-IR y negativamente con la concentración sérica de adiponectina total, definiendo un estado de inflamación subclínica en los individuos con RI.
Por otro lado, diferentes estudios reportan correlación positiva de los niveles séricos de resistina con la cantidad de grasa corporal, sin embargo, otros estudios no han encontrado correlación16. La asociación reportada más importante de los niveles séricos de resistina es con la proteína C reactiva, en estos reportes se ha propuesto a resistina como un marcador de inflamación en obesidad35.
Aunque en este estudio, los niveles de proteína C reactiva fluctuaron en una media relativamente baja, encontramos una correlación importante con el ARindex, la relación R/A y la adiposidad, en este escenario, sugerimos que existe un periodo de transición, en el que por una parte el proceso inflamatorio en la RI es reversible, por otro lado marca un momentum para la identificación temprana de RI, de la misma forma con base en los resultados obtenidos en este estudio y la propuesta de Lau, sugerimos que el ARindex y la relación R/A pueden ser indicadores tempranos de RI de manera independiente a otros indicadores.
Una potencial limitación de nuestro estudio es la ausencia de individuos portadores del genotipo homocigoto polimórfico AA y la posibilidad de la presencia e interacción con otras variantes polimórficas en el locus de resistina, por lo que sugerimos que será necesario que se estudie más ampliamente.
En conclusión, en este estudio observamos que los portadores del alelo polimórfico +62A mantienen niveles saludables de marcadores metabólicos, adiponectina y resistina, mientras que se mantiene en equilibrio el IMC y la adiposidad, en tanto que los índices ARindex y la relación R/A correlacionan con las reservas, distribución y acumulación de grasa corporal y el estatus inmuno-metabólico, por lo que se sugieren como indicadores para la identificación temprana de RI.
Agradecimientos
Los autores declaramos que no existe conflicto de interés para este estudio.
Referencias
1. Watanabe RM. The genetics of insulin resistance: Where's waldo? Current diabetes reports 2010; 10: 476-84. [ Links ]
2. Lumeng CN, Saltiel AR. Inflammatory links between obesity and metabolic disease. J Clin Invest 2011; 121: 2111-7. [ Links ]
3. Gutierrez JP, Rivera-Dammarco J, Shamah-Levy T, Villal-pando-Hernandez S, Franco A, Cuevas-Nasu L, et al. Encuesta nacional de salud y nutrición 2012. Resultados nacionales. Cuernavaca, México: Instituto Nacional de Salud Publica (MX), 2012.; 2012. [ Links ]
4. DeFronzo RA, Tobin JD, Andres R. Glucose clamp technique: A method for quantifying insulin secretion and resistance. Am J Physiol 1979; 237: E214-23. [ Links ]
5. Matthews DR, Hosker JP, Rudenski AS, Naylor BA, Treacher DF, Turner RC. Homeostasis model assessment: Insulin resistance and beta-cell function from fasting plasma glucose and insulin concentrations in man. Diabetologia 1985; 28: 412-9. [ Links ]
6. Katz A, Nambi SS, Mather K, Baron AD, Follmann DA, Sullivan G, et al. Quantitative insulin sensitivity check index: A simple, accurate method for assessing insulin sensitivity in humans. J Clin Endocrinol Metab 2000; 85: 2402-10. [ Links ]
7. Belkina AC, Denis GV. Obesity genes and insulin resistance. Current opinion in endocrinology, diabetes, and obesity 2010; 17:472-7. [ Links ]
8. Zeyda M, Stulnig TM. Obesity, inflammation, and insulin resistance-a mini-review. Gerontology. 2009; 55: 379-86. [ Links ]
9. Galic S, Oakhill JS, Steinberg GR. Adipose tissue as an endocrine organ. Mol Cell Endocrinol 2010; 316: 129-39. [ Links ]
10. World-Health-Organization. Obesity: Preventing and managing the global epidemic. WHO Technical Report Series 2000; 894. [ Links ]
11. Garaulet M, Hernandez-Morante JJ, Tebar FJ, Zamora S, Canteras M. Two-dimensional predictive equation to classify visceral obesity in clinical practice. Obesity (Silver Spring) 2006; 14: 1181-91. [ Links ]
12. Heymsfield SB, Heo M, Pietrobelli A. Are adult body circumferences associated with height? Relevance to normative ranges and circumferential indexes. Am J Clin Nutr 2011; 93: 302-7. [ Links ]
13. Al-Zurfi BMN, Aziz AA, Abdullah MR, Noor NM. Waist height ratio compared to body mass index and waist circumference in relation to glycemic control in malay type 2 diabetes mellitus patients, hospital universiti sains malaysia. International Journal of Collaborative Research on Internal Medicine & public Health (IJCRIMPH) 2012; 4: 406. [ Links ]
14. Antuna-Puente B, Feve B, Fellahi S, Bastard JP. Adipokines: The missing link between insulin resistance and obesity. Diabetes & metabolism 2008; 34: 2-11. [ Links ]
15. Matsuzawa Y. Establishment of a concept of visceral fat syndrome and discovery of adiponectin. Proceedings of the Japan Academy. Series B, Physical and biological sciences. 2010; 86: 131-41. [ Links ]
16. Gupta V, Singh AK, Pant AB. Could resistin be a noble marker for metabolic syndrome? Diabetes & Metabolic Syndrome: Clinical Research & Reviews 2010; 4: 239-44. [ Links ]
17. Lau CH, Muniandy S. Novel adiponectin-resistin (ar) and insulin resistance (irar) indexes are useful integrated diagnostic biomarkers for insulin resistance, type 2 diabetes and metabolic syndrome: A case control study. Cardiovasc Diabetol 2011; 10: 8. [ Links ]
18. Gouni-Berthold I, Giannakidou E, Faust M, Kratzsch J, Berthold HK, Krone W. Resistin gene 3'-untranslated region +62g->a polymorphism is associated with hypertension but not diabetes mellitus type 2 in a german population. J Intern Med 2005; 258: 518-26. [ Links ]
19. Tan MS, Chang SY, Chang DM, Tsai JC, Lee YJ. Association of resistin gene 3'-untranslated region +62g->a polymorphism with type 2 diabetes and hypertension in a chinese population. J Clin Endocrinol Metab 2003; 88: 1258-63. [ Links ]
20. Ury HK, Fleiss JL. On approximate sample sizes for comparing two independent proportions with the use of yates' correction. Biometrics 1980; 36: 347-51. [ Links ]
21. WMA. Ethical principles for medical research involving human subjects. 2008; 59th WMA: 5. [ Links ]
22. Stern SE, Williams K, Ferrannini E, DeFronzo RA, Bogardus C, Stern MP. Identification of individuals with insulin resistance using routine clinical measurements. Diabetes 2005; 54: 333-9. [ Links ]
23. O'Brien E, Asmar R, Beilin L, Imai Y, Mancia G, Mengden T, et al. Practice guidelines of the european society of hypertension for clinic, ambulatory and self blood pressure measurement. Journal of hypertension 2005; 23: 697-701. [ Links ]
24. Lukaski HC. Methods for the assessment of human body composition: Traditional and new. Am J Clin Nutr 1987; 46: 537-56. [ Links ]
25. Durnin JV, Rahaman MM. The assessment of the amount of fat in the human body from measurements of skinfold thickness. The British journal of nutrition 1967; 21: 681-9. [ Links ]
26. Friedewald WT, Levy RI, Fredrickson DS. Estimation of the concentration of low-density lipoprotein cholesterol in plasma, without use of the preparative ultracentrifuge. Clin Chem 1972; 18: 499-502. [ Links ]
27. Miller DN, Bryant JE, Madsen EL, Ghiorse WC. Evaluation and optimization of DNA extraction and purification procedures for soil and sediment samples. Applied and environmental microbiology 1999; 65: 4715-24. [ Links ]
28. Bigornia SJ, Farb MG, Mott MM, Hess DT, Carmine B, Fiscale A, et al. Relation of depot-specific adipose inflammation to insulin resistance in human obesity. Nutr Diabetes 2012; 2: e30. [ Links ]
29. Tokuyama Y, Osawa H, Ishizuka T, Onuma H, Matsui K, Egashira T, et al. Serum resistin level is associated with insulin sensitivity in japanese patients with type 2 diabetes mellitus. Metabolism2007; 56: 693-8. [ Links ]
30. De Luis DA, Gonzalez Sagrado M, Conde R, Aller R, Izaola O. Resistin levels and inflammatory markers in patients with morbid obesity. Nutr Hosp 2010; 25: 630-4. [ Links ]
31. Piernas Sanchez CM, Morales Falo EM, Zamora Navarro S, Garaulet Aza M. Study and classification of the abdominal adiposity throughout the application of the two-dimensional predictive equation garaulet, et al., in the clinical practice. Nutr Hosp 2010; 25: 270-4. [ Links ]
32. Bastard JP, Maachi M, Lagathu C, Kim MJ, Caron M, Vidal H, et al. Recent advances in the relationship between obesity, inflammation, and insulin resistance. European cytokine network 2006; 17: 4-12. [ Links ]
33. Jiao P, Xu H. Adipose inflammation: Cause or consequence of obesity-related insulin resistance. Diabetes, metabolic syndrome and obesity: targets and therapy 2008; 1: 25-31. [ Links ]
34. Choi J, Joseph L, Pilote L. Obesity and c-reactive protein in various populations: A systematic review and meta-analysis. Obes Rev 2013; 14: 232-44. [ Links ]
35. Pang SS, Le YY. Role of resistin in inflammation and inflammation-related diseases. Cellular & molecular immunology 2006; 3: 29-34. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Rosa Elena Navarro-Hernández.
Sierra Mojada No. 950, Ed. P, Planta Baja.
44340 Guadalajara. Jalisco. México.
E-mail: rosaelenan@hotmail.com
Recibido: 19-IV-2013.
1.a Revisión: 23-VIII-2013.
Aceptado: 29-VIII-2013.