Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Nutrición Hospitalaria
versão On-line ISSN 1699-5198versão impressa ISSN 0212-1611
Nutr. Hosp. vol.28 no.6 Madrid Nov./Dez. 2013
https://dx.doi.org/10.3305/nh.2013.28.6.6864
ORIGINAL / Nutrición enteral
Evaluación de buenas prácticas de manufactura en la elaboración de fórmulas enterales en hospitales públicos de Santiago, Chile
Evaluation of good manufacturing practices in the elaboration of enteral formulas in public hospitals of Santiago (Chile)
Sandra Lara González1, C. Domecq Jendres1 y Eduardo Atalah Samur2
1Hospital Clínico San José. Servicio de Salud Metropolitano Norte. Ministerio de Salud
2Departamento de Nutrición. Facultad de Medicina. Universidad de Chile. Chile
Dirección para correspondencia
RESUMEN
Antecedentes: La Elaboración de fórmulas enterales está sujeta a diversos riesgos de contaminación. La Organización Mundial de la Salud (OMS) y la Organización para la Alimentación y la Agricultura (FAO) han emitido alertas y recomendaciones para su prevención, sugiriendo la estandarización y protocolización de todos los procedimientos involucrados.
Objetivo: Elaborar y evaluar el cumplimiento de los criterios técnicos de una Pauta de Verificación de Buenas Prácticas de Manufactura, con relación a elaboración, conservación y administración de fórmulas enterales en hospitales de la provincia de Santiago.
Material y métodos: Los criterios de verificación consideraron Planta Física, Equipamiento e Implementación, Normas Higiénicas y Sanitarias, Recurso Humano, Organización y Administración, Garantía de Inocuidad y Aseguramiento de la Calidad. Se definieron 639 criterios, 309 de Riesgo Tipo 1, por mayor riesgo de producir contaminación. El estudio se hizo por observación de las Unidades de Central de Fórmulas Enterales y entrevista con el profesional encargado. Se analizó la mediana de cumplimiento de cada grupo de criterios de riesgo tipo 1 y total.
Resultados: Se evaluaron 14 hospitales públicos. El grado de cumplimiento de los 639 alcanzó una mediana de 33,2% (p25-75 31,6% -40,4%), con el valor más bajo para planta física con 27,9% (p25-75 23,9% -38,2%) y el mayor para recurso humano con 52,4% (p25-75 44,1%-52,4%). La mediana de grado de cumplimiento para Criterios Riesgo Tipo 1, fue sólo de 31,8% (p25-75 27,5% - 41,2%).
Conclusión: La mayoría de las Unidades evaluadas, cumple con menos de la mitad de las recomendaciones internacionales o del Ministerio de Salud de Chile. Se deben elaborar protocolos y capacitar al personal para asegurar la calidad e inocuidad en la elaboración de fórmulas enterales y reducir los riesgos de infección.
Palabras clave: Nutrición enteral. Fórmulas. Buenas prácticas de manufactura. Evaluación. Chile.
ABSTRACT
Background: The development of enteral formulas (FE) is subject to various risks of contamination. The World Health Organization (WHO) and the Food and Agriculture Organization (FAO), have worried about alerting, recommendations and documents released to prevent contamination the FE, suggesting the standardization and protocols for all procedures involved.
Objetives: The study was aimed to evaluate compliance with the technical criteria contained in a Guideline for Good Practice of Manufacture in relation to the development, maintenance and administration of enteral nutrition in hospitals of Santiago, in the Metropolitan Area.
Material and Methods: The verification criteria considered Physical Plant, Equipment and Implementation, Hygienic and Sanitary Standards, Human Resources, Organization and Management, Safety and Warranty Quality Assurance. 639 criteria were defined, 309 risk Type 1, by mayor risk of producing pollution. The study was conducted by observing Central Units Enteral Formulas and interview with the caregiver. Medium of compliance for each group of criteria risk 1 and overall, was analyzed.
Results: A total of 14 public hospitals were studied. The degree of compliance with the 639 reached a median of 33.2% (p25-75 31.6% -40.4%), with the lowest value for physical plant with 27.9% (p25-75 23.9% -38.2%) and the highest for human resources with 52.4% (p25-75 44.1% -52.4%). Median compliance for risk criteria Type 1 was only 31.8% (p25-75 27.5% - 41.2%).
Conclusion: Most of the units tested, meets less than half of the internationals recommendations, or the Ministry of Health of Chile. It should develop protocols and train staff to ensure quality and safety in the development of enteral formulas and reduce risk of infection.
Key words: Enteral nutrition. Formulas. Guideline for good practice manufacture. Evaluation. Chile.
Introduccción
La nutrición enteral (NE) es la administración de nutrientes a través del tracto gastrointestinal mediante fórmulas enterales (FE), que contienen aportes determinados de macro-micronutrientes, a pacientes que no se pueden nutrir por vía oral, respetando el circuito fisiológico entero hepático1,2. Este tipo de nutrición no está ajena de producir complicaciones, siendo las más frecuentes las infecciosas derivadas de la contaminación microbiana de las formulas, que pueden causar bacteremias, síndromes diarreicos, neumonías aspirativas y hasta sepsias3,4. Numerosas investigaciones señalan que un 14% a 67% de las FE, se encuentran contaminadas inmediatamente después de su preparación, lo que puede generar colonización y septicemia, asociada a diferentes bacterias patógenas5-7.
La contaminación de FE, proviene principalmente de fuentes exógenas, como planta física, equipamiento, equipos de administración y de las áreas de contaminación controlada. También por la manipulación inadecuada con técnicas asépticas deficientes, dotación y capacitación insuficiente de recurso humano en técnicas de almacenamiento, elaboración, refrigeración, esterilización, dispensación y distribución4,8,9.
La OMS y FAO, han emitido recomendaciones para la prevención de la contaminación de las FE, sugiriendo la estandarización y la protocolización de todos los procedimientos involucrados en su elaboración a partir de la materia prima en polvo, haciendo hincapié que ésta se realice en Unidades de contaminación controlada. Del mismo modo, organismos nacionales de salud y diversos autores, aconsejan realizar controles bacteriológicos periódicamente y en forma sistemática durante todo el proceso, para asegurar la calidad del producto final10,11. Se recomienda definir en todos los procesos los puntos críticos que involucran un mayor riesgo de contaminación, tanto en la preparación como administración de las formulas enterales, que garanticen su calidad e inocuidad.
El sistema Hazard Analisys Critical Control Point (HACCP) aplicado en la industria alimentaria ha demostrado mayor eficacia del sistema, minimizando o eliminando fuentes de contaminación bacteriana en las FE. La Organización Panamericana de la Salud, en el Manual de Buenas Prácticas para la Preparación de Alimentos en Servicios Hospitalarios, hace hincapié en la importancia de la supervisión profesional de todos los procedimientos, incluyendo la evaluación de la prescripción nutricional, almacenamiento, manipulación, elaboración, dispensación, distribución, conservación y el transporte6,12.
En nuestro medio existen diversas normas sobre el Sistema HACCP y Servicios Dietéticos de Leche y Central de Fórmulas Enterales13-15. Dado que la nutrición enteral se usa ampliamente en pacientes hospitalizados y puede estar sometida a diversos focos de contaminación, nació el interés por elaborar y aplicar una Pauta de Verificación de Buenas Prácticas de Manufactura. El objetivo del estudio es evaluar el funcionamiento de las Centrales de Fórmulas Enterales en los establecimientos públicos de la provincia de Santiago y proponer algunas recomendaciones según los resultados obtenidos.
Material y método
Se realizó un estudio transversal descriptivo. El universo estuvo constituido por todas las Unidades de Central de Fórmulas Enterales de los Hospitales Públicos de la provincia de Santiago. Se incluyeron aquellas Unidades que al momento del estudio llevaban a cabo las siguientes etapas en la elaboración de las FE: prescripción, formulación, preparación, dispensación, distribución, almacenamiento y administración de NE a pacientes hospitalizados. La única etapa opcional fue la preparación de FE, ya que también se disponía de FE listas para ser administradas.
Pauta de Verificación
Se formularon 639 criterios técnicos en relación a la elaboración, conservación y administración de NE, que comprendieron los aspectos de Planta Física, Equipamiento e Implementación, Normas Higiénicas y Sanitarias, Recurso Humano, Organización y Administración, Garantía de Inocuidad y Aseguramiento de la Calidad.
Los principales ítems incluidos en la pauta fueron:
- Planta Física (235 criterios): ubicación, construcción, superficies, pisos, paredes, cielos, puertas, iluminación y ventilación, entre otras.
- Equipamiento e Implementación de las Áreas de Trabajo (101): filtro sanitario, mesones, autoclaves, lavamanos, balanzas, refrigeradores entre otros.
- Recurso Humano (21): personal capacitado para la elaboración y administración de las FE y supervisión directa del profesional a cargo.
- Organización y Administración (19): Programas de pre-requisitos correspondientes a todos los procedimientos.
- Sistema de Garantía de Inocuidad y Aseguramiento de la Calidad (263): se evaluó si cumplía con el Programa de Pre-requisitos de Elaboración de FE.
En base a la literatura revisada, se identificó cada uno los criterios y estándares formulados en tres Tipos:
* Tipo 1: Mayor Riesgo, 309 criterios (48,4%). Estos criterios debieran ser cumplidos obligatoriamente ya que constituyen los puntos críticos en la elaboración, envasado, etiquetado, conservación, transporte y administración de las FE.
* Tipo 2: Mediano Riesgo, 209 criterios (32,7%). Procedimientos operacionales estandarizados que se registran en los programas de pre-requisitos y Manuales de Procedimientos respecto a las diversas etapas del proceso. Además se incluyen los criterios y estándares que se relacionan indirectamente con la calidad e inocuidad y que influyen directamente en la seguridad y trazabilidad.
* Tipo 3: Bajo Riesgo, 121 criterios (18,9%). Son aquellos calificados como de menor incidencia en la calidad e inocuidad de las FE, tales como procedimientos administrativos relacionados con el proceso de elaboración y que su cumplimiento facilite la ejecución del flujograma unidireccional de trabajo en la Unidad.
Validación de la Pauta de Verificación de Buenas Prácticas de Manufactura
Se aplicó en tres hospitales de la Provincia de Santiago y luego de analizar los resultados, se reformuló para obtener mayor precisión, objetividad, y aplicabilidad de la pauta.
Aplicación de la Pauta de Verificación
Posteriormente se procedió a evaluar las Unidades de Central de Fórmulas Enterales en el resto de los hospitales públicos de Santiago. La metodología utilizada fue la auditoria, que incluyó la inspección de las estructuras, equipamiento de las unidades, verificación de los procedimientos administrativos y técnicos involucrados en las buenas prácticas en la elaboración, conservación y administración de NE. Posteriormente se aplicó la lista de chequeo a través de una entrevista con el profesional encargado. La respuesta a los criterios fue siempre dicotómica y no dejó espacio para respuestas indefinidas. Una sola persona aplicó esta Pauta en el 100% de los establecimientos evaluados, en dos días habitualmente.
Análisis Estadístico
Se estudió la normalidad de cada variable y dado que la distribución de los valores no fue normal, se trabajó con mediana y percentiles. Se realizaron análisis descriptivo del porcentaje de cumplimiento de los diferentes criterios formulados en la Pauta de Verificación, clasificados según tipo 1, 2 ó 3.
Resultados
Al inicio del estudio se consideraron 19 hospitales, de los cuales 3 de ellos quedaron sin funcionamiento las centrales de alimentación enteral, a consecuencia de la destrucción ocasionada por el terremoto del 2010. Otros 2 hospitales no dieron respuesta a la solicitud para ser incluidos en el estudio, por lo tanto, se auditaron 14 Unidades.
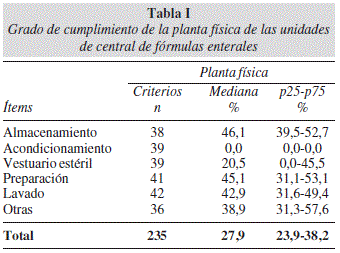
El grado de cumplimiento de la planta física, alcanzó una mediana de 27,9%, destacando un valor de 0,0% en el área de acondicionamiento de materia prima, ya que las Unidades prácticamente no contaban con esta área. En el área de vestuario estéril, la mediana fue solo 20,5%, a pesar de que estos dos aspectos han sido considerados críticos en el buen funcionamiento de la Unidad (Tabla I).
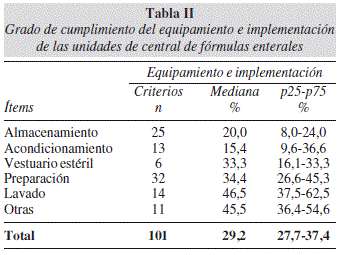
El grado de cumplimiento del Equipamiento e Implementación, tuvo una mediana de 29,2% con alguna dispersión de los valores entre los distintos ítems. Las medianas más bajas correspondieron a las variables de Acondicionamiento, Almacenamiento, Vestuario Estéril y Preparación (Tabla II).
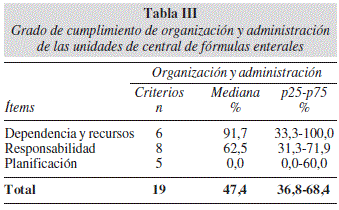
De los 19 criterios formulados para los ítems de Organización y Administración, el grado de cumplimiento logró una mediana cercana al 50%, con un valor más alto en las variables relacionadas con Dependencia y Asignación de Recursos. Llama la atención una mediana de 0,0% en los criterios de Planificación (Tabla III).
En Garantía de Inocuidad y Aseguramiento de la Calidad Nutricional, se observó una mediana de cumplimiento de 38,1%. El valor de la mediana más elevada fue para la variable de Planificación, Adquisición y Recepción de la Materia Prima, mientras que las cifras más bajas fueron para las variables de Ambiente y Equipos, Registros de Elaboración de FE y Controles Microbiológicos (Tabla IV). En la variable Recursos Humanos, se formularon 21 criterios con una mediana de cumplimiento de 52,4%.
La tabla V muestra el grado de cumplimiento de todas las variables incluidas en el estudio y de los criterios de riesgo tipo 1, observándose una mediana cercana al 30% en ambos casos, con el valor más bajo en planta física. Del total de los criterios estudiados 209 correspondieron a Riesgo Tipo 2 y 121 a Riesgo Tipo 3, obteniendo en ambos una mediana cercana al 40%, con un valor cercano al 60% en Organización y Administración (datos no mostrados).
Discusión
Para formular los criterios y estándares contenidos en ésta pauta se consideraron los informes de los casos clínicos asociados a contaminación de las FE, recomendaciones de la OMS y la FAO y la experiencia y opinión de los profesionales nutricionistas que se desempeñan en el área16,17.
En cuanto a la Planta Física, se recomienda contar con a lo menos cuatro áreas: Almacenamiento, Lavado, Vestuario Estéril y Preparación y ser de uso exclusivo para las funciones para cuales fueron diseñadas18. El grado de cumplimiento fue el valor más bajo, pues la mayoría de los hospitales sólo contaban con tres áreas y se adaptaban con doble funcionalidad, no cumpliendo con el requisito de proporcionar áreas de contaminación controlada.
Es preocupante también el bajo grado de cumplimiento en Equipamiento e Implementación de las áreas, lo que impide garantizar su inocuidad. Se observó falta de autoclave, refrigeradores científicos, material de los equipos de calidad no sanitizable. La disposición de los equipos debe permitir su movilidad, ser duraderos y desmontables para facilitar la higiene, limpieza de los mismos y de las áreas, para evitar la acumulación de suciedad y la presencia de plagas18-20.
En cuanto a Organización y Administración destaca la necesidad de optimizar la Planificación técnica administrativa, con mayor capacitación y supervisión de las técnicas higiénicas y sanitarias15,21. Los criterios de Registro y Trazabilidad de Elaboración de FE, alcanzaron en diez de los catorce hospitales evaluados, un grado de cumplimiento menor al 30%, lo que podría estar reflejando el déficit del recurso profesional para cumplir con este objetivo. Esto es especialmente importante, pues facilita el seguimiento de todos los procedimientos involucrados en la elaboración y administración de la NE.
La variable de Ambiente y Equipos, tuvo un Grado de cumplimiento menor a un 10%. Estos criterios dijeron relación con la calidad microbiológica de las áreas de contaminación controlada, requisito que se logra por inyección de aire a través de filtros HEPA. Sólo cuatro de los hospitales, contaban con éste sistema, de los cuales dos de ellos, no se encontraban en funcionamiento al momento de la evaluación. Además no se llevaban los controles del particulado de las áreas y lo más preocupante, tampoco los controles microbiológicos de las FE6,16.
Los resultados reflejan un déficit del recurso nutricionista en relación al número de fórmulas elaboradas. Este profesional debe supervisar en forma directa todos los procedimientos involucrados en la elaboración, dispensación, distribución y administración, además de la supervisión de los aspectos técnicos administrativos de la Unidad6,15,22.
Los criterios tipo 1, para las variables de Planta Física y Equipamiento e Implementación, alcanzaron el 65%. La Sociedad Americana de Nutrición Enteral y Parenteral (ASPEN) recomienda que las FE deben ser elaboradas dentro de un ambiente limpio, ISO clase 5 y por personal entrenado en técnicas asépticas utilizando vestimenta apropiada, bata desechable, mascarillas, guantes y cobertor de cabeza, estériles, además de la práctica del lavado quirúrgico de manos16,23.
Por otra parte, se identificaron los requisitos que deben cumplir los recursos de materia prima como la leche en polvo, fórmula enteral en polvo y agua segura. La OMS, recomienda que el agua a utilizar sea segura, esto es filtrada y estéril, pues el agua potable, aunque es sanitizada puede contener patógenos y alto contenido de minerales que pudiesen a su vez, alterar los componentes de las FE9,10.
Los criterios de riesgo tipo 1, del ítem de Garantía de Inocuidad y Aseguramiento de la Calidad, fueron formulados para identificar los puntos críticos en los procedimientos de elaboración: rotulado correcto de la materia prima, fecha y hora de apertura de los envases, temperatura y tiempo de refrigeración, temperatura del calentamiento a baño maría, registros de temperatura y tiempos de esterilización de las formulas reconstituidas y el control químico de cada ciclo de esterilización mediante tira reactiva. Además se consideraron los criterios que identificaron el uso de agua segura y las condiciones higiénicas en que el personal técnico elaboraba las FE12,14.
Estudios realizados en Chile, han mostrado que la mayor fuente de contaminación de las FE preparadas con materia prima en polvo, se produciría en la etapa de elaboración por manipulación o utensilios contaminados. Se recomienda que las fórmulas elaboradas con materia prima en polvo no deberían estar colgadas por más de cuatro horas, durante su administración y las que vienen en envases listas para usar, serían más seguras desde el punto de vista microbiológico y se podrían usar por 24 horas una vez abierto el envase, a temperatura ambiente24-26.
La variable Garantía de Inocuidad y Aseguramiento de la Calidad, representó el 61% del total de los criterios tipo 2 y dicen relación con el registro y documentación de la calidad de la elaboración. La literatura, avala y recomienda la importancia de los sistemas de registros, formular protocolos, dar monitoreo a la calidad de las formulas a través de los registros de trazabilidad y los manuales de calidad respectivos14,16.
Los criterios tipo 3, están relacionados con la planificación y registro de la mantención de Planta Física, Equipamientos, Insumos y programas de mejoras y registros de la Unidad, aspecto sobre el cual hacen énfasis diversos organismos internacionales23,27.
Se puede concluir que la Pauta elaborada tiene un alto nivel de exigencia, un número importante de criterios de evaluación y que permite identificar los puntos críticos (riesgo tipo 1). Es preocupante el bajo grado de cumplimiento de todas las variables estudiadas, considerando que son hospitales públicos de larga trayectoria y alta complejidad. Diversos aspectos pueden ser mejorados elaborando protocolos para instaurar programas de pre-requisitos para el aseguramiento de la calidad e inocuidad en la elaboración de fórmulas enterales. También es fundamental la dotación de Recursos Humanos idóneos y motivados, una Gestión de Calidad adecuada, apoyo institucional y respaldo de las autoridades de la Salud. Todo ello permitiría reducir los riesgos asociados a la contaminación de las formulas enterales en pacientes críticos y eventualmente reducir la estadía y costos de hospitalización.
Referencias
1. Mesejo A, Acosta J, Vaquerizo C. Nutrición enteral. En: Gil A, Ed. Editorial Médica Panamericana, Madrid 2010. Tomo IV: 117-142. [ Links ]
2. Brantley SL. Implementation of the enteral nutrition practice recommendations. Nutr Clin Pract 2009; 24: 335-43. [ Links ]
3. Okuma T., Nakamura M., Totake H, Fukunaga Y. Microbial Contamination of Enteral Feeding Formulas and Diarrhea. Nutrition 2000; 16: 719-22. [ Links ]
4. Mathus-Vliegen E, Bredius M, Binnekade J. Analysis of Sites Bacterial Contamination in an Enteral Feeding. JPEN 2006; 30: 519-25. [ Links ]
5. Hsu TC, Chen NR, Sullivan MM, Kohn-Keeth CL, Meints AS. Shott S. Comer GM. Effect of High Ambient Temperature on Contamination and Physical Stability of One-Liter Ready-to-Hang Enteral Delivery Systems. Nutrition 2000; 16: 165-7. [ Links ]
6. Moreno J, Segovia M, Serra J. "Preparación y Manejo de las Formulas Infantiles en polvo. Reflexiones en Torno a las recomendaciones del Comité de Nutrición de la ESPGHAN". Acta Pediatr Esp 2005; 63: 279-82. [ Links ]
7. Kim H, Ryu J, Beuchat R. Attachment of and Biofilm Formation by Enterobacter Sakazakii on Stainless and Enteral Feeding Tubes. Appl Environ Microbiol 2006; 72: 5846-56. [ Links ]
8. Hegazi RA, Wischmeyer PE. Clinical review: Optimizing enteral nutrition for critically ill patients-a simple data-driven formula. Crit Care 2011; 15: 234-45. [ Links ]
9. ASPEN. Enteral Nutrition Practice Recommendations. JEPN 2009; 20: 1-46. [ Links ]
10. Vargas H, Rodríguez V, Lorite R, Pérez C, Redecillas S, Campis M. Guía para la Elaboración de Fórmulas Infantiles en Polvo en el Medio Hospitalario. Sistema de Análisis de Peligros y Puntos de Crítico de Control. Ann Pediatr 2009; 70 (6): 586-93. [ Links ]
11. Comisión Codex Alimentarius. FAO/OMS. Sobre Normas Alimentarias. 24-87, 2008. [ Links ]
12. Oliveira M, Batista C, Aidoo K. Application of Hazard Analysis Critical Control Points System to enteral tube feeding in Hospital. The British Dietetic Association. J Hum Nutr Dietet 2001; 14: 397-403. [ Links ]
13. Instituto Nacional de Normalización. Norma Chilena Oficial NCh 2861. Sistema de Análisis de Peligros y Puntos Críticos de Control (HACCP). Primera edición, Chile, 2004: 1-21. [ Links ]
14. Ministerio de Salud. Subsecretaría de Salud. Norma Técnica Para la Determinación de Implementación del Análisis de Peligros y Puntos Críticos de Control (HACCP) en Establecimiento de Alimentos. Resolución Exenta No 187; 2008. [ Links ]
15. Ministerio de Salud. Subsecretaría de Salud Pública. Departamento Asesoría Jurídica. "Orientación Técnica de los Servicios Dietéticos de Leche (SEDILE) y Central de Fórmulas Enterales. (CEFE). Santiago, Chile 2011. [ Links ]
16. Ministerio de Salud. Dpto de Salud Ambiental. Sociedad Chilena de Microbiología e Higiene de los Alimentos. Programa de Pre-Requisitos: Base Fundamental Para la Inocuidad Alimentaria 2004; 1-29. [ Links ]
17. Instituto Nacional de Normalización. Norma Chilena Oficial NCh 2861. Sistema de Análisis de Peligros y Puntos Críticos de Control (HACCP). Primera edición, Chile, 2004. pp. 1-21. [ Links ]
18. Instituto de Salud Pública. Normas de buenas prácticas de elaboración de nutriciones parenterales en recetarios magistrales, Santiago, Chile 2010. [ Links ]
19. República de Chile. Ministerio de Salud. Subsecretaría de Salud Pública. Dpto. Asesoría Jurídica Reglamento de Pesticidas de Uso Sanitario y Doméstico. No157, Santiago 2005. [ Links ]
20. Iversen C, Forsythe S. Comparison of Media for the Isolation of Enterobacter Sakazakii. Applied and Environmental Microbiology 2007; 73: 48-52. [ Links ]
21. Vargas H, Rodríguez V, Lorite R, Pérez C, Redecillas S, Campis M. Guía para la Elaboración de Fórmulas Infantiles en Polvo en el Medio Hospitalario. Sistema de Análisis de Peligros y Puntos de Crítico de Control. Ann Pediatr 2009; 70: 586-93. [ Links ]
22. Kochevar M, Guenter P, Holcombe B, Malone A, Mirtallo J; ASPEN Board of Directors and Task Force on Parenteral Nutrition Standardization. ASPEN statement on parenteral nutrition standardization. JPEN J Parenter Enteral Nutr 2007; 31: 441-8. [ Links ]
23. Pérez AJ, Abilés R, Abud J. Perspectivas en el Diseño y Desarrollo de Productos para Nutrición Enteral. Nutrición Hospitalaria 2006; 21: 100-10. [ Links ]
24. Klaassen J, García C, Maiz A, Campano M. Mecanismos de Contaminación de las Fórmulas para Nutrición Enteral. Revista. Chilena Infectología 2002; 19: 69-73. [ Links ]
25. Kehr J, Castillo L, Morales B, Riderman K, Campano M, Aranda W. Contaminación Microbiana de Fórmulas Enterales de Uso Hospitalario. Rev Chil Pediat 2002; 73: 248-56. [ Links ]
26. Kehr J, Morales B, Contreras P, Castillo L, Aranda W. Calidad Microbiológica de una Fórmula Enteral Lista para Usar. Rev Chil Infect 2004; 21: 312-6. [ Links ]
27. Comité de Normatización de Asociación Argentina de Nutrición Enteral y Parenteral. Normas de Buenas Prácticas para la Preparación y Administración de Terapia Nutricional Enteral. RNC Publicación Científica sobre Nutrición Clínica 2004; 13: 41-56. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Eduarho Atalah Samur
Independencia 1027
Santiago. Chile
E-mail: eatalah@med.uchile.cl
Recibido: 23-VII-2013
Aceptado: 30-VII-2013