Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Nutrición Hospitalaria
versão On-line ISSN 1699-5198versão impressa ISSN 0212-1611
Nutr. Hosp. vol.33 no.1 Madrid Jan./Fev. 2016
https://dx.doi.org/10.20960/nh.37
TRABAJO ORIGINAL / Otros
Cáncer de vesícula biliar en Chile y factores nutricionales de riesgo
Gallbladder cancer and nutritional risk factors in Chile
Deborah Navarro Rosenblatt1 y Samuel Durán Agüero2
1Programa de Doctorado Salud Pública. Escuela de Salud Pública Universidad de Chile. Chile.
2Nutrición y Dietética. Facultad de Ciencias de la Salud. Universidad San Sebastián. Chile
Dirección para correspondencia
RESUMEN
El cáncer de vesícula biliar es la neoplasia maligna más común en el tracto biliar. Chile presenta la tercera prevalencia más alta de cáncer de vesícula en el continente americano, siendo las mujeres chilenas de la ciudad de Valdivia las que presentan la prevalencia más alta.
Los principales factores que se han asociado al cáncer de vesícula son: ser mujer, colelitiasis, obesidad, etnia, inflamación crónica, historia de enfermedades infecciones, como H. pylori y Salmonella e historia familiar de cáncer.
En Chile la mortalidad por cáncer de vesícula es cercana al nivel de prevalencia. Esto se debe en parte a que el cáncer de vesícula es una enfermedad silenciosa y sin síntomas específicos en primeras instancias.
Presentar obesidad y ser portador de agentes infecciosos, como Helicobacter pylori, son dos de los factores de riesgo más importantes para desarrollar cáncer de vesícula en Chile, ya que existe y una prevalencia de obesidad cercana al 30%.
El objetivo de esta revisión literaria es informar y resumir los factores de riesgo de cáncer de vesícula prevalentes en Chile, para así enfocarse en la prevención y cuidado de estos, con el propósito de reducir la prevalencia de esta letal enfermedad.
Palabras clave: Cáncer de vesícula biliar. Obesidad. Chile. Etnicidad. Nutrición.
ABSTRACT
Gallbladder cancer is the most malign neoplasm of the biliary tract. Chile presents the third highest prevalence of gallbladder cancer in the Americas, being Chilean women from the city of Valdivia the ones with the highest prevalence.
The main risk factors associated with gallbladder cancer are: sex, cholelithiasis, obesity, ethnicity, chronic inflammation, history of infection diseases such as Helicobacter pylori and Salmonella and family history of gallbladder cancer.
In Chile gallbladder cancer mortality is close to prevalence level. This is related to the silent symptomatology of this cancer, as well as the lack of specific symptoms.
The high prevalence of obesity and infectious diseases present in Chile are two of the main risk factors of gallbladder cancer and Chile has prevalence of obesity close to 30%
The aim of this literary review is to inform and summarize the main risk factors of gallbladder cancer that are prevalent in Chile, in order to be able to focus preventive and management interventions of this risk factor for the reduction in prevalence and mortality of gallbladder cancer in Chile.
Key words: Gallbladder cancer. Obesity. Chile. Ethnicity. Nutrition.
Introducción
El cáncer, después de las enfermedades cardiovasculares, constituye la segunda causa de muerte a nivel mundial con más de 8 millones de muertes el año 2012 (1). En Chile, en el año 2009, el cáncer alcanzó al 25,6% del total de defunciones por grupos de muertes (2). En el año 2010 se registraron en total 23.136 defunciones por cáncer, con una tasa de 135,3 por 100 mil habitantes (3).
En relación a la incidencia, en el año 2012 ocurrieron en el mundo más de 14 millones de casos nuevos de cáncer (excluyendo los cánceres de piel), mientras en Chile, la Agencia Internacional para la Investigación del Cáncer (IARC) estima tasas de incidencia semejantes a las de países desarrollados (1).
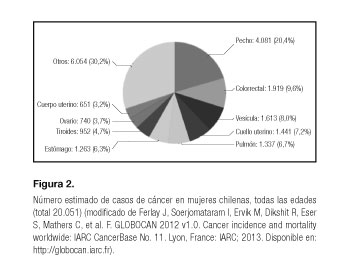
Los cánceres más frecuentes en las mujeres chilenas son el de mama, vesícula biliar y cuello uterino (55,3%) y en los hombres el de próstata, estómago y piel (58,7%) (3) (Fig. 1). Según GLOBOCAN, la prevalencia de CVB en mujeres alcanza a un 8% (Figs. 2 y 3).
El cáncer de vesícula biliar (CVB) es la neoplasia maligna más común en el tracto biliar, representando el 80-95% de los cánceres de las vías biliares en todo el mundo (4). Además, ocupa el sexto lugar entre los cánceres gastrointestinales, presentando una gran variabilidad en el mundo, posiblemente debido a diferentes factores ambientales y predisposición genética. El CVB es poco frecuente en el mundo y altamente fatal. Incluso, después de dos siglos de su primera descripción, el CVB sigue caracterizándose por un pronóstico desfavorable debido a la progresión silenciosa de su evolución (5).
Incidencia y mortalidad
La incidencia de CVB varía en diferentes partes del mundo (5-7). Por ejemplo, la tasa más alta de CVB se encuentra en indígenas mapuches de Valdivia (Chile) con 12,3 casos por cada 100.000 en hombres y 27,3 casos por cada 100.000 en mujeres. Le siguen los indígenas norteamericanos del estado de Nuevo México con 8,9 casos por 100.000 individuos, siendo la incidencia en todo Estados Unidos de 1,5/100.000. Corea del Sur presenta la incidencia más alta en Asia con 8,1 casos por 100.000 individuos en hombres y 5,6/100.000 en mujeres. Canadá presenta una incidencia de 1,6/100.000, Argelia de 10/100.000 e Israel de 5/100.000 (5,8,9).
Chile presenta la tercera prevalencia de CVB en las Américas, después de Estados Unidos y Brasil (10).
El Primer informe de registros poblacionales de cáncer en Chile (quinquenio 2003-2007) muestra que la prevalencia de CVB en la Región de los Ríos alcanzó el 10,7 en hombres y 32 en mujeres, en la Región de Antofagasta 3,9 en hombres y 9,5 en mujeres y en la provincia del Biobío un 12,4 en hombres y 28 en mujeres por cada 100.000 habitantes (11).
En cuanto a mortalidad, este cáncer es la tercera causa de muerte en mujeres chilenas, por debajo del cáncer de mama y estómago. En Chile, la tasa de mortalidad es más elevada en las regiones del sur, especialmente en áreas con alto nivel de pobreza y en población mapuche (12).
Desde una perspectiva epidemiológica, la tasa de mortalidad es similar a la de incidencia, ya que la expectativa de vida después de identificando el CVB no sobrepasa los 5 años. Esto debido a que el CVB es un cáncer sin sintomatología específica, lo que hace que por lo general el CVB sea diagnosticado en etapas avanzadas. La baja sobrevida en los pacientes con CVB se relaciona con la poca especificidad y la compleja ubicación de la vesícula en el cuerpo humano (13).
En la mayoría de los casos el CVB se manifiesta entre 5 a 15 años después de desarrollar el cáncer, el que por lo general se diagnostica en etapa avanzada, con una tasa de sobrevida a los 5 años de menos del 10% (14). Poco se sabe de la etiología de este tumor, además de estar estrechamente vinculado con cálculos biliares (15).
El objetivo de esta revisión literaria es describir los diferentes factores de riesgo relacionados con el CVB, tanto en relación a incidencia como a mortalidad, que se han reportado en los últimos años, principalmente los factores con mayor relevancia para la población chilena.
Factores de riesgo para cáncer de vesícula
Los principales factores de riesgo que han sido estudiados en relación al cáncer en general son el tabaco, alcohol, agentes infecciosos, radiación ionizante, agentes químicos, patrones dietarios y la obesidad (16-19). Específicamente para el CVB, se han identificado como componentes de riesgo ser de sexo femenino, colelitiasis, obesidad, etnia, inflamación crónica, historia de enfermedades infecciones como H. pylori e historia familiar de cáncer (6,15).
Factores no modificables
Sexo femenino
Las mujeres son más propensas a presentar este tipo de cáncer (15,20,21). Por ejemplo, en las mujeres del norte de la India el CVB se manifiesta entre 2 a 6 veces más que los hombres (22). Un meta-análisis que incluyó 8 estudios de cohorte y 4 de caso-control confirman esta situación de mayor riesgo en las mujeres RR = 1,88 (IC 95%: 1,66-2,13) que los hombres RR = 1,35 (IC 95%: 1,09-1,68) (24). Las mujeres chilenas de la ciudad de Valdivia presentan la incidencia de CVB más alta del mundo, con una tasa ajustada por edad de 12,8 por cada 100.000 individuos (8).
Etnia y región geográfica
El CVB presenta un patrón geográfico y étnico muy variado. La incidencia es baja en la población caucásica de los Estados Unidos y en la mayoría de los países de Europa occidental, en cambio es muy alta en Asía y Latinoamérica (12,16,17). La etnia mapuche presenta la tasa más alta de vesícula biliar a nivel mundial (25,26). Andia y cols. (16) señala en su estudio que la etnia mapuche tiene el riesgo más alto de presentar CVB, con un OR = 3,9 (IC 95%: 1,8-8,7).
El estudio realizado por Bertran (8) señala que la población de la ciudad de Valdivia, Chile, manifestó una incidencia cruda de cáncer de vesícula de 17,8 por 100.000 habitantes y un SIR ajustado por edad de 17,5 (CI 95%; 15,5-19,4). En este estudio, el 76% de los casos fueron mujeres, con una incidencia cruda de 26,7 y un SIR de 24,3 (CI 95%; 21,2-27,4). Los hombres manifestaron una incidencia cruda de 8,4 y un SIR de 8,6 (IC 95%: 6,7-10,6). Al comparar la incidencia de cáncer de vesícula en mujeres y hombres, el RR fue de 2,82 (CI 95%; 2,3-3,7).
Andia y cols. (16) también muestran otros factores que incrementan el riesgo de presentar CVB, como la fiebre tifoidea con un OR = 2,9 (IC 95%; 1,2-6,9), bajo nivel socio-económico OR = 5,1 (IC 95%: 1,6-15,9), el bajo acceso a la colecistectomía OR = 3,9 (IC 95%: 1,5-10,1), escasa accesibilidad a la atención hospitalaria OR = 14,2 (IC 95%: 4,2-48,7) y alta urbanización OR = 8,0 (IC 95%: 3,4-18,7).
Los mapuches presentan una elevada prevalencia de diabetes, síndrome metabólico y obesidad, siendo esta última de prevalente en un 63% en mujeres y 40% en hombres, prevalencia más elevada que el promedio nacional (27).
Factores modicables
Colelitiasis
La colelitiasis es una enfermedad crónica que se encuentra entre las más frecuentes del aparato digestivo, y su tratamiento (colecistectomía), es uno de las cirugías abdominales más habituales llevadas a cabo en Chile (25). La colecistectomía está dentro de las cinco primeras causas de intervención quirúrgica a nivel mundial y es una de las intervenciones más costosas entre las practicadas en enfermedades digestivas (26). Varios estudios de casos-controles han identificado a los cálculos biliares como un factor de riesgo para CVB (20,27,28). También se ha señalado la relación entre obesidad y cálculos biliares (29).
El estudio de Chow y cols. (30) en 60.176 daneses demostró que los cálculos biliares no tratados confieren un aumento de Standardized Incidence Ratio (SIR) = 2,7 (IC 95%: 1,5-4,4) cuando se comparan casos esperados versus casos observados. Resultados similares fueron encontrados en la cohorte de Minnesota, Estados Unidos con 2.583 individuos RR = 3 (IC 95%: 1,0-30,0) (31). El estudio de Chianale y cols. encontró una relación directa, sin alcanzar significación estadística, entre la mortalidad regional y la tasa de pacientes en lista de espera de colecistectomías, con un 27% de aumento en la mortalidad por CVB entre 1980 y 1988 (31). Un estudio realizado por Pérez-Ayuso (27) entre los años 2000-2001, en población urbana y rural mapuche, señala que individuos con colecistectomías y sintomáticos en Chile presentan escasas posibilidades para acceder a la colecistectomía electiva.
Obesidad
Estudios epidemiológicos han demostrado que la obesidad se asocia con un mayor riesgo de varios tipos de cáncer incluyendo colon, endometrio, mama post menopáusico, riñón, páncreas, vesícula biliar e hígado (33-35). El Segundo Reporte de Expertos del Fondo Mundial para la Investigación del cáncer (FMIC, o sus siglas en ingles WCRF), publicado en el año 2007, concluyó que hay información suficiente para afirmar que existe una probable asociación entre CVB y obesidad (34). Desde la publicación del Reporte de WCRF hasta la fecha, varios autores han publicado consistentemente resultados que asocian obesidad con la incidencia de CVB (35-40).
Garmendia y cols. (41) calcularon en un 7% para hombres y 27% para mujeres el riesgo atribuible a obesidad en el cáncer de vesícula en la población chilena.
La relación entre obesidad y cáncer es compleja, y hasta el momento no existe una comprensión acabada de todos los mecanismos involucrados en los diferentes tipos de cáncer. Para el cáncer de vesícula, se ha establecido que el tejido adiposo es un órgano endocrino vivo que produce constantemente hormonas secretoras de poli-péptidos, adipoquinas, leptina y adiponectina. La leptina, hormona abundante en obesos, induce la progresión del cáncer a través de la activación de la proliferación celular. Las personas obesas presentas cantidades disminuidas de adiponectina, que está relacionada con mecanismos opuestos a los de la leptina (42-44). Se ha observado que el exceso de insulina circulante también está relacionado con el cáncer a través de estimulaciones del factor de crecimiento insulínico tipo 1 y de la presencia de inflamación crónica (45,46). Otros mecanismos incluyen niveles elevados de factores de crecimiento, modulación defectuosa del balance energético y fallas en vías de señalización (44-47).
La revisión sistemática y el meta-análisis realizados por Renehan y cols (48), que incluyeron 141 artículos y a 28.2137 casos, mostraron que un incremento de 5 kg/m2 estaba asociado significativamente a diferentes tipos de cáncer incluido, el CVB, con un RR = 1,59 (IC 95%: 1,02-2,47) para mujeres y RR = 1,09 (IC 95%: 0,99-1,21). Otro meta-análisis de 8 cohortes mostró que personas con sobrepeso y obesidad presentaba un OR = 1,69 (IC 95%: 1,48-1,92), respectivamente, de desarrollar CVB (38).
El estudio Metabolic Syndrome and Cancer Project (Me-Can) (40), que incluyó 3 estudios de cohorte con 12 años de seguimiento (578.700 hombres y mujeres de Austria, Noruega y Suecia), mostró que un IMC aumentado OR = 1,31 (IC 95%: 1,11-1,57) y glucosa alta en sangre OR = 1,70 (IC 95%: 1,10-2,85) incrementan el riesgo de CVB.
Según la Segunda Encuesta Nacional de Salud (SENS), el IMC promedio de los chilenos es de 27,4%. En mujeres, el 30,7% presenta obesidad (IMC ≥ 30), alcanzando esta un 44,8 % en mujeres entre los 45 y 64 años. Al evaluar el estado nutricional por nivel educativo, las mujeres de nivel educacional bajo presentan un IMC promedio de 30,0 kg/m2, en cambio en el nivel educacional alto es de 26,8% (49).
Alimentación
Se ha observado un aumento del riesgo de CVB con una ingesta elevada de calorías, hidratos de carbono y una mayor preferencia por consumo de alimentos altos en grasa (50).
En un estudio de caso-control realizado por Negri (51), se muestra que el consumo de 1 a 3 frutas y verduras por semana es protector contra el CVB, con un OR = 0,3 (IC 95%: 0,19-0,49) para el consumo de frutas y un OR = 0,45 (IC 95%: 0,21-1,00) para el de verduras cocidas. Un estudio chileno de caso-control, mostró que un bajo consumo de frutas frescas se asocia con una mayor probabilidad de presentar CVB, con un OR = 6,40 (IC 95%: 1,40-30,3) para las personas que tienen un consumo de menos de 1 fruta a la semana (52). Otro estudio caso-control realizado en India mostró una reducción significativa en el riesgo de CVB en el consumo de rábano OR = 0,4 (IC 95%: 0,17-0,94), ají verde con un OR = 0,45 (IC 95%: 0,21-0,94 ) y de batata/yuca OR = 0,33 (IC 95%: 0,13-0,83), entre los vegetales y el mango OR = 0,4 (IC 95% 0,16 -0,99), naranja OR= 0,45 (IC 95%: 0,22-0,93), melón OR = 0,3 (IC 95% 0,14-0,64) y la papaya OR = 0,44 (IC 95%: 0,2-0,64) entre las frutas (53). Diversos estudios realizados en India, observan una tendencia protectora entre el consumo de verduras de hoja verde y el CVB (54-56). Entre las posibles razones que explicarían que una dieta alta en frutas y verduras podría prevenir la aparición de CVB, se encuentra el gran número de agentes potencialmente anticancerígenos como carotenoides, vitamina C, vitamina E, selenio, ácido fólico, fibra dietética, fenoles, flavonoides, inhibidores de la proteasa, compuestos alílicos y esteroles vegetales que se encuentran en estas fuentes de alimentos (57). Además, las dietas basadas en vegetales tienen baja densidad energética, bajo contenido de colesterol y grasas, alto volumen, lo que ayuda a la prevención de la obesidad (58).
Chile presenta un bajo consumo de frutas y verduras, como lo muestran diversos estudios realizados en distintos grupos etarios, en ninguno de ellos se llega a la recomendación de 400 g/día. Según la Segunda Encuesta Nacional de Salud (SENS) (49), el 7,9% de la población chilena reporta no consumir frutas en una semana mientras que el 24,2% consume frutas ocasionalmente. Con respecto a las verduras, los resultados son similares. El 1,5% de la población dice que no consume verduras en una semana habitual y el 10,3% consume verduras u hortalizas solo una o dos veces por semana. El 60,8% consume verduras diariamente, pero sin alcanzar las recomendaciones diarias de ingesta. La población femenina mostró un consumo diario de frutas y verduras superior al de los hombres (59-61).
El alto consumo de azúcar constituye uno de los factores de riesgo de enfermedades de la vesícula biliar y el CVB (54, 62). Un estudio muestra que la población en el tercio superior de ingesta de azúcar presenta un incremento del riesgo de presentar CVB de OR = 2,38 (IC 95%: 1,03-5,46) (63). El azúcar puede influir en la composición de la bilis a través del metabolismo de lipoproteína (63). El azúcar también está relacionado con el aumento de la ingesta de calorías sin aportar los nutrientes que reducen el riesgo de cáncer (64), con el aumento de la obesidad y la elevación de los niveles de insulina, el alto consumo de azúcar puede aumentar el riesgo de cáncer (65).
Con respecto a la ingesta de grasa y su asociación con CVB, los resultados aún son contradictorios. Un estudio de caso-control realizado en Japón reportó un mayor riesgo de CVB con una alimentación rica en alimentos grasos (OR = 3,29 [IC 95%: 1,68-6,43]) (50). Otro estudio de caso-control realizado en Chile mostró asociación entre consumo de alimentos fritos (> 200 g/día) y CVB, con un OR = 2,1 (IC 95%: 1,1-3,8) (51). Este mismo estudio indicó que el consumo de ají rojo se asoció con un incremento en el riesgo de CVB OR = 2,5 (IC 95%: 1,2-5,2). Un estudio descriptivo evaluó ajíes obtenidos del Mercado Central (Santiago, Chile), mostrando que el ají rojo está contaminado con aflatoxinas en cantidades bajas. Las aflatoxina B1 y G1 se encontraron en cantidades de 4 ng/g y 0,5 ng/g respectivamente. Su consumo prolongado puede estar asociado al desarrollo de CVB en Chile (66).
Conclusiones
Debido a la alta prevalencia de H. pylori, obesidad y deficientes hábitos alimentarios que el país presenta, los chilenos tienen un riesgo elevado de presentar CVB. Es por esto que es de extremada importancia tomar medidas de prevención y control.
Recomendaciones
Para disminuir la incidencia del CVB en la población chilena es necesario incentivar programas de promoción de hábitos alimentarios saludables desde la infancia y de forma permanente. Así mismo, es trascendental impulsar políticas públicas efectivas para la reducción y mantenimiento de un peso saludable, probablemente el factor de riesgo modificable más importante en el CVB.
El manejo oportuno de infecciones por H. pylori también es un factor fundamental en la prevención del CVB.
Tampoco debemos dejar de lado la importancia de tener profesionales de salud conscientes de que existen formas de prevenir el CVB, junto con otros tipos de cáncer, en Chile y de que es nuestro rol informar a los pacientes de los factores de riesgo que aumentan la probabilidad de padecer esta letal enfermedad.
Es necesario desarrollar programas prevención de CVB en grupos vulnerables, como lo es la comunidad mapuche chilena.
Agradecimientos
A la Profesora Juliana Kain por sus sugerencias y revisión crítica del documento. La información expresada por los autores en esta revisión literaria son las opiniones de los autores, estas pueden no representar las opiniones de WCRF y pueden ser diferentes a futuras actualizaciones de la evidencia.
Bibliografía
1. Ferlay J, Soerjomataram I, Ervik M, Dikshit R, Eser S, Mathers C, et al. GLOBOCAN 2012 v1.0. Cancer incidence and mortality worldwide: IARC CancerBase No. 11 (Internet). Lyon, France: International Agency for Research on Cancer; 2013. Disponible en: http://globocan.iarc.fr (Último acceso 24/10/2014). [ Links ]
2. Departamento de Estadísticas e Información en Salud. Ministerio de Salud. Gobierno de Chile. Estadísticas vitales. Disponible en: http://deis.minsal.cl/deis/vitales/vita.asp (Último acceso 10/10/2014). [ Links ]
3. Departamento de Estadísticas e Información en Salud. Ministerio de Salud. Defunciones por grandes grupos de causas. Chile; 2009. Disponible en: http://www.deis.cl/ (Último acceso 10/10/2014). [ Links ]
4. Lazcano-Ponce EC, Miquel JF, Munoz N, Herrero R, Ferrecio C, Wistuba, II, et al. Epidemiology and molecular pathology of gallbladder cancer. CA Cancer J Clin 2001;51(6):349-64. [ Links ]
5. Hundal R, Shaffer EA. Gallbladder cancer: epidemiology and outcome. Clin Epidemiol 2014;6:99-109. [ Links ]
6. Eslick GD. Prevalence and epidemiology of gastrointestinal symptoms among normal weight, overweight, obese and extremely obese individuals. Gastroenterol Clin North Am 2010;39(1):9-22. [ Links ]
7. Sharma JD, Kalit M, Nirmolia T, Saikia SP, Sharma A, Barman D. Cancer: scenario and relationship of different geographical areas of the globe with special reference to North East-India. Asian Pac J Cancer Prev 2014;15(8):3721-9. [ Links ]
8. Bertran E, Heise K, Andia ME, Ferreccio C. Gallbladder cancer: incidence and survival in a high-risk area of Chile. Int J Cancer 2010;127(10):2446-5. [ Links ]
9. Wistuba, II, Gazdar AF. Gallbladder cancer: lessons from a rare tumour. Nat Rev Cancer 2004;4(9):695-706. [ Links ]
10. Bray F, Ren JS, Masuyer E, Ferlay J. Estimates of global cancer prevalence for 27 sites in the adult population in 2008. Int J Cancer 2013;132(5):1133-45. [ Links ]
11. MINSAL. Primer Informe de registros poblacionales de cáncer en Chile (quinquenio 2003-2007). Unidad de Vigilancia de enfermedades no transmisibles y estudios. Departamento de Epidemiología. División Planificación Sanitaria; 2012. Disponible en: http://epi.minsal.cl/epi/ (Último acceso 10/10/2014). [ Links ]
12. Andia KM, Gederlini GA, Ferreccio RC. Gallbladder cancer: trend and risk distribution in Chile. Rev Med Chil 2006;134(5):565-74. [ Links ]
13. Lim H, Seo DW, Park do H, Lee SS, Lee SK, Kim MH, et al. Prognostic factors in patients with gallbladder cancer after surgical resection: analysis of 279 operated patients. J Clin Gastroenterol 2013;47(5):443-8. [ Links ]
14. Misra S, Chaturvedi A, Misra NC, Sharma ID. Carcinoma of the gallbladder. Lancet Oncol 2003;4(3):167-76. [ Links ]
15. Randi G, Franceschi S, La Vecchia C. Gallbladder cancer worldwide: geographical distribution and risk factors. Int J Cancer 2006;118(7):1591-602. [ Links ]
16. Andia ME, Hsing AW, Andreotti G, Ferreccio C. Geographic variation of gallbladder cancer mortality and risk factors in Chile: a population-based ecologic study. Int J Cancer 2008;123(6):1411-6. [ Links ]
17. Moore SP, Forman D, Pineros M, Fernandez SM, De-Oliveira-Santos M, Bray F. Cancer in indigenous people in Latin America and the Caribbean: a review. Cancer Med 2014;3(1):70-80. [ Links ]
18. Doll R. The causes of cancer. Rev Epidemiol Sante Publique 200;49(2):193-200. [ Links ]
19. Stewar B, Wild C. World Cancer Report 2014. Lyon: IARC /WHO; 2014. [ Links ]
20. Zatonski WA, Lowenfels AB, Boyle P, Maisonneuve P, Bueno-de-Mesquita HB, Ghadirian P, et al. Epidemiologic aspects of gallbladder cancer: a case-control study of the SEARCH Program of the International Agency for Research on Cancer. J Natl Cancer Inst 1997;89(15):1132-8. [ Links ]
21. Gupta P, Agarwal A, Gupta V, Singh PK, Pantola C, Amit S. Expression and clinicopathological significance of estrogen and progesterone receptors in gallbladder cancer. Gastrointest Cancer Res 2012;5(2):41-7. [ Links ]
22. Randi G, Malvezzi M, Levi F, Ferlay J, Negri E, Franceschi S, et al. Epidemiology of biliary tract cancers: an update. Ann Oncol 2009;20(1):146-59. [ Links ]
23. Konstantinidis IT, Deshpande V, Genevay M, Berger D, Fernandez-del-Castillo C, Tanabe KK, et al. Trends in presentation and survival for gallbladder cancer during a period of more than 4 decades: a single-institution experience. Arch Surg 2009;144(5):441-7. [ Links ]
24. Hariharan D, Saied A, Kocher HM. Analysis of mortality rates for gallbladder cancer across the world. HPB (Oxford) 2008;10(5):327-31. [ Links ]
25. Csendes A, Korn O, Medina E, Becerra M, Csendes P. Biliary surgery mortality in Chile in 1990. Cooperative study in 17 hospitals. Rev Med Chil 1993;121(8):937-42. [ Links ]
26. Surveillance, Epidemiology and End-Results Program (SEER). The Four Most Common Cancers for Different Ethnic Populations 2013. Bethesda, MD: National Cancer Institute; 2013. [ Links ]
27. Perez-Ayuso RM, Hernandez V, Gonzalez B, Carvacho C, Navarrete C, Alvarez M, et al. Natural history of cholelithiasis and incidence of cholecystectomy in an urban and a Mapuche rural area. Rev Med Chil 2002;130(7):723-30. [ Links ]
28. Roa I, de Aretxabala X, Ibacache G, Munoz S. Association between cholesterolosis and gallbladder cancer. Rev Med Chil 2010;138(7):804-8. [ Links ]
29. Roa I, Ibacache G, Roa J, Araya J, De-Aretxabala X, Munoz S. Gallstones and gallbladder cancer-volume and weight of gallstones are associated with gallbladder cancer: a case-control study. J Surg Oncol 2006;93(8):624-8. [ Links ]
30. Chow WH, Johansen C, Gridley G, Mellemkjaer L, Olsen JH, Fraumeni JF, et al. Cholecystectomy and risk of cancers of the liver, biliary tract and pancreas. Br J Cancer 1999;79(3-4):640-4. [ Links ]
31. Maringhini A, Moreau JA, Melton LJ, Hench VS, Zinsmeister AR, DiMagno EP. Gallstones, gallbladder cancer, and other gastrointestinal malignancies. An epidemiologic study in Rochester, Minnesota. Ann Intern Med 1987;107(1):30-5. [ Links ]
32. Chianale J, Valdivia G, del Pino G, Nervi F. Gallbladder cancer mortality in Chile and its relation to cholecystectomy rates. An analysis of the last decade. Rev Med Chil 1990;118(11):1284-8. [ Links ]
33. World Cancer Research Fund International/American Institute for Cancer Research. Continuous Update Project Report: Diet, Nutrition, Physical Activity and Gallbladder Cancer. 2015. Disponible en: wcrf.org/Gallbladder-Cancer-2015. [ Links ]
34. Jee SH, Yun JE, Park EJ, Cho ER, Park IS, Sull JW, et al. Body mass index and cancer risk in Korean men and women. Int J Cancer 2008;123(8):1892-6. [ Links ]
35. Schlesinger S, Aleksandrova K, Pischon T, Fedirko V, Jenab M, Trepo E, et al. Abdominal obesity, weight gain during adulthood and risk of liver and biliary tract cancer in a European cohort. Int J Cancer 2013;132(3):645-57. [ Links ]
36. Vucenik I, Stains JP. Obesity and cancer risk: evidence, mechanisms, and recommendations. Ann N Y Acad Sci 2012;1271:37-43. [ Links ]
37. Stinton LM, Shaffer EA. Epidemiology of gallbladder disease: cholelithiasis and cancer. Gut Liver 2012;6(2):172-87. [ Links ]
38. Larsson SC, Wolk A. Obesity and the risk of gallbladder cancer: a meta-analysis. Br J Cancer 2007;96(9):1457-61. [ Links ]
39. Wolin KY, Carson K, Colditz GA. Obesity and cancer. Oncologist 2010;15(6):556-65. [ Links ]
40. Borena W, Edlinger M, Bjorge T, Haggstrom C, Lindkvist B, Nagel G, et al. A prospective study on metabolic risk factors and gallbladder cancer in the metabolic syndrome and cancer (Me-Can) collaborative study. PLoS One 2014;9(2):e89368. [ Links ]
41. Garmendia ML, Ruiz P, Uauy R. Obesity and cancer in Chile: estimation of population attributable fractions. Rev Med Chil 2013;141(8):987-94. [ Links ]
42. Roberts DL, Dive C, Renehan AG. Biological mechanisms linking obesity and cancer risk: new perspectives. Annu Rev Med 2010;61:301-16. [ Links ]
43. Dalamaga M, Diakopoulos KN, Mantzoros CS. The role of adiponectin in cancer: a review of current evidence. Endocr Rev 2012;33(4):547-94. [ Links ]
44. Drew JE. Molecular mechanisms linking adipokines to obesity-related colon cancer: focus on leptin. Proc Nutr Soc 2012;71(1):175-80. [ Links ]
45. Gallagher EJ, LeRoith D. Minireview: IGF, Insulin, and Cancer. Endocrinology 2011;152(7):2546-51. [ Links ]
46. Hursting SD, Berger NA. Energy balance, host-related factors, and cancer progression. J Clin Oncol 2010;28(26):4058-65. [ Links ]
47. Chen J. Multiple signal pathways in obesity-associated cancer. Obes Rev 2011;12(12):1063-70. [ Links ]
48. Renehan AG, Tyson M, Egger M, Heller RF, Zwahlen M. Body-mass index and incidence of cancer: a systematic review and meta-analysis of prospective observational studies. Lancet 2008;371(9612):569-78. [ Links ]
49. Encuesta Nacional de Salud 2009-2010, Chile. Disponible en: http://epi.minsal.cl/wp-content/uploads/2012/07/InformeENS_2009-2010_CAP1.pdf (Ultimo acceso 24/10/2014). [ Links ]
50. Kato K, Akai S, Tominaga S, Kato I. A case-control study of biliary tract cancer in Niigata Prefecture, Japan. Jpn J Cancer Res 1989;80(10):932-8. [ Links ]
51. Negri E, La Vecchia C, Franceschi S, D'Avanzo B, Parazzini F. Vegetable and fruit consumption and cancer risk. Int J Cancer 1991;48(3):350-4. [ Links ]
52. Serra I, Yamamoto M, Calvo A, Cavada G, Baez S, Endoh K, et al. Association of chili pepper consumption, low socioeconomic status and longstanding gallstones with gallbladder cancer in a Chilean population. Int J Cancer 2002;102(4):407-11. [ Links ]
53. Pandey M, Shukla VK. Diet and gallbladder cancer: a case-control study. Eur J Cancer Prev 2002;11(4):365-8. [ Links ]
54. Rai A, Mohapatra SC, Shukla HS. A review of association of dietary factors in gallbladder cancer. Indian J Cancer 2004;41(4):147-51. [ Links ]
55. Rai A, Mohapatra SC, Shukla HS. Correlates between vegetable consumption and gallbladder cancer. Eur J Cancer Prev 2006;15(2):134-7. [ Links ]
56. Panda D, Sharma A, Shukla NK, Jaiswal R, Dwivedi S, Raina V, et al. Gall bladder cancer and the role of dietary and lifestyle factors: a case-control study in a North Indian population. Eur J Cancer Prev 2013;22(5):431-7. [ Links ]
57. Thompson R. Preventing cancer: the role of food, nutrition and physical activity. J Fam Health Care 2010;20(3):100-2. [ Links ]
58. Herber D. Vegetables, fruits and phytoestrogens in the prevention of disease. J Postgrad Med 2004;50(2):145-9. [ Links ]
59. Duran-Aguero S, Bazaez-Diaz G, Figueroa-Velasquez K, Berlanga-Zuniga-Mdel R, Encina-Vega C, Rodriguez-Noel MP. Comparison between the quality of life and nutritional status of nutrition students and those of other university careers at the Santo Thomas University in Chile. Nutr Hosp 2012;27(3):739-46. [ Links ]
60. Olivares S, Kain J, Lera L, Pizarro F, Vio F, Moron C. Nutritional status, food consumption and physical activity among Chilean school children: a descriptive study. Eur J Clin Nutr 2004;58(9):1278-85. [ Links ]
61. Salazar G, Vasquez F, Concha F, Rodriguez-Mdel P, Berlanga-Mdel R, Rojas J, et al. Pilot nutrition and physical activity intervention for preschool children attending daycare centres (JUNJI): primary and secondary outcomes. Nutr Hosp 2014;29(5):1004-12. [ Links ]
62. Barclay AW, Petocz P, McMillan-Price J, Flood VM, Prvan T, Mitchell P, et al. Glycemic index, glycemic load, and chronic disease risk--a meta-analysis of observational studies. Am J Clin Nutr 2008;87(3):627-37. [ Links ]
63. Moerman CJ, Bueno-de-Mesquita HB, Runia S. Dietary sugar intake in the aetiology of biliary tract cancer. Int J Epidemiol 1993;22(2):207-14. [ Links ]
64. Key TJ, Schatzkin A, Willett WC, Allen NE, Spencer EA, Travis RC. Diet, nutrition and the prevention of cancer. Public Health Nutr 2004;7(1A):187-200. [ Links ]
65. Kaaks R, Lukanova A. Energy balance and cancer: the role of insulin and insulin-like growth factor-I. Proc Nutr Soc 2001;60(1):91-106. [ Links ]
66. Tsuchiya Y, Terao M, Okano K, Nakamura K, Oyama M, Ikegami K, et al. Mutagenicity and mutagens of the red chili pepper as gallbladder cancer risk factor in Chilean women. Asian Pac J Cancer Prev 2011;12(2):471-6. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Deborah Navarro Rosenblatt.
Escuela de Salud Pública.
Universidad de Chile. Independencia 939.
Programa Doctorado en Salud Pública. Chile
e-mail: Dnavarro.rosenblatt@gmail.com
Recibido: 14/09/15
Aceptado: 15/10/15