Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Nutrición Hospitalaria
versión On-line ISSN 1699-5198versión impresa ISSN 0212-1611
Nutr. Hosp. vol.33 no.4 Madrid jul./ago. 2016
https://dx.doi.org/10.20960/nh.400
REVISIÓN
Teduglutida: revisión de su uso en el síndrome de intestino corto
Teduglutide: a review of its use in short bowel syndrome
Rosa Burgos Peláez1, M.a Cristina Cuerda Compes2, Pedro P. García-Luna3, Ceferino Martínez Faedo4, Sílvia Mauri Roca5, José Manuel Moreno Villares6, M. Nuria Virgili Casas7 y Carmina Wanden-Berghe8
1Unidad de Soporte Nutricional. Hospital Universitario Vall d'Hebron. Barcelona.
2Unidad de Nutrición. Hospital General Universitario Gregorio Marañón. Madrid.
3U. Nutrición (UGEN). Hospital Universitario Virgen del Rocío. Sevilla.
4Unidad de Nutrición. Hospital Universitario Central de Asturias (HUCA). Oviedo.
5Hospital Universitari Doctor Josep Trueta. Girona.
6Nutrición Clínica. Hospital Universitario 12 de Octubre. Madrid.
7Unidad de Nutrición y Dietética. Servicio de Endocrinología y Nutrición. Hospital Universitario de Bellvitge. L'Hospitalet de Llobregat, Barcelona.
8Unidad de Hospitalización a Domicilio. Hospital General Universitario de Alicante. ISABIAL-FISABIO. Alicante
Dirección para correspondencia
RESUMEN
Introducción: la nutrición parenteral (NP) a largo plazo puede asociarse a complicaciones graves, con un deterioro importante de la calidad de vida de los pacientes con síndrome de intestino corto (SIC). La teduglutida, un análogo del péptido-2 similar al glucagón, pertenece a una nueva familia terapéutica y representa el primer abordaje no sintomático del SIC.
Objetivos: revisar los datos preclínicos y clínicos en cuanto a eficacia y seguridad de la teduglutida.
Resultados: la aprobación de la teduglutida se basó en los resultados de un estudio en fase III de 24 semanas, doble ciego, controlado con placebo (STEPS). Pacientes con fallo intestinal por SIC dependientes de NP ≥ 3 veces/semana durante ≥ 12 meses recibieron 0,05 mg/kg de teduglutida (n = 43) o placebo (n = 43) 1 vez/día. En la semana 24 hubo significativamente más respondedores en el grupo de la teduglutida que en el de placebo (63 vs. 30%; p = 0,002). La reducción absoluta media del volumen de NP frente al valor basal en la semana 24 fue significativamente mayor con la teduglutida (4,4 vs. 2,3 l/semana; p < 0,001). La necesidad de NP se redujo ≥ 1 día en la semana 24 en el 54% de pacientes tratados con teduglutida vs. 23% con placebo. Del total de pacientes que recibieron teduglutida en los ensayos en fase III (n = 134), el 12% consiguió una autonomía completa de la NP. Por lo general, la administración subcutánea de teduglutida se toleró bien.
Conclusiones: se ha demostrado que teduglutida recupera la absorción intestinal y reduce significativamente la dependencia de la NP, consiguiendo incluso la independencia en algunos pacientes.
Palabras clave: Fallo intestinal. Teduglutida. Síndrome de intestino corto. GLP-2. Nutrición parenteral.
ABSTRACT
Introduction: Long-term Parenteral Support (PS) can be associated with serious complications, with a significant deterioration in the quality of life of patients with short bowel syndrome (SBS). Teduglutide is a recombinant analogue of glucagon-like peptide-2; it belongs to a novel therapeutic family and represents the first non-symptomatic approach against SBS.
Objectives: To review the non-clinical and clinical data on efficacy and safety of teduglutide.
Results: Teduglutide approval was based on results from a pivotal Phase III, 24-week, double-blind, placebo-controlled study (STEPS). SBS patients dependent on PS ≥ 3 times/week for ≥ 12 months received 0.05 mg/kg teduglutide (n = 43) or placebo (n = 43) 1 time/day. At week 24 there were significantly more responders in the teduglutide group vs. placebo (63 vs. 30%; p = 0.002). The overall mean reduction vs. PS baseline volume at week 24 was significantly higher with teduglutide vs. placebo (4.4 vs. 2.3 l/ week, p < 0.001). At week 24 the need for PS was reduced in at least 1 day in 54% of patients treated with teduglutide vs. 23% with placebo. Of the total of patients who received teduglutide in phase III trials (n = 134), 12% achieved complete autonomy from PS. Subcutaneous teduglutide was generally well tolerated.
Conclusions: Teduglutide has been shown to enhance intestinal absorptive capacity and significantly reduce PS dependency, even achieving independency in some patients.
Key words: Intestinal failure. Teduglutide. Short-bowel syndrome. GLP-2. Parenteral nutrition.
Introducción
El fracaso intestinal es una entidad compleja que se define como una disminución de la función intestinal por debajo del mínimo necesario para la absorción de macronutrientes y/o de agua y electrolitos, de manera que se precise su administración intravenosa para mantener la salud o el crecimiento (1). Puede tener distintas fisiopatologías, siendo la más frecuente el síndrome de intestino corto (SIC), que se produce como resultado de la pérdida física de segmentos de intestino por resecciones quirúrgicas extensas debido a isquemia, traumatismo o tumores, o por alteraciones congénitas (2,3). El intestino delgado en adultos tiene una longitud variable, entre 275-850 cm, dependiendo de si la medición proviene de autopsias o se realiza durante la cirugía. El SIC, causa más frecuente de fallo intestinal (4), aparece cuando el intestino delgado remanente es inferior a 200 cm (1-3).
En los dos años posteriores a la resección intestinal tiene lugar un proceso de adaptación intestinal, durante el cual se trata de restablecer la absorción intestinal para compensar la pérdida de superficie absortiva (2,5). Durante este proceso de adaptación se produce un aumento de la superficie absortiva (adaptación estructural) junto a un enlentecimiento del tránsito gastrointestinal (adaptación funcional). En cualquier caso, la clínica asociada al SIC varía en función de la longitud y de la zona de intestino afectada, la presencia de enfermedad intestinal subyacente, la presencia o ausencia de colon y de válvula ileocecal, y la naturaleza de la enfermedad de base (6).
Aunque los síntomas varían entre pacientes, el SIC se caracteriza por diarrea, esteatorrea, dolor abdominal, alteraciones electrolíticas, deshidratación, desnutrición y pérdida de peso (2,3). La diarrea y la pérdida de abundante líquido por estomas son los síntomas más comunes y debilitantes. Pueden aparecer además manifestaciones extraintestinales tales como nefrolitiasis o enfermedad hepática y enfermedad metabólica ósea causadas por la malabsorción y el sobrecrecimiento bacteriano. Todo ello empeora la calidad de vida de los pacientes, que experimentan un deterioro de su estado de salud y padecen de estrés, bajas laborales y frecuentes visitas médicas u hospitalizaciones (7). El SIC se asocia además a una disminución de la supervivencia. Así, en adultos con SIC de origen no oncológico se han notificado estimaciones de supervivencia global del 94%, 70% y 52% a 1, 5 y 10 años, respectivamente (8).
MANEJO ACTUAL DEL SÍNDROME DE INTESTINO CORTO
Epidemiología
El SIC presenta una morbilidad y mortalidad significativas, con unos costes anuales estimados de 150.000 dólares/paciente (7). Su incidencia y prevalencia exactas se desconocen debido a la falta de bases de datos fiables (2,9). Aproximadamente el 50% de los pacientes con SIC presentan fallo intestinal y dependen de tratamiento con nutrición parenteral (NP) y/o fluidoterapia para mantener un adecuado estado de nutrición e hidratación.
Según un registro estadounidense de 1992, aproximadamente 40.000 adultos estaban recibiendo NP o fluidoterapia a largo plazo, de los que unos 10.000 estaban diagnosticados de SIC (10). En Europa, considerando que los pacientes con SIC constituyen el 35% de la población tratada con NP o fluidoterapia (11), se calcula que el SIC podría tener una prevalencia de 1,4 pacientes/millón habitantes (12).
La incidencia de NP y del SIC difiere entre los países europeos. En un análisis retrospectivo realizado en 1997 (n = 494), la prevalencia de Nutrición Parenteral Domiciliaria (NPD) varió entre 12,7 pacientes/millón habitantes en Dinamarca y 0,65 en España. Este mismo estudio determinó como principal etiología de la NP el cáncer (39%), la enfermedad de Crohn (19%), las enfermedades vasculares (15%), la enteritis por radiación (7%) y el sida (2%) (11).
En cuanto a los datos del SIC, de los 688 pacientes adultos tratados con NP/fluidoterapia a largo plazo estudiados por Pironi y cols., este estaba presente en aproximadamente un 75% de ellos (13). Las causas principales fueron la isquemia mesentérica (27%), la enfermedad de Crohn (23%) y la enteritis por radiación (11%). En cambio, en un reciente estudio que incluye a 268 pacientes con SIC se han descrito como etiologías principales el infarto mesentérico (43%), la enteritis por radiación (23%), las complicaciones quirúrgicas (12%), la enfermedad de Crohn (6%) y los tumores de tejidos blandos (6%) (8).
En España, algunos autores han establecido una prevalencia de la NPD de 5,06/millón habitantes (14). Según los datos del registro de NPD del grupo NADYA-SENPE, en 2013 se registraron 197 pacientes, lo cual representa una tasa de 4,22 pacientes/millón habitantes/año. La edad media fue de 53 años (rango 40-64) en los pacientes mayores de 14 años (n = 189), y de 7 meses en los niños (rango 6-35,5). En cuanto a la causa, la más frecuente en adultos fue la neoplasia (30,7%) seguida de otras patologías (20,1%) y de la isquemia mesentérica (12,7%). En el 35,4% de los casos el motivo de indicación fue el SIC, seguido de la obstrucción intestinal (25,9%) (15).
OPCIONES TERAPÉUTICAS EN EL SÍNDROME DE INTESTINO CORTO
El principal objetivo del tratamiento de los pacientes con SIC es la rehabilitación intestinal, es decir, potenciar al máximo la capacidad absortiva y digestiva del tracto gastrointestinal remanente (16). El tratamiento incluye diferentes abordajes: farmacológico (agentes antidiarreicos, antisecretores, suplementos orales o intravenosos de vitaminas, minerales y fluidos), nutricional (adecuación o modificaciones de la dieta oral, nutrición enteral o parenteral), o quirúrgico (técnicas de elongación intestinal o trasplante intestinal) (4,16).
La nutrición por vía digestiva estimula la adaptación intestinal y es clave en su rehabilitación (16). Por lo general, la adaptación intestinal, la hiperfagia compensatoria y distintas modificaciones dietéticas hacen que los pacientes consigan autonomía nutricional en el 50-70% de los casos. Sin embargo, aquellos pacientes con una resección intestinal masiva, enfermedad de base activa, colon ausente, estoma de alto débito, mala rehabilitación intestinal o diversas comorbilidades pueden requerir NP a largo plazo o indefinida. Por último, la reconstrucción quirúrgica y el trasplante intestinal se llevan a cabo en un grupo seleccionado de pacientes; la primera es factible en muchos centros, mientras que el trasplante solo está disponible en centros de referencia (17).
La NP/fluidoterapia proporciona la nutrición, los líquidos y electrolitos necesarios para mantener un estado de salud y peso corporal adecuados (18,19). Las estrategias terapéuticas se adaptan individualmente ajustando la dosis de medicación y la frecuencia, el volumen y la composición de la NP. Los líquidos y electrolitos intravenosos evitan la deshidratación grave, la hipotensión y los desequilibrios electrolíticos. Aunque algunos pacientes pueden disminuir gradualmente la dependencia y abandonar la NP, otros deberán recibirla a largo plazo (19,20). Se ha descrito una probabilidad de fallo intestinal permanente del 95% tras 2 años de dependencia de la NP/fluidoterapia (21,22). Por tanto, el objetivo es reducir la dependencia de los líquidos y nutrientes intravenosos a largo plazo y, cuando sea posible, suprimirlos (23).
Por otro lado, el empleo a largo plazo de NP puede asociarse a complicaciones relativas al catéter (infecciones, trombosis, oclusión), complicaciones metabólicas (enfermedad hepática, enfermedad ósea metabólica, insuficiencia renal), y deterioro de la calidad de vida (16,17,24). En pacientes que reciben NPD se ha notificado una incidencia de 3,6 complicaciones/1.000 días-catéter (25). En un metaanálisis de 39 estudios bien diseñados realizados en 14 países, la incidencia de bacteriemia asociada al catéter fue de 0,38-4,58 episodios/1.000 días-catéter (mediana 1,31) (26). En cuanto a la trombosis asociada al catéter, se ha descrito una incidencia en adultos y niños de 0,07 episodios/año-catéter (27). El riesgo de fallecimiento asociado a la NPD aumenta con la duración de esta (28).
Los pacientes que reciben cualquier tipo de soporte nutricional, especialmente aquellos que reciben NP o fluidoterapia durante un largo periodo de tiempo, requieren una monitorización especial que ayude a optimizar los fluidos y la nutrición administrados. Esta monitorización comprende medidas de seguimiento relativas a la dieta, la hidratación, el peso corporal, las pérdidas a través del estoma o de las heces, el perfil sanguíneo y urinario, así como al estado funcional (16).
TRATAMIENTOS SINTOMÁTICOS DEL SÍNDROME DE INTESTINO CORTO
Hasta hace poco, la farmacoterapia disponible para tratar el SIC tenía como función controlar los síntomas y ser un tratamiento de apoyo. Entre los fármacos incluidos están los antidiarreicos para enlentecer el tránsito intestinal y evitar la pérdida excesiva de líquidos; los antagonistas de los receptores H2 e inhibidores de la bomba de protones para tratar la hipergastrinemia; enzimas pancreáticas si existe esteatorrea; y antibióticos, prebióticos y probióticos para combatir el sobrecrecimiento bacteriano (9,16,29).
Los tratamientos antidiarreicos más comunes son loperamida, difenoxilato con atropina y opioides (16). La somatostatina y su análogo octreótida se han empleado para reducir las pérdidas en estomas de alto débito mediante la inhibición de las secreciones gástricas, pancreáticas e intestinales (30). Sin embargo, el uso de somatostatina podría limitar el proceso de adaptación y asociarse a colelitiasis (30,31).
Asimismo, se han utilizado factores de crecimiento y otras hormonas tróficas para mejorar la adaptación intestinal (32). La hormona de crecimiento humana recombinante fue el primer medicamento aprobado por la Food and Drug Administration (FDA) con indicación específica en SIC combinado con glutamina y optimización/modificaciones de la dieta. No obstante, su empleo se ha visto limitado por problemas de eficacia y porque su uso solo estaba aprobado a corto plazo (33,34); además, no está aprobado en Europa para esta indicación. En consecuencia, no ha existido un tratamiento trófico a largo plazo específico frente al SIC hasta la aprobación de teduglutida en 2012 (6,7,35).
Teduglutida
La teduglutida es un nuevo principio activo, análogo del péptido-2 similar al glucagón (GLP-2) humano, producido mediante tecnología de ADN recombinante a partir de E. coli. Pertenece al grupo farmacoterapéutico "otros productos para el aparato digestivo y metabolismo" (código ATC A16AX08) (36).
La teduglutida está indicada para el tratamiento del SIC en adultos mayores de 18 años que se encuentren estables tras el periodo de adaptación intestinal posterior a la cirugía. Se trata del primer tratamiento aprobado a largo plazo para adultos con SIC tanto en EE. UU. como en Europa; tiene la categoría de medicamento huérfano. En España se encuentra registrado y autorizado para uso compasivo.
FARMACOCINÉTICA Y FARMACODINAMIA
El GLP-2 es un péptido secretado por las células L intestinales localizadas en el íleon. Identificado por Drucker en 1996 (37), aumenta el flujo sanguíneo portal e intestinal, inhibe la secreción ácida del estómago y reduce la motilidad intestinal (38). Al igual que el GLP-2, la teduglutida tiene una longitud de 33 aminoácidos, aunque con una sustitución de un residuo de alanina por uno de glicina en la segunda posición del extremo N-terminal. La variación de un solo aminoácido con respecto al GLP-2 natural aumenta la resistencia a la degradación in vivo por la dipeptidil peptidasa IV, lo cual prolonga sustancialmente su semivida de unos 7 minutos hasta 3 horas (36,39-41).
En varios estudios preclínicos se ha observado que teduglutida preserva la integridad de la mucosa promoviendo la reparación y el crecimiento normal del intestino mediante un aumento de la longitud de las vellosidades intestinales y de la profundidad de las criptas (36,42-44). Teduglutida se une a los receptores GLP-2 presentes en subpoblaciones intestinales de células enteroendocrinas, miofibroblastos subepiteliales y neuronas entéricas del plexo submucoso y mientérico (38). La activación de estos receptores provoca la liberación local de numerosos mediadores, incluido el factor de crecimiento similar a la insulina tipo 1, el óxido nítrico y el factor de crecimiento de queratinocitos (38).
La teduglutida presenta una elevada biodisponibilidad cuando se administra por vía subcutánea (s.c.). Se elimina por vía renal (7) y su semivida es de aproximadamente 2 horas. Tras administración intravenosa, el aclaramiento plasmático de la teduglutida es de unos 127 ml/h/kg, lo cual equivale a su velocidad de filtración glomerular (36).
La velocidad y el grado de absorción de la teduglutida son proporcionales a la dosis, tanto en dosis única como en dosis repetidas de hasta 20 mg por vía s.c. No se observa acumulación de teduglutida tras la administración de dosis repetidas en voluntarios sanos (36,40).
POSOLOGÍA Y MODO DE ADMINISTRACIÓN
Según los estudios en fase III realizados, la dosis recomendada en adultos es de 0,05 mg/kg de peso corporal una vez al día. Antes del comienzo del tratamiento se deben optimizar y estabilizar el fluido intravenoso y el aporte nutricional. Debido a la heterogeneidad de la población con SIC, en algunos pacientes la dosis diaria deberá disminuirse de forma monitorizada con el fin de optimizar la tolerancia (36).
La teduglutida se presenta como polvo y disolvente para solución inyectable por vía s.c. Una vez reconstituido, cada vial contiene 5 mg en 0,5 ml de disolución (concentración de 10 mg/ml); debe administrarse por inyección 1 vez/día alternando los cuatro cuadrantes del abdomen. También se puede administrar en el muslo (36).
Teduglutida no debe administrarse a pacientes con neoplasia maligna posible o activa, ni a pacientes con antecedentes de neoplasia maligna en el tracto gastrointestinal, incluido el sistema hepatobiliar, en los últimos 5 años (36).
EFICACIA
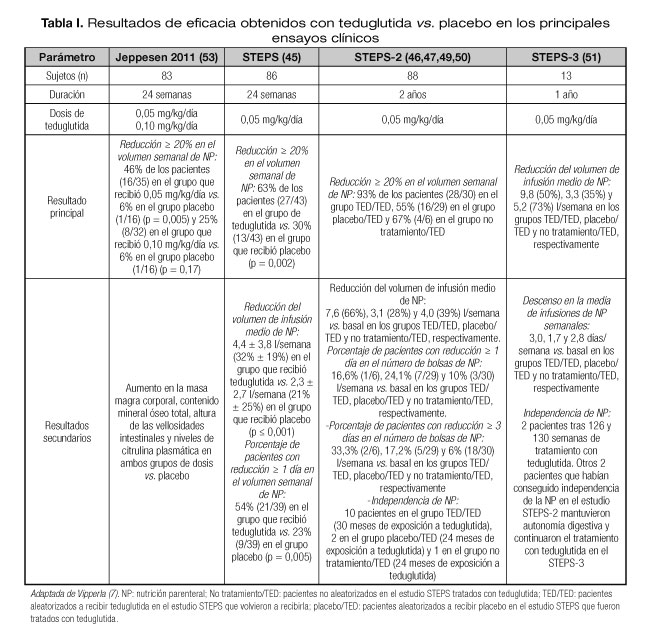
Los objetivos de eficacia alcanzados con teduglutida vs. placebo en los principales ensayos clínicos se resumen en la tabla I. En estos estudios el objetivo de respuesta consistió en disminuir en al menos un 20% el volumen de NP. Si un paciente recibiera NP durante 5 días a la semana, esto equivaldría a reducir en un día el número de infusiones semanales.
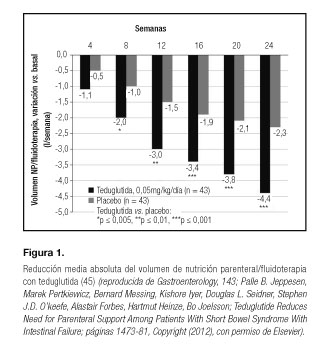
La aprobación de teduglutida se basó en los resultados de un estudio en fase III de 24 semanas, doble ciego, controlado con placebo (STEPS) (45). Pacientes con fallo intestinal por SIC dependientes de NP al menos 3 veces/semana durante ≥ 12 meses recibieron 0,05 mg/kg de teduglutida (n = 43) o placebo (n = 43) 1 vez/día durante 24 semanas. Los pacientes habían superado un periodo de optimización y posterior estabilización para establecer con precisión los valores basales de necesidades de líquidos (ingesta oral y NP) y la producción de orina (1-2 l/día), así como para asegurar una hidratación adecuada (45). El criterio de valoración principal fue la tasa de respondedores, definida como la proporción de pacientes que consiguieron una reducción ≥ 20% en el volumen de NP en la semana 20 frente al valor basal y que mantuvieron dicha respuesta en la semana 24 (45). El volumen de NP se redujo en un 10-30% cuando el volumen de orina de 48 horas superó en ≥ 10% al de la visita previa.
El volumen de NP se redujo con teduglutida (45) (Fig. 1, Tabla I) y dicha mejoría se mantuvo a largo plazo (46-48). En la semana 24 hubo significativamente más respondedores en el grupo de teduglutida que en el de placebo (63 vs. 30%; p = 0,002) (45). La reducción absoluta media frente al valor basal del volumen de NP en la semana 24 fue significativamente mayor con teduglutida frente a placebo (4,4 vs. 2,3 l/semana; p < 0,001); los valores basales de NP fueron de 12,9 y 13,2 l/semana, respectivamente. El incremento en la absorción se observó desde las primeras semanas de tratamiento con teduglutida. La diferencia entre grupos en el descenso absoluto del volumen de NP frente al valor basal favoreció a teduglutida desde la semana 4, y fue estadísticamente significativa desde la semana 8 (p = 0,011) hasta la 24. La necesidad semanal de NP se redujo en al menos 1 día en la semana 24 en el 53,8% de los pacientes en el grupo de teduglutida frente al 23% en el grupo placebo (Fig. 2).
En la extensión abierta del estudio STEPS (STEPS-2), todos los pacientes continuaron el tratamiento con teduglutida (o fueron cambiados a él). Se incluyó a algunos pacientes que habían completado las fases de optimización de fluidos y estabilización del estudio STEPS pero que no habían recibido el tratamiento aleatorizado (46,47,49,50). Durante los 2 años adicionales de tratamiento en el estudio STEPS-2 (n = 88), la mayoría de los pacientes alcanzaron o mantuvieron respuestas importantes con la teduglutida. Entre aquellos que recibieron teduglutida durante más tiempo (hasta 30 meses), incluido el estudio controlado con placebo y la extensión (n = 30 pacientes), el volumen de NP se redujo en un 20-100% en el 93% de los pacientes, con una reducción media de 7,6 l/semana (66%) vs. basal (46,47,49,50). La necesidad de NP se redujo en al menos 1 día/semana en 11 pacientes y 10 alcanzaron una independencia completa (Tabla I).
El estudio STEPS-3 (51) fue una extensión abierta de un año en el que 13 pacientes que completaron los estudios STEPS o STEPS-2 recibieron 0,05 mg/kg/d de teduglutida y mantuvieron los resultados de eficacia a largo plazo (Tabla I).
Del total de pacientes que recibieron teduglutida en los ensayos en fase III (n = 134), 16 (12%) consiguieron una autonomía completa de la NP (46,47,52). Trece de los pacientes con SIC que lograron la independencia del NP/fluidoterapia participaron en el estudio STEPS-2 y representan el 15% (13/88) de la población por intención de tratar y el 20% de la población por protocolo (13/65), respectivamente (49). Esta independencia se alcanzó tras un intervalo de 12-130 semanas de tratamiento con teduglutida, lo cual sugiere que el beneficio podría ser mayor con el tratamiento a largo plazo.
SEGURIDAD
Por lo general, la administración s.c. de teduglutida 0,05 mg/kg/día se toleró bien en los ensayos clínicos, incluidos periodos de tratamiento de hasta 30 meses (45-47,49,53,54). Los efectos secundarios más frecuentes fueron gastrointestinales, incluido dolor abdominal, náuseas, distensión abdominal y modificaciones del estoma (Fig. 3).
En el ensayo STEPS de 24 semanas se observaron efectos adversos en el 83% de los pacientes (35/42) en el grupo de teduglutida, frente al 79% (34/43) de los que recibieron placebo (45), siendo graves en el 36% frente al 28%, respectivamente. Dos de ellos se consideraron relacionados con teduglutida, un caso de colecistitis aguda y otro de estenosis del intestino delgado; aunque ambos se resolvieron. El tratamiento se interrumpió debido a efectos adversos en el 5% y el 7% de los pacientes que recibieron teduglutida y placebo, respectivamente (45).
Tal y como ocurre con los medicamentos que contienen péptidos, es posible que la administración de teduglutida desencadene la síntesis de anticuerpos. En estudios de fase III en pacientes que recibieron teduglutida durante un máximo de un año, el 30% desarrolló anticuerpos frente a teduglutida y el 40% frente a proteínas de E. coli. La formación de anticuerpos no se ha asociado a hallazgos de seguridad clínicamente relevantes, ni a una menor eficacia o cambios en la farmacocinética de teduglutida (36).
En el ensayo STEPS y en su extensión a largo plazo, un 52% de los pacientes experimentaron efectos adversos que se consideraron relacionados con el tratamiento (46,47). Los más frecuentes durante los 30 meses de tratamiento fueron dolor abdominal (34%), sepsis asociada al catéter (28%) y pérdida de peso (25%). Un 11% de los pacientes interrumpió el tratamiento debido a efectos adversos relacionados con él. Ocurrieron 3 fallecimientos, de los que uno, debido a un adenocarcinoma metastásico de origen primario desconocido, se consideró posiblemente relacionado con el tratamiento (46,47). De ahí las recomendaciones recogidas en ficha técnica de no administrar teduglutida a pacientes con antecedentes o presencia de neoplasia maligna.
PERFIL DEL PACIENTE SUSCEPTIBLE DE SER TRATADO CON TEDUGLUTIDA
Los pacientes incluidos en el mayor ensayo completado con teduglutida habían dependido de NP/fluidoterapia (≥ 3 veces/semana) durante al menos 12 meses seguidos y tenían un índice de masa corporal > 15 kg/m2 (2,45). No obstante, dado que los criterios de selección de pacientes en ensayos clínicos no siempre se aplican a los candidatos reales, se necesita cierta orientación clínica para establecer la idoneidad del paciente que puede ser tratado con teduglutida.
Entre las consideraciones sobre el paciente idóneo para ser tratado con teduglutida (Tabla II) se encuentran: a) que sea clínicamente estable, con enfermedad no obstructiva y no maligna; b) que tenga necesidad persistente de NP/fluidoterapia a pesar del tratamiento optimizado (incluidas modificaciones dietéticas e intervenciones farmacológicas); c) que esté optimizado nutricional e hidroelectrolíticamente; d) que desee reducir o interrumpir la NP/fluidoterapia; y e) que esté dispuesto a administrarse diariamente la medicación por vía s.c. (16,45).
No se han identificado características del paciente que permitan anticipar la respuesta a la teduglutida; sus beneficios se han observado en pacientes con diferencias en cuanto a rasgos de la enfermedad y anatomía del intestino remanente (46,47). Así, el tratamiento con teduglutida fue beneficioso con independencia de la longitud del intestino remanente y de la continuidad o no del colon, según un reciente subanálisis de datos a las 24 semanas del estudio STEP (n = 40) (48). Del mismo modo, no se han hallado factores predictivos de respuesta que identifiquen a los pacientes tratados con teduglutida que pueden llegar a ser autónomos de la NP. En cualquier caso, aunque el número de pacientes fue insuficiente para determinar factores predictivos de independencia de la NP, al analizar los datos de todos los ensayos en fase III (n = 134) la mayoría de los que lo consiguieron tenían colon en continuidad (12/16) y/o menores requisitos basales de NP (< 7 l/semana) (11/16) (47).
Se dispone de poca información sobre cuál es el momento óptimo para recibir teduglutida tras la resección quirúrgica (16). Tampoco se ha determinado la duración de su efecto una vez se suspende el tratamiento. Existen indicios de que, cuando se interrumpe la teduglutida, algunos pacientes requieren aumentos de NP casi inmediatos, mientras que otros pueden mantenerla reducida hasta 1 año (45).
El grupo de pacientes que más podría beneficiarse del tratamiento con teduglutida es aquel dependiente de NP sin accesos venosos o con dificultad de acceso venoso, pacientes con riesgo de mala tolerancia a volúmenes de infusión elevados, aquellos que no cumplan criterios de NP o que tengan una mala evolución con esta, pacientes en proceso de conseguir la independencia de la NP, o bien aquellos más jóvenes que suelen mostrar una mayor capacidad de rehabilitación intestinal.
Conclusiones
Aunque la NP a largo plazo aumenta la supervivencia de pacientes con fallo intestinal, es un tratamiento que puede asociarse a complicaciones graves como sepsis asociada al catéter, oclusiones venosas e insuficiencia hepática, con un deterioro importante de la calidad de vida de los pacientes con SIC.
La teduglutida es un análogo del GLP-2 que pertenece a una nueva familia terapéutica y representa el primer abordaje terapéutico no sintomático para el SIC. En los ensayos clínicos realizados hasta la fecha se ha demostrado que recupera la función de absorción intestinal y que reduce significativamente la dependencia de la NP (en al menos un 20% del volumen semanal), consiguiendo incluso la independencia total en algunos pacientes.
Bibliografía
1. Pironi L, Arends J, Baxter J, Bozzetti F, Peláez RB, Cuerda C, et al. Home Artificial Nutrition & Chronic Intestinal Failure; Acute Intestinal Failure Special Interest Groups of ESPEN. ESPEN endorsed recommendations. Definition and classification of intestinal failure in adults. Clin Nutr 2015;34(2):171-80. [ Links ]
2. O'Keefe SJ, Buchman AL, Fishbein TM, Jeejeebhoy KN, Jeppesen PB, Shaffer J. Short bowel syndrome and intestinal failure: consensus definitions and overview. Clin Gastroenterol Hepatol 2006;4(1):6-10. [ Links ]
3. Misiakos EP, Macheras A, Kapetanakis T, Liakakos T. Short bowel syndrome: current medical and surgical trends. J Clin Gastroenterol 2007;41(1):5-18. [ Links ]
4. Nightingale J, Woodward JM. Guidelines for management of patients with a short bowel. Gut 2006;55(Supl. 4):iv1-12. [ Links ]
5. Drozdowski LA, Clandinin MT, Thomson AB. Morphological, kinetic, membrane biochemical and genetic aspects of intestinal enteroplasticity. World J Gastroenterol 2009;15(7):774-87. [ Links ]
6. Tappenden KA. Pathophysiology of Short Bowel Syndrome: Considerations of Resected and Residual Anatomy. JPEN J Parenter Enteral Nutr 2014;38(Supl. 1):S14-S22. [ Links ]
7. Vipperla K, O'Keefe SJ. Targeted therapy of short-bowel syndrome with teduglutide: the new kid on the block. Clin Exp Gastroenterol 2014;7:489-95. [ Links ]
8. Amiot A, Messing B, Corcos O, Panis Y, Joly F. Determinants of home parenteral nutrition dependence and survival of 268 patients with nonmalignant short bowel syndrome. Clin Nutr 2013;32:368-74. [ Links ]
9. DiBaise JK. Management of the short bowel syndrome. In: DeLegge MH, editors. Nutrition and Gastrointestinal Disease. Totowa, NJ: Humana Press; 2007. p. 177-204. [ Links ]
10. North American Home Parenteral Nutrition and Enteral Nutrition Patient Registry Annual Report. Albany, NY: Oley Foundation; 1994. [ Links ]
11. Bakker H, Bozzetti F, Staun M, Leon-Sanz M, Hebuterne X, Pertkiewicz M, et al. Home parenteral nutrition in adults: a european multicentre survey in 1997. ESPEN-Home Artificial Nutrition Working Group. Clin Nutr 1999;18(3):135-40. [ Links ]
12. Jeppesen PB. Spectrum of Short Bowel Syndrome in Adults: Intestinal Insufficiency to Intestinal Failure. JPEN J Parenter Enteral Nutr 2014;38(Supl. 1):S8-S13. [ Links ]
13. Pironi L, Hebuterne X, Van Gossum A, Messing B, Lyszkowska M, Colomb V, et al. Candidates for intestinal transplantation: a multicenter survey in Europe. Am J Gastroenterol 2006;101:1633-43; quiz 1679. [ Links ]
14. Juana-Roa J, Wanden-Berghe C, Sanz-Valero J. La realidad de la nutrición parenteral domiciliaria en España. Nutr Hosp 2011;26(2):364-8. [ Links ]
15. Wanden-Berghe C, Cuerda C, Burgos R, Gómez C, Virgili N, Pérez de la Cruz A, et al. A home and ambulatory artificial nutrition (NADYA) Group Report, Home Parenteral Nutrition in Spain, 2013. Nutr Hosp 2015;31(6):2533-8. [ Links ]
16. Seidner DL, Schwartz LK, Winkler MF, Jeejeebhoy K, Boullata JI, Tappenden KA. Increased intestinal absorption in the era of teduglutide and its impact on management strategies in patients with short bowel syndrome-associated intestinal failure. JPEN J Parenter Enteral Nutr 2013;37(2):201-11. [ Links ]
17. Winkler MF, Smith CE. Clinical, Social, and Economic Impacts of Home Parenteral Nutrition Dependence in Short Bowel Syndrome. JPEN J Parenter Enter Nutr 2014;38(Supl. 1):S32-S37. [ Links ]
18. Van Gossum A, Cabre E, Hebuterne X, Jeppesen P, Krznaric Z, Messing B, et al. ESPEN guidelines on parenteral nutrition: gastroenterology. Clin Nutr 2009;28:415-27. [ Links ]
19. Grupo de Trabajo de Nutrición Artificial Domiciliaria y Ambulatoria (NADYA) Guía de Práctica Clínica de Nutrición Parenteral Domiciliaria. Nutr Hosp Supl 2009;2(1):1-36. [ Links ]
20. Matarese LE. Nutrition and fluid optimization for patients with short bowel syndrome. JPEN J Parenter Enteral Nutr 2013;37(2):161-70. [ Links ]
21. Sundaram A, Koutkia P, Apovian CM. Nutritional management of short bowel syndrome in adults. J Clin Gastroenterol 2002;34:207-20. [ Links ]
22. Messing B, Crenn P, Beau P, Boutron MC, Rambaud JC, Matuchansky C. Long-term survival and parenteral nutrition-dependency of adult patients with nonmalignant short bowel. Transplant Proc 1998;30(6):2548. [ Links ]
23. Jeppesen PB. Pharmacologic Options for Intestinal Rehabilitation in Patients With Short Bowel Syndrome. JPEN J Parenter Enteral Nutr 2014;38(Supl. 1):S45-S52. [ Links ]
24. Burness CB, McCormack PL. Teduglutide: A Review of its Use in the Treatment of Patients with Short Bowel Syndrome. Drugs 2013;73(9):935-47. [ Links ]
25. Gillanders L, Angstmann K, Ball P, O'Callaghan M, Thomson A, Wong T, et al. A prospective study of catheter-related complications in HPN patients. Clin Nutr 2012;31:30-4. [ Links ]
26. Metzger LC. Education materials for home nutrition support consumers. Nutr Clin Pract 2010;25:451-70. [ Links ]
27. Buchman AL. Complications of long-term home total parenteral nutrition their identification, prevention and treatment. Dig Dis Sci 2001;46:1-18. [ Links ]
28. Pironi L, Joly F, Forbes A, Colomb V, Lyszkowska M, Baxter J, et al. Long-term follow-up of patients on home parenteral nutrition in Europe: implications for intestinal transplantation. Gut 2011;60(1):17-25. [ Links ]
29. Kumpf VJ. Pharmacologic management of diarrhea in patients with short bowel syndrome. JPEN J Parenter Enteral Nutr 2014;38(Supl. 1):S38-S44. [ Links ]
30. DiBaise JK, Young RJ, Vanderhoof JA. Intestinal rehabilitation and the short bowel syndrome: part 2. Am J Gastroenterol 2004;99:1823-32. [ Links ]
31. O'Keefe SJ, Haymond MW, Bennet WM, Oswald B, Nelson DK, Shorter RG. Long-acting somatostatin analogue therapy and protein metabolism in patients with jejunostomies. Gastroenterol 1994;107(2):379-88. [ Links ]
32. McMellen ME, Wakeman D, Longshore SW, McDuffie LA, Warner BW. Growth factors: possible roles for clinical management of the short bowel syndrome. Semin Pediatr Surg 2010;19(1):35-43. [ Links ]
33. Steiger E. Guidelines for pharmacotherapy, nutritional management, and weaning parenteral nutrition in adult patients with short bowel syndrome: introduction. J Clin Gastroenterol 2006;40(Supl. 2):S73-S74. [ Links ]
34. Food and Drug Administration. FDA briefing information for the 16 October 2012 meeting of the GastroIntestinal Drugs Advisory Committee 2012. Disponible en: http://www.fda.gov/downloads/AdvisoryCommittees/CommitteesMeetingMaterials/Drugs/GastrointestinalDrugsAdvisoryCommittee/UCM323504.pdf. Último acceso febrero 2016. [ Links ]
35. Wales PW, Nasr A, de Silva N, Yamada J. Human growth hormone and glutamine for patients with short bowel syndrome. Cochrane Database Syst Rev 2010;(6):CD006321. [ Links ]
36. European Medicines Agency. Revestive (teduglutide): summary of product characteristics 2012. Available at: http://www.ema.europa.eu/ema/?curl=pages/medicines/human/medicines/002345/human_med_001583.jsp&mid=WC0b01ac058001d124. Último acceso febrero 2016. [ Links ]
37. Drucker DJ, Erlich P, Asa SL, Brubaker PL. Induction of intestinal epithelial proliferation by glucagon-like peptide 2. Proc Natl Acad Sci USA 1996;93(15):7911-6. [ Links ]
38. Wallis K, Walters JRF, Gabe S. Short bowel syndrome: the role of GLP-2 on improving outcome. Curr Opin Clin Nutr Metab Care 2009;12(5):526-32. [ Links ]
39. Yazbeck R, Howarth GS, Abbott CA. Growth factor based therapies and intestinal disease: is glucagon-like peptide-2 the new way forward? Cytokine Growth Factor Rev 2009;20(2):175-84. [ Links ]
40. Marier JF, Beliveau M, Mouksassi MS, Shaw P, Cyran J, Kesavan J, et al. Pharmacokinetics, safety, and tolerability of teduglutide, a glucagon-like peptide-2 (GLP-2) analog, following multiple ascending subcutaneous administrations in healthy subjects. J Clin Pharmacol 2008;48(11):1289-99. [ Links ]
41. Marier J-F, Mouksassi M-S, Gosselin NH, Beliveau M, Cyran J, Wallens J. Population pharmacokinetics of teduglutide following repeated subcutaneous administrations in healthy participants and in patients with short bowel syndrome and Crohn's disease. J Clin Pharmacol 2010;50(1):36-49. [ Links ]
42. Brubaker PL, Izzo A, Hill M, Drucker DJ. Intestinal function in mice with small bowel growth induced by glucagon-like peptide-2. Am J Physiol 1997;272:E1050-8. [ Links ]
43. Wojdemann M, Wettergren A, Hartmann B, Holst JJ. Glucagon-like peptide-2 inhibits centrally induced antral motility in pigs. Scand J Gastroenterol 1998;33:828-32. [ Links ]
44. Baldassano S, Liu S, Qu MH, Mule F, Wood JD. Glucagon-like peptide-2 modulates neurally evoked mucosal chloride secretion in guinea pig small intestine in vitro. Am J Physiol Gastrointest Liver Physiol 2009;297:G800-G805. [ Links ]
45. Jeppesen PB, Pertkiewicz M, Messing B, Iyer K, Seidner DL, O'keefe SJ, et al. Teduglutide reduces need for parenteral support among patients with short bowel syndrome with intestinal failure. Gastroenterol 2012; 143:1473-81. [ Links ]
46. Jeppesen PB, Fujioka K, Youssef NN, O'Keefe SJ. Long-term safety and efficacy of teduglutide treatment for intestinal failure associated with short bowel syndrome (SBS-IF): final results of a 2-year, multicenter, open-label, clinical trial (abstract no. PP101 plus poster). En: The European Society for Clinical Nutrition and Metabolism. 2014. [ Links ]
47. Jeppesen PB, Boullata JI, Ziegler TR, Pape U, Iyer K, Kunecki M, et al. Independence from parenteral support achieved with teduglutide treatment in patients with intestinal failure associated with short bowel syndrome. En: The European Society for Clinical Nutrition adn Metabolism 2014 (abstract no. 131 plus poster). [ Links ]
48. Fujioka K, Schneider S, Nader NY, Youssef NN, Pape UF, Jeejeebhoy K. Teduglutide reduces the need for parenteral support in patients with short bowel syndrome who have ultra-short remnant bowel and/or no colon in continuity. In: Poster presented at the American Society for Parenteral and Enteral Nutrition: Clinical Nutrition Week 2015 (poster M-41). [ Links ]
49. Schwartz LK, O'Keefe S, Jeppesen P, Pertkiewicz M, Youssef N, Fujioka K. Long-Term Safety and Efficacy of Teduglutide for the Treatment of Intestinal Failure Associated With Short Bowel Syndrome: Final Results of the STEPS-2 Study, a 2-Year, Multicenter, Open-Label Clinical Trial. Poster presented at the American College of Gastroenterology 2013 Annual Scientific Meeting, 11-16 October 2013; San Diego, CA. Am J Gastroenterol 2013;108(Supl. 1):S101. [ Links ]
50. Fujioka K, Pertkiewicz M, Gabe SM, Youssef NN, Jeppesen PB. Final results of STEPS-2, a 2-year, multicenter, open-label clinical trial: safety and efficacy of long-term teduglutide 0.05-mg/kg/day treatment for intestinal failure associated with short bowel syndrome. Oral presentation at the American Society for Parenteral and Enteral Nutrition, Clinical Nutrition Week 2014; January 18-21, 2014; Savannah, GA. [ Links ]
51. Iyer K, Fujioka K, Boullata JI, Ziegler TR, Youssef NN, Seidner D. Long-term safety and efficacy with teduglutide treatment in patients with intestinal failure associated with short bowel syndrome (SBS-IF): The STEPS-3 study. Clin Nutr 2014;33(Supl.1):S167-S168. [ Links ]
52. McKeage K. Teduglutide: A Guide to Its Use in Short Bowel Syndrome Clin Drug Investig 2015;35(5):335-40. [ Links ]
53. Jeppesen PB, Gilroy R, Pertkiewicz M, Allard JP, Messing B, O'Keefe SJ. Randomised placebo-controlled trial of teduglutide in reducing parenteral nutrition and/or intravenous fluid requirements in patients with short bowel syndrome. Gut 2011;60(7):902-14. [ Links ]
54. O'Keefe JD, Jeppesen PB, Gilroy R Pertkiewicz M, Allard JP, Messing B. Safety and Efficacy of Teduglutide After 52 Weeks of Treatment in Patients With Short Bowel Intestinal Failure. Clin Gastroenterol Hepatol 2013;11:815-23. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Rosa Burgos Peláez.
Unidad de Soporte Nutricional.
Hospital Universitario Vall d'Hebron.
Passeig de la Vall d'Hebron, 119-129.
08035 Barcelona
e-mail: rburgos@vhebron.net
Recibido: 24/02/2016
Aceptado: 09/03/2016