INTRODUCCIÓN
La nutrición parenteral total (NPT) es una terapia nutricional que permite mantener el estado nutricional en aquellos pacientes que no pueden cubrir sus requerimientos nutricionales por vía oral/enteral al no poder utilizar con total seguridad el tracto gastrointestinal 1. Este tipo de soporte nutricional puede asociarse con el desarrollo de complicaciones metabólicas debidas principalmente a las características y a la cantidad de nutrientes administrados y/o al tipo de paciente candidato a recibir este tratamiento nutricional 2. Habitualmente, los pacientes con indicación de NPT suelen presentar un proceso inflamatorio agudo que genera un estado catabólico en el cual queda comprometido el metabolismo proteico, lipídico y de los hidratos de carbono 3.
La hipertrigliceridemia es una frecuente complicación metabólica relacionada con la administración de la NPT cuya incidencia se encuentra entre el 6% y el 60% de los casos 4,5. Aunque no existe un consenso universal para definir esta situación metabólica, la mayor parte de los autores consideran la existencia de hipertrigliceridemia asociada a la NPT cuando los valores plasmáticos de triglicéridos son superiores a 200 mg/dl 4,6,7.
A pesar de que en la actualidad no ha sido establecida cuál es la relevancia clínica de la hipertrigliceridemia, existe una evidencia creciente que demuestra que esta complicación metabólica puede asociarse con un aumento de la morbilidad por complicaciones infecciosas y prolongar la estancia hospitalaria 6.
La etiología de la hipertrigliceridemia es compleja y multifactorial y estaría relacionada con una alteración del aclaramiento plasmático de los lípidos, bien por un aporte excesivo de grasa o glucosa en la NPT o bien por una disminución de la actividad de la lipoproteinlipasa (LPL) 8. Se han descrito diferentes factores de riesgo asociados con el desarrollo de hipertrigliceridemia entre los que cabe destacar la sepsis, la insuficiencia renal, la pancreatitis, la hiperglucemia, la obesidad y la administración de ciertos fármacos como el propofol, la heparina y los corticoides 9,10,11.
La composición de los ácidos grasos presentes en la emulsión lipídica también podría influir en la etiopatogenia de la hipertrigliceridemia. Se ha observado que las emulsiones lipídicas que contienen ácidos grasos poliinsaturados (PUFA) omega-3 poseen un aclaramiento plasmático lipídico más rápido que el aceite de soja, de oliva o la mezcla LCT/MCT 12. Algunos autores han documentado que la sustitución o la adición de aceite de pescado rico en PUFA omega-3 en la emulsión lipídica puede asociarse con una reducción de los niveles plasmáticos de triglicéridos fundamentalmente en niños que reciben NPT a largo plazo 13,14,15. Se han encontrado resultados contradictorios con respecto a la implicación de estas emulsiones lipídicas enriquecidas en aceite de pescado en el perfil lipídico de los pacientes adultos que reciben NPT a corto plazo 16,17,18.
El objetivo de nuestro trabajo fue determinar los factores predictores de hipertrigliceridemia en pacientes adultos hospitalizados no críticos que reciben NPT a corto plazo y evaluar el efecto que ejerce una emulsión lipídica enriquecida con ácidos grasos omega-3 en la hipertrigliceridemia asociada a la NPT.
MATERIAL Y MÉTODOS
DISEÑO DEL ESTUDIO
Se realizó un estudio observacional de cohortes retrospectivo en el cual fueron analizados pacientes ingresados en un hospital de tercer nivel que recibieron NPT durante el periodo de junio de 2012 hasta febrero de 2014. Se incluyó a pacientes mayores de 18 años con incapacidad para cubrir sus requerimientos nutricionales por vía oral y/o enteral y que precisaron NPT durante al menos una semana. Se consideraron criterios de exclusión los pacientes críticos hospitalizados en la Unidad de Cuidados Intensivos, el embarazo y la administración concomitante de nutrición enteral.
SOPORTE NUTRICIONAL
La NPT estaba compuesta por una mezcla ternaria de macronutrientes junto con vitaminas, minerales y oligoelementos. El único fármaco que se aditivó a la bolsa fue la insulina. La NPT se infundió a través de un catéter venoso central a un ritmo constante, controlado mediante una bomba de perfusión, durante 24 horas.
El aporte calórico suministrado fue de 25-30 kcal/kg/día con unos requerimientos proteicos de 1,1-1,5 proteínas/kg y una ratio hidratos de carbono/grasas desde 70/30 hasta 60/40. La NPT fue prescrita de forma individualizada para cada paciente y su composición se modificó de acuerdo a la situación clínica y a los parámetros de laboratorio.
Las bolsas de NPT fueron elaboradas y suministradas por el servicio Nutriservice(r) del laboratorio B. Braun y en la campana de flujo laminar del Servicio de Farmacia del hospital se aditivaron diariamente las vitaminas y los oligoelementos.
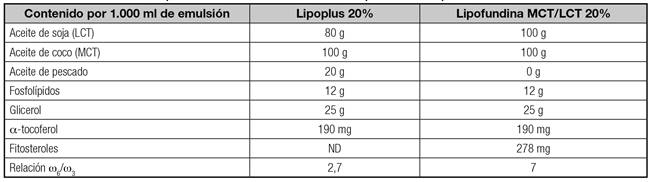
Todos los pacientes recibieron los mismos productos usados en su elaboración: glucosa a diferentes concentraciones, una solución de aminoácidos de estrés (Aminoplasmal PO), vitaminas (Cernevit; Baxter Clintec, Maurepas, France) y oligoelementos (Addamel; Fresenius Kabi, Halden, Noruega). Las emulsiones lipídicas infundidas fueron una mezcla al 50% de LCT y MCT (Lipofundina LCT/MCT 20%) o una mezcla basada en el 50% de MCT, 40% de LCT y 10% de aceite de pescado omega-3 (Lipoplus 20%). La composición de ambas emulsiones lipídicas se describe en la tabla I. La indicación del tipo de emulsión lipídica dependió de la duración prevista de la NPT y del grado de estrés metabólico. Se empleó la emulsión lipídica enriquecida en omega-3 en aquellos pacientes donde se preveía que la NPT iba a ser infundida durante un periodo prolongado de tiempo o cuando existía una mayor gravedad o severidad de la situación clínica.
VARIABLES CLÍNICAS
Se recogieron las variables edad, sexo, motivo de indicación de la NPT y consumo de fármacos y tóxicos (corticoides, heparina, ciclosporina, tacrolimus, alcohol y tabaco). Así mismo, se analizó la existencia de algunas enfermedades subyacentes: pancreatitis aguda, insuficiencia renal (filtrado glomerular < 60 ml/min), fístula enterocutánea de alto débito (pérdidas digestivas superiores a 500 ml/día), diabetes mellitus y obesidad (IMC > 30 kg/m2).
Los pacientes fueron evaluados hasta ser dados de alta del hospital y se registraron la duración de la estancia hospitalaria, las complicaciones infecciosas (bacteriemia por catéter, infección del tracto urinario, neumonía e infección de la herida quirúrgica) y la mortalidad.
VARIABLES NUTRICIONALES
Se analizaron la talla, el peso actual y el peso habitual y se calculó el índice de masa corporal (IMC) con la formula peso/talla2. Se realizó un cribado nutricional mediante el cuestionario Nutritional Screenig Risk (NRS-2002).
Como variables específicas relacionadas con los componentes de la NPT se evaluaron los gramos medios de los tres macronutrientes, así como el aporte calórico total. Estos valores medios se calcularon en relación al peso y se analizaron como gglucosa/kg/día, glípidos/kg/día, gn2/kg/día y kcal/kg/día. También se evaluó el tipo de grasas infundidas (LCT/MCT o LCT/MCT/omega-3).
Se clasificó el aporte calórico de la bolsa de NPT como alto o bajo en kcal/kg (con un punto de corte en 27), alto o bajo en lípidos (con un punto de corte en 0,9 g/kg) y alto o bajo en HC (con un punto de corte en 3,1 g/kg). La duración de la infusión de la NPT se consideró prolongada cuando superó los once días. Se seleccionaron estos valores por aproximarse a las medianas de la distribución de la muestra de los pacientes incluidos en el estudio.
VARIABLES BIOQUÍMICAS
En todos los pacientes se realizó una extracción de una muestra de sangre venosa antes del inicio de la NPT y semanalmente hasta que la NPT fue retirada. Las muestras fueron recogidas a las 8:00 a.m., sin detener la NPT durante el periodo nocturno. Los principales parámetros bioquímicos plasmáticos determinados fueron: triglicéridos, colesterol total, LDL-colesterol (que se calculó mediante la fórmula de Friedwald cuando los triglicéridos fueron inferiores a 400 mg/dl [LDLc = colesterol total - triglicéridos/5 - HDLc]), HDL-colesterol, glucosa, HbA1c e insulina. Se calculó la resistencia insulínica mediante el índice HOMA (Homeostasis Model Assessment) = glucosa (mg/dl) x insulina (µU/ml)/405.
Otros parámetros analizados fueron el filtrado glomerular (según la formula MDRD4-IDMS), la urea, la creatinina, las enzimas hepáticas, el hemograma, el fibrinógeno y la ferritina. Como marcadores proteicos se determinaron la albúmina, la prealbúmina, la transferrina, las proteínas totales y la proteína C reactiva (PCR) ultrasensible.
VARIABLES DEPENDIENTES
Se consideró hipertrigliceridemia cuando los niveles plasmáticos de triglicéridos fueron superiores a 200 mg/dl al finalizar la infusión de NPT. Se definió incremento de triglicéridos (IT) según la siguiente formula: IT (%) = ([triglicéridos finales-triglicéridos iniciales]/triglicéridos iniciales) x 100.
ANÁLISIS ESTADÍSTICO
Las variables cuantitativas se describieron mediante media y desviación estándar (DE) y las cualitativas, con distribución de frecuencias. Se realizó una trasformación logarítmica de los triglicéridos dada su desviación manifiesta de la normalidad en su distribución. Se compararon las características de los pacientes mediante prueba no paramétrica de Mann-Whitney (cuantitativas) o Chi cuadrado (cualitativas). El análisis del cambio durante el seguimiento en las variables cuantitativas se ejecutó mediante t de Student para datos emparejados y con el test de McNemar en las variables cualitativas.
El riesgo de cada variable sobre la aparición del pronóstico de interés se evaluó mediante regresión logística uni y multivariante. Mediante procedimiento de exclusión secuencial se seleccionaron los mejores modelos predictivos. Se consideraron significativas las asociaciones con p < 0,05. El análisis estadístico de los datos se realizó con el programa SPSS versión 22.0 para Windows.
RESULTADOS
Fueron incluidos 101 pacientes (61,4% varones y 36,8% mujeres) con una edad media de 65 (DE 15) años y un IMC medio de 24,5 (desviación estándar [DE] 4,7) kg/m2. Un 25,7% de los pacientes presentaron diabetes mellitus.
El aporte calórico medio diario administrado en la NPT fue de 26,8 (DE 4) kcal/kg/día, distribuido como 3,1 (DE 0,5) gde glucosa/kg/día, 0,89 (DE 0,18) gde grasas/kg/día y 0,2 (DE 0,03) gde N2/kg/día. Se indicó una emulsión lipídica enriquecida en ácidos grasos omega-3 en el 53,5% de los pacientes. La duración media de la administración de la NPT fue de 14,3 (DE 8) días, con una mediana de once días. En la tabla II se detallan las características demográficas, clínicas y nutricionales de la población estudiada.
Las principales indicaciones de NPT fueron las complicaciones postoperatorias de cirugía mayor abdominal (46%), seguidas de la mucositis asociada a quimioterapia y/o radioterapia (13%) y del preoperatorio en pacientes con desnutrición severa (11%).
La estancia media hospitalaria fue de 39,1 (DE 28,5) días. Cincuenta y seis (57,7%) pacientes desarrollaron complicaciones infecciosas, que estuvieron relacionadas con la herida quirúrgica en 32 casos (32,7%), y diez pacientes (9,9%) fallecieron.
Al finalizar el estudio se constató una incidencia de hipertrigliceridemia del 33,3%. Se observó un incremento significativo en los niveles de triglicéridos entre el inicio y el final de la infusión de NPT (logaritmo triglicéridos 4,89 ± 0,57 vs. 5,1 ± 0,48; p = 0,007), con un incremento porcentual del 37,6%.
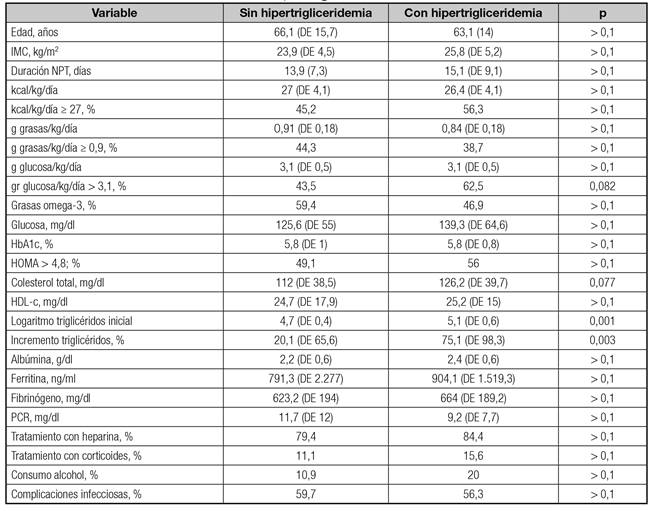
Los pacientes a los que se les objetivo hipertrigliceridemia al final de la administración de NPT se caracterizaron por presentar de forma significativa valores iniciales más elevados de triglicéridos (logaritmo triglicéridos 5,1 ± 0,6 vs. 4,7 ± 0,4; p = 0,001) y un incremento porcentual más marcado en los niveles de triglicéridos (75,1 ± 98,3% vs. 20,1 ± 65,6%; p = 0,003). No se encontraron diferencias significativas en el resto de las variables clínicas, analíticas o en los componentes de la NPT, aunque unos valores iniciales más elevados de colesterol total (126,2 ± 39,7 vs. 112 ± 38,5; p = 0,077) y un aporte superior a 3,1 gde glucosa/kg/día en la bolsa de NPT (62,5% vs. 43,5%; p = 0,082) quedaron en el límite de la significación estadística (Tabla III).
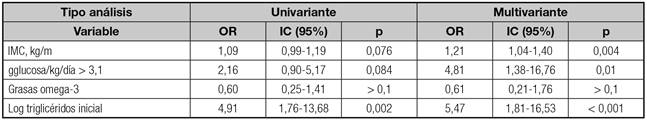
En el análisis univariante, las variables que alcanzaron odds ratios (OR) significativas para el desarrollo de hipertrigliceridemia fueron los valores iniciales de triglicéridos (OR = 4,91; IC 95%: 1,76-13,68; p = 0,002) y el incremento porcentual en los niveles de triglicéridos (OR = 1,009; IC 95%: 1,003-1,015; p = 0,005). El IMC (OR = 1,09; IC 95%: 0,99-1,19; p = 0,076) y un aporte mayor de 3,1 g/kg/día de glucosa en la NPT (OR = 2,16; IC 95%: 0,90-5,15; p = 0,084) quedaron en los límites de la significación estadística. El empleo de la emulsión lipídica enriquecida en omega-3 se asoció de forma no significativa con un menor riesgo de hipertrigliceridemia (OR = 0,60; IC 95%: 0,25-1,41; p > 0,1).
En el análisis multivariante, el mejor modelo (R2 = 0,331) para predecir la aparición de hipertrigliceridemia fue el compuesto (por orden de importancia pronóstica) por las variables valores iniciales de triglicéridos (OR = 5,47; IC 95%: 1,81-16,53; x2 = 12,34; p < 0,001), IMC (OR = 1,21; IC 95%: 1,04-1,40; x2 = 8,31; p = 0,004) y aporte de glucosa en la NPT superior a 3,1 g/kg (OR = 4,81; IC 95%: 1,38-16,76; x2 = 6,71; p = 0,010). La infusión de la emulsión lipídica rica en aceite de pescado se asoció con un descenso no significativo del riesgo de hipertrigliceridemia (OR = 0,61; IC 95%: 0,21-1,76; x2 = 0,81; p > 0,1) (Tabla IV).
Cuando se evaluó la asociación entre el incremento porcentual de triglicéridos y el empleo de ácidos grasos omega-3, y tras ajustar para factores de confusión como IMC y niveles iniciales de triglicéridos, los ácidos grasos omega-3 se asociaron con un incremento de un 11,25% menor de los valores de triglicéridos (b = -11,25; IC 95%: -39,3-16,90; p = 0,43).
DISCUSIÓN
La hipertrigliceridemia es una frecuente complicación metabólica asociada a la administración de NPT 8,19. En nuestro estudio se ha objetivado que la incidencia de hipertrigliceridemia es del 33,3%, situándose en un término medio dentro del amplio rango publicado en la literatura, que oscila entre el 6% y el 60% 4,5,9,20,21. Estas diferencias en la incidencia podrían ser atribuidas a los criterios empleados para definir la hipertrigliceridemia y a las características de los pacientes estudiados.
En un estudio multicéntrico español en el cual se analizó a 260 pacientes a los que se les infundió una NPT durante al menos siete días y se definió la hipertrigliceridemia como unos valores de triglicéridos superiores a 265 mg/dl (3 mmol/l), se observó una incidencia de hipertrigliceridemia del 26,2% 9. Cuando para definir la hipertrigliceridemia se emplea un punto de corte en los niveles plasmáticos de triglicéridos de 200 mg/dl, la incidencia de esta complicación metabólica aumenta, e incluso puede duplicarse. En otro estudio español que incluyó una población de pacientes con un tamaño muestral y unas características demográficas, clínicas y nutricionales muy parecidas a las de nuestro estudio, la incidencia de hipertrigliceridemia duplicó la de nuestro trabajo (60,7%) 4. Por el contrario, Kao y cols. 6, en una muestra más pequeña (66 pacientes) aunque muy similar a la nuestra en cuanto a la composición nutricional y a la duración de la NPT, encontraron una incidencia de hipertrigliceridemia semejante a la de nuestro estudio (31%).
Existen algunos grupos de pacientes que presentan un riesgo más elevado de desarrollar hipertrigliceridemia, como es el caso de los enfermos con fístulas enterocutáneas de alto débito, los pacientes críticos y los enfermos con obesidad, cuya incidencia se encuentra en torno al 35% 22,23. En nuestro trabajo, debido a la limitación del tamaño muestral y al tratarse de una población bastante homogénea, compuesta fundamentalmente por enfermos perioperatorios no críticos de los cuales solo había un 9% de pacientes obesos y un 7% de enfermos con fístulas enterocutáneas, no pudimos realizar un análisis referente al tipo de enfermo.
El principal objetivo de nuestro estudio fue conocer cuáles eran los factores predictores de hipertrigliceridemia asociada a la NPT. Hemos observado que en la aparición de la hipertrigliceridemia está implicada una combinación de factores de riesgo relacionados con algún componente de la NPT y con el enfermo, sobre todo con su situación clínica metabólica. El IMC, los niveles plasmáticos de triglicéridos previos al inicio de la NPT y un aporte de glucosa superior a 3,1 g/kg/día son los principales factores predictores de hipertrigliceridemia.
Uno de los factores de riesgo clásicamente asociados con el desarrollo de hipertrigliceridemia es el elevado aporte calórico en forma de glucosa 24. En los años 80, Meguid y cols. 25 demostraron que la sustitución de un tercio de las calorías procedentes de la glucosa por grasa se asociaba con un descenso significativo de los niveles de triglicéridos. Posteriormente, Tappy y cols. 26 randomizaron a 16 pacientes a recibir una NPT normocalórica normoproteica que contenía un 75% de glucosa frente a una NPT que solo contenía el 15% de glucosa, y observaron una mayor elevación en los niveles plasmáticos de glucosa, insulina y triglicéridos y un mayor incremento de la lipogénesis de novo en los enfermos a los que se les había administrado la NPT que aportaba un 75% de glucosa.
El mecanismo por el cual un excesivo aporte de glucosa causa hipertrigliceridemia parece estar relacionado con una elevación en la secreción de insulina, la cual estimula la síntesis hepática de ácidos grasos, con la consiguiente producción de triglicéridos hepáticos. Por otro lado, la hiperinsulinemia inhibe a la enzima carnitina aciltransferasa, limitando la oxidación mitocondrial de los ácidos grasos. Todo ello conduce a la síntesis y liberación hepática de triglicéridos y VLDL 27,28.
Otro de los componentes de la NPT implicados en el desarrollo de la hipertrigliceridemia son las emulsiones lipídicas, fundamentalmente la dosis y el tipo de ácidos grasos infundidos 19,29. Se ha demostrado que la administración de una dosis lipídica superior a 1,5 g/kg/día se relaciona con la presencia de hipertrigliceridemia 9,30. En nuestro trabajo, un aporte de grasa superior a 0,9 g/kg/día no se asoció con el desarrollo de hipertrigliceridemia, y podría ser considerada una dosis segura para evitar la aparición de esta complicación. Estos resultados concuerdan con una revisión realizada por Miles y cols. 8), en la cual opinan que la hipertrigliceridemia en pacientes con NPT puede ser relativamente controlada limitando el aporte lipídico a 0,7-1,2 g/kg/día.
El tipo de ácidos grasos presentes en la emulsión lipídica también podría influir en la etiopatogenia de la hipertrigliceridemia 18,31,32. En nuestro trabajo hemos observado que enriquecer con un 10% de aceite de pescado la emulsión lipídica LCT/MCT se asocia con un descenso no significativo del riesgo de hipertrigliceridemia.
Aunque en niños que reciben NPT a largo plazo este tipo de emulsión lipídica podría ejercer un efecto beneficioso en la reducción de la hipertrigliceridemia asociada a la NPT 13,14,15, no ocurre lo mismo en los pacientes adultos a los que se les infunde NPT durante un corto periodo de tiempo, en cuyo caso los resultados encontrados son contradictorios. Simoens y cols. 12 compararon la administración durante cinco horas de una emulsión lipídica LCT/MCT/W3 con una emulsión LCT/MCT cuatro días consecutivos en ocho pacientes normolipémicos, y demostraron un aclaramiento plasmático más rápido de los triglicéridos infundidos en el grupo de pacientes que recibieron la mezcla de aceites LCT/MCT/W3. Wichmann y cols. 16 randomizaron a un amplio grupo de pacientes quirúrgicos a recibir durante cinco días una emulsión LCT/MCT/W3 o una emulsión LCT, y observaron unos niveles significativamente más bajos de triglicéridos plasmáticos en el grupo de pacientes a los que se les infundió la emulsión que contenía LCT/MCT/W3. En un metaanálisis publicado por Pradelli y cols. 17, donde analizaron 23 ensayos clínicos que incluían a 1.500 pacientes críticos o con cirugía electiva y comparaban el empleo de una NPT que contenía diferentes emulsiones lipídicas enriquecidas en ácidos grasos omega-3 (LCT/W3, LCT/MCT/W3, LCT/MCT/oliva/W3) con otras emulsiones lipídicas estándar (LCT, LCT/MCT, LCT/oliva), no se encontraron diferencias significativas en los valores de triglicéridos plasmáticos con el empleo de la emulsión enriquecida en omega-3.
Se han descrito otros factores de riesgo que predisponen al desarrollo de hipertrigliceridemia y que no se encuentran directamente relacionados con la NPT, sino que dependen de la situación clínica o metabólica del enfermo o del tratamiento empleado.
Está bien establecida la relación existente entre la obesidad y las alteraciones en el metabolismo lipídico. Kao y cols. 6 analizaron a 66 pacientes adultos que recibieron NPT durante más de siete días y cuya emulsión lipídica era LCT/MCT, la cual aportaba el 25% de las calorías totales, y demostraron una correlación significativa entre los valores iniciales de triglicéridos, el IMC y los niveles de adiponectina con el desarrollo de hipertrigliceridemia. Frazee y cols. 23 evaluaron a 287 pacientes adultos a los que se les infundió una media de 45 gde grasa en la NPT, y observaron que las concentraciones medias de triglicéridos durante la infusión de la NPT eran significativamente más bajas en los pacientes con un IMC < 16 kg/m2 que en aquellos pacientes con un IMC > 16 kg/m2, a pesar de la mayor tasa de infusión lipídica que recibieron los sujetos con un IMC < 16 kg/m2. También documentaron que, tras ajustar por tasa de infusión lipídica, existía una clara correlación entre niveles de triglicéridos e IMC y entre concentraciones de triglicéridos y grasa visceral. Estos mismos autores analizaron a un grupo de pacientes con trasplante de medula ósea y encontraron una correlación entre niveles iniciales de triglicéridos y niveles de triglicéridos durante la infusión de NPT. Por el contrario, en una población de 102 pacientes con fístulas enterocutáneas, Visschers y cols. 22 no encontraron asociación entre IMC e hipertrigliceridemia.
Muy citado ha sido el estudio prospectivo multicéntrico español publicado en 2003 por Llop y cols. 10, en el cual analizaron a 260 pacientes hospitalizados con NPT y documentaron que los niveles plasmáticos de glucosa > 180 mg/dl, la sepsis, la insuficiencia renal, la pancreatitis aguda, la administración de corticoides a dosis superiores a 0,5 mg/kg y el tratamiento con heparina a dosis superiores a 3 mg/kg/día eran factores de riesgo independientes para el desarrollo de hipertrigliceridemia en pacientes que reciben NPT.
En nuestros enfermos no se ha constatado una asociación entre las diferentes variables relacionadas con el metabolismo de los hidratos de carbono (glucemia, insulina, HbA1c, insulinorresistencia) o los marcadores indicadores de inflamación y la presencia de hipertrigliceridemia.
Entre las limitaciones de nuestro trabajo cabe destacar que, debido a la limitación del tamaño muestral, no se pudieron analizar otras situaciones clínicas ni el tratamiento farmacológico, ya que el número de pacientes con pancreatitis, insuficiencia renal, fístulas enterocutáneas y tratamiento con corticoides era escaso.
En conclusión, nuestros resultados demuestran que la incidencia de hipertrigliceridemia en pacientes adultos hospitalizados no críticos que reciben NPT es elevada. Esta complicación está más relacionada con la situación clínica metabólica del paciente que con la cantidad de lípidos infundidos en la NPT, aunque parece necesario un control estricto del aporte calórico proveniente de los hidratos de carbono. La administración a corto plazo de una emulsión lipídica enriquecida en PUFA omega-3 es segura, aunque no ejerció un efecto protector significativo sobre el riesgo de aparición de hipertrigliceridemia.