INTRODUCCIÓN
Los niños que necesitan nutrición parenteral (NP) constituyen un grupo heterogéneo tanto por la enfermedad de base que presentan como por su edad, ya que esta última determina las características fisiológicas y los requerimientos para el crecimiento. Todo ello influye de manera decisiva en la composición de la NP.
En el año 2007, el grupo de Estandarización y Protocolos de la Sociedad Española de Nutrición Parenteral y Enteral (SENPE) publicó el "Documento de consenso SENPE/SEGHNP/SEFH sobre nutrición parenteral pediátrica" 1, planteándose en la actualidad su revisión y puesta al día.
Para ello, se ha realizado una revisión pormenorizada de la literatura buscando las evidencias que nos permiten elaborar una Guía de Práctica Clínica siguiendo los criterios del Oxford Centre for Evidence-Based Medicine 2. El texto completo se publicará en un número monográfico de Nutrición Hospitalaria y este artículo constituye la versión corta de la Guía.
INDICACIONES
La NP puede ser utilizada en todo niño desnutrido o con riesgo de desarrollar desnutrición aguda o crónica cuando sus necesidades nutricionales no logren ser administradas completamente por vía enteral 1) (3) (4. De este modo se dará cobertura a sus necesidades de energía y nutrientes para mantener o recuperar su salud y crecimiento. Se recomienda potenciar al máximo la ingesta por la vía digestiva ya que mantiene el trofismo intestinal y disminuye la incidencia de complicaciones secundarias a la NP 5. En la tabla I se muestran las indicaciones de NP.
Los niños son particularmente sensibles a las restricciones nutricionales debido a sus necesidades para mantener un crecimiento óptimo, fundamentalmente en las épocas de máximo desarrollo. Por ello, la NP estará indicada en:
La NP debe mantenerse hasta que se consiga una adecuada transición a la nutrición enteral (NE) y dichos aportes alcancen al menos 2/3 de los requerimientos nutricionales estimados.
VÍAS DE ACCESO
Las vías de acceso venoso para NP pueden ser periféricas y centrales. La elección dependerá del tiempo previsto de tratamiento, de los requerimientos nutricionales del paciente, de la enfermedad de base, del estado nutricional y de los accesos vasculares disponibles.
ACCESOS VENOSOS PERIFÉRICOS
Se sitúan en venas subcutáneas, a través de las cuales pueden infundirse soluciones con una osmolaridad máxima de 850 mOsm/l (GdE 3) 8 y, por tanto, con un aporte de nutrientes limitado, por el riesgo de flebitis. Los catéteres venosos percutáneos periféricos largos (midline catheters) se pueden utilizar en el medio hospitalario para la administración de NP normocalórica durante periodos de varias semanas (GdE 2) 9. La NP por vía periférica se utiliza solo como medida temporal, cuando los requerimientos del paciente son bajos por ser un complemento de la NE o porque no se pueden lograr accesos venosos centrales.
ACCESOS VENOSOS CENTRALES
Los catéteres venosos centrales (CVC) se pueden clasificar según el tiempo durante el que vayan a ser utilizados:
- NP a corto plazo (hasta tres semanas): se insertan percutáneamente directamente en una vía central (vena subclavia, yugular interna, vena innominada o vena femoral). Están pensados para un uso continuado y solo deben ser utilizados en pacientes hospitalizados por cortos espacios de tiempo (de días a semanas) (GdE 3) 10. En cuanto a los catéteres umbilicales en el recién nacido (RN), deben retirarse antes del día 14 los venosos y antes del quinto día los arteriales (GdE 1) 11.
- NP a medio plazo (de tres semanas a tres meses): CVC no tunelizados para un uso discontinuo o transitorio. Los hay de dos tipos, los catéteres venosos centrales de inserción periférica (PICC) en una vía del brazo, tórax o cuello, y los CVC percutáneos no tunelizados, tipo Hohn. Se pueden utilizar tanto en pacientes hospitalizados como domiciliarios hasta tres meses, aunque no son una solución óptima para la administración de nutrición parenteral domiciliaria (NPD) (GdE 2) 9.
-
- NP a largo plazo (más de tres meses) 10: especialmente para pacientes en NPD. Requieren CVC tunelizados y fijados tipo Broviac, Hickman, etc. (GdE 2).
Los catéteres totalmente implantados subcutáneamente tipo Port-a-Cath no son idóneos para la administración de NPD (GdE 3).
En la tabla II se indican los calibres recomendables de los CVC y PICC en función del peso y edad de los pacientes. Los catéteres pueden tener una o varias luces.
Tabla II Calibres de los catéteres en función de la edad y peso del paciente

Fr: french; 1 Fr: 0,3 mm diámetro externo.
La técnica de elección para la colocación de una vía central es la canulación percutánea guiada por ecografía (GdE 1) 12. En caso contrario, es necesario un control radiológico para confirmar la localización de la punta y descartar iatrogenia durante la inserción (GdE 2).
COLOCACIÓN Y MANIPULACIÓN DE LAS VÍAS (ASEPSIA)
La colocación de los CVC se debe realizar con técnica estéril. Se deben seguir estrictas medidas antisépticas tanto en el lavado de las manos como en la manipulación de las conexiones al manipular los CVC (GdE 1) 12.
REQUERIMIENTOS EN NUTRICIÓN PARENTERAL PEDIÁTRICA
REQUERIMIENTOS ENERGÉTICOS
Clásicamente, la principal preocupación a la hora de prescribir una NP era el no alcanzar las necesidades energéticas del paciente; sin embargo, actualmente, el problema se centra más en las consecuencias negativas a las que conduce el exceso o desequilibrio de los diversos nutrientes. La estimación de las necesidades energéticas en los niños con NP precisa considerar los distintos componentes del gasto energético y el hecho de que la mayoría de ellos están hospitalizados, inactivos, con o sin alimentación enteral concomitante y con diversos grados de estrés metabólico 1) (13.
El cálculo de los requerimientos energéticos debe realizarse de forma individualizada, según edad, estado nutricional y enfermedad subyacente. En pacientes con enfermedades que conlleven alto riesgo de desnutrición, el mejor método es el cálculo del gasto energético en reposo (GER) corregido por un factor que incluye la actividad y el grado de estrés. La forma idónea de conocer el GER es mediante calorimetría indirecta. Sin embargo, la mayoría de los clínicos no disponen de esta técnica y, por tanto, precisan estimar las necesidades energéticas con cálculos orientativos mediante ecuaciones de predicción, siendo la más aceptada la fórmula de Schofield 14.
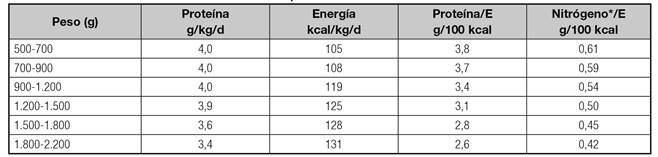
Una vez calculado el GER tal como se indica en la tabla III se corregirá por un factor que tenga en cuenta el estrés de la enfermedad y la actividad física. Generalmente, para evitar la sobrealimentación se suele emplear un factor de multiplicación 1,1-1,2 en niños con enfermedad de moderada intensidad (GdE 4) 15. No hay razones para incrementar la energía en casos de cirugía no complicada (GdE 2) 15. En situaciones de NP prolongada y desnutrición grave este factor se puede incrementar hasta 1,3-1,5 (GdE 4) 15. En la tabla IV se recogen las cantidades aproximadas de energía según la edad 1) (13) (15) (16) (17.
Tabla III Ecuaciones de predicción para el cálculo de los requerimientos energéticos en NP (kcal/día) y relación kcal no proteicas por gramo de nitrógeno
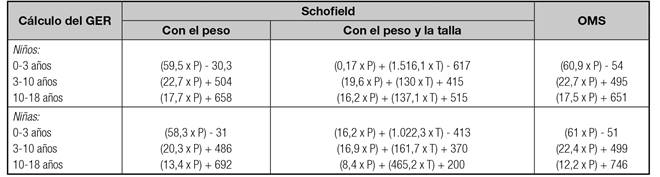
P: peso (kg); T: talla (m); GER: gasto energético en reposo. Requerimientos energéticos totales (kcal/día): GER x factor (1,1-1,2). Relación kcal no proteicas/gramo de nitrógeno: 150-200 kcal no proteicas por cada g nitrógeno. En críticos, 100-130 kcal no proteicas por cada g nitrógeno.
Una vez calculada la energía total diaria es fundamental que su aporte en principios inmediatos esté equilibrado, para conseguir una adecuada retención nitrogenada y evitar alteraciones metabólicas 18. El cálculo de los requerimientos de proteína debe realizarse siempre en primer lugar y es el que determina el resto del aporte calórico no proteico. Se recomienda 100-200 kcal no proteicas por cada gramo de nitrógeno (Tabla IV y tabla VI) 1) (13) (19) (20.
Tabla IV Necesidades energéticas aproximadas en NP según la edad

*Ref. 17; resto de las edades modificado de ref. 16.
Para menores de un año las recomendaciones se basan en el GET incluyendo el crecimiento 16.
A partir de un año las cifras de energía/kg/d que se muestran corresponden al GER (Schofield) 14 para cada uno de los rangos de edad. En ellos y en función de la situación clínica del niño estas cifras se multiplicarán por un factor 1,1-1,2 o por el que se considere adecuado.
REQUERIMIENTOS PROTEICOS
Las proteínas se suministran en forma de soluciones de aminoácidos (AA) y son esenciales para mantener la masa corporal magra. Los aportes recomendados según la edad se recogen en la tabla V 1) (13) (15. Estudios recientes sustentan la importancia de alcanzar rápidamente las dosis máximas incluso en el neonato pretérmino siempre que se guarde la relación nitrógeno/kcal no proteicas 21 (Tabla VI).
REQUERIMIENTOS DE LÍPIDOS
Los lípidos deben formar parte de las soluciones de NP por su elevada densidad calórica, por ser fuente de ácidos grasos esenciales (AGE), por disminuir la osmolaridad de la solución y por evitar los efectos negativos de la sobrecarga de glucosa. Se recomienda que constituyan del 25 al 40% de las calorías no proteicas 13) (15. Los aportes máximos diarios recomendados en NP se resumen en la tabla VII 13) (15. Deben controlarse las cifras de triglicéridos, que no deben superar la concentración de 150 mg/dl en pretérminos, 250 mg/dl en lactantes y 400 mg/dl en los niños mayores 15) (22. En algunas circunstancias, hay que tener precaución y reducir los aportes (0,5-1 g/kg/día), garantizando el aporte de AGE: infecciones graves, hiperbilirrubinemia neonatal, trombocitopenia < 100.000/mm3, insuficiencia hepática y enfermedades pulmonares 19) (20. En pretérminos de muy bajo peso al nacer, su inicio en los dos primeros días de vida es seguro (GdE 1) 23.
REQUERIMIENTOS DE GLUCOSA
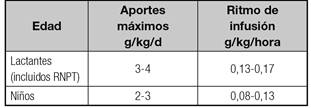
Su aporte no debe exceder el 60-75% de las calorías no proteicas 1) (13) (15. El ritmo de infusión (mg/kg/minuto) debe ser progresivo y dependiente de la edad, tal y como se detalla en la tabla VIII, para evitar la hiperglucemia y la diuresis osmótica. En los neonatos, especialmente en los RNPT, se recomienda poner especial énfasis en evitar la hipoglucemia y en tratarla sistemáticamente en caso de presentarse (GdE 1) 24. Se sugiere, además, que la glucemia no sobrepase los 150 mg/dl (GdE 5) 24 ya que se asocia con mayores complicaciones, particularmente en los RNPT y/o de bajo peso al nacer. El uso de insulina debe restringirse a casos de difícil control de la hiperglucemia.
REQUERIMIENTOS DE AGUA Y ELECTROLITOS
Se calcularán en función de la edad, el tamaño corporal, el estado de hidratación, los factores ambientales, la enfermedad subyacente y el estado nutricional, especialmente en el RN 1) (13) (15) (17. Se resumen en las tabla IXA y tabla IXB.
Tabla IXA Aportes de agua y electrolitos en NP* de recién nacidos
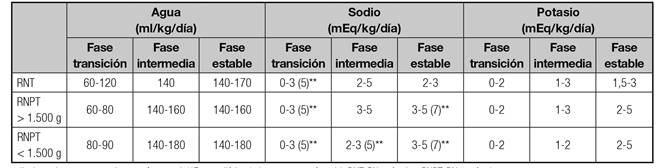
*Incluye el aporte progresivo por vía enteral. **Fase poliúrica (valores entre paréntesis). RNT: RN a término. RNPT: RN pretérmino.
Tabla IXB Aportes de agua y electrolitos en NP

*Holliday-Segar (mantenimiento):
- Hasta 10 kg, 100 ml/kg (total 1.000 ml);
- Entre 10 y 20 kg = 1.000 ml por los primeros 10 kg más 50 ml/kg por los segundos 10 kg (total 1.500 ml);
- A partir de 20 kg = 1.500 ml por los primeros 20 kg más 20 ml/kg por los kilos que superen 20 kg. Máximo 2.000-2.500 ml/24 horas.
REQUERIMIENTOS DE MINERALES Y OLIGOELEMENTOS
Varían según la edad y el peso corporal. Para conseguir una mejor retención fosfo-cálcica se recomienda una relación calcio:fósforo molar de 1,3/1 o una relación por peso de 1,3-1,7/1 (1,13,19,20). Los oligoelementos suelen administrarse de forma conjunta, aunque es posible proporcionar algún elemento aislado como el zinc (tabla X y tabla XI).
Tabla X Aportes de minerales en NP

RNPT: RN pretérmino; RNT: RN a término. Calcio: 1 mM = 40 mg = 2 mEq (gluconato Ca 10%: 100 mg = 9 mg Ca); Fósforo: 1 mM = 31 mg = 2 mEq (relación calcio/fósforo = 1,3/1); Magnesio: 1mM = 24 mg = 2 mEq.
REQUERIMIENTOS DE VITAMINAS
Las recomendaciones según ASPEN en vitaminas para el RNPT y resto de las edades se recogen en la tabla XII, que constituye una síntesis de las principales recomendaciones 1) (13) (25.
Tabla XII Recomendaciones y preparados de vitaminas en NP

1. El Soluvit(r) es un vial de vitaminas hidrosolubles liofilizadas que se disuelven en 10 ml y el Vitalipid Infantil(r) contiene vitaminas liposolubles en emulsión lipídica en ampollas de 10 ml. 2. Infuvite(r). Dos viales multidosis; uno de 1 ml con folato, biotina y vitamina B12, y otro de 4 ml con el resto de vitaminas. La dosis recomendada es 1 ml + 4 ml. Medicamento extranjero. Dosis: RNPT < 1 kg: 1,5 ml; 1-3 kg peso: 3 ml; resto edades: 5 ml. 3. El Cernevit es un vial de liofilizado que se recomienda disolver en 5 ml de agua estéril. 4. Equivalencia: 1 mcg de vitamina A = 3,3 UI. 5. Equivalencia: 1 mcg de vitamina D = 40 UI. 6. RNPT (recién nacido pretérmino) con enfermedad pulmonar: 450-850 mcg. B1 (tiamina); B2 (rivoflabina); B3 (niacina); B5 (pantoténico); B6 (piridoxina).
MODIFICACIONES EN SITUACIONES ESPECIALES
Entre los pacientes pediátricos que precisan NP existen una serie de circunstancias que hacen necesario matizar las consideraciones sobre requerimientos que se han expuesto anteriormente. En la tabla XIII se resumen las más importantes.
COMPONENTES DE LAS MEZCLAS DE NP PARA PEDIATRÍA
AMINOÁCIDOS
En pacientes pediátricos, y especialmente en neonatos, está recomendado el uso de soluciones de AA específicas debido a la inmadurez de sus sistemas enzimáticos (GdE 5) 47. No existen estudios sobre la adecuación de estas soluciones a niños de mayor edad, aunque tampoco sobre la idoneidad de las soluciones para adultos.
LÍPIDOS
Se recomienda el uso de emulsiones lipídicas al 20%. La composición de sus triglicéridos varía según su fuente única o combinada (aceite de soja, coco, oliva y pescado), aunque ninguna ha demostrado una superioridad clara y definitiva sobre las otras 23) (48. En tanto se dispone de estudios con evidencia suficiente sobre los efectos de las soluciones mixtas con w3, consideramos que por su composición (equilibrio de AGE, ausencia de fitosteroles y contenido en vitamina E) parecen las más recomendables. El uso rutinario de heparina no está recomendado.
ELECTROLITOS Y MINERALES
El mayor problema para poder añadir en la bolsa de NP todos los electrolitos que requiere el paciente pediátrico es la precipitación calcio-fosfato. Esta se puede disminuir con la utilización del glicerofosfato sódico 49. Es indispensable el uso de filtros de 1,2 micras en la administración de mezclas ternarias, y de filtros de 0,22 micras para mezclas binarias en el sistema de administración para evitar los posibles precipitados (GdE 5) 13) (15) (20.
PRESCRIPCIÓN Y ESTANDARIZACIÓN
La prescripción de NP es un proceso susceptible de errores. Un impreso de prescripción bien diseñado, así como la informatización de la prescripción, puede disminuir la incidencia de errores y aumentar la eficiencia del procedimiento 15) (51. Estos beneficios pueden aumentarse con el uso de soluciones estandarizadas. La prescripción de la NP ha de hacerse a diario tanto si es estándar como individualizada.
Para lograr la estandarización es necesario un rango amplio de soluciones de NP que se ajuste a los diferentes requerimientos de macronutrientes, electrolitos y volumen de los pacientes. Cuando estos no puedan alcanzarse, se emplearán nutriciones individualizadas. En pediatría existe poca experiencia en el uso de soluciones estandarizadas.
PREPARACIÓN
La preparación de la NP está centralizada en los servicios de Farmacia para poder garantizar las condiciones de asepsia y validar la compatibilidad, estabilidad y adecuación de los requerimientos prescritos. Se trabaja en cabina de flujo laminar horizontal cumpliendo estrictamente una normativa de trabajo y es importante realizar controles microbiológicos periódicamente (GdE 5) 52.
Todas las bolsas preparadas deben ir identificadas con el nombre del paciente y su ubicación, la composición exhaustiva de la mezcla y otros datos que puedan ayudar en la administración (GdE 5) 52.
Las soluciones de NP "todo en uno" necesitan menor manipulación tanto en la preparación como en la administración, suponen menor gasto de material fungible y de personal, solo precisan una bomba de administración y son peor caldo de cultivo para microorganismos que los lípidos separados. Por estas razones, si la estabilidad de la emulsión lo permite, esta es la forma ideal de administración 53. Para evitar la desestabilización de la NP es importante seguir un orden de adición de los componentes (siempre los AA primero) y vigilar la concentración final de AA (mayor de 2-2,5%), glucosa y lípidos (GdE 5) 52) (53.
La precipitación calcio-fosfato es el mayor problema de compatibilidad de las mezclas de NP. Se produce a rangos de concentración compatibles con las necesidades del paciente, especialmente en niños, ya que tienen altos requerimientos de estas sustancias. Las sales orgánicas de calcio y fosfato son mucho menos proclives a precipitar que las inorgánicas 49, por lo que se recomienda su uso (GdE 5) 52. Los fosfatos orgánicos tienen una buena tolerancia y son una fuente eficaz de fósforo.
Se recomienda el aporte diario de vitaminas y oligoelementos, los cuales se pueden aportar juntos en la misma bolsa. La degradación de vitaminas se puede minimizar utilizando NP "todo en uno", bolsas multicapa y bolsas exteriores de fotoprotección (GdE 5) 52) (53) (54.
La generación de peróxidos es de especial importancia por su efecto deletéreo en neonatología. Para prevenirla es fundamental evitar la luz y el contacto con el oxígeno. Se recomienda su fotoprotección con sobrebolsas fotoprotectoras y la utilización de sistemas de administración que eviten el paso de la luz (GdE 1) 55.
El aluminio se puede acumular en el cuerpo y producir efectos nocivos. Es importante conocer el contenido de aluminio de los distintos componentes de la NP para intentar disminuir su aporte. Es preferible utilizar electrolitos en envases plásticos que en cristal 56.
Solamente se pueden incluir en la bolsa de NP los medicamentos compatibles con los componentes de la NP y que no desestabilicen la emulsión.
ADMINISTRACIÓN
Para la administración 57 de NP en pediatría se precisan contenedores preferiblemente multicapa y sobrebolsa fotoprotectora. Idealmente, los sistemas de infusión deberán ser opacos. Los dispositivos protectores tipo Segur-Lock o válvulas herméticas sin aguja son de gran utilidad, ya que evitan tener que pinzar la vía durante la manipulación o desconexión de la línea y los pinchazos accidentales. Además, desinfectados antes y después de su uso de forma adecuada podrían disminuir el riesgo de infección.
Los filtros impiden la entrada de aire y partículas en el torrente circulatorio. Se recomienda el uso de sistemas de administración que tengan incorporado el filtro de 1,2 µm si la NP contiene lípidos y de 0,22 µm si no los lleva (GdE 5) 57. Si no es posible su utilización rutinaria, se aconseja al menos emplearlos en los recién nacidos, en los pacientes en los cuales se prevé un tratamiento largo (especialmente en nutrición parenteral domiciliaria), en los enfermos con enfermedad respiratoria y en las infusiones con alto contenido en partículas (medicamentos que requieren preparación de reconstitución) o con peligro de desestabilizarse.
Las soluciones de NP deben ser administradas con un preciso control de la velocidad de infusión mediante bombas volumétricas. El sistema de infusión debe ser regularmente controlado. Las infusiones a través de una vía periférica deben ser frecuentemente controladas para detectar signos de extravasación. Las bombas de infusión deben tener sistemas de prevención de libre flujo si se abren durante su uso (GdE 5) 57.
La manipulación de las vías debe realizarse con la máxima asepsia, por lo que es imprescindible realizar siempre un lavado antiséptico de las manos, usar guantes estériles y establecer un campo estéril.
Para prevenir la oclusión del catéter es importante infundir suero fisiológico al finalizar la administración.
La infusión puede ser continua, a lo largo de 24 horas, o intermitente en periodos más cortos de tiempo. La administración cíclica es habitual en pacientes con tratamientos de larga duración y en domicilio.
Es deseable administrar la NP por una luz del catéter exclusiva para ello. No se recomienda usar el catéter para extracciones. No se debe administrar ningún fármaco en "Y" con la NP excepto si existen estudios sobre su compatibilidad.
MONITORIZACIÓN
La monitorización de la NP comprende una valoración inicial completa antes de su inicio, en la que se incluirán la propia indicación de la NP, el estado nutricional del niño, el tipo de acceso venoso y una serie de controles analíticos que se detallan en la tabla XIV (GdE 5) 15. La frecuencia con la que se deben realizar estos últimos dependerá de la situación clínica y de la duración del soporte nutricional. Se deben seguir algoritmos de soporte nutricional para la solicitud y monitorización de la NP (GdE 5) 15.
Tabla XIV Monitorización de la NP en niños
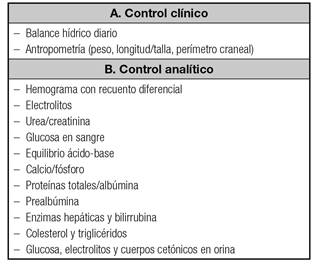
Estos parámetros deben realizarse al inicio de la NP y posteriormente con frecuencia variable según la situación clínica del paciente (por ejemplo, dos o tres veces a la semana inicialmente). Si la NP se prolonga durante meses hay que monitorizar también oligoelementos, vitaminas, mineralización y edad ósea y estudio de coagulación (estudio de factores de riesgo trombótico).
Cuando se trata de pacientes con NPD o prolongada, además de las determinaciones habituales, se monitorizarán niveles de vitaminas y elementos traza (GdE 5) 15.
Se deberían realizar medidas antropométricas y una evaluación clínica en pacientes que reciben NP, 2-3 veces por semana, por parte de un profesional experto (GdE 5) 15.
COMPLICACIONES
ASOCIADAS A LOS CVC
Pueden ser de varios tipos: complicaciones técnicas en relación con la inserción del catéter (neumotórax, laceración de un vaso, arritmias, perforación cardiaca con taponamiento, embolismo aéreo, lesión de un plexo nervioso o localización anómala del catéter), mucho menos frecuentes cuando la colocación se dirige mediante ecografía (GdE 1) 12; rotura o desplazamiento accidental, oclusión, trombosis venosa e infección.
La oclusión consiste en la obstrucción parcial o completa de un catéter que limita o impide la posibilidad de extraer sangre o infundir a su través. Es una complicación frecuente sobre todo en niños. Para prevenirla se recomienda infundir suero fisiológico (3-5 ml) después de la administración de medicaciones o tras la extracción de sangre (GdE 3) 15) (58. El lavado con heparina a baja concentración no aporta ninguna ventaja frente al suero salino (GdE 2) 58. El empleo de heparina, catéteres impregnados de heparina, heparina de bajo peso molecular o warfarina de forma profiláctica no ha demostrado ser una medida eficaz en la prevención de trombosis venosa (GdE 2) 59.
La actuación dependerá de la causa que se sospeche 10. Antes de iniciar un tratamiento farmacológico, deberá descartarse oclusión no trombótica causada por precipitados de fármacos o minerales que pueden ser disueltos con hidróxido sódico o ácido clorhídrico (GdE 3), depósitos de lípidos que se disuelven con etanol (GdE 3) o malposición del CVC 60.
En las oclusiones trombóticas el coágulo puede formarse como una vaina de fibrina en el extremo distal del catéter o como un trombo en la pared externa del CVC o en la pared del vaso en el que se sitúa el catéter. En estos casos puede usarse estreptoquinasa, uroquinasa o factor activador del plasminógeno (alteplasa) (GdE 3) 61. Los datos con el empleo de otros agentes trombolíticos (alfimeprasa, tenecteplasa) en niños son muy limitados (GdE 4).
La trombosis de una vena central puede ser asintomática, manifestarse como dolor o edema local en la extremidad afecta o incluso como un tromboembolismo potencialmente fatal. Un ecocardiograma o una ecografía-doppler, un escáner torácico o una venografía pueden confirmar el diagnóstico. La trombosis aguda puede tratarse con agentes trombolíticos, pero la forma más habitual de tratamiento es la anticoagulación. En pacientes con necesidad de NP prolongada o con alto riesgo de tromboembolismo puede ser interesante el uso de antagonistas de la vitamina K o de heparinas de bajo peso molecular 59) (60) (61).
Las infecciones, bacteriemias asociadas a catéter (BC), son una de las complicaciones más comunes y potencialmente graves. Las dos principales puertas de infección son el punto de inserción en la piel (en los catéteres de corta duración) o el cabezal del catéter (en los catéteres permanentes) 62. Los gérmenes más frecuentes son: Staphylococcus epidermidis, Enterobacter spp, Escherichia coli, Klebsiella pneumoniae, Pseudomona aeruginosa, Staphyloccus aureus, Enterococcus (E. faecalis, E. faecium) y Candida albicans u otros hongos.
Debe sospecharse una infección asociada a catéter si el niño presenta fiebre > 38,5 °C, acidosis metabólica, trombocitopenia o inestabilidad en la homeostasis de la glucosa, en ausencia de otro foco en la exploración. Deben realizarse hemocultivos simultáneos de sangre periférica y central, extraídos a través de cada una de las luces del catéter, y proceder a su cultivo cuantitativo (GdE 1) 10) (11) (12) (62) (63. Tras ello, se comenzará con antibioterapia empírica (GdE 2) que cubra el germen más frecuentemente implicado en las BC (estafilococo plasmocoagulasa negativo) y los bacilos Gram negativos, incluida Pseudomona aeruginosa. Una vez conocido el resultado del hemocultivo y del antibiograma se modificará la pauta antibiótica. La duración del tratamiento dependerá del germen aislado 10) (11) (12) (62) (63.
La retirada del catéter es el tratamiento de elección ante una BC, en especial en los catéteres de corta duración (GdE 3) 10) (11) (12) (62) (63. En los casos de BC en un catéter de larga duración podemos intentar evitar la retirada del mismo asociando a la antibioterapia sistémica un sellado 63)(64) con antibióticos (antibiotic-lock) (GdE 4) o con taurolidina.
La inserción del catéter y su manipulación con técnica aséptica disminuyen el riesgo de BC (GdE 1) 10) (11) (12) (63. El punto clave en su prevención es el cumplimiento de la técnica aséptica en el manejo del catéter, incluyendo el lavado de manos (GdE 1) 63.
COMPLICACIONES METABÓLICAS
Están derivadas del déficit o del exceso de alguno de los componentes individuales de la solución de NP o de la presencia de contaminantes. Hay que ser extremadamente cuidadoso en la alimentación de niños desnutridos para evitar el síndrome de realimentación, en especial en el paciente crítico 65.
ENFERMEDAD METABÓLICA ÓSEA (OSTEOPOROSIS, OSTEOMALACIA)
Ocurre en pacientes con NP de muy larga duración, especialmente si se asocia a fracaso intestinal 66. El origen es multifactorial.
COMPLICACIONES HEPÁTICAS
La elevación de las enzimas hepáticas (sobre todo GGT) y de la bilirrubina es frecuente en niños con NP de duración superior a 15 días 67. El origen es desconocido y en su aparición pueden influir distintos factores como la disminución del circuito enterohepático, el empleo de soluciones pobres en taurina y ricas en glicina, la composición de las emulsiones lipídicas, la sobrealimentación y las infecciones, entre otras 68. Son importantes en la NP de larga duración, en especial en el seno de un fracaso intestinal, y pueden manifestarse como litiasis biliar o alteración hepática variable (esteatosis, cirrosis, colestasis, etc.). La suspensión de los lípidos intravenosos de la NP y el empleo de una emulsión de aceite de pescado al 10% (Omegaven(r), Fresenius-Kabi), 1 g/kd/día por un tiempo limitado, han conseguido mejorar o revertir la colestasis relacionada con el fracaso intestinal (GdE 4) 68.
La prevención de las complicaciones hepáticas debe considerar todos los factores potenciales de riesgo.
PROBLEMAS PSICOSOCIALES
La enfermedad de base, las hospitalizaciones repetidas y prolongadas, la dependencia de máquinas y la sobreprotección de los padres pueden perturbar el desarrollo normal de algunos niños con NP prolongada. Hemos de procurar enviar a los niños con NP prolongada lo antes posible a su domicilio 69.
NUTRICIÓN PARENTERAL DOMICILIARIA
La NPD, aquella que se administra en el domicilio del paciente, es una alternativa a la hospitalización prolongada. Sus objetivos son: mejorar o mantener el estado nutricional del paciente, facilitar la adaptación intestinal, reducir el riesgo de complicaciones relacionadas con la hospitalización (infecciones), mejorar la calidad de vida del niño y su familia y disminuir los costes del tratamiento, evitando hospitalizaciones 69) (70.
Para implantar una NPD es necesaria la participación de un equipo multidisciplinar. La familia debe ser adecuadamente entrenada para poder realizar el tratamiento de forma segura y el paciente debe estar en una situación clínica estable. No merece la pena iniciar una NPD si se prevé una duración inferior a 30 días. Debe valorarse el impacto de la NPD en la vida social y laboral de la familia y facilitarse el contacto con personal experto durante las 24 horas del día.
INDICACIONES
La indicación más frecuente es el fracaso intestinal prolongado o permanente 71. La causa más común es el síndrome de intestino corto, seguido por los trastornos de motilidad y la diarrea grave rebelde. Las indicaciones extradigestivas comprenden las complicaciones de los procesos tumorales y las inmunodeficiencias primarias o secundarias.
Las características de la familia y de su entorno social son críticas para iniciar un programa de NPD 69) (72. Hay que comprobar que la familia puede y quiere hacerse cargo del cuidado del niño y que tiene los recursos materiales adecuados para llevarlo a cabo.
ACCESOS VASCULARES
La NPD requiere un acceso venoso central adecuado 12. La composición de la NPD se adapta a las necesidades individuales del paciente, no difiere de la NP hospitalaria y va a depender, sobre todo, de la edad del paciente y de los aportes tolerados por vía digestiva 1) (15) (19) (68.
ENTRENAMIENTO DE LAS FAMILIAS Y SEGUIMIENTO
La formación tiene como objetivo adquirir los conocimientos y habilidades necesarios para efectuar los cuidados que requiere la NPD, así como prevenir y reconocer las complicaciones 69,72. Debe comenzarse lo antes posible, implicar a todos los miembros del equipo y proporcionar las instrucciones orales y escritas hasta asegurar su correcta realización. Es imprescindible la evaluación periódica.
Antes del alta, el equipo de NPD tiene que contactar con el pediatra del paciente y el hospital más cercano a su domicilio para conseguir un seguimiento (Tabla XIV) y tratamiento más eficaces 15) (69) (72. La preparación de la NPD se realizará en dicho hospital, en el de origen o por un servicio de catering.
COMPLICACIONES DE LA NPD
No difieren de las observadas en la NP hospitalaria, excepto en lo que se refiere a su frecuencia en relación con la duración más prolongada del tratamiento, sobre todo las infecciones, la trombosis venosa y la hepatopatía. Existe una serie de factores de riesgo que pueden contribuir a su fracaso y a la necesidad de valoración del paciente como posible candidato a trasplante (Tabla XV). La remisión adecuada y precoz a unidades de Rehabilitación Intestinal y Trasplante puede mejorar el pronóstico y la evolución (73 (Tabla XVI).
CALIDAD DE VIDA
Los indicadores de calidad de vida de los pacientes con NPD son significativamente peores que los observados en los controles sanos, pero la situación es significativamente mejor cuando la comparación se establece con pacientes en hospitalización prolongada 74.
REVISORES
Elena Balmaseda Serrano. Unidad de Gastroenterología y Nutrición Pediátricas. Servicio de Pediatría. Complejo Hospitalario Universitario. Albacete.
Elvira Cañedo Villarroya. Sección de Gastroenterología y Nutrición. Hospital Infantil Universitario Niño Jesús. Madrid.
Carolina Gutiérrez Junquera. Unidad de Gastroenterología y Nutrición Pediátricas. Servicio de Pediatría. Hospital Universitario Puerta de Hierro. Majadahonda. Madrid.
Ana Morais López. Unidad de Nutrición Infantil y Enfermedades Metabólicas. Hospital Universitario La Paz. Madrid.
Silvia Meavilla Olivas. Sección de Gastroenterología, Hepatología y Nutrición. Hospital Sant Joan de Deu. Barcelona.
Víctor Manuel Navas López. Unidad de Gastroenterología y Nutrición infantil. Hospital Materno-Infantil. Málaga.
María Rubio Murillo. Sección de Gastroenterología y Nutrición. Hospital Infantil Universitario Virgen del Rocío. Sevilla.
Inmaculada Vives Piñera. Sección de Gastroenterología y Nutrición, Servicio de Pediatría. Hospital Virgen de la Arrixaca. Murcia
Grupo de Nutrición de la Sociedad Española de Farmacia Hospitalaria.
Coordinador de los Grupos de Trabajo de SENPE: Alfonso Vidal Casariego.
Comité Científico Educacional de SENPE (Cristina de la Cuerda Compés, Pilar Matía Martín, Laura Frías Soriano, Mª Dolores Ruiz López, Clara Vaquerizo Alonso, Pilar Gomis Muñoz, Cleofé Pérez-Portabella Maristany).