Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Nutrición Hospitalaria
versão On-line ISSN 1699-5198versão impressa ISSN 0212-1611
Nutr. Hosp. vol.34 no.4 Madrid Jul./Ago. 2017
https://dx.doi.org/10.20960/nh.409
Estudio multicéntrico español: niños con hiperamoniemia no asociada a errores innatos del metabolismo
Spanish multicenter study: hyperammonemia not associated with inborn errors of metabolism in children
Mercedes Gil-Campos1, Javier Blasco-Alonso2, Concepción Sierra Córcoles3, José Luis Cuevas Cervera4, Luisa Arrabal Fernández5, Luis Aldámiz Echevarría6 y Amaya Belanger7
1Unidad de Metabolismo e Investigación Pediátrica. Hospital Universitario Reina Sofía. Córdoba. Instituto Maimónides de Investigación Biomédica (IMIBIC). Córdoba. Ciber de Obesidad y Nutrición (CiberObn).
2Unidad de Gastroenterología y Nutrición Infantil. Hospital Regional Universitario de Málaga. Málaga.
3Unidad de Neurología Pediátrica. Complejo Hospitalario de Jaén. Jaén.
4Hospital Universitario San Agustín de Linares. Linares, Jaén.
5Unidad de Neuropediatría. Hospital Materno-Infantil Virgen de las Nieves. Complejo Hospitalario de Granada. Granada.
6Unidad de Enfermedades Raras Metabólicas. Hospital Universitario de Cruces. BioCruces. Bilbao.
7Unidad de Enfermedades Metabólicas. Servicio de Pediatría. Hospital Universitario Ramón y Cajal. Madrid
Dirección para correspondencia
RESUMEN
Introducción: la encefalopatía hiperamoniémica inducida por causas diferentes a los errores innatos del metabolismo es una complicación relativamente infrecuente, pero muy grave.
Objetivos: conocer las características de un episodio de hiperamoniemia secundaria, tratar de discernir las causas desencadenantes, cómo se llega al diagnóstico del episodio y cómo se desarrolla la actuación terapéutica.
Métodos: es un estudio multicéntrico retrospectivo de casos pediátricos con hiperamoniemia no relacionada con errores innatos del metabolismo, llevado a cabo en hospitales españoles.
Resultados: fueron seleccionados 19 pacientes y en un 47% el episodio de hiperamoniemia apareció en menores de un año, que fueron diagnosticados mayoritariamente con dos o más síntomas. La clínica más frecuente fue la de alteración del nivel de conciencia tipo intoxicación, seguida de las crisis convulsivas, sumando en ambas hasta 14 pacientes con alguna de ellas o las dos. Doce de los 19 pacientes utilizaban más de dos fármacos antiepilépticos de forma habitual. Todos los niños recibieron tratamiento con restricción proteica (n: 10), quelantes (n: 10) y/o ácido carglúmico (n: 12) para el tratamiento de la hiperamoniemia.
Conclusiones: este estudio sugiere que la hiperamoniemia secundaria puede estar infradiagnosticada y solo se detecta cuando aparece una sintomatología grave. Parecen ser pacientes de riesgo aquellos que reciben fármacos antiepilépticos o aquellos críticos con una alimentación restringida o un metabolismo elevado. La respuesta con tratamiento específico es adecuada pero debe ser precoz para evitar las secuelas neurológicas de esta entidad.
Palabras clave: Amonio. Ácido carglúmico. Ácido valproico. Antiepilépticos. Encefalopatía metabólica.
ABSTRACT
Introduction: The hyperammonemic encephalopathy induced by causes different from inborn errors of metabolism is a relatively uncommon but severe complication.
Objectives: To study the characteristics of a secondary hyperammonemia episode to discern the triggering causes to get to the diagnosis, and the development in the therapeutic intervention.
Methods: A multicenter retrospective study of children with hyperammonemia unrelated to inborn errors of metabolism, conducted in Spanish hospitals.
Results: Nineteen patients were selected; hyperammonemia developed in infants under one year old in 47% of them, being diagnosed mostly with two or more symptoms. The most common clinical finding was an altered consciousness level similar to that of intoxication symptoms, followed by seizures. These clinical symptoms were present in 14 patients, with one of them or both. Twelve of the 19 patients were in treatment with more than two antiepileptic drugs routinely. All children were treated with protein restriction (n: 10), scavengers (n: 10) and/or carglumic acid (n: 12) for the treatment of hyperammonemia.
Conclusions: This study suggests that secondary hyperammonemia could be underdiagnosed because it is only detected when severe symptoms appear. Risk seems to be higher in those patients receiving antiepileptic drugs or those critically ill with a restricted diet or incremented metabolism. The response to specific treatment is adequate but should be established earlier to avoid neurological sequelae of this entity.
Key words: Ammonia. Carglumic acid. Valproic acid. Antiepileptic drugs. Metabolic encephalopathy.
Introducción
La encefalopatía hiperamoniémica (EH) inducida por causas diferentes a los errores innatos del metabolismo (EIM) es una complicación relativamente infrecuente, pero muy grave. En general, se ha asociado a la administración de fármacos, principalmente antiepilépticos, pero también puede ocurrir en otras situaciones como infecciones urinarias por gérmenes ureasa (+) en niños con estasis urinario o con ureterosigmoidostomías, anastomosis portosistémicas u otras alteraciones hepáticas, quedando en algunas ocasiones la causa como desconocida.
La hiperamoniemia constituye una verdadera emergencia por su alta toxicidad en el sistema nervioso central, especialmente si ocurre en edades tempranas de la vida, cuando cualquier agresión puede tener importantes repercusiones en el neurodesarrollo. Las causas de hiperamoniemia neonatal suelen ser defectos genéticos de las enzimas del ciclo de la urea, acidemias orgánicas y otros EIM. También en niños mayores, además, hay que hacer diagnóstico diferencial con la deficiencia de carnitina, el síndrome de Reye, la insuficiencia hepática, la insuficiencia renal y el tratamiento con fármacos como los salicilatos, el ácido valproico (VPA), la fenitoína, el fenobarbital, el topiramato (TPM) y el 5-fluorouracilo. En algunas de estas condiciones, los niveles de amonio en la sangre se deben a la reducción de N-acetilglutamato (NAG), un cofactor esencial necesario para la función del ciclo de la urea y la reducción de la actividad de la enzima carbamil-fosfato sintasa-I (CPS-I) (1).
El mecanismo fisiopatológico de hiperamoniemia secundaria más descrito en la literatura en niños es el inducido por VPA, que produce hepatotoxicidad con inhibición de la actividad CPS-I (primera reacción enzimática en el ciclo de la urea), y asociado a politerapia anticonvulsivante (2). Además, el VPA es ampliamente metabolizado por el hígado a través de la conjugación de ácido glucurónico y una beta-oxidación mitocondrial y citosólica, que produce metabolitos implicados en la génesis de la hiperamoniemia (3). También se ha descrito una inhibición directa de la actividad de la N-acetil glutamato sintasa (NAGS) por uno de estos metabolitos (4).
El ácido carglúmico es un análogo de NAG que tiene una acción directa sobre la enzima, reactivando el ciclo de la urea y reduciendo los niveles de amoniaco en plasma. Como consecuencia, se mejora el tratamiento tradicional, lo cual evita la necesidad de hemodiálisis y diálisis peritoneal (1).
Hay evidencia clínica y experimental de que el amoniaco es un factor importante en la patogénesis de la encefalopatía hepática. Así, la hiperamoniemia es un síntoma que puede aparecer secundariamente a otras enfermedades o tras instauración de algunos tratamientos farmacológicos que modifican el metabolismo hepático. Este diagnóstico puede pasar desapercibido, ya que la clínica neurológica puede ser muy diversa y presentarse de forma subaguda, variando desde la sintomatología psiquiátrica (trastornos de conducta, depresión, delirio, etc.) hasta la neurológica, como la confusión mental o el coma.
Los objetivos del presente trabajo son conocer las características clínicas con las que se han presentado los episodios de hiperamoniemia secundaria, tratar de discernir las causas que hayan desencadenado una elevación tóxica del amonio en sangre, y los tratamientos utilizados en la resolución del episodio.
Métodos
Se realizó un sondeo por encuesta en los principales centros hospitalarios españoles con unidades pediátricas especializadas de diagnóstico y seguimiento de pacientes con errores innatos del metabolismo, en relación con posibles casos pediátricos registrados de hiperamoniemia no relacionada con EIM de los que hubiera un mínimo de datos clínicos y analíticos disponibles. Posteriormente, se realizó un estudio retrospectivo multicéntrico que proporcionó los datos requeridos tras revisión de historias clínicas por los médicos de los pacientes, utilizando la anonimización y codificación de los datos para su uso. El estudio fue aprobado por el Comité de Ética e Investigación del hospital coordinador.
Los criterios de inclusión fueron:
1. Niños de entre 0-14 años que presentaran hiperamoniemia demostrada mediante análisis bioquímico, con clínica compatible.
2. Niños que tuviesen el estudio realizado para descartar los principales EIM relacionados con hiperamoniemia, cuyos resultados fueran negativos. Para el despistaje de errores congénitos del metabolismo que cursan con hiperamoniemia se exigió que en cada paciente seleccionado se hubieran descartado, al menos, aminoacidopatías, acidurias orgánicas, trastornos del ciclo de la urea, y trastornos de la beta oxidación de ácidos grasos a través de estudios bioquímicos en centros especializados, y con normalidad en los resultados.
3. Con acceso a un mínimo de datos disponibles en su historia clínica, tanto del episodio acontecido como de otros, hasta el procesamiento de los datos.
Las variables de estudio registradas fueron: edad de presentación; sexo, síntomas de inicio de la clínica; patología previa y otra sintomatología asociada; toma de medicación si la hubiese (antiepilépticos u otros); motivo de ingreso, valor de amonio plasmático al diagnóstico y valores y horarios de determinaciones posteriores; medicación recibida para el tratamiento de los síntomas; y tratamiento específico utilizado en la reducción de los niveles de amonio.
ANÁLISIS ESTADÍSTICO
El análisis estadístico se realizó con el programa SPSS versión 18.0 de software. Se realizó un análisis descriptivo para variables cuantitativas mediante el cálculo de media (m) y desviación típica o estándar (DS), y para las variables cualitativas, mediante el cálculo de proporciones (%). La determinación de la bondad de ajuste a una distribución normal (datos normales) se hizo mediante la prueba de Shapiro-Wilk. Si las muestras no seguían una distribución normal se aplicaron test no paramétricos.
Resultados
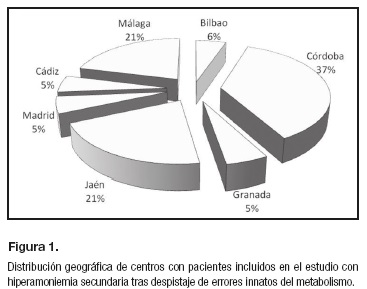
Tras el contacto con todos los especialistas en diagnóstico de errores congénitos del metabolismo en el ámbito pediátrico nacional para solicitar su participación si habían tenido casos de hiperamoniemias de causa no relacionada con un EIM, la participación final fue de siete centros. Los casos se obtuvieron de aquellos con el diagnóstico de "hiperamoniemia" de los centros participantes tras búsqueda en las bases de datos procedentes de las consultas especializadas y/o ingresos hospitalarios. Estos aportaron la muestra de pacientes pediátricos con hiperamoniemia tras despistaje de EIM y con suficiente información clínica en relación con las variables de medida requeridas, con un total de 19 casos. Todos los casos se registraron entre los años 2007 y 2015 (Fig. 1).
En la tabla I se indica la edad de presentación, que fue variable, con aparición del episodio de hiperamoniemia mayoritariamente en menores de dos años. Además, se expresa el número de síntomas que influyeron en el diagnóstico específico (dos o más síntomas). Todos los pacientes (100%) presentaron algún síntoma, sin que se detectara ningún caso por controles rutinarios de pacientes asintomáticos. El síntoma más frecuente fue la alteración del nivel de conciencia con clínica de intoxicación, seguido de las crisis convulsivas, sumando hasta 14 pacientes con alguna de ellas o ambas. Los vómitos como sintomatología habitual también asociada a la hiperamoniemia solo los presentaron cinco de los 19 pacientes. En ningún caso se registró cefalea. En total, el 74% presentó uno o más de estos tres síntomas principales (Fig. 2).
En relación con la administración de fármacos que pudieran tener como efecto adverso la hiperamoniemia, todos los que se asociaron fueron antiepilépticos. Diez de los 19 pacientes utilizaban más de dos fármacos antiepilépticos de forma habitual (53%). En siete casos, el tratamiento era VPA y la hiperamoniemia no se asoció a otro posible origen. De los 12 niños restantes, 9 estaban ingresados en el hospital antes de que apareciera la clínica: cinco con un fallo hepático de posible origen infeccioso pero de causa no determinada y sin ingesta previa de fármacos y otros cuatro tras un trasplante de médula ósea, y con nutrición parenteral (uno de ellos en tratamiento previo con fenitoína). Los tres últimos fueron infecciones respiratorias de vías bajas (dos de ellos en tratamiento previo con levetiracetam y VPA). En todos los casos, se hizo despistaje de EIM con la metodología que se ha referido, sin resultados positivos.
En la actuación respecto a los controles seriados de amonio en sangre, se detectó que, en casi la mitad de los casos en estudio, la determinación analítica de la amoniemia se repitió solo una vez, preferentemente a las cuatro o seis horas después de la primera evaluación, y a las 24 horas. Solo en seis pacientes se realizaron determinaciones analíticas posteriores a las 24 h (Fig. 3). En los registros de las historias clínicas, estas medidas consecutivas presentan en muchos casos un aumento de los niveles de amonio, sin poder disponer de datos objetivos de la disminución de estos niveles en analíticas de control. Con este resultado, no se ha podido estimar el tiempo de respuesta a los tratamientos administrados. No obstante, los valores medios del amonio en la primera determinación fueron: 231 ± 70 (mediana 133) umol/l. En la determinación con más valores, a las 24h, se observa una clara disminución del amonio en sangre hacia la normalidad: 99 ± 20 (mediana 95) umol/l (Fig. 3). De los cinco niños con valores basales de amonio > 200 umol/l, en tres de ellos se asoció únicamente la administración previa de VPA. En relación a la terapia recibida para disminuir la hiperamoniemia, todos los niños recibieron algún tipo de tratamiento, bien con restricción proteica (n: 10), bien con quelantes (n: 10) o con ácido carglúmico (n: 12), o alguna combinación de los anteriores. Dieciséis pacientes recibieron quelantes y/o restricción proteica, sin conferir ambas en todos los pacientes, y tres tuvieron respuesta usando únicamente ácido carglúmico. Todos los episodios del estudio se resolvieron con estas terapias sin precisar hemodiálisis o hemodiafiltración.
Discusión
Este estudio pediátrico multicéntrico ha evaluado 19 pacientes pediátricos con EH sin EIM demostrados en los estudios realizados. Aunque la muestra es pequeña, también hay que valorar que es una entidad de baja incidencia, así como que estos casos están infradiagnosticados y, por tanto, es difícil alcanzar una muestra real. No obstante, es interesante destacar que se han recogido por primera vez las características clínicas con las que se han presentado estos episodios, como la edad de presentación muy temprana, o que los síntomas iniciales han sido graves, lo que indica que hay que hacer una llamada de atención sobre esta posibilidad diagnóstica. Además, en ellos se utilizaron diferentes tratamientos para la resolución de la hiperamoniemia, usando entre las opciones posibles el ácido carglúmico, reactivando así el ciclo de la urea.
En concreto, en pacientes que recibían medicación que se ha asociado a EH, casi la mitad de los pacientes estaban tomando VPA cuando apareció el episodio de hiperamoniemia. La EH inducida por VPA es un efecto adverso inusual (< 1/10.000 pacientes tratados), pero grave (5). Existen escasas publicaciones en el ámbito pediátrico acerca del efecto clínico tras una sobredosificación del VPA. No obstante, es sabido que ocasiona una clínica grave que puede desencadenar edema cerebral y muerte (6).
La hiperamoniemia inducida por antiepilépticos como el VPA parece estar infradiagnosticada, habiendo incluso autores que resaltan la primera presentación de este caso clínico en un niño de baja edad (7). Probablemente, es un efecto más frecuente que el realmente descrito en la literatura, al que no se le ha prestado la atención que requiere, y que no siempre está asociado a niveles altos del fármaco en sangre. De hecho, algunos autores han referido que el tiempo de tratamiento, la dosis, los niveles en suero del fármaco e incluso los niveles de amonio no parecen estar relacionados con el inicio o la severidad de la encefalopatía (8) y que es necesario un control regular de los niveles de los fármacos en sangre o saliva para evitar este efecto secundario (9). En el presente trabajo, se destaca una muestra multicéntrica con diferentes edades de presentación en el ámbito pediátrico y de diversas causas asociadas a la hiperamoniemia secundaria con la que los autores queremos resaltar la importancia de pensar en esta posibilidad ya que aparece con una sintomatología grave, para actuar precozmente y con un tratamiento adecuado.
Se han publicado algunos casos en los que se ha evaluado la respuesta de la hiperamoniemia inducida por VPA tras tratamiento con ácido carglúmico (10) y se han descrito respuestas rápidas a este tratamiento que sugieren una limitación de las secuelas neurológicas. El mecanismo por el cual se desarrolla la hiperamoniemia asociada a la administración de VPA todavía no está aclarado. Puede resultar de la estimulación de la glutaminasa en la corteza renal, el agotamiento de acetil CoA mitocondrial y la disminución de producción de NAG, pero también de la acumulación de propionato, un metabolito del valproato. La reducción de NAG hepático, activador de la primera enzima del ciclo de la urea, conduce a la reducción de la actividad en este (11).
Por otra parte, la adición de otros fármacos también puede precipitar la EH en pacientes previamente asintomáticos. Se han descrito casos en los que la asociación de varios antiepilépticos como el TPM y el VPA induce hiperamoniemia con mayor frecuencia (8,12-14). El TPM inhibe a la anhidrasa carbónica elevando los niveles de amonio y disminuyendo la síntesis de urea. Además, el TPM altera la actividad de la glutamina sintetasa cerebral, lo que aumenta el efecto de la hiperamoniemia. Otras drogas como la fenitoína, fenobarbital y carbamazepina también favorecen la síntesis de metabolitos tóxicos asociados al VPA (14). Entre los medicamentos psicotropos, además del VPA, la risperidona se ha relacionado con la aparición de EH en los niños al favorecer un aumento de VPA en suero por la competencia de esta en sitios de unión a determinadas proteínas (15).
Es también relevante destacar los casos de pacientes oncológicos con nutrición parenteral en los que se ha detectado hiperamoniemia tras sintomatología neurológica, en muchos casos potencialmente grave. En estos pacientes, es necesario aportar cantidades adecuadas de energía, macro y micronutrientes. Generalmente, se calculan adecuadamente los requerimientos proteicos, pero no es fácil predecir la intensidad del catabolismo proteico endógeno, que puede ser la causa de una descompensación metabólica. En los pacientes críticos, es habitual hacer controles de niveles de proteínas pero no de aminoácidos en plasma. El análisis del perfil de aminoácidos puede reflejar una alteración en el funcionamiento del ciclo de la urea que desencadene a su vez la hiperamoniemia secundariamente. Esta situación puede ser prevenible modificando la suplementación de la alimentación. En los casos que se presentan en este estudio, los pacientes tras trasplante de médula ósea solo recibían nutrición parenteral como forma de alimentación cuando ocurrió el episodio de hiperamoniemia, además de no tener suplementos como la arginina. El uso de técnicas como la gastrostomía podría ser esencial para asegurar una ingesta adecuada a largo plazo y como apoyo nutricional de más fácil control en diferentes áreas de la patología pediátrica, evitando también así algunas deficiencias. Sin embargo, no es utilizada comúnmente en niños con enfermedades oncológicas por la percepción del riesgo de complicaciones como las infecciones (16).
En relación al tratamiento para reducir los niveles de amonio en sangre, este está estandarizado en los casos de EIM conocidos e incluso protocolizado en los casos de hiperamoniemia de causa desconocida (17,18). Sin embargo, como se observa en este estudio, en general parece haber variabilidad en la práctica. Esto puede ser debido a la no disponibilidad de determinados fármacos o terapias de diálisis. Por otro lado, en la figura 3 se puede observar el retraso o no efecto en la actuación, llegando en muchas ocasiones a aumentar los niveles de amonio en las siguientes determinaciones.
En concreto, en los neonatos y lactantes pequeños, la hiperamoniemia es una verdadera emergencia con una alta mortalidad y complicaciones neurológicas en la mayoría de los supervivientes. Se requiere un tratamiento rápido e intenso, con el fin de normalizar la concentración de amoniaco tan rápido como sea posible. La N-carbamilglutamato (NCG) es un análogo de N-acetilglutamato que activa la N-acetilglutamato sintasa (NAGS). Esta molécula reduce los niveles plasmáticos de amoniaco y glutamina y aumenta la tasa de generación de urea en pacientes con determinados EIM como los trastornos del ciclo de la urea primarios, o las acidemias orgánicas (19). Sumado al tratamiento clásico, disminuye de forma rápida los niveles de amoniaco en plasma y en muchas ocasiones evita la necesidad de hemodiálisis o diálisis peritoneal (20). Hasta hace poco, la NGG se utilizaba solo después del fracaso del tratamiento clásico; no obstante, diferentes autores han recomendado administrar este fármaco para los recién nacidos tan pronto como se detecten severos episodios de hiperamoniemia de causa aún no conocida (20-22) y actualmente es un fármaco de primera línea en los protocolos (23).
Así, en pacientes incluso mayores con EH de causa no aclarada, también podría ser de utilidad. Incluso, se ha descrito que en pacientes con EIM que además precisan quimioterapia también puede administrarse este fármaco para prevenir este efecto secundario (16). Por ello, se podría plantear también su uso en aquellos pacientes en tratamiento previo con quimioterapia y sin otra patología metabólica congénita de base en los que se desencadena una hiperamoniemia secundaria. En nuestro estudio, la difícil disponibilidad de acceso al ácido carglúmico o el desconocimiento de su posible utilidad han podido ser la causa de no utilizarlo de forma estandarizada asociado al resto del tratamiento, para reducir los niveles de amonio en todos los pacientes (n: 12/19).
También en pacientes con enfermedad hepática crónica o progresiva, especialmente en los adultos en los que la prevalencia es mayor, podría plantearse su uso si hay hiperamoniemia asociada, aunque no hay estudios que refieran haber utilizado esta molécula para el tratamiento de esta complicación (24). De hecho, en el paciente con niveles muy elevados de amonio basales, > 1.000 umol/L, la causa fue un fallo hepático agudo, y estos valores descendieron de forma rápida tras la instauración de todo el tratamiento estándar con ácido carglúmico, quelantes, e incluso hemodiálisis. No obstante, son necesarios más estudios, incluso en pacientes pediátricos, para conocer el riesgo de hiperamoniemia asociado a patología hepática y las posibilidades de tratamiento con nuevos fármacos.
La carnitina también puede ser utilizada en determinados casos de EH, ya que disminuye el efecto tóxico hepático de la encefalopatía inducida por VPA (3,9). Respecto a la alimentación, las fórmulas enterales y/o parenterales suelen ser libres de carnitina y la suma de administración de varios antiepilépticos y un bajo peso son factores de riesgo para la deficiencia de carnitina en niños con epilepsia. Por ello, algunos autores recomiendan suplementar preventivamente en aquellos pacientes con riesgo de deficiencia de carnitina, así como en aquellos que están tratados con varios fármacos antiepilépticos, que son pacientes pediátricos, tienen discapacidad intelectual o alimentación parenteral (25). En nuestro grupo de pacientes no se determinó la carnitina en plasma, ni se registró que tomaran carnitina como suplemento, pero llama la atención que algunos casos aparecieran en pacientes con enfermedades crónicas y nutrición parenteral, por lo que la deficiencia de esta pudo ser uno de los factores favorecedores del desarrollo de la EH.
En conclusión, los resultados de este trabajo, aun con las limitaciones comentadas, sugieren que la hiperamoniemia secundaria puede estar infradiagnosticada en la etapa infantil ya que solo se detecta cuando aparece una sintomatología grave. Parecen ser pacientes de riesgo aquellos que reciben fármacos antiepilépticos o aquellos en una situación crítica con una alimentación restringida o un catabolismo proteico elevado. Por tanto, es destacable la necesidad de estudios con moléculas específicas que puedan modular un descenso precoz del amonio para evitar las secuelas neurológicas de la encefalopatía hiperamoniémica, además de reflexionar sobre la importancia de tener disponibilidad para realizar determinaciones de amonio urgentes en pacientes de riesgo, tratando la hiperamoniemia antes de que aparezca la clínica, mediante el cumplimiento de los protocolos establecidos para ello.
Agradecimientos
Los investigadores de este estudio quieren expresar su agradecimiento al personal de sus departamentos/servicios, los cuales han hecho posible la aportación conjunta de los casos presentados.
Bibliografía
1. Daniotti M, La Marca G, Fiorini P, Filippi L. New developments in the treatment of hyperammonemia: Emerging use of carglumic acid. Int J Gen Med 2011;4:21-8. [ Links ]
2. Star K, Edwards IR, Choonara I. Valproic acid and fatalities in children: A review of individual case safety reports in VigiBase. PLoS One 2014;9:e108970. [ Links ]
3. Lheureux PE, Penaloza A, Zahir S, Gris M. Science review: Carnitine in the treatment of valproic acid-induced toxicity - What is the evidence? Crit Care 2005;9:431-40. [ Links ]
4. Aires CC, Van Cruchten A, Ijlst L, De Almeida IT, Duran M, Wanders RJ, et al. New insights on the mechanisms of valproate-induced hyperammonemia: Inhibition of hepatic N-acetylglutamate synthase activity by valproyl-CoA. J Hepatol 2011;55:426-34. [ Links ]
5. Gramage Caro T, Vélez-Díaz-Pallarés M, Serna Pérez J, Bermejo Vicedo T. Carglumic acid for treatment of valproic acid-induced hyperammonaemia in a paediatric patient. Farm Hosp 2012;5:437. [ Links ]
6. Segura-Bruna N, Rodríguez-Campello A, Puente V, Roquer J. Valproate-induced hyperammonemic encephalopathy. Acta Neurol Scand 2006;114:1-7. [ Links ]
7. Grynnerup A, Sánchez Fernández I, Calzada Hernández J, Deyà Martínez A, Muchart López J, García-Alix A. A severe valproate overdose with complete recovery in a newborn. J Child Neurol 2012;27:1072-6. [ Links ]
8. Weise S, Syrbe S, Preuss M, Bertsche A, Merkenschlager A, Bernhard MK. Pronounced reversible hyperammonemic encephalopathy associated with combined valproate-topiramate therapy in a 7-year-old girl. Springerplus 2015;4:276. [ Links ]
9. Vázquez M, Fagiolino P, Maldonado C, Olmos I, Ibarra M, Alvariza S, et al. Hyperammonemia associated with valproic acid concentrations. Biomed Res Int 2014;2014:217269. [ Links ]
10. Pedrón Giner C, López Marín L, Quijada Fraile P, Lara Herguedas J, García-Peñas JJ, Duat Rodríguez A, et al. Valproate induced hyperammonaemic encephalopathy syndrome. Treatment with carglumic acid. J Inherit Metab Dis 2008;31(Suppl 1):S89. [ Links ]
11. Chopra A, Prakash Kolla B, Mansukhani MP, Netzel P, Frye MA. Valproate induced hyperammonemic encephalopathy: An update on risk factors, clinical correlates and management. Gen Hosp Psychiatry 2012;34:290-8. [ Links ]
12. Noh Y, Kim DW, Chu K, St Lee, Jung KH, Moon JH, et al. Topiramate increases the risk of valproic acid-induced encephalopathy. Epilepsia 2013;54:e1-4. [ Links ]
13. Hamer HM, Knake S, Schomburg U, Rosenow F. Valproate-induced hyperammonemic encephalopathy in the presence of topiramate. Neurology 2000;54:230-2. [ Links ]
14. Gómez-Ibáñez A, Urrestarazu-Bolumburu E, Viteri-Torres C. Hyperammonemic encephalopathy related to valproate, phenobarbital, and topiramate synergism. Epilepsy Behav 2011;21:480-2. [ Links ]
15. Carlson T, Reynolds CA, Caplan R. Case report: Valproic acid and risperidone treatment leading to development of hyperammonemia and mania. J Am Acad Child Adolesc Psychiatry 2007;46:356-61. [ Links ]
16. Martín-Hernández E, Quijada-Fraile P, Oliveros-Leal L, García-Silva MT, Pérez-Cerdá C, Baro-Fernández M, et al. Nutritional and pharmacological management during chemotherapy in a patient with propionic acidaemia and rhabdomyosarcoma botryoides. JIMD Rep 2012;6:73-8. [ Links ]
17. Grupo de consenso. Protocolo hipano-luso de diagnóstico y tratamiento de las hiperamoniemias en pacientes neonatos y de más de 30 días de vida. 2a ed. Madrid: Ergón; 2009. [ Links ]
18. Alfadhel M, Middle East Hyperammonemia and Urea Cycle Disorders Scientific Group (MHUSG). Guidelines for acute management of hyperammonemia in the Middle East region. Ther Clin Risk Manag 2016;12:479-87. [ Links ]
19. Valayannopoulos V, Baruteau J, Bueno Delgado M, Cano A, Couce ML, Del Toro M, et al. Carglumic acid enhances rapid ammonia detoxification in classical organic acidurias with a favourable risk-benefit profile: A retrospective observational study. Orphanet J Rare Dis 2016;11:32. [ Links ]
20. Filippi L, Gozzini E, Fiorini P, Malvagia S, La Marca G, Donati MA. N-carbamylglutamate in emergency management of hyperammonemia in neonatal acute onset propionic and methylmalonic aciduria. Neonatol 2010;97: 286-90. [ Links ]
21. Gebhardt B, Dittrich S, Parbel S, Vlaho S, Matsika O, Bohles H. N-carbamylglutamate protects patients with decompensated propionic aciduria from hyperammonaemia. J Inherit Metab Dis 2005;28:241-4. [ Links ]
22. Kasapkara CS1, Ezgu FS, Okur I, Tumer L, Biberoglu G, Hasanoglu A. N-carbamylglutamate treatment for acute neonatal hyperammonemia in isovaleric acidemia. Eur J Pediatr 2011;170:799-801. [ Links ]
23. Häberle J, Boddaert N, Burlina A, Chakrapani A, Dixon M, Huemer M, et al. Suggested guidelines for the diagnosis and management of urea cycle disorders. Orphanet J Rare Dis 2012;7:32. [ Links ]
24. Atluri DK, Prakash R, Mullen KD. Pathogenesis, diagnosis, and treatment of hepatic encephalopathy. J Clin Exp Hepatol 2011;1:77-86. [ Links ]
25. Fukada M, Kawabe M, Takehara M, Iwano S, Kuwabara K, Kikuchi C, et al. Carnitine deficiency: Risk factors and incidence in children with epilepsy. Brain 2014. doi: 10.1016/j.braindev.2014.12.004;S0387-7604(14) 00289-7. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Mercedes Gil-Campos.
Unidad de Metabolismo e Investigación Pediátrica.
Hospital Universitario Reina Sofía.
Av. Menéndez Pidal, s/n. 14004 Córdoba.
e-mail: mercedes_gil_campos@yahoo.es
Recibido: 10/12/2016
Aceptado: 08/03/2017