Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Nutrición Hospitalaria
versión On-line ISSN 1699-5198versión impresa ISSN 0212-1611
Nutr. Hosp. vol.34 supl.1 Madrid 2017
https://dx.doi.org/10.20960/nh.1237
Abordaje nutricional del paciente con diabetes mellitus e insuficiencia renal crónica, a propósito de un caso
Nutritional approach of the patient with diabetes mellitus and chronic kidney disease. A case report
Beatriz Torres Torres, Olatz Izaola Jáuregui y Daniel A. de Luis Román
Servicio de Endocrinología y Nutrición. Hospital Clínico Universitario de Valladolid. Centro de Investigación de la Facultad de Medicina. Universidad de Valladolid. Valladolid
Dirección para correspondencia
RESUMEN
La prevención y el tratamiento de la enfermedad renal crónica (ERC) en pacientes con diabetes ha sido un tema de gran interés a lo largo de los años. Para conseguir un adecuado control glucémico, una función renal estable y una reducción del riesgo cardiovascular, es fundamental un correcto aporte de hidratos de carbono, lípidos y proteínas.
Las medidas dietéticas realizadas se irán modificando a lo largo de la evolución de la ERC. La malnutrición energético-proteica es muy frecuente en pacientes con ERC y diabetes y es un importante predictor de morbimortalidad. Revisamos el manejo nutricional de un paciente diabético a lo largo de la progresión de su ERC.
Palabras clave: Enfermedad renal crónica. Diabetes mellitus. Malnutrición energético-proteica. Soporte nutricional.
ABSTRACT
The prevention and treatment of chronic kidney disease (CKD) in diabetes through diet and lifestyle have been a topic of much interest over the years. Consideration of the type and amount of carbohydrate, protein and fat is required for optimal blood glucose control, for clinical outcomes related to renal function and for consideration of risk reduction for cardiovascular disease.
Depending on the CKD stage different dietary changes should be considered protein-calorie malnutrition is common in chronic kidney disease patients and is a powerful predictor of morbidity and mortality. We review the nutritional management of a diabetic patient throughout the progression of their CKD.
Key words: Chronic kidney disease. Diabetes mellitus. Protein-energy wasting. Nutricional support.
INTRODUCCIÓN
La enfermedad renal crónica (ERC) afecta a un porcentaje alto de la población. En España se estima una prevalencia del 10% de los adultos (1) y está relacionado con condiciones patológicas, como el envejecimiento, la diabetes mellitus (DM), la hipertensión arterial (HTA) y la enfermedad cardiovascular.
La prevalencia de diabetes en España es el 13,8% de la población adulta (2), siendo la DM2 la principal causa de ERC y representado una morbilidad frecuente en la nefropatía no diabética.
En nuestro entorno, el 22% de los pacientes con DM2 tienen un filtrado glomerular estimado (FGe) por debajo de 60 ml/min/1,73 m2 (3). La prevalencia de DM1 en España es del 0,3% en España y el 15% desarrollará nefropatía diabética a lo largo de su enfermedad (4).
Además, la DM representa la principal causa de ERC avanzada en España y es responsable del 24,7% de los casos de tratamiento sustitutivo renal (5). La presencia de ERC es un importante marcador de morbimortalidad en los pacientes con DM, ya que se ha relacionado con un incremento del número de eventos cardiovasculares (CV) que será la principal causa de mortalidad en estos pacientes (6).
En la asociación de DM y ERC, un adecuado soporte nutricional es una pieza clave en el manejo de estos pacientes desde estadios precoces de la enfermedad.
CLASIFICACIÓN Y DEFINICIÓN DE ERC
La ERC está definida por las alteraciones en la estructura o función renal durante al menos 3 meses: un filtrado glomerular estimado (FGe) inferior a 60 ml/min/1,73 m2 o de lesiones renales estructurales (alteraciones histológicas en la biopsia renal) o funcionales (albuminuria, alteraciones en el sedimento urinario o en las pruebas de imagen) que puedan provocar potencialmente un descenso del FGe (7). Se han establecido diferentes estadios de ERC en función del FG, que se resumen en la tabla I.
Fisiopatología de la ERC en la DM
La enfermedad renal crónica en los pacientes con DM es secundaria fundamentalmente a concentraciones elevadas y mantenidas de glucosa, y a la hipertensión arterial (HTA).
Las concentraciones elevadas y mantenidas de glucosa causan glucosilación de las proteínas. Estos productos de glucosilación están asociados a daño vascular y cambios estructurales en el riñón que, asociados a un aumento de la presión intraglomerular e hiperfiltración (en pacientes con HTA), provocan una disfunción renal (8).
Factores de riesgo modificables en la progresión hacia ERC en pacientes con DM
Un deficiente control glucémico, la HTA o el hábito tabáquico son factores de riesgo (FR) conocidos en pacientes con DM y que van a ser factores hacia una progresión a ERC.
La obesidad está asociada a un incremento de la incidencia de ERC, y algunos expertos estiman que hasta en el 25% de los pacientes las ERC podrían prevenirse únicamente con la pérdida de peso (9). Además, la ERC y la DM son importantes marcadores de daño cardiovascular, por lo que el manejo del perfil lipídico se debe equiparar al de los pacientes con cardiopatía establecida (9,10).
El objetivo de control glucémico en los pacientes con ERC es de una Hba1c < 7% para evitar su progresión (9), aunque en pacientes con riesgo de hipoglucemia, un objetivo superior HbA1c > 7% será el adecuado (11). Debemos tener en cuenta que a medida que progresa la ERC el riesgo de hipoglucemia está incrementado por la disminución en el aclaramiento de la insulina y otros antidiabéticos orales, y por la reducción de la gluconeogénesis secundaria a disminución de la masa renal (10,12).
ETIOLOGÍA DE LA DESNUTRICIÓN EN PACIENTES CON ERC Y DIABETES MELLITUS
La desnutrición en la ERC, es multifactorial:
1. La toxicidad urémica tiene un papel principal en la desnutrición de los pacientes con ERC:
- Es en parte responsable de la anorexia y las náuseas que se manifiestan con una disminución espontánea de la ingesta de energía y proteínas a medida que la enfermedad progresa (13). Por otra parte, la disminución del aclaramiento de leptina y de los niveles de ghrelina contribuyen a una menor ingesta (14).
- Interfiere en la absorción de nutrientes, objetivados como cambios en la microbiota intestinal que se evidencia en la disminución en la producción de ácidos grasos de cadena corta y de los niveles de vitamina K (15-17).
- Es responsable del incremento de la insulin-resistencia por una disminución del aclaramiento de algunas hormonas contrarreguladoras como el cortisol o el glucagón, así como de la disminución de la acción biológica del IGF-1 (18).
2. Otros factores que contribuyen a una menor ingesta son:
- Las dietas restrictivas en proteínas, potasio, fósforo y sal. En los pacientes diabéticos añadiremos, además, dietas controladas en hidratos de carbono con alto índice glucémico.
- Dispepsia y disgeusia por la polimedicación y la uremia.
- En los pacientes diabéticos no debemos olvidar una de las complicaciones más importantes, la gastroparesia diabética, que puede llegar a ser el principal factor limitante en la ingesta oral.
- Anemia: por disminución de la secreción de eritropoyetina, induce anorexia. La corrección con eritropoyetina incrementa el apetito.
3. La acidosis metabólica: aumenta el catabolismo proteico por disminución de los niveles de bicarbonato sérico. Es fundamental su suplementación para mejorar el estado nutricional (19).
4. Síndrome de malnutrición-inflamación-arteriosclerosis (síndrome MIA): fundamentalmente en pacientes en diálisis. Este concepto se propuso para definir la gran relación entre malnutrición, inflamación y arteriosclerosis, y cómo se potencian entre sí estas tres entidades. La inflamación crónica induce la formación de citokinas inflamatorias y la activación del catabolismo proteico. Las citokinas proinflamatorias también suprimen el apetito aumentando la malnutrición (20).
Por lo tanto, las enfermedades intercurrentes deben ser tratadas, porque incrementan el catabolismo proteico y pueden disminuir la eficacia del soporte nutricional.
5. Factores endocrinológicos: a medida que progresa la ERC, los niveles de PTH se van incrementando secundariamente a la acumulación de fósforo sérico y al descenso de la producción de vitamina D.
6. Factores relacionados con el tratamiento renal sustitutivo (TRS):
- Durante el TRS existe un incremento del catabolismo proteico, así como una pérdida de proteínas y aminoácidos. Por lo que en estos pacientes están incrementados los requerimientos de proteínas.
- Los requerimientos de vitaminas hidrosolubles y algunos oligoelementos están aumentados por su aclaramiento durante el TRS.
- Inflamación relacionada con el TRS (14).
- Los pacientes con TRS tienen mayor número de complicaciones infecciosas e ingresos hospitalarios (21).
VALORACIÓN NUTRICIONAL Y CONSUNCIÓN ENERGÉTICO-PROTEICA (PROTEIN ENERGY WASTING, PEW)
Desde hace años se han publicado estudios demostrando que cuando la malnutrición está presente en pacientes con ERC, el riesgo de mortalidad aumenta. En 2008 se planteó que el término PEW era más adecuado que el de malnutrición en estos pacientes con ERC, porque se hacía hincapié en la gran influencia de la inflamación, uremia y catabolismo en el estado nutricional. En los pacientes con diagnóstico de PEW se ha descrito un incremento de la morbimortalidad y una disminución de la calidad de vida (22).
La PEW se caracteriza por la pérdida de las reservas de proteínas y energía asociadas a múltiples desarreglos metabólicos, muchos de ellos característicos de la PEW. La prevalencia de PEW variará según el estadio renal: se estima el 20-25% de los pacientes en estadios 3-4, incrementándose con la progresión de la ERC, pudiendo alcanzar hasta el 75% de los pacientes en estadio 5 (14).
Además, los pacientes con diabetes tienen mayor incidencia de PEW, probablemente por el efecto negativo de la insulin-resistencia sobre el metabolismo proteico. Además, algunas de las complicaciones crónicas de la diabetes, como la gastroparesia diabética, son determinantes en muchos pacientes en la aparición de PEW (23). Por tanto un adecuado manejo de la diabetes y de la insulin-resistencia es importante en la prevención de PEW.
Métodos de valoración nutricional en el paciente con ERC
La valoración global subjetiva (VGS) es una adecuada herramienta para el diagnóstico de desnutrición en los pacientes con ERC (24,25). Posteriormente, los mismos autores desarrollaron el Malnutrition Inflammation Store (MIS), basado en la VGS al que se han añadido los parámetros de índice de masa corporal, albúmina sérica y transferrina sérica, también validada en pacientes con ERC (26). El diagnóstico de malnutrición con cualquiera de estas dos herramientas es un signo de mal pronóstico e incrementa la tasa de mortalidad (24,26).
Para el diagnóstico de PEW se han propuesto unos parámetros de 4 categorías diferentes; se debe cumplir al menos un parámetro de 3 de las 4 categorías (22):
1. Ingesta de alimentos: se puede evaluar mediante una encuesta nutricional:
- Ingesta calórica < 25 kcal /día durante 2 meses.
- Ingesta proteica < 0,8 g/kg peso de proteínas en pacientes en diálisis. < 0,6 g/kg peso prediálisis.
2. Cambios ponderales:
- IMC < 23 kg/m2.
- Pérdida de peso involuntaria: > 5% en 3 meses o > 10% en 6 meses.
- Porcentaje de compartimento graso total < 10%.
3. Compartimento muscular:
- Pérdida de masa muscular: > 5% en 3 meses o > 10% en 6 meses.
- Disminución del compartimento muscular del brazo (CMB) > 10% respecto al percentil 50 de población de referencia.
4. Datos bioquímicos:
- Albúmina < 3,8 g/dl.
- Prealbúmina < 30 g/dl.
- Colesterol total < 100 mg/dl.
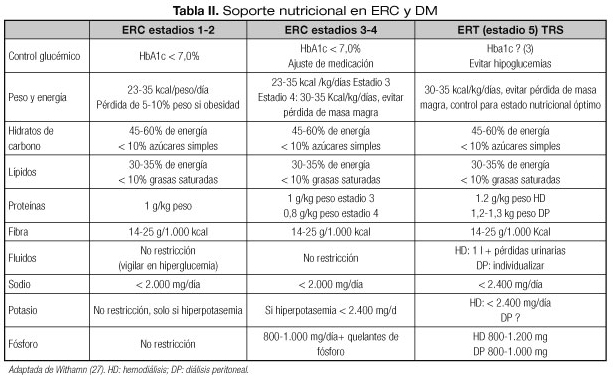
MANEJO NUTRICIONAL EN EL PACIENTE CON ERC y DM (Tabla II)
El manejo nutricional será diferente en función del estadio renal en el que nos encontremos. A medida que progresa la ERC, la prevalencia de PEW y malnutrición se va incrementando, por lo que deberemos estar más atentos a la evolución de nuestros pacientes. Los pacientes que inician TRS incrementarán el aporte de proteínas, pero continuarán con restricciones en sodio, potasio y fósforo.
Proteínas
Las recomendaciones sobre el aporte diario de proteínas se modificarán con la progresión de la ERC. En el paciente diabético el aporte de proteínas potencia el efecto de la insulina endógena, promoviendo la saciedad, por lo que la restricción de estas es un tema controvertido.
Clásicamente, la recomendación de dietas restrictivas en proteínas era la norma. Se basaba en el hecho de que una dieta hiperproteica (una ingesta de proteínas 1,2-1,4 g/kg peso) se relacionaba con una hiperfiltración y acumulación de toxinas urémicas que podrían ser responsables de la progresión de la ERC (27).
Aunque es cierto que varios estudios han demostrado cómo una disminución de la ingesta proteica de 0,2 g/kg/día es suficiente para registrar una mejoría metabólica en niveles de urea, acidosis metabólica e hiperfosfatemia (28), en la mayor parte de estudios, las dietas, inicialmente, eran hiperproteicas.
Por ello, en las últimas guías clínicas de American Diabetes Association (ADA) y del National Institute of Health and Care Excelence (NICE) (10,29), las recomendaciones en estadios 1-3 sobre el aporte de proteínas es de una dieta normoproteica, intentando no superar un aporte diario de 1 g/kg de peso, y de 0,8 g/kg de peso en estadio prediálisis más avanzados, siendo más del 50% de las proteínas aportadas de alto valor biológico. No recomiendan ingestas menores porque no se ha comprobado una disminución en la progresión del deterioro del FG en estadios avanzados de ERC y, sin embargo, las dietas muy restrictivas desde el punto de vista proteico, pueden contribuir a un deterioro de su estado nutricional.
Además, los pacientes con proteinuria deberán añadir un 1 g de proteínas de alto valor biológico por cada gramo de pérdida de proteínas por orina (18).
Solo en pacientes en estadio 5 no candidatos a terapia renal sustitutiva, el aporte de proteínas será de 0,6 g/kg (con más del 60% de alto valor biológico) o de 0,3 g/kg, pero suplementadas con aminoácidos esenciales o cetoanálogos para ralentizar la progresión y disminuir la sintomatología urémica (18).
Sin embargo, el tratamiento con TRS incrementa las pérdidas y el catabolismo de proteínas, por lo que en estos pacientes el aporte proteico debe incrementarse: en los pacientes con hemodiálisis (HD) en 1,2-1,4 g/kg/día y en los pacientes con diálisis peritoneal en 1,2-1,3 g/kg/día (> 50% de alto valor biológico) (27).
Aporte de energía
En estadios iniciales de ERC, la obesidad tiene una elevada prevalencia en pacientes con DM2. La propia obesidad es un factor de riesgo para el desarrollo de ERC y de su progresión. En estadio 1-3 se recomienda una ingesta calórica de 23-35 kcal/kg, similar a pacientes sanos, recomendando en pacientes con obesidad o sobrepeso una pérdida del 5-10%. Sin embargo, en estadios avanzados de ERC (4-5) y en pacientes con TRS un IMC elevado es un factor de protección (30) por lo que hay que ser cauto en las recomendaciones de dieta hipocalórica y se recomienda un mayor aporte calórico de 30-35 kcal/kg para conseguir un balance nitrogenado neutro o positivo, fundamentalmente en los pacientes con restricción proteica (9,14).
Lípidos
La ERC y la diabetes mellitus son dos entidades asociadas a un alto riesgo de enfermedad cardiovascular, por lo que desde el inicio se recomienda reducir ingesta de alcohol, grasas trans y saturadas. Los ácidos grasos omega 3 podrían tener efectos beneficiosos en la progresión hacia peores estadios de ERC, con reducciones de la proteinuria, aunque los datos son limitados (3,10).
Carbohidratos
Se recomienda un aporte del 45-60% de las kilocalorías totales y en su mayoría carbohidratos complejos. Evitar los carbohidratos con elevado índice glucémico se podría justificar por un mayor control de la glucemia pospandrial (31), aunque muchos de los alimentos con bajo índice glucémico son ricos en potasio (vegetales, frutas), por lo que en estadios avanzados se deberán realizar técnicas para disminuir el aporte de potasio de estos alimentos (27). Una ingesta de fibra de 15-25 g/1.000 kcal es la recomendada, pero en estadios avanzados de la enfermedad (estadios 4 y 5) es difícil conseguir estos requerimientos porque es fundamental el control en la ingesta de fósforo y potasio.
Sodio
Las dietas con alto aporte de sodio están asociadas con elevación de la presión arterial, empeoramiento de la proteinuria y una menor respuesta al tratamiento con bloqueadores del sistema renina-angiotensina-aldosterona.
Las recomendaciones generales son de hasta 2 g al día de sodio en estadios 1-4 (32).
Sin embargo, los pacientes con DM, se podrían beneficiar de restricciones mayores (1,2-1,5 g/24 h) no solamente por su efecto sobre la presión arterial sino también porque la dieta hiposódica tiene un efecto beneficioso sobre la insulin-resistencia (27).
Potasio
El 90% del potasio administrado en la dieta es eliminado por el riñón. La hiperpotasemia aparece por una disminución de la excreción renal de potasio y de la salida del potasio intracelular durante el catabolismo tisular causado por una enfermedad aguda y la presencia de acidosis (32).
Los niveles de potasio pueden comenzar a elevarse desde ERC estadio 3, estos niveles son los que van a determinar cuándo iniciar medidas para el control de potasio:
- Se recomienda una ingesta de potasio en ERC prediálisis de 1.500-2.000 mg/día, aunque en pacientes con diuresis elevadas la elevación de potasio es menos pronunciada y una ingesta de hasta 3.000 mg/día sería adecuada.
- En pacientes en HD las recomendación de ingesta de potasio es de 1.500-2.000 mg/día y en pacientes con diálisis peritoneal de 2.000-3.000 mg/día (18).
Fósforo
Como con los niveles de potasio, los de fósforo se elevarán con la progresión de la ERC (desde estadios 3). La elevación de fósforo o de la PTH nos alertará sobre cuándo comenzar con medidas nutricionales. Se recomienda una ingesta de fósforo 400-700 mg/día (500-1.200 mg/día en TRS). Es una restricción difícil de llevar a cabo únicamente con medidas dietéticas, por lo que es fundamental asociar quelantes de fósforo durante las comidas. Los quelantes de fósforo son sustancias fijadoras de fósforo que disminuyen la absorción intestinal de este.
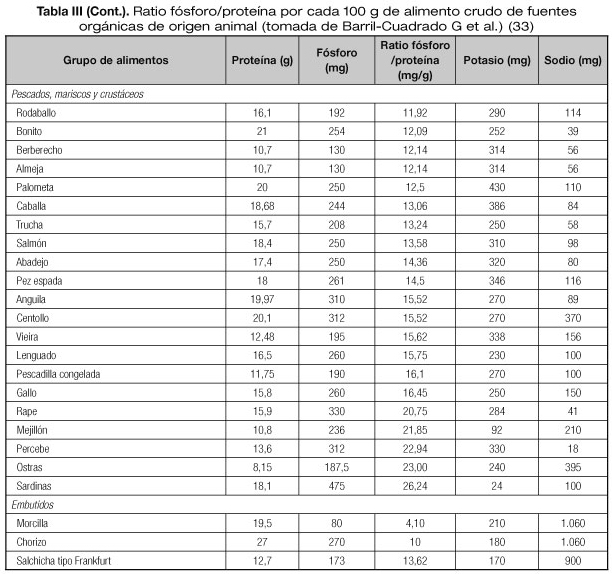
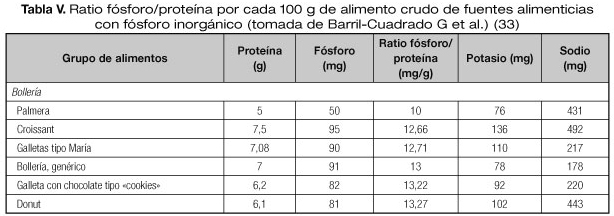
Cuando se realizan medidas higiénico-dietéticas para el control del fósforo, se debe recordar la estrecha relación entre contenido de fósforo y las proteínas de los alimentos, por lo que es difícil la restricción del fósforo sin una restricción de la ingesta proteica, fundamentalmente en pacientes en TRS. Una manera de evitar una restricción en la ingesta de proteínas de estos pacientes es utilizar el ratio fósforo (mg)/proteína (g) de un alimento dado, de manera que se podrá aportar la cantidad necesaria de proteínas con alimentos proteicos con menor contenido de fósforo. Las guías K/DOQI recomiendan una ratio de 12-16 mg fósforo/g de proteína (33).
Además, se ha de tener en cuenta si el fósforo aportado en la dieta es orgánico o inorgánico. El fósforo orgánico está presente en los alimentos naturales, y el inorgánico en los alimentos procesados (añadidos como aditivos). La absorción intestinal del fósforo orgánico es del 40-60% y del inorgánico del 90-100%. Por este motivo, una de las recomendaciones para el control en la ingesta de fósforo es evitar los alimentos procesados.
Se han elaborado tablas ratio fósforo/proteína a las que se han añadido contenido de sodio y potasio (Tablas III-V). La limitación de estas tablas son los escasos datos aportados en los alimentos procesados sobre el aporte real de fósforo inorgánico (33).
Manejo de la acidosis metabólica
La acidosis metabólica durante los estadios avanzados de ERC es secundaria al incremento de la producción de ácidos del catabolismo de nutrientes, del catabolismo tisular y de la disminución sérica de bicarbonato. En las primeros estadios de la ERC ocurre una adaptación renal, pero cuando el FGE < 40 ml/min/1,73 m2, esta adaptación ya no es eficiente. Se recomienda suplementación con bicarbonato cuando este en suero sea inferior a 22 mmol/l y FGE < 30 ml/min/1,73 m2 (9,29). La acidosis metabólica está relacionada con el aumento del catabolismo proteico, por lo que su tratamiento es primordial para garantizar la eficacia del soporte nutricional.
Micronutrientes
El déficit de vitaminas es habitual en pacientes con estadios avanzados de ERC y el TRS. Hay varias causas entre las que está la disminución de la ingesta (dietas restrictivas, anorexia), el aclaramiento durante el TRS, o la disminución de formas activas. La restricción dietética en estos pacientes limita, fundamentalmente, la ingesta de vitaminas hidrosolubles presentes en comidas ricas en fósforo y potasio (frutas y verduras). No existe un consenso sobre la suplementación universal de todas las vitaminas hidrosolubles. Se recomienda el aporte de ácido fólico y vitamina C en pacientes con TRS (34,35).
Dentro de las vitaminas liposolubles se recomienda la suplementación de vitamina D, en los pacientes con ERC, para alcanzar niveles de 25 hidroxi vitamina D < 30 ng/ml (18). Otros micronutrientes que pueden ser deficitarios en pacientes con ERC son el zinc, selenio (35), sin que hasta el momento se hayan establecido unas claras pautas para su suplementación (36).
CASO CLÍNICO
Presentamos el caso de un varón de 75 años que acude al Servicio de Nutrición Clínica en 2011 para control metabólico. Es derivado desde el Hospital Comarcal para manejo de su diabetes mellitus. En un ingreso reciente en el Servicio de Medicina Interna por un síndrome de hipoventilación en paciente con obstrucción crónica del flujo aéreo conocido, se realiza diagnóstico de ERC. Conoce diabetes mellitus tipo 2 desde hace 18 años, en tratamiento con metformina 1.000 mg (1-0-1). No ha realizado controles de su diabetes desde hace 4 años. Además, HTA en tratamiento con enalapril 20 mg (1-0-0). Como complicaciones microangiopáticas se observa una ERC probablemente secundaria a nefropatía diabética, asociada a clínica de disfunción eréctil de años de evolución. Es remitido a nuestras consultas con la siguiente analítica:
Hb: 13.3; Hto: 33%; HbA1c: 8,7%; glucemia plasmática: 144 mg/dl; colesterol total: 240 mg/dl; colesterol-LDL: 152 mg/dl; colesterol-HDL: 52 mg/dl; triglicéridos: 179 mg/dl; ác. úrico: 3,7 mg/dl; creatinina: 1,67 mg/dl; urea: 65 potasio: 4,5 mEq/l; sodio 145 mEq/l FGe: 42 ml/m/1,73 m2, PTH 58,86 pg/l, albúmina 4,2 g/dL; fósforo: 3,5 mg/dl; prealbúmina: 35 mg/dl; bicarbonato sérico: 27 meq/l.
Durante la exploración física no se observaron edemas en extremidades. Presentó una tensión arterial de 150/95 mmHg con una frecuencia cardiaca: 64 lpm. Peso 101 kg, índice de masa corporal (IMC): 35,75 kg/m2.
Por tanto, es un paciente obeso con una DM2 de larga evolución y deficiente control metabólico y de su presión arterial, con una ERC estadio 3 secundaria a nefropatía diabética. Para poder establecer un correcto soporte nutricional se debe realizar una valoración nutricional adecuada, así como conocer cuáles son los hábitos dietéticos del paciente. Como se ha comentado previamente (24), la valoración global subjetiva es una herramienta validada en pacientes con ERC. En nuestro paciente, sin alteraciones en la ingesta, sin disminución de peso y parámetros nutricionales no alterados, cumplía criterios de grado A (normonutrido).
La ingesta nutricional se valoró con una encuesta nutricional (Tabla VI). En nuestro caso, debemos recordar que nuestro paciente presentaba una obesidad grado 2, por lo que los requerimientos de energía y nutrientes se establecieron en función del peso ajustado.
En los pacientes obesos con IRC se aconseja calcular el peso ajustado mediante la siguiente fórmula:
Peso ajustado = [(peso real – peso ideal)] x 0,25 + peso ideal

(Peso ideal: 64,92 kg; peso ajustado: 73,94 kg)
Los requerimientos de energía y nutrientes deben individualizarse según el estadio de la ERC. Una ingesta energética de 23-35 kcal/kg/día permite alcanzar y/o mantener un balance nitrogenado neutro en una IRC-3. En nuestro paciente se estimó un aporte calórico de 25 kcal/kg/día a partir del peso ajustado, siendo necesario un aporte de 1.848,5 kcal/día. Las recomendaciones de proteínas para nuestro paciente en ERC-3 se establecieron en 1 g/kg/día, por lo que se estimó un aporte proteico a partir del peso ajustado (73,94 g/kg/día).
No nos debemos olvidar de administrar una dieta equilibrada en cuanto al aporte de hidratos de carbono (HC) y lípidos para evitar la utilización de la proteína como sustrato energético. El aporte recomendado de HC en ERC y DM es de 55-60% de la energía total/día con predominio de los HC complejos para prevenir la hiperglucemia asociada a insulin-resistencia. En pacientes con DM, ERC, e HTA los requerimientos de sodio recomendados son < 2 g/día (27,35).
A nuestro paciente se le proporcionaron medidas higiénico-dietéticas para el control del aporte calórico y de los macronutrientes, así como unas recomendaciones de restricción de sodio (Tabla VII).
Para evitar la progresión y la aparición de la ERC crónica es fundamental un adecuado soporte nutricional, aunque debemos recordar que los factores que más van a repercutir en su progresión y su aparición van a ser un adecuado control metabólico y de los niveles de presión arterial (3).
Para el manejo de su diabetes se redujo la dosis de metformina a 1.000 mg diarios por el grado de ERC (3) y se asoció tratamiento con insulina Glargina 22 U por la noche con ajuste progresivo, y se añadió enalapril 20 mg 1 cp al día y 20 mg atorvastatina.
Tres meses después acude nuevamente a la consulta de Nutrición Clínica con la siguiente analítica: HbA1c- 7,2%; glucosa: 98 mg/dl: Cr. 1,63; FGe: 44 mg/min/1,73; peso: 92 kg, IMC: 33,4 kg/m2; TA: 135/77 mmHg, por lo que se refuerza la implementación de medidas higiénico-dietéticas y se remite a su centro de referencia.
Cinco años después acude a urgencias de nuestro hospital por cuadro de 5 meses de evolución de saciedad precoz, distensión abdominal posprandial, hiporexia que en las últimas 3 semanas ha empeorado comenzando con vómitos alimentarios y pérdida de 8 kg de peso. En tratamiento con insulina Glargina (20 UI por la noche), metformina 1000 mg cada 24 horas, enalapril 20 mg y atorvastatina 20 mg. Tras reposición hidroelectrolítica endovenosa y estabilización del paciente se solicita consulta para nueva valoración nutricional.
Presenta la siguiente analítica:
- Creatinina: 3,0 mg/dl; urea: 110 mg/dl; potasio: 5,5 mEq/l; Na: 140 mEq/l.
- FGe: 22 ml/m/1,73 m2; PTH 110 pg/l; fósforo: 6 mg/dl.
- Albúmina: 3,1 g/dl; bicarbonato: 19 meq/l.
- Hb: 10,2 g/dl; Hto: 31%; HbA1C: 5,7%; glucemia plasmática: 56 mg/dl; colesterol total: 97 mg/dl; colesterol-LDL: 40 mg/dl; colesterol-HDL: 40 mg/dl; triglicéridos: 80 mg/dl.
Nos encontramos con un paciente con diabetes de larga evolución y complicaciones microvasculares asociadas, con una clínica larvada de años de evolución de náuseas, sensación de plenitud precoz y agudización en las últimas semanas. Con un posible diagnóstico de gastroparesia diabética, se realiza gastroscopia, en la que se observa abundante contenido gástrico, sin obstrucción mecánica asociada.
La gastroparesia diabética es una alteración de la motilidad gástrica caracterizada por un retraso del vaciamiento gástrico. Cuando se manifiesta suelen existir otras complicaciones microvasculares asociadas. Los síntomas habituales son saciedad precoz, náusea, vómitos y disconfort abdominal superior. Los síntomas más habituales son las náuseas (37). La prueba “gold standard” para su diagnóstico es la gammagrafía de vaciamiento gástrico (38). Los pacientes con gastroparesia diabética son más susceptibles a sufrir un deterioro del estado nutricional y, en nuestro paciente, además, un deterioro de su ERC.
El manejo de la gastroparesia diabética inicialmente debe incluir (38):
- Adecuado control metabólico de la diabetes para reducir el efecto inhibitorio de la hiperglucemia sobre la motilidad gástrica.
- Medidas higiénico-dietéticas que favorezcan, o por lo menos no retrasen, el vaciamiento gástrico.
- Tratamiento con fármacos procinéticos.
Presenta ta: 96/56 mmHg. Fc: 102 lpm. Edemas en extremidades inferiores (refiere que habitualmente presenta diuresis buena y que los últimos días ha sido escasa). Actualmente el paciente se encuentra en una ERC estadio 4 con (FG 21 ml/m/1,73).
El peso habitual del paciente en los 2 últimos años ha sido de 85 kg. Hace 3 meses tenía un peso de 80 kg y el peso actual es de 72 kg, IMC 27,43 kg/m2. Circunferencia muscular braquial de 19 cm: pérdida de peso del 10% en 3 meses.
Tras realizar una exhaustiva valoración de su ingesta y de los parámetros nutricionales, el paciente cumple criterios de PEW:
1. Alteración de los parámetros bioquímicos (bajos niveles de albúmina, prealbúmina o colesterol). En el caso de nuestro paciente presentaba albúmina 3,1 g/dl, prealbúmina 17 mg/dl y un colesterol de 97 mg/dl.
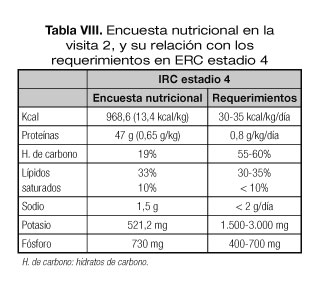
2. Pérdida de peso asociada a inadecuación de la ingesta proteica y energética. El paciente presentaba una pérdida de peso de 8 kg (< 10%) y una ingesta escasa cuantificada mediante encuesta de 2 días (Tabla VIII).
3. Depleción de la masa muscular (sarcopenia). Circunferencia muscular del brazo 10% inferior al P50.
4. Ingesta menor a 20 kcal/kg peso.
Tras la realización de la VGS, y debido a que existía pérdida de peso, disminución de la ingesta alimentaria y disfunción gastrointestinal, el paciente se encuentra en un grado B (moderadamente o sospecha de estar desnutrido) (Fig. 1).
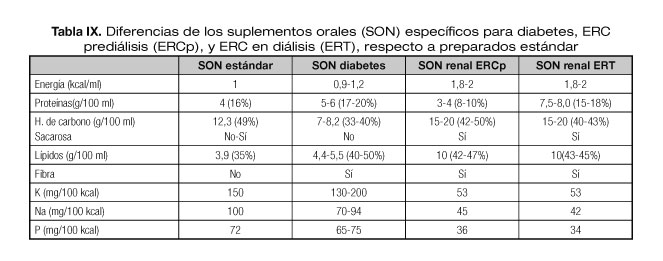
Para revertir esta situación de PEW, en nuestro paciente se prescribió suplemento nutricional oral específico para pacientes renales prediálisis (400 kcal + 8 g proteínas) (Tabla IX), aportando un brik al día repartido durante todo el día, para completar ingesta además de dieta fraccionada controlada en fósforo, potasio y sodio, de 1.800 kcal + 50 g proteínas.
En los pacientes en los que no es posible un adecuado soporte nutricional únicamente con medidas higiénico-dietéticas, el soporte nutricional artificial es fundamental.
Los pacientes candidatos a soporte nutricional artificial son aquellos con ingestas orales disminuidas, parámetros bioquímicos alterados o criterios de PEW (Fig. 2). Cuando añadimos suplementos orales nutricionales (SON) podemos incrementar hasta en 10 kcal/día y 0,3-0,4 g de proteínas por kg de peso (39).
Los preparados nutricionales específicos para pacientes con ERC son hipercalóricos, controlados en sodio, potasio y fósforo (Tabla IX). Los preparados para ERC prediálisis son hipoproteicos (8-10% del contenido calórico), y los específicos de TRS son hiperproteicos (17-19% del aporte calórico total).
Por otro lado, hay SON específicos para pacientes con diabetes, sin restricción en fósforo, sodio, potasio y normocalóricos (normo/hiperproteicos). Estos SON contienen carbohidratos complejos, con menor índice glucémico, y logran un mejor control de las glucemias postprandiales y menores requerimientos de insulina (40,41).
El uso de uno u otro dependerá de la situación clínica del paciente y de cuál sea su patología predominante. En nuestro paciente con niveles de glucemia controlados con dosis bajas de insulina, y elevación de potasio y fósforo, gana más peso el uso de preparados específicos para ERC prediálisis.
Se pauta tratamiento para gatroparesia con metoclopramida, además de ajustar el tratamiento para su diabetes (ya se había suspendido la metformina), junto con medidas higiénico- dietéticas para facilitar el vaciamiento gástrico (Tabla X).
Tras garantizar un correcto cumplimiento del SON y dietético, el paciente es dado de alta con dieta fraccionada controlada en potasio, fósforo y sodio (Tabla VI), a la que se asoció suplementación oral con SON específico de ERC prediálisis, con un aporte diario de 1.900 kcal, 58 g de proteínas, 1.000 mg potasio, 1,5 g sodio y 800 mg de fósforo. Al alta, el paciente inició tratamiento con bicarbonato oral, quelantes de fósforo y eritropoyetina recombinante.
El tratamiento al alta fue:
- Insulina Glargina 20 UI por la mañana.
- Metoclopramida 10 mg (antes de las comidas principales).
- Resin Calcio sobres de 15 gramos (con el desayuno, comida y cena).
- Darbopoetina una inyección subcutánea cada 30 días.
- Enalapril 20 mg: 1 comprimido en desayuno.
- Bicarbonato sódico sobres de 1 gramo: 1 sobre en desayuno, comida y cena.
- Furosemida 40 mg: medio comprimido en desayuno.
- Atorvastatina 40 mg: 1 comprimido en la cena.
Cuatro meses después del alta hospitalaria y ante el deterioro mantenido de función renal FGE < 20 ml/min/1,73 m2, el paciente ingresa en el Servicio de Cirugía Vascular para realización de fístula arteriovenosa para comenzar con HD en los próximos meses. Durante dicho ingreso, el paciente presenta una sepsis, tras la realización de fístula, que precisa ingreso en UCI durante 4 días. Tras el alta a planta hospitalaria, con hemodiálisis diaria, inicia tolerancia oral con sensación de plenitud y vómitos de repetición.
Solicitan entonces interconsulta a Nutrición Clínica:
En la exploración física: peso seco: 67 kg; talla: 1,66 m; IMC: 24,3 kg/m2; no edemas.
Analítica: Cr 4,5 mg/dl; urea 200 mg/dl; albúmina: 2,7 g/dl; prealbúmina: 20 mg/dl.
FGe: 12 ml/min/1,73 m2; colesterol total: 70 mg/dl: HbA1c: 5%; glucemia: 65 mg/dl; bicarbonato 17 meq/l.
La tolerancia oral es menor a 700 kcal día, con un aporte de proteínas de 30 g/24 h, con vómitos de repetición, en un paciente con diagnóstico previo de gastroparesia diabética asociada a una situación de toxicidad urémica y desnutrición severa (VGS grado C).
En pacientes con PEW una ingesta espontánea menor de 20 kcal/día y situación de estrés catabólico asociado, lo más adecuado es un soporte nutricional artificial completo (Fig. 2), ya que con un soporte nutricional complementario no se alcanzarían requerimientos nutricionales.
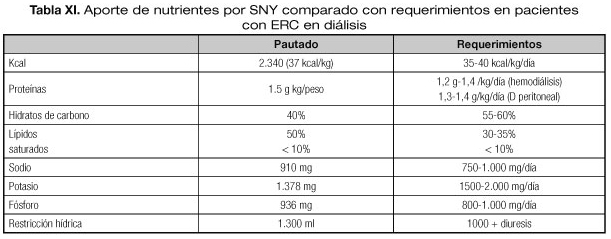
En nuestro paciente que presentaba una mala tolerancia gástrica, se decidió nutrición enteral (NE) por sonda nasoyeyunal (SNY) de doble luz, para permitir simultáneamente la aspiración y descompresión gástrica con el aporte de nutrientes a nivel intestinal.
La alimentación enteral siempre es preferible a la parenteral con intestino funcionante ya que es más fisiológica con menor número de complicaciones graves y se asocia a una menor prevalencia de hiperglucemia (42).
Se administró una fórmula específica para ERT polimérica hiperproteica para insuficiencia renal (Tabla IX) comenzando con ritmos de infusión bajos. Tras garantizar tolerancia se incrementó el aporte de NE progresivamente hasta alcanzar 1.300 ml/día.
En las primeras 24 horas, por la luz gástrica, se aspiraron 800 cc de secreciones gástricas. Se asoció metoclopramida endovenosa y se inició tratamiento con insulina Glargina 16 U/24 horas, con una pauta de rescate de insulina regular cada 6 horas. Setenta y dos horas después del inicio de la NE se alcanzó un adecuado control glucémico.
En la tabla VII se resumen las características de la NE por la SNY que fue administrada al paciente. Vemos cómo el aporte de proteínas, fósforo, sodio y potasio es adecuado a las recomendaciones, pero teniendo en cuenta que nuestro paciente es diabético, la composición de macronutrientes es adecuada, pero con menor cantidad de hidratos de carbono complejos.
El paciente recibió durante 10 días dicha fórmula, presentando mejoría analítica; toleró adecuadamente la NE, con deposiciones poco abundantes, de características normales. Después de 3 días sin salida de contenido gástrico por luz gástrica se decide iniciar tolerancia oral.
La transición desde la NE a la oral debe hacerse lentamente hasta asegurarnos de que es capaz de ingerir al menos un 70% de las necesidades calóricas diarias (39). Una forma útil de realizarla es mediante la NE cíclica nocturna a la vez que se estimula la ingesta oral durante el día. Tras 4 días con nutrición enteral nocturna y adecuada tolerancia oral se retira SNY y se complementa ingesta oral con SON específico para pacientes con ERC en TRS (Tabla IX).
En el momento de empezar la diálisis y 2 horas posdiálisis se realiza al paciente una bioimpedanciometría (BIA). Es un método que está cobrando fuerza como herramienta de apoyo en la evaluación del estado de hidratación y nutrición, si bien, en pacientes renales, ha tenido problemas de aplicación práctica dado que puede dar lugar a estimaciones no fiables en pacientes con hidratación anómala (43).
Se basa en el principio de que los tejidos corporales ofrecen diferentes oposiciones al paso de corriente eléctrica. Los componentes resistencia (R) y reactancia (Xc) son comúnmente relacionados con el contenido de agua corporal y la capacidad de la célula de almacenar energía, respectivamente. Clínicamente, R determina el estado de hidratación y Xc el estado nutricional (44).
La interpretación de los datos de la BIA se realiza mediante la bioimpedancia vectorial o análisis vectorial (BIVA), que además de la resistencia tiene en cuenta la reactancia y, con ambas, se obtiene el vector de impedancia Z, que es representado gráficamente mediante el gráfico RXc (45) (Fig. 3).
Este gráfico está estandarizado por altura y en él figuran las elipses que indican el 50%, 75% y el 95% de tolerancia en población sana, siendo distintas según el sexo y la raza. Dependiendo de la situación del vector con respecto a las elipses se puede conocer si los estados de hidratación y nutrición del paciente están dentro de la normalidad (44).
Cuando el vector de impedancia de un paciente cae fuera de la elipse de tolerancia al 75% es posible identificar si esta alteración es debida a su estado de hidratación o de nutrición según el desplazamiento del vector sobre los ejes.
En el caso de nuestro paciente se obtuvo el siguiente análisis vectorial (Fig. 4): se observaron diferencias significativas entre los vectores pre y posdiálisis. En la prediálisis el paciente mostró un patrón vectorial de sobrehidratación (punto 1 de la figura 4), mientras que en la postdiálisis se observó una mejoría significativa de la sobrehidratación (punto 2 de la figura 4).
Finalmente, el paciente fue dado de alta con una dieta hiperproteica (1,4 g de proteínas/kg/día y con 38 kcal/kg de peso); para conseguir este aporte se asoció SON con 200 ml de preparado específico para ERC en pacientes TRS y una ingesta de líquidos de 1 litro cada 24 horas (el paciente tenía una diuresis residual de 200 cc):
- Insulina Glargina 12 UI por la mañana.
- Metoclopramida 10 mg (antes de las comidas principales).
- Resin Calcio sobres de 15 gramos (con la comida y cena).
- Darbopoetina 30 una inyección subcutánea cada 21 días.
- Bicarbonato sódico sobres de 1 gramo: 1 en desayuno, 2 comida y 2 cena.
- Furosemida 40: medio comprimido en desayuno.
- Atorvastatina 40: 1 comprimido en la cena.
- Sevelamer 800 mg con desayuno, comida y cena.
- Doxazosina 4 mg un comprimido en desayuno y en la cena.
Es fundamental evitar la desnutrición, tanto antes de entrar en la diálisis, como al iniciarla, asegurando un aporte energético y proteico suficiente.
Se recomienda un aporte de fibra de 20 a 25 g/día para evitar el estreñimiento debido a la falta de actividad física, baja ingesta de agua y consumo de medicamentos. Hay que evitar el uso de productos integrales por su alto contenido en potasio y fósforo. En caso necesario se puede recurrir a suplementos en forma de celulosa y mucílagos.
En los pacientes en TRS es importante también limitar la ingesta de sodio y líquidos para evitar sobrecargas de volumen. La hidratación corporal y la ingesta de sodio deben monitorizarse en función de la presión arterial, la ganancia de peso, los edemas y la sensación de sed.
Al alta se le proporcionaron medidas higiénico-dietéticas con recomendaciones de restricción de sodio, potasio y fósforo (Tabla VI).
Valorado 1 mes después en consulta de Nutrición Clínica, el paciente refiere no tomar SON por sensación de plenitud, además presenta hipoglucemias durante la HD (que realiza 3 días a la semana, durante 4 horas): se plantea un soporte nutricional durante las horas de HD para garantizar adherencia, valorar tolerancia y evitar la hipoglucemia posdiálisis.
Durante la HD se han postulado dos tipos de soporte nutricional: la nutrición parenteral intradiálisis y SON intradiálisis.
Nutrición oral intradiálisis (NOID)
La ingesta oral de comida rica en proteínas o de SON se ha postulado efectiva en la disminución del catabolismo inducido por la HD, asociado a un incremento de la ingesta de proteínas y de energía. La hipotensión intradialítica, secundaria a la vasodilatación esplénica durante y después de la NOID, es muy infrecuente en pacientes estables y sin riesgo, por lo que la NOID suele tolerarse bien. Además, la ingesta de SON intradialítico en pacientes con niveles disminuidos de albúmina ha demostrado incrementos en la supervivencia, con un efecto positivo sobre la albúmina sérica, inflamación, mortalidad y tasa de hospitalización (46). La NOID puede antagonizar el catabolismo inducido por la HD, manteniendo este efecto incluso después de finalizar la sesión de HD (39,46).
NP intradiálisis (NPID)
El alto flujo de la fístula para la diálisis puede considerarse como una vía central y nos permite utilizar preparados parenterales con osmolaridad elevada. Aunque debemos tener en cuenta que el aporte por esta vía es limitado a los días y horas de HD, se ha estimado que, con la NPID, no se puede aportar más de 25% de los requerimientos diarios. Estaría recomendado en pacientes con una ingesta oral superior a 20 kcal/día/kg y a 0,8-0,9 g/kg/día de proteínas (39). Se debe indicar si no es posible la suplementación oral y retirar cuando se garantice una correcta ingesta oral y niveles de albúmina mantenidos > 3,8 mg/dl. Algunos estudios han demostrado un aumento de los niveles de albúmina, prealbúmina, y mejoría del balance nitrogenado, aunque son variables los datos en cuanto a disminución tasa de hospitalización y mortalidad (47).
Por tanto estaría indicado en pacientes en los que la NOID no sea posible, debiendo tener en cuenta las posibles complicaciones de esta modalidad terapéutica como son la hiperglucemia, hipertrigliceridemia o las alteraciones hepatobiliares.
En nuestro paciente se decidió iniciar NOID con SON con formulación específica renal hiperproteica. Se introdujo paulatinamente con aceptable tolerancia, desapareciendo las hipoglucemias posdiálisis.
Tres meses después, con una albúmina: 3,7 mg/dl, y un incremento del peso seco de 3 kg, se realizó nueva BIA (punto 3 de la figura 4) en periodo posdiálisis, observando una mejoría de la masa muscular. En el momento actual, el paciente continúa en programa de HD, dieta controlada en potasio, sodio y fósforo, restricción hídrica a 1.000 cc/24 horas, HbA1c: 7,6%, y SON intradiálisis con buena adherencia.
CONCLUSIONES
Un correcto tratamiento nutricional de los pacientes con diabetes mellitus y ERC, exige un conocimiento y tratamiento de las entidades que producen un deterioro de la función renal y de su control glucémico. Un adecuado manejo nutricional puede retrasar la progresión de la enfermedad renal crónica y mejorar el pronóstico de nuestros pacientes con diabetes mellitus.
BIBLIOGRAFÍA
1. Otero A, de Francisco A, Gayoso P, García F. Prevalencia de la insuficiencia renal crónica en España: resultados del estudio EPIRCE. Nefrologia 2010;30:78-86. [ Links ]
2. Soriguer F, Goday A, Bosch-Comas A, Bordiú E, Calle-Pascual A, Carmena R, et al. Prevalence of diabetes mellitus and impaired glucose regulation in Spain: The Di@bet.es Study. Diabetologia 2012;55:88-93. [ Links ]
3. Gómez-Huelgas R, Martínez-Castelao A, Artola S, Górriz JL, Menéndez E. Documento de Consenso sobre el tratamiento de la diabetes tipo 2 en el paciente con enfermedad renal crónica. Nefrologia 2014;34(1):34-45. [ Links ]
4. Molitch ME, DeFronzo RA, Franz MJ, Keane WF, Mogensen CE, Parving HH, et al. Nephropathy in diabetes. Diabetes Care 2004;27(1):79-83. [ Links ]
5. De Pablos-Velasco PL, Ampudia-Blasco FJ, Cobos A, Bergonon S, Pedrianes P, en representación del Grupo de Investigadores DIABIR. Estimated prevalence of chronic renal failure among patients with type 2 diabetes in Spain Med Clin (Barc) 2010;134:340-5. [ Links ]
6. Go AS, Chertow GM, Fan D, et al. Chronic kidney disease and the risks of death, cardiovascular events, and hospitalization. N Engl J Med 2004;351(13):1296-305. [ Links ]
7. Improving Global Outcomes (KDIGO) CKD Work Group. KDIGO. Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease. Kidney Int 2013;3(Suppl):S6-308. [ Links ]
8. De Pablos Velasco PL. Nefropatía diabética. En: Menéndez Torre E, Barrio Castellanos B, Novials Sardá A. Tratado de Diabetes Mellitus. 2ª ed. Madrid: Editorial Médica Panamericana Díaz de Santos; 2016. pp. 601-8. [ Links ]
9. National Kidney Foundation: KDOQI clinical practice guidelines for diabetes and chronic kidney disease. Am J Kidney Dis 2012;49(2):S1e179. [ Links ]
10. American Diabetes Association. Executive summary: Standards of medical care in diabetes-2017. Diabetes Care 2016;36(Suppl 1):S4-10. [ Links ]
11. Bonds DE, Miller ME, Bergenstal RM, Buse JB, Byington RP, Cutler JA, et al. The association between symptomatic, severe hypoglycaemia and mortality in type 2 diabetes: retrospective epidemiological analysis of the ACCORD study. BMJ 2010;340:b4909. [ Links ]
12. Muhlhauser I, Toth G, Sawicki PT, Berger M. Severe hypoglycemia in type I diabetic patients with impaired kidney function. Diabetes Care 1991;14(4):344-6. [ Links ]
13. Kopple JD, Greene T, Chumlea WC, Hollinger D, Maroni BJ, Merrill D, et al. Relationship between nutritional status and the glomerular filtration rate: results from the MDRD study. Kidney Int 2000;57(4):1688-703. [ Links ]
14. Kovesdy CP, Kopple JD, Kalantar-Zadeh K. Management of protein-energy wasting in non-dialysis-dependent chronic kidney disease: reconciling low protein intake with nutritional therapy Am J Clin Nutr 2013;97:1163-77. [ Links ]
15. Schepers E, Glorieux G, Vanholder R. The gut: the forgotten organ inuremia? Blood Purification 2010;29(2):130-6. [ Links ]
16. Holden RM, Morton AR, Garland JS, Pavlov A, Day AG, Booth SL. Vitamins K and D status in stages3-5 chronic kidney disease. Clin J Am Soc Nephrol 2010;5(4):590-7. [ Links ]
17. Schlieper G, Westenfeld R, Kruger T, Cranenburg EC, Magdeleyns EJ, Brandenburg VM, et al. Circulating non phosphorylated carboxylated matrix gla protein predicts survival in ESRD. J Am SocNephrol 2011;22(2):387-95. [ Links ]
18. Riobó Serván P, Ortíz Arduán A. Nutrición e insuficiencia renal crónica. Nutr Hosp 2012;5(Suppl 1):41-52. [ Links ]
19. De Brito-Ashurst I, Varagunam M, Raftery MJ, Yaqoob MM. Bicarbonate supplementation slows progression of CKD and improves nutritional status. J Am Soc Nephrol 2009;20:2075-84. [ Links ]
20. Stenvinkel P, Heimburger O, Lindholm B, Kaysen GA, Bergstrom J. Are there two types of malnutrition in chronic renal failure? Evidence for relationships between malnutrition, inflammation and atherosclerosis (MIA syndrome). Nephrol Dial Transplant 2000;15:953-960. [ Links ]
21. Bolasco P, Cupisti A, Locatelli F, Caria S, Kalantar-Zadeh K. Dietary management of incremental transition to dialysis therapy: once-weekly hemodialysis combined with low-protein diet. J Ren Nutr 2016;26(6):352-9. [ Links ]
22. Ikizler TA, Cano NJ, Franch H, Fouque D, Himmelfarb J, Kalantar-Zadeh K, et al. Prevention and treatment of protein energy wasting in chronic kidney disease patients: a consensus statement by the International Society of Renal Nutrition and Metabolism. Kidney Int 2013;84:1096-107. [ Links ]
23. Garibotto G, Sofia A, Russo R, Paoletti E, Bonanni A, Parodi EL, et al. Insulin sensitivity of muscle protein metabolism is altered in patients with chronic kidney disease and metabolic acidosis. Kidney Int 2015;88:1419-26. [ Links ]
24. Steiber A, Leon JB, Secker D, McCarthy M, McCann L, Serra M, et al. Multicenter study of the validity and reliability of subjective global assessment in the hemodialysis population. J Ren Nutr 2007;17(5):336-42. [ Links ]
25. Kalantar-Zadeh K, Kopple JD, Block G, Humphreys MH. A malnutrition-inflammation score is correlated with morbidity and mortality in maintenance hemodialysis patients. Am J KidneyDis 2001;38:1251-63. [ Links ]
26. Rambod M, Bross R, Zitterkoph J, Benner D, Pithia J, Colman S, et al. Association of Malnutrition- Inflammation Score with quality of life and mortality in hemodialysis patients: a 5-year prospective cohort study. Am J Kidney Dis 2009;53(2):298-309. [ Links ]
27. Whitham D. Nutrition for the Prevention and Treatment of Chronic Kidney Disease in Diabetes. Can J Diabetes 2014;38:344e348. [ Links ]
28. Bellizzi V. Low-protein diet or nutritional therapy in chronic kidney disease. Blood Purif 2013;36:41-6. [ Links ]
29. NICE guidelines 2014. Chronic kidney disease in adults: assessment and management. Disponible en: https://www.nice.org.uk/guidance/CG182/chapter/1-Recommendations
30. Obermayr RP, Temml C, Gutjahr G, Kainz A, Klauser-Braun R, Függer R, et al. Body mass index modifies the risk of cardiovascular death in proteinuric chronic kidney disease. Nephrol Dial Transplantation 2009;24(8): 2421-8. [ Links ]
31. De Natale C, Annuzzi G, Bozzetto L, Mazzarella R, Costabile G, Ciano O, et al. Effects of a plant-based high-carbohydrate/high-fiber diet versus high-monounsaturated fat/low-carbohydrate diet on postprandial lipids in type 2 diabetic patients. Diabetes Care 2009;32:2168-73. [ Links ]
32. Common Clinically Aplicable Situations. Renal Failure. In: Canada TW, Tajchman SK, Tucker AM, Ybarra JV, editors. ASPEN. Fluids, Electrlytes, and Acid-Basic Disorders Handbook. Silver Spring: ASPEN 2015. pp. 253-67. [ Links ]
33. Barril-Cuadrado G, Bernardita Puchulu M, Sánchez-Tomero JA. Tablas de ratio fósforo/proteína de alimentos para población española. Utilidad en la enfermedad renal crónica Nefrología 2013;33(3):362-71. [ Links ]
34. Steiber AL, Kopple JD. Vitamin status and needs for people with stages 3-5 chronic kidney disease. J Ren Nutr 2011;21(5):355-68. [ Links ]
35. Cano N, Fiaccadori E, Tesinsky P, Toigo G, Druml W, Kuhlmann M, et al. ESPEN Guidelines on Enteral Nutrition: Adult Renal Failure Clinical Nutrition 2006;25:295-310. [ Links ]
36. Tucker BM, Safadi S, Friedman AN. Is routine multivitamin supplementation necessary in us chronic adult hemodialysis patients? A systematic review. Journal of Renal Nutrition 2015;25(3):257-64. [ Links ]
37. Parkman HP, Hasler WL, Fisher RS. American Gastroenterological Association technical review on the diagnosis and treatment of gastroparesis. Gastroenterology. 2004;127:1592-622. [ Links ]
38. Parkman H, Yates KP, Hasler WL, Nguya L, Pasricha PJ, Snape WJ, et al. Dietary intake and nutritional deficiencies in patients with diabetic or idiopathic gastroparesis. Gastroenterology 2011;141(2):486-98. [ Links ]
39. Sabatino A, Regolisti G, Karupaiah T, Sahathevan S, Sadu Singh BK, Khor BH, et al. Protein-energy wasting and nutritional supplementation in patients with end-stage renal disease on hemodialysis. Clin Nutr 2016 DOI: 10.1016/j.clnu.2016.06.007 [Epub ahead of print] [ Links ]
40. Magnoni D, Rouws C, Lansink M, Van Laere K, Campos AC. Long-term use of a diabetes-specific oral nutritional supplement results in a low-postprandial glucose response in diabetes patients. Diabetes Res Clin Pract 2008;80:75-82. [ Links ]
41. Inzucchi SE, Bergenstal RM, Buse JB, Diamant M, Ferrannini E, Nauck M, et al. Management of hyperglycemia in type 2 diabetes: A patient centered approach: Position statement of the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care 2012;35:1364-79. [ Links ]
42. Muñoz Aguilar A, Ortego Rojo J. Seguimiento del paciente con nutrición enteral y complicaciones asociadas. Oliveira Fuster G, editor. Manual de Nutrición Clínica y dietética. 2ª ed. Madrid: Díaz de Santos; 2008. pp. 221-32. [ Links ]
43. Pillon L, Piccoli A, Lowrie EG, Lazarus JM, Chertow GM. Vector length as a proxy for the adequacy of ultrafiltration in hemodialysis. Kidney Int 2004;66(3):1266-71. [ Links ]
44. Bozzetto S, Piccoli A, Montini G. Bioelectrical impedance vector analysis to evaluate relative hydration status. Pediatr Nephrol 2010;25(2):329-34. [ Links ]
45. Piccoli A, Nigrelli S, Caberlotto A, Bottazzo S, Rossi B, Pillon L, et al. Bivariate normal values of the bioelectrical impedance vector in adult and elderly populations. Am J Clin Nutr 1995;61:269-70. [ Links ]
46. Sezer S, Bal Z, Tutal E, Uyar ME, Acar NO. Long-term oral nutrition supplementation improvesoutcomes in malnourished patients with chronic kidney disease on hemodialysis. JPEN J Parenter Enteral Nutr 2014;38(8) 960-5. [ Links ]
47. Sabatino A, Regolisti G,Antonucci E, Cabassi A,Morabito S, Fiaccadori E. Intradialytic parenteral nutrition in end-stage renal disease:practical aspects, indications and limits J Nephrol 2014;27:377-83. [ Links ]
 Dirección para correspondencia:
Dirección para correspondencia:
Beatriz Torres Torres.
Servicio de Endocrinología y Nutrición.
Hospital Clínico Universitario de Valladolid.
Avda. Ramón y Cajal, 3.
47003 Valladolid
e-mail: beatriztorrestorrres@hotmail.com