My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Nutrición Hospitalaria
On-line version ISSN 1699-5198Print version ISSN 0212-1611
Nutr. Hosp. vol.34 suppl.3 Madrid 2017
https://dx.doi.org/10.20960/nh.1383
Complicaciones de la nutrición parenteral pediátrica
Complications of pediatric parenteral nutrition
José Manuel Moreno Villares1, Iñaki Irastorza Terradillos2 y Gerardo Prieto Bozano3
1Unidad de Nutrición Clínica. Servicio de Pediatría. Hospital Universitario 12 de Octubre. Madrid.
2Sección de Gastroenterología, Hepatología y Nutrición Pediátrica. Departamento de Pediatría. Hospital Universitario Cruces. Barakaldo, Bizkaia.
3Servicio de Gastroenterología y Nutrición. Hospital Universitario Infantil La Paz. Madrid
INTRODUCCIÓN
Podemos clasificar las complicaciones en cuatro grupos: las relacionadas con el catéter venoso central (CVC); las complicaciones metabólicas; las dependientes de la estabilidad de las soluciones o de las interacciones con fármacos y las psicosociales. La revisión se centra en el paciente pediátrico y no es aplicable en todas sus consideraciones al neonato, especialmente al prematuro.
COMPLICACIONES ASOCIADAS A LOS CATÉTERES VENOSOS CENTRALES
Dentro de estas se incluyen las complicaciones mecánicas (las derivadas de la inserción, la rotura o la obstrucción del catéter y la trombosis venosa) y las infecciones relacionadas con el catéter.
Complicaciones en relación con la inserción del CVC
La frecuencia de este tipo de complicaciones es de alrededor del 4% (1). Entre ellas destacan: el neumotórax, el hemotórax, la laceración de un vaso, las arritmias, la perforación cardiaca con taponamiento, el embolismo aéreo, la lesión de un plexo nervioso o la localización anómala del catéter (2). La inserción dirigida por ecografía minimiza el riesgo de complicaciones en la inserción (3) (GdE 1).
Rotura o desplazamiento accidental
El CVC puede desplazarse accidentalmente o deliberadamente al tirar de él. Para evitar desplazamientos o retiradas accidentales del catéter es preciso asegurarlo bien, adecuando tanto las medidas de recubrimiento del catéter como las propias vestimentas del niño. Esto es especialmente cierto para los catéteres de larga duración (tunelizados, catéteres venosos centrales de abordaje periférico -PICC-).
Con el uso prolongado, el catéter puede deteriorarse y presentar orificios o desgarros. Algunos de los fabricantes de CVC de larga duración disponen de kits de reparación sin necesidad de recambiar todo el catéter.
Oclusión/trombosis relacionada con el catéter
Existen tres tipos de complicaciones trombóticas relacionadas con el catéter: la aparición de una vaina de fibrina (fibrin sheat) alrededor de la punta del catéter, la obstrucción en la luz del catéter o una trombosis venosa (4). La oclusión parcial o completa de un CVC limita o impide la posibilidad de extraer sangre o infundir a través del mismo. Puede ocurrir tanto por obstrucción de la luz del catéter como por una compresión externa del catéter o por una malposición del mismo (Tabla I). La incidencia es muy variable, dependiendo de la técnica diagnóstica utilizada, aunque sensiblemente mayor que en la población adulta. En general, las complicaciones trombóticas ocurren en pacientes con dependencia prolongada de la nutrición parenteral (NP), en especial en nutrición parenteral domiciliaria (NPD).
Se recomienda infundir suero fisiológico -flushing- (3 a 5 ml) a través del catéter después de la administración de medicaciones o tras la extracción de sangre con el fin de prevenir la oclusión. Las guías de la European Society of Pediatric Gastroenterology/European Society for Clinical Nutrition and Metabolism (ESPGHAN/ESPEN) (2005) recomiendan infundir suero salino fisiológico después de la administración de cualquier medicación y la instilación de heparina semanalmente cuando no se usa el catéter (5). El lavado con heparina a baja concentración no aporta ninguna ventaja frente al suero salino (6) (GdE 2). Las técnicas de presión positiva en la retirada de la NP o la infusión pulsátil con un volumen mayor -10 ml- confieren ventajas respecto a métodos convencionales. El empleo de heparina, catéteres impregnados de heparina, heparina de bajo peso molecular o warfarina de forma profiláctica no han demostrado ser una medida eficaz en la prevención de la obstrucción del catéter (7,8).
Una vez descartada una obstrucción mecánica, la oclusión del catéter puede tratarse con un fibrinolítico (uroquinasa o alteplasa) si se sospecha un depósito de sangre o fibrina y con alcohol o ácido clorhídrico si se sospecha que se deba a los lípidos o a la precipitación de algún fármaco (9).
Actuación ante una obstrucción del catéter
Dependerá de la causa que se sospeche. Antes de iniciar un tratamiento farmacológico deberá descartarse oclusión no trombótica.
1. Malposición:
- Conectar una jeringa de suero fisiológico al catéter e intentar aspirar variando la posición del paciente (decúbito lateral, posición de Trendelenburg, maniobra de Valsalva, tos, respiración profunda, elevación de brazos).
- Radiografía de tórax para descartar migración o malposición:
• En el caso de que se evidencie una malposición intravascular, intentar corregirla.
• Si se confirma la localización extravascular hay que retirarlo.
2. Precipitados de fármacos o minerales:
- Los precipitados que se disuelven en medio ácido (precipitados de calcio-fosfato, vancomicina o etopósido): utilizar 0,2-3 ml de ácido clorhídico (HCl) 0,1 N (10).
- Precipitados que se disuelven en medio básico (ticarcilina, oxacilina, fenitoína, imipenem): utilizar 1 ml de bicarbonato sódico 1N o 1M.
3. Depósitos de lípidos:
Deberá sospecharse si la oclusión se ha producido tras la administración de NP o de fármacos vehiculizados en excipientes oleosos. Se pueden utilizar 3-5 ml de etanol al 70% durante 1-2 horas, aspirándolo después, o, si fracasa, hidróxido sódico (NaOH) 0,1 mmol/ml (11) o 0,5 ml de HCl 0,1 N seguido de solución heparinizada (9).
4. Oclusion trombótica:
Para restaurar la permeabilidad de la vía en caso de una oclusión trombótica puede usarse estreptoquinasa, uroquinasa o factor activador del plasminógeno (alteplasa) (12-14) (GdE 3). Aunque existen otros agentes trombolíticos (alfimeprasa, tenecteplasa) los datos de su empleo en niños son muy limitados (15) (GdE 4). La obstrucción también puede ser debida a agregados lipídicos de la NP que se disuelven con etanol, o la precipitación de fármacos o componentes de la NP que pueden ser disueltos con hidróxido sódico o ácido clorhídrico. (GdE 3) (ver capítulo de "Vías de acceso en nutrición parenteral pediátrica").
Consideraciones previas respecto a los fibrinolíticos
- Se pueden utilizar en la desobstrucción de coágulos debidos a fibrina o sangre pero no son efectivos en precipitados lipídicos.
- El volumen de trombolítico debe permitir rellenar toda la cavidad interior del catéter (entre 1 y 3 ml).
- El fibrinolítico permanecerá en la luz entre 30 y 60 minutos aunque en ocasiones pudiera ser necesario más tiempo.
- El fibrinolítico debe ser aspirado para evitar reacciones sistémicas. Cuando se reestablece el flujo deben aspirarse unos 5 mL de sangre para retirar el fármaco y el coágulo.
- Si es necesario, el procedimiento se puede repetir una vez y/o prolongar el tiempo de exposición.
- Se debe infundir en el catéter suero fisiológico y heparina tras el procedimiento de desobstrucción.
Tratamiento trombolítico estándar
- Se inicia con heparina sódica 1% (1.000 UI/ml) seguido de 1 ml de suero fisiológico en la luz y se clampa durante 15-30 minutos tras los cuales se intenta aspirar para valorar su efecto.
- Si fracasa, se prueba con uroquinasa (5.000 UI/ml) que se clampa durante 20-30 minutos. Se aspira a continuación y se valora respuesta. Este proceso se puede repetir varias veces con un porcentaje de éxito de 50-95%.
En los catéteres tipo Hickman se suelen usar dosis mayores por su mayor calibre y longitud. La alteplasa y la uroquinasa no estimulan la formación de anticuerpos y por lo tanto es posible su administración repetida como terapia trombolítica. En las tablas II y III se muestra la pauta de tratamiento con uroquinasa y alteplasa (16).
Trombosis de una vena central
Puede ser asintomática, manifestarse como dolor o edema local en la extremidad afecta o incluso como un tromboembolismo potencialmente fatal. Un ecocardiograma o una ecografía-doppler, un escáner torácico o una venografía pueden confirmar el diagnóstico. Esta complicación se asocia con frecuencia a infecciones de repetición del catéter, a cambios frecuentes de localización, a la colocación anómala del extremo distal del catéter, a extracciones analíticas frecuentes a través del catéter o al uso de soluciones hipertónicas. La trombosis aguda puede tratarse con agentes trombolíticos pero la forma más habitual de tratamiento es la anticoagulación (heparina IV, dosis de carga de 75 UI/kg en 10 minutos y mantenimiento de 28 UI/kg/h en menores de 1 año y de 20 UI/kg/h en mayores de 1 año; o heparina de bajo peso molecular SC, enoxaparina a 1,5 mg/kg/12 h en lactantes menores de 2 meses y 1,0 mg/kg/12 h en mayores de 2 meses, con ajustes para alcanzar un nivel de antifactor Xa de 0,5 a 1 unidad/mL) (17). La duración del tratamiento debe ser, al menos, de tres meses. En pacientes con necesidad de NP prolongada o con alto riesgo de tromboembolismo puede ser interesante el uso de antagonistas de la vitamina K (para mantener un International Normalized Ratio, INR > 2) o de heparinas de bajo peso molecular (18,19), aunque el valor de la evidencia de estas medidas es bajo (20).
Infecciones
Las bacteriemias asociadas a catéter (BC, en inglés, CLABSI -Central Line-associated Bloodstream Infection-) son una de las complicaciones más comunes de los CVC y son potencialmente graves. Aunque su incidencia es variable, oscila entre 0,2 y 11 episodios por cada 1.000 días de catéter. Los gérmenes más frecuentes son: Staphylococcus epidermidis, Enterobacter spp, Escherichia coli, Klebsiella pneumoniae, Pseudomona aeruginosa, Staphyloccus aureus, Enterococcus (E. faecalis, E. faecium) y Candida albicans u otros hongos. La infección puede proceder de la flora de la piel, de la contaminación del cabezal ("hub") del catéter, de siembras hematógenas a distancia o de la contaminación de la solución infundida. Las dos principales puertas de infección son el punto de inserción en la piel (en los catéteres de corta duración) o el cabezal del catéter (en los catéteres permanentes) (21).
La inserción del catéter y su manipulación con técnica aséptica disminuyen el riesgo de CLABSI. En catéteres de larga duración, el empleo de sellados de taurolidina o de antibiótico pueden reducir el riesgo de infección en algunos grupos de pacientes (22,23).
Diagnóstico de una bacteriemia relacionada con el catéter
En un paciente portador de un CVC, todo proceso febril sin foco debe considerarse una BC mientras no se demuestre lo contrario. Debe sospecharse una infección asociada a catéter si el niño presenta fiebre > 38,5 °C, acidosis metabólica, trombocitopenia o inestabilidad en la homeostasis de la glucosa, en ausencia de otro foco en la exploración.
Si se retira el CVC, el cultivo cuantitativo o semi-cuantitativo de la punta del CVC puede establecer el diagnóstico. Si no se retira el CVC, que es lo más habitual, se deben extraer hemocultivos pareados del CVC y percutáneo periférico. La técnica ideal es el cultivo cuantitativo de ambas muestras (GdE 1), comparando el número de unidades formadoras de colonias que crecen en un mismo volumen de sangre extraído en cada vía. También resulta útil el cultivo cualitativo de ambas muestras comparando el tiempo de positivización del hemocultivo central y periférico.
Tratamiento
Aunque el germen más frecuentemente implicado en las BC es el estafilococo plasmocoagulasa negativo, la terapia antibiótica empírica debe cubrir también bacilos gram negativos, incluida Pseudomona aeruginosa. Una vez conocido el resultado del hemocultivo y del antibiograma se modificará la pauta antibiótica. La duración del tratamiento dependerá del germen aislado, pero en general no inferior a 10-14 días si no se retira el catéter. Si se trata de un estafilococo coagulasa negativo y se retira el catéter es suficiente un ciclo de 5 a 7 días (24).
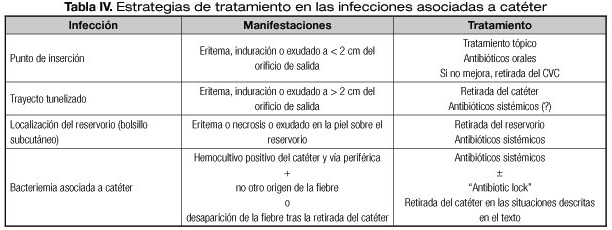
- Catéteres no tunelizados: se deben retirar siempre que existan signos de infección en el punto de inserción del CVC, si hay signos clínicos de sepsis o si el cultivo pareado central/periférico es positivo. Además de retirar el catéter se debe administrar tratamiento antibiótico endovenoso (GdE 2).
- Catéteres tunelizados: si existe infección del túnel, trombosis séptica, endocarditis u osteomielitis (infecciones complicadas), o si el germen causante es Candida spp. siempre se debe retirar el CVC y tratar con antibiótico por vía endovenosa entre 2 y 8 semanas, dependiendo del tipo de infección (GdE 2). En el caso de BC por S. aureus o bacilos gram negativos, también suele ser necesario retirar el CVC aunque se puede intentar preservar el catéter sellándolo durante 2 semanas con antibióticos y administrando antibióticos endovenosos. Las BC por estafilococo coagulasa negativo se suelen tratar con éxito con antibióticos endovenosos y sellados del catéter con vancomicina (GdE 2).
Si es necesario retirar el CVC, idealmente no se debería insertar uno nuevo hasta que la fiebre haya desaparecido y los hemocultivos de control, extraídos tras retirar el CVC infectado, sean negativos (26) (GdE 3), aunque frecuentemente no es factible esperar tanto tiempo por la dependencia del paciente de la NP.
En los CVC de larga duración, las indicaciones de retirada son: infecciones fúngicas documentadas, bacteriemias recurrentes, persistencia de fiebre o alteración hemodinámica más de 48 horas después de iniciado el tratamiento antibiótico y las infecciones polimicrobianas. En catéteres de larga duración podemos intentar evitar la retirada del catéter asociando a la antibioterapia sistémica un sellado con antibióticos ("antibiotic-lock") (25) (GdE 4). Consiste, ante la sospecha de bacteriemia asociada a CVC y tras obtener hemocultivos, en dejar en la luz del catéter 1,5 a 3 mL de una solución de antibióticos (por ejemplo vancomicina 5 mg/mL) que puede mantenerse 2-3 días o cambiarse diariamente. En esta situación se suspende la NP por esa vía durante 2 o 3 días. Si al reiniciar la NP no se produce una recurrencia de la bacteriemia, se mantiene el tratamiento (tanto "antibiotic-lock" como sistémico) durante dos semanas, evitando la retirada del catéter. Se optará por pautas antibióticas que se infundan cada 12 o 24 horas, mientras que el sellado se mantendrá durante las horas en las que no se infunde la NP. Las estrategias terapéuticas y la antibioterapia se recogen en la tabla IV.
El punto clave en la prevención de las infecciones asociadas a catéter es el cumplimiento de la técnica aséptica en el manejo del catéter, incluyendo el lavado de manos (26). En los últimos años se ha utilizado la profilaxis secundaria con soluciones de taurolidina (27) y alcohol al 70% (28) para el sellado del CVC en pacientes con antecedentes de BC (29). Aunque efectivos, su seguridad y coste-beneficio aún están por determinar. El sellado se realiza diariamente con la taurolodina, preferiblemente con taurolodina-citrato o taurolodina-heparina, una vez terminada la infusión de la NP. Se recomienda su aspiración antes de volver a conectar la NP. Hay más disparidad en la técnica del sellado con etanol 70%.
COMPLICACIONES METABÓLICAS
Incluyen las derivadas del déficit o del exceso de alguno de los componentes individuales de la solución de NP o de la presencia de contaminantes.
Déficit o exceso de micronutrientes
Las más frecuentes son las debidas al déficit de nutrientes: hipoglucemia, hipofosfatemia e hipocalcemia; las debidas al exceso de nutrientes: hiperglucemia e hipertrigliceridemia, cuando se sobrepasa la capacidad plasmática de aclaramiento lipídico, y las debidas al exceso o al déficit de líquidos (30). Se ha demostrado la asociación entre hiperglucemia, inmunodepresión y riesgo de infección, sobre todo en el paciente crítico (31), aunque no han podido confirmarse las ventajas de un control estricto de la glucemia en el paciente pediátrico crítico (32).
Síndrome de realimentación
Hay que ser extremadamente cuidadoso en la alimentación de niños desnutridos para evitar el síndrome de realimentación, en especial en el paciente crítico (33). Consiste en un desequilibrio de líquidos y electrolitos, intolerancia a los hidratos de carbono y déficit de vitaminas que ocurre en pacientes muy desnutridos durante una realimentación rápida (34). Estos rápidos cambios metabólicos pueden ocasionar graves complicaciones que amenacen la vida. Para disminuir el riesgo de aparición del síndrome de realimentación ha de actuarse cuidadosamente, especialmente en la fase inicial de la realimentación con aportes graduales de energía y nutrientes, y monitorización estrecha de potasio, fósforo y magnesio junto un aporte suficiente de vitaminas y oligoelementos.
Enfermedad metabólica ósea (osteoporosis, osteomalacia)
Se da en pacientes con NP de muy larga duración, especialmente si se asocia a fracaso intestinal (35). El origen es multifactorial, en el que influyen tanto la enfermedad de base como mecanismos relacionados con la NP: deficiencia de vitamina D, desequilibrio en los aportes de fósforo, nitrógeno y energía, exceso de aminoácidos y contaminación con aluminio, entre otros. Una revisión reciente sugiere que los aumentos en los niveles de fosfatasa alcalina que se ven con frecuencia en NP en lactantes son de causa ósea y no hepática en la mayoría de ocasiones (36).
Alteraciones hepáticas
Entre el 30 y el 50% de niños con NP durante más de dos semanas presentan elevaciones en las enzimas hepáticas, sobre todo GGT y en la bilirrubina, generalmente de carácter autolimitado (37). El origen es desconocido y, en su aparición, pueden influir distintos factores como la disminución del circuito enterohepático, el empleo de soluciones pobres en taurina y ricas en glicina, y las infecciones, entre otras (38). En los últimos años se ha prestado mucha atención al papel de las emulsiones lipídicas en la aparición de afectación hepática (exceso de ácidos grasos polinsaturados de cadena larga n-6, fitosteroles).
Las complicaciones hepatobiliares son importantes en la NP de larga duración, en especial en el seno de un fracaso intestinal, y pueden manifestarse como litiasis biliar o afectación hepática, desde la esteatosis a la cirrosis, pasando por una simple elevación de las enzimas hepáticas, la colestasis y la fibrosis (39). Mientras la esteatosis es más frecuente en pacientes adultos, la colestasis lo es en los niños (40). La esteatosis hepática puede estar originada por una excesiva infusión de glucosa, o de lípidos, o ser debida a deficiencias en determinados nutrientes como la carnitina, la colina o los ácidos grasos esenciales. En la aparición de la colestasis influyen una duración prolongada de la NP, el exceso de aporte calórico, la presencia de un síndrome de intestino corto, el reposo intestinal, las infecciones bacterianas y el sobrecrecimiento bacteriano (41,42). La colestasis es reversible si la NP puede suspenderse antes de que se produzca un daño hepático irreversible o si se eliminan o minimizan los factores predisponentes. En los últimos años se han publicado numerosos trabajos en los que la suspensión de los lípidos convencionales de la NP y el empleo de una emulsión de aceite de pescado al 10% (Omegaven®, Fresenius-Kabi), 1 g/kd/día por un tiempo limitado, han conseguido mejorar o revertir la colestasis, en especial en situaciones de fracaso intestinal (43) (GdE 4). La historia natural de la colestasis es a su desaparición tras la retirada de la NP (44).
La prevención de las complicaciones hepáticas debe considerar todos los factores potenciales de riesgo. Algunas medidas pueden limitar o revertir la afectación hepática: la instauración precoz de una nutrición enteral mínima, la NP cíclica, el tratamiento del sobrecrecimiento bacteriano, la prevención y el tratamiento precoz de las infecciones, disminuir el aporte de lípidos a < 1 g/kg/día, uso de nuevas emulsiones lipídicas con omega 3, etc. (45) y la administración de fármacos coleréticos, en especial el ácido ursodeoxicólico (10 a 30 mg/kg/d), son las medidas más eficaces (46).
PROBLEMAS PSICOSOCIALES
La enfermedad de base, las hospitalizaciones repetidas y prolongadas, la dependencia de máquinas y la sobreprotección de los padres pueden perturbar el desarrollo normal de algunos niños con NP prolongada. Hemos de procurar enviar a los niños con NP prolongada lo antes posible a su domicilio (47).
RECOMENDACIONES
- La canalización de una vena central dirigida por ecografía minimiza el riesgo de complicaciones técnicas (GdE 1).
- Se recomienda infundir suero a través del catéter después de la administración de medicaciones o tras la extracción de sangre con el fin de prevenir la oclusión (GdE 3).
- El lavado con heparina a baja concentración no aporta ninguna ventaja frente al suero salino (GdE 2).
- El empleo de heparina, catéteres impregnados de heparina, heparina de bajo peso molecular o warfarina de forma profiláctica no ha demostrado ser una medida eficaz en la prevención de trombosis venosa (GdE 2).
- Para restaurar la permeabilidad de la vía en caso de una oclusión trombótica puede usarse estreptoquinasa, uroquinasa o factor activador del plasminógeno (alteplasa) (GdE 3).
- Los datos con el empleo de otros agentes trombolíticos (alfimeprasa, tenecteplasa) en niños son muy limitados (GdE 4).
- La inserción del catéter y su manipulación con técnica aséptica disminuyen el riesgo de bacteriemia relacionada con el catéter (GdE 1).
- Ante la sospecha de bacteriemia relacionada con el catéter deben realizarse hemocultivos simultáneos de sangre periférica y central, extraídos a través de cada una de las luces del catéter, y, posteriormente, comenzar antibioterapia de amplio espectro de forma empírica (GdE 2).
- La retirada del catéter es el tratamiento de elección ante una bacteriemia relacionada con el catéter, en especial en los catéteres de corta duración (GdE 3).
- Ante una bacteriemia asociada a un catéter de larga duración podemos intentar evitar la retirada del mismo asociando a la antibioterapia sistémica un sellado con antibióticos ("antibiotic-lock") (GdE 4).
- El punto clave en la prevención de las infecciones asociadas a catéter es el cumplimiento de la técnica aséptica en el manejo del catéter, incluyendo el lavado de manos (GdE 1).
- La suspensión de los lípidos intravenosos de la NP y el empleo de una emulsión de aceite de pescado al 10% (Omegaven®, Fresenius-Kabi), 1 g/kd/día por un tiempo limitado, han conseguido mejorar o revertir la colestasis relacionada con el fracaso intestinal (GdE 4).
BIBLIOGRAFÍA
1. Trieschmann U, ten F Cate U, Sreeram N. Central venous catheters in children and neonates- what is important? Images Paediatr Cardiol 2007;9(4):1-8.
2. Chwals WJ. Vascular access for home intravenous therapy in children. JPEN J Parenter Enteral Nutr 2006;30:S65-9.
3. Murphy PC, Arnold P. Ultrasound-assisted vascular access in children. Contin Educ Anaesth Crit Care Pain 2011;11:44-9.
4. Journeycake JM, Buchanan GR. Thrombotic complications of central venous catheters in children. Curr Opin Hematol 2003;10:369-74.
5. Koletzko B, Goulet O, Hunt J, Krohn K, Shamir R. Complications. En: Guidelines on pediatric parenteral nutrition of the European Society of Pediatric Gastroenterology, Hepatology and Nutrition (ESPGHAN) and the European Society for Clinical Nutrition and Metabolism (ESPEN); supported by the European Society for Pediatric Research (ESPR): J Pediatr Gastroenterol Nutr 2005;41:S76-84.
6. Goossens GA. Flushing and locking of venous catheters: available evidence and evidence deficit. Nurs Res Pract 2015;2015:985686.
7. Vidal E, Sharathkumar A, Glover J, Faustino EV. Central venosus catheter-related thrombosis and thromboprophylasis in children: a systematic review and meta-analysis. J Thromb Haemost 2014;12:1096-109.
8. Brandão LR, Shah N, Shah PS. Low molecular weight heparin for prevention of central venous catheterization-related thrombosis in children. Cochrane Database Syst Rev 2014;3:CD005982.
9. Kerner JA, Garcia-Careaga MG, Fisher AA, Poole RL. Treatment of catheter occlusion in pediatric patients. JPEN J Parenter Enteral Nutr 2006;30:S73-S81.
10. Werlin SL, Lausten T, Jessen S, Toy L, Norton A, Dallman L, et al. Treatment of central venous catheter occlusion with ethanol and hydrochloridic acid. JPEN J Parenter Enteral Nutr 1995;19:416-8.
11. Ter Borg F, Timmer J, de Kam SS, Sauerwein HP. Use of sodium hydroxide to clear partially occluded vascular access ports. JPEN J Parenter Enteral Nutr 1993;17:289-91.
12. Ponec D, Irwin D, Haire WD, Hill PA, Li X, McCluskey ER, for the COOL investigators. Recombinant tissue plasminogen activator (Alteplase) for restoration of flow in occluded central venous access devices: a doble-blind placebo-controlled trial. The Cardiovascular thrombolytic to Open Occluded Lines (COOL) Efficacy Trial. J Vasc Interv Radiol 2001;12:951-5.
13. ShenV, Li X, Murdock M, Resnansky L, McCluskey ER, for the COOL investigators. Recombinant tissue plasminogen activator (Alteplase) for restoration of flow in occluded central venous access catheters in pediatric patients. J Pediatr Hematol Oncol 2003;25:38-45.
14. Van Miert C, Hill R, Jones L. Interventions for restoring patency of occluded central venous catheter lumens. Cochrane Databas Syst Rev 2012; 4:CD00719.
15. Baskin JL, Reiss U, Wilimas JA, Metzger ML, Ribeiro RC, Puis CH, et al. Thrombolytic therapy for central venous catheter occlusion. Haematologica 2012;97:641-50.
16. Monagle P, Chalmers E, Chan A, deVeber G, Kirkham F, Massicotte P, et al. Antithrombotic therapy in neonates and children: American College of Chest Physicians. Evidence-Based Clinical Practice Guidelines. 8th ed. Chest 2008;133:887-968S.
17. Grant J. Recognition, prevention, and treatment of home total parenteral nutrition central venous access complications. JPEN J Parenter Enteral Nutr 2002;26:S21-8.
18. Van Ommen CH, Tabbers MM. Catheter-related thrombosis in children with intestinal failure and long-term parenteral nutrition: how to treat and to prevent? Thrombosis Res 2010;126:465-70.
19. Cortejoso L, Manrique-Rodríguez S, Fernández-Llamazares CM, Sanjurjo-Sáez M. Treatment and prophylaxis of catheter-related thromboembolic events in children. J Pharm Pharm Sci 2012;15(5):632-41.
20. van Miert C, Hill R, Jones L. Interventions for restoring patency of occluded central venous catheter lumens (Review). Evid Based Child Health 2013;8(2):695-749.
21. Brennan C, Wang VJ. Management of fever and suspected infection in pediatric patients with central venous catheters. Pediatr Emerg Med Pract 2015;12:e.1-e20.
22. O'Grady NP, Alexander M, Burs LA, Dellinger EP, Garland J, Heard SO, et al. Healthcare Infection Control Practices Advisory Committee. Guidelines for the prevention of intravascular catheter-realted infections. Am J Infect Control 2011;39(4 Suppl 1):S1-34.
23. Bowen A, Carapetis J. Advances in the diagnosis and management of central venous access device infections in children. Adv Exp Med Biol 2011;697: 91-106.
24. Wolf J, Curtis N, Worth LJ, Flynn PM. Central line-associated bloodstream infection in children: an update on treatment. Pediatr Infect Dis J 2013;32:905-10.
25. Messing B, Man F, Colimon R, Thuillier F, Beliah M. Antibiotic-lock technique is an effective treatment of bacterial catheter-related sepsis during parenteral nutrition. Clin Nutr 1990;9:220-5.
26. Janum S, Zingg W, Classsen V, Afshari A. Bench-to-bedside review: challenges of diagnosis, care and prevention of central catheter-related bloodstream infections in children. Crit Care 2013;28:238.
27. Liu Y, Zhang A, Cao L, Xia H, Ma J. Taurolidine lock solutions for the prevention of catheter-related bloodstream infections: A systematic review and meta-analysis of randomized controlled trials. PLoS One 2013;8:e79417.
28. Pieroni KP, Nespor C, Ng M, Garcia M, Hurwitz M, Berquist WE, et al. Evaluation of ethanol lock therapy in pediatric patients on long-term parenteral nutrition. Nutr Clin Pract 2013;28:226-31.
29. Germán Díaz M, Moreno Villares JM, Gomis Muñoz P, León Sanz M. Sellado con antibióticos o antisépticos en pacientes pediátricos con nutrición parenteral domiciliaria. Puesta al día. Nutr Hosp 2016;33:771-81.
30. Howard L, Ashley C. Management of complications in patients receiving home parenteral nutrition. Gastroenterology 2003;124:1651-61.
31. Van Den Berghe G, Wouters PJ, Weekers F, Bouillon R, Weekers F, Verwaest C, et al. Intensive insulin therapy in critically ill patients. N Engl J Med 2001; 345:1359-67.
32. Macrae D, Grieve R, Allen E, Sadique Z, Betts H, Morris K, et al. A clinical and economic evaluation of control of Hyperglycemia in Paediatric Intensive Care (CHiP): a randomized controlled trial. Health Technol Assess 2014;18:1-210.
33. Byrnes MC, Stangenes J. Refeeding in the ICU: an adult and pediatric problem. Curr Opin Clin Nutr Metab Care 2011;14(2):186-92.
34. Crook MA, Hally V, Pantelli JV. The importance of the refeeding syndrome. Nutrition 2001;17:632-7.
35. Demehri FR, Simha S, Stephensa L, Harris MB, Arnold MA, Brown PI, et al. Pediatric intestinal failure: predictors of metabolic bone disease. J Pediatr Surg 2015;50:958-62.
36. Nandivada P, Potemkin AK, Carlson SJ, Chang SJ, Cowan MI, O´Loughlin AA, et al. Elevated alkaline phosphatase in infants with parenteral nutrition-associted liver disease reflects bone rather than liver disease. JPEN J Parenter Enteral Nutr 2015;39(8):973-6.
37. Lauriti G, Zani A, Aufieri R, Cananzi M, Chiesa PL, Eaton S, et al. Incidence, prevention, and treatment of parenteral nutrition-associated cholestasis and intestinal failure-associated liver disease in infants and children: a systematic review. JPEN J Parenter Enteral Nutr 2014;38:70-85.
38. Rangel SJ, Calkns CM, Cowles RA, Barnhart DC, Huang EY, Abdullah F, et al. Parenteral nutrition-associated cholestasis: an American Pediatric Surgical Association Outcomes and Clinical Trials. Committee systematic review. J Pediatr Surg 2012;47:225-40.
39. Cavicchi M, Beau P, Crenn P, Degott C, Messing B. Prevalence of liver disease and contributing factors in patients receiving home parenteral nutrition for permanent intestinal failure. Ann Intern Med 2000;132: 525-32.
40. Btaiche IF, Khalidi N. Metabolic complications of parenteral nutrition in adults, part 2. Am J Health-Syst Pharm 2004;61(19):2050-7; quiz 2058-9. Review. Erratum in: Am J Health Syst Pharm 2004;61(24):2616.
41. Forchielli ML, Walker WA. Nutritional factors contributing to the development of cholestasis during total parenteral nutrition. Adv Pediatr 2003;50:245-67.
42. Van Saene HKF, Taylor N, Donnell SC, Van Saene HKF, Taylor N, Donnell SC, et al. Gut overgrowth with abnormal flora: the missing link in parenteral nutrition-related sepsis in surgical neonates. Eur J Clin Nutr 2003;57:548-53.
43. Cowan E, Nandivada P, Puder M. Fish-oil emulsion in the treatment of parenteral nutrition-associated liver disease. Curr Opin Pediatr 2013;25:193-200.
44. Mangalat N, Bell C, Graves A, Imseis EM. Natural history of conjugated bilirubin trajectory in neonates following parenteral nutrition cessation. BMC Pediatr 2014;14:298. DOI: 10.1186/s12887-014-0298-z.
45. Wales PW, Allen N, Worthington P, George D, Compher C; American Society for Parenteral and Enteral Nutrition, A.S.P.E.N. clinical guidelines: support of pediatric patients with intestinal failure at risk of parenteral nutrition-associated liver disease. JPEN J Parenter Enteral Nutr 2014;38(5):538-57.
46. Wu PA, Kerner JA, Berquist WE. Parenteral nutrition-associated cholestasis related to parental care. Nutr Clin Pract 2006;21:291-5.
47. Pedrón-Giner C, Martínez-Costa C, Gómez-López L, Navas-López VM, Redecillas Ferreiro S, Moreno-Villares JM, et al. Home parenteral nutrition in children: procedures, experiences and reflections. Nutr Hosp 2010;25(5):705-11.