Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Nutrición Hospitalaria
versión On-line ISSN 1699-5198versión impresa ISSN 0212-1611
Nutr. Hosp. vol.34 supl.3 Madrid 2017
https://dx.doi.org/10.20960/nh.1384
Nutrición parenteral domiciliaria pediátrica
Pediatric home parenteral nutrition
Gerardo Prieto Bozano
Servicio de Gastroenterología y Nutrición. Hospital Universitario Infantil La Paz. Madrid
INTRODUCCIÓN
La nutrición parenteral domiciliaria (NPD), aquella que se administra en el domicilio del paciente, es una alternativa a la hospitalización prolongada y es reconocida como la mejor opción para mejorar la calidad de vida de los niños y sus familias. Se trata de un tratamiento caro que requiere el entrenamiento familiar. Las mejoras en las fórmulas de nutrición parenteral (NP) y en los catéteres utilizados para los accesos vasculares han disminuido significativamente las tasas de morbilidad y mortalidad asociadas a la NP prolongada y ampliado el número de indicaciones para las que se considera beneficiosa (1).
En los últimos 20 años se han publicado numerosas series de niños que recibieron NPD por diferentes motivos. Una de las más amplias incluye 302 pacientes (2). La indicación de NPD en 230 (76%) de ellos fue una enfermedad digestiva primaria, sobre todo síndrome de intestino corto (atresia intestinal, vólvulo, gastrosquisis, enterocolitis necrosante), seguido por enfermedad inflamatoria intestinal, pseudoobstrucción intestinal y diarrea intratable. En un 24% la indicación fue una enfermedad no digestiva, sobre todo inmunodeficiencias congénitas o adquiridas. La mediana de edad de inicio de NPD fue de 1,5 años y la duración media de la misma de 2,6 años. La complicación más frecuente fue la sepsis relacionada con catéter con una incidencia de 0,44 episodios por paciente/año de NPD o 1,2/1.000 días de NPD. Al final del estudio, el 54% de los pacientes estaban libres de NP y la mortalidad global fue del 16%, relacionada con la enfermedad primaria, hepatopatía y sepsis. Resultados similares se han observado en otras series más cortas, tanto europeas (3-5) como norteamericanas (6-8).
Para implantar una NPD es necesaria la participación de un equipo multidisciplinar, cuyos componentes se adaptarán a las características y posibilidades del hospital. La familia debe ser adecuadamente entrenada para poder realizar el tratamiento de forma segura y el paciente debe estar en una situación clínica estable. No merece la pena iniciar una NPD si se prevé una duración inferior a 30 días. Debe valorarse el impacto de la NPD en la vida social y laboral de la familia, y facilitarse el contacto con personal experto durante las 24 horas.
Los objetivos de la NPD son: mejorar o mantener el estado nutricional, facilitar la adaptación intestinal, reducir el riesgo de complicaciones relacionadas con la hospitalización (infecciones), mejorar la calidad de vida del niño y su familia, y disminuir los costes del tratamiento, evitando hospitalizaciones.
INDICACIONES
Ya se han referido las principales indicaciones de la NPD (2). La indicación más frecuente es el fracaso intestinal prolongado o permanente. La causa más frecuente de esta situación es el síndrome de intestino corto, seguido por los trastornos de motilidad (pseudoobstrucción intestinal, enfermedad de Hirschsprung extensa) y la diarrea grave rebelde (enfermedad de inclusiones microvellositarias, displasia epitelial intestinal, síndrome tricohepatoentérico, enteropatía autoinmune, anendocrinosis entérica, etc.). Las indicaciones extradigestivas más frecuentes son las complicaciones de los procesos tumorales y las inmunodeficiencias primarias o secundarias.
Las características de la familia y de su entorno social son críticas para iniciar un programa de NPD (9-11). Hay que comprobar que puede y quiere hacerse cargo del cuidado del niño, y que tiene los recursos materiales adecuados para llevarlo a cabo. Es importante conocer las características del domicilio familiar el cual debe tener unas condiciones mínimas de confortabilidad que permitan el cuidado del paciente. Para ello es imprescindible el trabajo de los trabajadores sociales y enfermera de enlace. En determinadas circunstancias, el alta del paciente debe posponerse hasta conseguir un medio adecuado o la tutela de los servicios de protección a la infancia.
COMPOSICIÓN, ESTABILIDAD Y ADMINISTRACIÓN
La composición de la NPD se adapta a las necesidades individuales del paciente y no difiere de la NP hospitalaria y va a depender, sobre todo, de la edad del paciente y de los aportes tolerados por vía digestiva (12,13) (ver capítulo de "Requerimientos en nutrición parenteral pediátrica" y "Componentes de las mezclas de nutrición parenteral para pediátria").
ACCESOS VASCULARES Y CATÉTERES DE ALIMENTACIÓN INTRAVENOSA
La NPD requiere un acceso venoso central adecuado (14-16) (ver capítulo de "Vías de acceso en nutrición parenteral pediátrica").
ENTRENAMIENTO DE LAS FAMILIAS Y SEGUIMIENTO
La formación de la familia o del cuidador tiene como objetivo adquirir los conocimientos y habilidades necesarios para efectuar los cuidados que requiere la NPD, así como prevenir y reconocer las complicaciones (9-11). Debe comenzarse lo antes posible una vez se ha identificado que el paciente es candidato a NPD y debe implicar a todos los miembros del equipo (10). La información debe proporcionarse mediante instrucciones orales y escritas durante un periodo mínimo de 1-2 semanas, de acuerdo al nivel sociocultural de la familia. El procedimiento debe practicarse y repetirse hasta no cometer errores y la formación debe ser evaluada por el personal responsable de la instrucción. Conviene entrenar a más de una persona de la familia y repetir el adiestramiento periódicamente.
Antes del alta, el equipo de NPD tiene que contactar con el pediatra del paciente y el hospital más cercano a su domicilio. De este modo se asegura un seguimiento cercano y un plan de tratamiento más eficaz (9-11). Si dicho hospital tiene posibilidad de preparar la NPD se establecerán las vías de comunicación para que la prescripción sea la indicada por el equipo de NPD. En caso contrario se recurrirá a la preparación en el hospital de origen o por un servicio de catering.
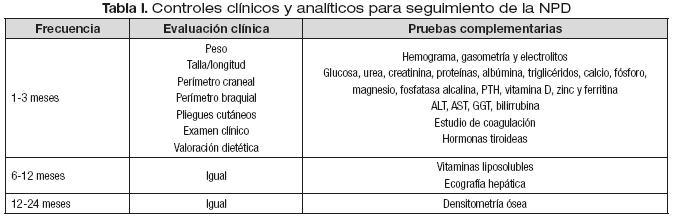
Debe realizarse un seguimiento regular en los aspectos relacionados con la administración, tolerancia y eficacia de la NPD (Tabla I). Para ello es muy importante proporcionar a la familia un formulario estructurado de recogida de parámetros que les permita un fácil control, el plan de actuación para valorar, prevenir o actuar cuando se presente algún tipo de incidencia y un teléfono de contacto disponible las 24 horas del día. Además es indispensable que la familia conozca el modo de obtención del material necesario y el calendario previsto para las consultas de seguimiento. La prescripción de la NPD se ajustará en cada momento a las necesidades del paciente.
COMPLICACIONES DE LA NPD
Las complicaciones de la NPD no difieren de las observadas en la NP hospitalaria, excepto en lo que se refiere a su frecuencia en relación con la duración más prolongada del tratamiento (ver capítulo de "Complicaciones de la nutrición parenteral pediátrica").
CALIDAD DE VIDA
Los indicadores de calidad de vida de los pacientes con NPD son significativamente peores que los observados en los controles sanos, en relación a la edad, existencia de estomas, número de infusiones semanales, imposibilidad para comer o beber, malestar abdominal, etc. No obstante, la situación es significativamente mejor cuando la comparación se establece con pacientes en hospitalización prolongada (17,18).
La NPD es una técnica segura que, en muchos casos, facilita la adaptación intestinal y la autonomía digestiva (19), pero existen una serie de factores de riesgo que pueden contribuir a su fracaso y a la necesidad de valoración como posibles candidatos a trasplante (Tabla II). La remisión adecuada y precoz a Unidades de Rehabilitación Intestinal y Trasplante puede mejorar el pronóstico y la evolución (20) (Tabla III).
En resumen, la NPD constituye una alternativa a la hospitalización prolongada en niños con fracaso intestinal dependiente de NP y deben desarrollarse estrategias que disminuyan el riesgo de infecciones, trombosis venosas y hepatopatía, dado que la prevención de estas complicaciones es primordial para la supervivencia de los pacientes.
BIBLIOGRAFÍA
1. Vanderhoof JA, Young RJ. Overview of considerations for the pediatric patient receiving home parenteral and enteral nutrition. Nutr Clin Pract 2003;18:221-6.
2. Colomb V, Dabbas-Tyan M, Taupin P, Talbotec C, Revillon Y, Jan D, et al. Long-term outcome of children receiving home parenteral nutrition: a 20-year single-center experience in 302 patients. J Pediatr Gastroenterol Nutr 2007;44:347-53.
3. Bisset WM, Stapleford P, Long S, Chamberlain A, Sokel B, Milla PJ. Home parenteral nutrition in chronic intestinal failure. Arch Dis Child 1992;67:109-14.
4. Wiskin AE, Cole C, Owens DR, Morgan M, Burge DM, Beattie RM. Ten-year experience of home parenteral nutrition in a single center. Acta Paediatr 2012;101:524-7.
5. Petit LM, Girard D, Ganousse-Mazeron S, Talbotec C, Pigneur B, Elie C, et al. Weaning off prognosis factors of home parenteral nutrition for children with primary digestive disease. J Pediatr Gastroenterol Nutr 2016;62(3):462-8.
6. Quiros-Tejeira RE, Ament ME, Reyen L, Herzog F, Merjanian M, Olivares-Serrano N, et al. Long-term parenteral nutritional support and intestinal adaptation in children with short bowel syndrome: a 25-year experience. J Pediatr Gastroenterol Nutr 2004;145:157-63.
7. Shatnawei A, Parekh NR, Rhoda KM, Speerhas R, Stafford J, Dasari V, et al. Intestinal failure management at the Cleveland Clinic. Arch Surg 2010;145:521-7.
8. Vargas JH, Ament ME, Berquist WE. Long-term home parenteral nutrition in pediatrics: ten years of experience in 102 patients. J Pediatr Gastroenterol Nutr 1987;6:24-32.
9. Gifford H, Delegge M, Epperson LA. Education methods and techniques for training home parenteral nutrition patients. Nutr Clin Pract 2010;25(5):443-50.
10. Norman JL, Crill CM. Optimizing the transition to home parenteral nutrition in pediatric patients. Nutr Clin Pract. 2011; 26(3):273-85.
11. Kumpf VJ, Tillman EM. Home parenteral nutrition: safe transition from hospital to home. Nutr Clin Pract 2012;27(6):749-57.
12. Martínez Costa C, Sierra C, Pedrón C, Moreno JM, Lama R, Codoceo R. Nutrición enteral y parenteral en pediatría. An Esp Pediatr 2000;52(Supl 3):1-33.
13. Koletzko B, Goulet O, Hunt J, Krohn K, Shamir R. Guidelines on Paediatric Parenteral Nutrition of the European Society of Paediatric Gastroenterology, Hepatology and Nutrition (ESPGHAN) and the EUROPEAN Society for Clinical Nutrition and Metabolism (ESPEN), supported by the European Society of Paediatric Research (ESPR). J Pediatr Gastroenterol Nutr 2005;41(Suppl 2):S1-87.
14. Barrier A, Williams DJ, Connelly M, Creech B. Frequency of peripherally inserted central catheter complications in children. Pediatr Infect Dis J 2012;31:519-21.
15. Jumani K, Advani S, Reich NG, Gosey L, Milstone AM. Risk factors for peripherally inserted central venous catheter complications in children. JAMA Pediatr 2013;167:429-35.
16. Piper HG, Silva NT, Amaral JG, Avitzur Y, Wales PW. Peripherally inserted central catheters for long-term parenteral nutrition in infants with intestinal failure. J Pediatr Gastroenterol Nutr 2013;56:578-81.
17. Candusso M, Faraguna D, Sperli D, Dodaro N. Outcome and quality of life in paediatric home parenteral nutrition. Curr Opin Clin Nutr Metab Care 2002;5:309-14.
18. Gottrand F, Staszewski P, Colomb V, Loras-Duclaux I, Gumber D, Marinier E, et al. Satisfaction in different life domains in children receiving home parenteral nutrition and their families. J Pediatr 2005;146:793-7.
19. Ganousse-Mazeron S, Lacaille F, Colomb-Jung V, Talbotec C, Ruemmele F, Sauvat F, et al. Assessment and outcome of children with intestinal failure referred for intestinal transplantation. Clin Nutr 2015;34:428-35.
20. Beath S, Pironi L, Gabe S, Horslen S, Sudan D, Mazariegos G, et al. Collaborative strategies to reduce mortality and morbidity in patients with chronic intestinal failure including those who are referred for small bowel transplantation. Transplantation 2008;85:1378-84.