Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Nutrición Hospitalaria
versión On-line ISSN 1699-5198versión impresa ISSN 0212-1611
Nutr. Hosp. vol.34 no.6 Madrid nov./dic. 2017
https://dx.doi.org/10.20960/nh.1220
Inyección intragástrica de toxina botulínica mediante endoscopia, ¿una alternativa para el tratamiento de la obesidad?. Una revisión sistemática
Intragastric injection of botulinum toxin. A real alternative for obesity treatment?. A systematic review
Francisco José Sánchez Torralvo1,2, Sergio Valdés Hernández1,3, María José Tapia1, Jose Abuín-Fernández1 y Gabriel Olveira1,2
1UGC Endocrinología y Nutrición. Hospital Regional Universitario de Málaga. Málaga.
2Universidad de Málaga.
3Instituto de Investigación Biomédica de Málaga. Málaga
Financiación: Beca SAEDYN 2015.
Dirección para correspondencia
RESUMEN
Introducción: la obesidad es una patología de elevada prevalencia en nuestro medio, cuyas comorbilidades asociadas representan un gran reto para la salud pública global.
La inyección de toxina botulínica intragástrica en animales y humanos se ha empleado como tratamiento para la obesidad. Su efecto incluiría el retraso del vaciamiento gástrico y la inducción de saciedad temprana, con la consiguiente disminución de la ingesta y la pérdida de peso.
Materiales y métodos: se realizó una búsqueda bibliográfica en las bases de datos PubMed, Scopus y EMBASE, para el periodo comprendido entre 2000 y 2016. Se incluyeron los artículos que trataron las bases del tratamiento con toxina botulínica intragástrica en humanos, así como los diferentes estudios de intervención, aleatorizados o no.
Resultados: se encontraron un total de 105 artículos y, utilizando los criterios de inclusión, se seleccionaron 10. De ellos, solo cuatro fueron aleatorizados y ocho duraron entre 8 y 24 semanas. En cuatro de los estudios, uno de ellos aleatorizado, se encontró una pérdida de peso significativa, que varió entre los 3,5 y los 11,8 kg.
La mayor parte de los estudios halló un enlentecimiento del vaciado gástrico. Ningún estudio comunicó efectos secundarios de relevancia.
Conclusión: la inyección de toxina botulínica intragástrica podría ser eficaz y segura en el tratamiento de la obesidad, pero son necesarios estudios bien diseñados, controlados con placebo, de largo seguimiento y adecuado tamaño muestral.
Palabras clave: Toxina botulínica. Endoscopia. Obesidad. Saciedad.
ABSTRACT
Background: Obesity is a prevalent disease in our environment, which comorbidities suppose a great challenge to public health.
Intragastric injection of botulinum toxin has been used as treatment for obesity, both in humans and animals. It acts by inhibiting gastric emptying and inducing early satiety, consequently reducing intake and finally achieving weight loss.
Materials and methods: A bibliographic search in PubMed, Scopus and EMBASE databases between 2000 and 2016 was carried out. Articles regarding the physiological basis of the treatment with intragastric injection of botulinum toxin in human were included, as well as interventional studies, randomised or not.
Results: A total of 105 articles were found and 10 were chosen according to our inclusion criteria. Of those, only 4 were randomised and 8 lasted between 8 and 24 weeks. In four of the studies, one randomised, a statistically significant weight loss was found which varied between 3.5 and 11.8 kg.
Most of the studies found slowing of gastric emptying. None of them notified any significant side-effects.
Conclusion: Intragastric injection of botulinum toxin could be useful and safe in the treatment of obesity but better designed, placebo-controlled, long term and with an adequate sample size studies are needed.
Key words: Botulinum toxin. Endoscopy. Obesity. Satiety.
INTRODUCCIÓN
La obesidad constituye uno de los mayores problemas de salud a los que se enfrentan las sociedades modernas. Según la OMS, se define en adultos con un IMC superior a 30 kg/m2. Se trata de una patología muy frecuente en nuestro medio, que continúa en aumento desde 1980 (1), llegando a doblar su prevalencia en las últimas tres décadas. Los datos del estudio ENRICA arrojaron en España una prevalencia de obesidad en adultos del 22,9% (24,4% en hombres y 21,4% en mujeres), llegando a presentar obesidad abdominal un 36% (32% de los hombres y 39% de las mujeres) (2).
Se ha observado un aumento de la morbimortalidad asociada a obesidad, directamente relacionado con el IMC, en la mayor parte de los países del mundo (3). Sus comorbilidades asociadas a nivel cardiovascular, metabólico y oncológico, entre otros muchos, representan un gran reto para la salud pública global (4).
Cada vez se apuesta más por un enfoque integral de su manejo, incluyendo una mejora en los hábitos alimentarios, un incremento de la actividad física, la asociación de fármacos cuando sean aconsejables y la cirugía bariátrica en la obesidad mórbida y extrema. No obstante, los cambios dietéticos, de estilo de vida y farmacológicos han demostrado un efecto y duración limitados.
Los tratamientos quirúrgicos (banda gástrica, bypass gástrico, etc.) (5) constituyen actualmente el enfoque más efectivo en la pérdida de peso, pero se trata de técnicas invasivas que no están exentas de riesgo (6).
La búsqueda de nuevos tratamientos endoscópicos para la obesidad es constante (7), con el objetivo de minimizar las complicaciones y encontrar una técnica menos invasiva que pueda resultar aplicable a un mayor número de pacientes.
Entre las técnicas mínimamente invasivas emergentes existen métodos de restricción mecánica (balón intragástrico, gastroplastia vertical endoluminal, gastroplastia transoral, implante endoscópico transoral restrictivo) y de restricción funcional (marcapasos gástrico, toxina botulínica) (8).
Desde la descripción de la inyección de toxina botulínica intragástrica en estudios en animales (9), se ha probado el uso de este fármaco como tratamiento para la obesidad. Se postula que su efecto incluiría el retraso del vaciamiento gástrico y la inducción de saciedad temprana, con la consiguiente disminución de la ingesta y la pérdida de peso.
La toxina botulínica es producida por la bacteria Clostridium botulinum. Se distinguen diversos serotipos de la misma, cuya nomenclatura va desde el serotipo A hasta el G. La ingesta de esta toxina por el ser humano puede producir una intoxicación llamada botulismo (10).
La toxina botulínica serotipo A (en adelante TB-A), la usada más ampliamente en la práctica clínica (11), se une con alta afinidad a las terminaciones nerviosas colinérgicas, mediadas por la acetilcolina, inhibiendo su actividad. La acetilcolina está considerada como el neurotransmisor más importante a nivel del sistema nervioso mientérico, encargado de los movimientos intrínsecos gastrointestinales. El bloqueo de este neurotransmisor provoca un potente y duradero efecto inhibidor sobre la contracción de la musculatura lisa y estriada (12).
De ese modo, inyectada directamente en el músculo liso del tracto digestivo, la TB-A actúa bloqueando la liberación de acetilcolina, y relajando el músculo implicado (13,14). Este efecto es ampliamente conocido y se ha usado satisfactoriamente en patología digestiva, caracterizada por espasmo muscular (acalasia, fisura anal, disfunción del esfínter de Oddi, gastroparesia diabética…) (15-17), así como en otras patologías (18).
Se ha comprobado que una vez inyectada en la capa muscular, la TB-A tiene una capacidad de difusión en un área de hasta 3 cm desde el punto de inyección. La duración de su efecto relajante podría alargarse desde un periodo de latencia de unos 7 días hasta un efecto máximo de entre 3 y 6 meses (19). Estudios realizados con electromiografía parecen indicar que este tipo de técnica no implica una difusión de la toxina hacia tejidos cercanos (20).
El objetivo de esta revisión es recopilar la evidencia disponible sobre los efectos de la inyección intragástrica de toxina botulínica mediante endoscopia como tratamiento para la obesidad.
MATERIAL Y MÉTODOS
Para realizar esta revisión sistemática se siguieron los criterios establecidos por la declaración PRISMA. La búsqueda bibliográfica se llevó a cabo a lo largo del mes de febrero de 2017 para el periodo comprendido entre 2000 y 2016, tanto en inglés como en español. Se consultaron las siguientes bases de datos: PubMed, Scopus y EMBASE. La estrategia de búsqueda incluyó los siguientes términos en inglés: botulinum toxin, obesity, endoscopic; y se amplió con los siguientes términos en español: toxina botulínica, obesidad, endoscopia.
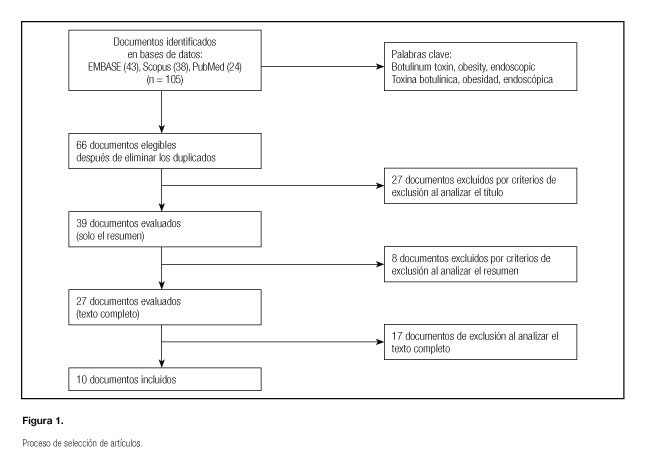
Tras la primera búsqueda se encontraron 105 (24 + 38 + 43) artículos. Después de eliminar los duplicados, quedaron 66 artículos. Fueron evaluados 39 resúmenes, de los que se analizó el texto completo de 27 artículos. Finalmente, se seleccionaron 10 para la revisión, excluyendo los estudios en animales, los que no estaban relacionados con el tratamiento de la obesidad y los que tenían un enfoque meramente fisiopatológico (Fig. 1).
RESULTADOS
Los trabajos seleccionados para esta revisión fueron 10. Estos se analizaron según el diseño del estudio. De ellos, 4 eran estudios no controlados y 5 eran ensayos clínicos. Solo uno era un metaanálisis.
Efecto de la TB-A sobre la motilidad gástrica, la saciedad y el peso
En el cuerpo distal y el antro gástrico se producen una serie de ondas peristálticas que avanzan distalmente y aumentan de amplitud y velocidad a medida que se propagan. Estas ondas consiguen un impulso del contenido gástrico hacia el duodeno (21). En principio, durante el periodo postprandial, la musculatura del anillo pilórico se encuentra contraída, produciéndose un retorno del bolo alimenticio que se produce en varias ocasiones hasta que el píloro se relaja (22).
A nivel de fundus y porción proximal del cuerpo gástrico, se produce el fenómeno conocido como acomodación gástrica. Se trata de una relajación de la musculatura a ese nivel, que permite la función de reservorio del estómago, evitando la elevación de la presión intragástrica que se produciría por la acumulación de alimento en el estómago tras la ingesta.
El mal funcionamiento de este mecanismo se ha relacionado con sensación de plenitud y saciedad precoz por una hipotética reducción en la capacidad gástrica (23).
La velocidad del vaciamiento gástrico depende de diversos factores, como la textura de la comida, su osmolaridad o su composición química. También se ve influenciada por determinados mediadores hormonales, como la colecistoquinina (CCK), ghrelina o PYY, que son activados por estímulos químicos y mecánicos.
Según lo expuesto, la administración intragástrica de TB-A en la capa muscular a nivel de antro y fundus afectaría a la motilidad gástrica, causando un retardo en el vaciamiento gástrico y una saciedad temprana, lo que eventualmente implicaría una reducción en la ingesta.
Por otro lado, tendría un efecto contrario (aceleración del vaciamiento gástrico) si se administra en anillo pilórico, debido a la relajación del mismo. Esto podría convertirse en un inconveniente importante, que debería tenerse en cuenta a la hora de establecer las zonas de inyección de la toxina.
La administración de TB-A en la capa muscular a nivel de fundus y porción proximal del cuerpo gástrico deterioraría la acomodación gástrica, implicando una reducción de la capacidad gástrica y, por tanto, mayor sensación de plenitud y saciedad precoz.
La mayor parte de los estudios realizados incluyen técnicas que miden el vaciamiento gástrico, y varios de ellos concluyen que se produce un enlentecimiento significativo del mismo (24-26).
Existen estudios que han demostrado que la inyección intragástrica de TB-A reduce la ingesta basal en un 38% y reduce hasta un 14% el peso en ratas, con un efecto de hasta 2 meses (9), hecho que ha sido refrendado en trabajos posteriores (27).
Rollnik y cols. comunicaron en 2003 el caso del primer paciente obeso en el que se probó la inyección intragástrica de TB-A mediante endoscopia, resultando en una reducción de peso de 9 kg en 4 meses, motivado por un descenso de hasta el 67,5% de su ingesta basal (28).
Posteriormente, varios autores han evaluado este método mediante estudios con diferentes diseños.
Series de casos
En un estudio piloto en 2005, Albani y cols. (29) analizaron la eficacia de la inyección de 500 UI de BT-A en capa muscular de antro gástrico en ocho pacientes obesos, seguida de consejo dietético y un seguimiento de hasta 4 meses. Se produjo una disminución de la ingesta calórica, así como una pérdida de peso significativa (2,6 kg) en el primer mes.
El mismo año, García-Compean y cols. (30) comunicaron en otro estudio piloto la inyección intragástrica en antro de 100 UI de BT-A, evaluando el peso corporal y la función gástrica en 12 semanas, no encontrando cambios significativos.
En 2006, Junior y cols. (31) evaluaron diferentes dosis de BT-A (200-300 UI) en varias regiones del antro gástrico en un total de 12 pacientes obesos divididos en 4 grupos de tratamiento. El tiempo de vaciado gástrico no se redujo significativamente antes y después de la inyección durante un periodo de 12 semanas, aunque todos los pacientes informaron una sensación de saciedad temprana y se apreció una tendencia a la disminución del IMC no significativa.
Ensayos clínicos aleatorizados
El primer ensayo clínico aleatorizado controlado por placebo, doble ciego, fue publicado por Gui (32) en 2006. Se asignaron 14 pacientes obesos en total a tres grupos, dos de tratamiento con 133 UI y 200 UI de BT-A respectivamente, y un tercero de control, en el que se inyectó solución salina. En ambos grupos de tratamiento se demostró una reducción del apetito, así como pérdida de peso, aunque no estadísticamente significativa.
En 2007, Mittermair y cols. (33) presentaron un nuevo ensayo clínico en el que no se encontraron diferencias significativas en el peso entre el tratamiento con toxina botulínica mediante endoscopia frente al grupo placebo. En este caso, se incluyeron únicamente 10 pacientes obesos.
Un mayor tamaño de muestra incluyó Foschi (24) en 2008, en el estudio que hasta ahora ha demostrado mejor efectividad en cuanto a la pérdida de peso. En dicho ensayo se evaluó la respuesta de 24 pacientes con obesidad mórbida al tratamiento con 200 UI de BT-A, incluyendo en esta ocasión el fundus gástrico como objetivo de las inyecciones, además de las que se realizaban en cuerpo en estudios previos. A los sujetos de ambos grupos, tratamiento y control, se les prescribió una dieta hipocalórica de 1.200 kcal. Se halló una pérdida de peso en ambos grupos, siendo significativamente mayor a las 8 semanas en el grupo que se trató con BT-A (11,8 kg en total, una reducción del 9,8%). Además, este estudio encontró un retardo en el tiempo de vaciado gástrico y una reducción de la capacidad gástrica máxima medida mediante el aporte de una comida mixta y posterior test del aliento marcado con 13C-octanoato.
En el estudio de Li y cols. (26) de 2012, diseñado en principio como ensayo clínico controlado por placebo, se incluyeron 19 pacientes obesos, aunque finalmente se presentó como estudio pre-post. Se demostró un enlentecimiento del vaciamiento gástrico medido mediante un test del aliento, así como una pérdida de peso significativa, entre 1 y 12 kg en el seguimiento de 12 semanas (una media de reducción del 5,9% del peso basal). Se incluyeron determinaciones basales de mediadores de apetito y saciedad, encontrando una disminución significativa de la ghrelina en la cuarta semana.
En 2013, Topazian y cols. comunicaron el ensayo clínico aleatorizado controlado con placebo más amplio realizado hasta la fecha, reclutando a 60 pacientes obesos, con un seguimiento de 6 meses. Se demostró un retraso en el vaciado gástrico medido mediante gammagrafía, aunque no se hallaron diferencias significativas en el peso.
Seok Bang y cols. (34) realizaron un metaanálisis en el que se incluyeron varios de los estudios previos, concluyendo que la inyección intragástrica de TB-A es efectiva para el tratamiento de la obesidad con una pérdida de peso estadísticamente significativa (g de Hedges -0,443; 95% CI, -0,845 a -0,040; p = 0,031 para los estudios pre-post y g de Hedges -0,521; 95% CI, -0,956 a -0,085; p = 0,019 para los ensayos controlados por placebo).
Los resultados de este metaanálisis, publicado en 2015, han sido criticados (35), ya que hay importantes limitaciones en el diseño; así la mayor parte de los resultados provienen de estudios pre-post y de series de casos. Al combinar los escasos ensayos clínicos aleatorizados con estos en el citado metaanálisis, se resta potencia para apoyar una recomendación.
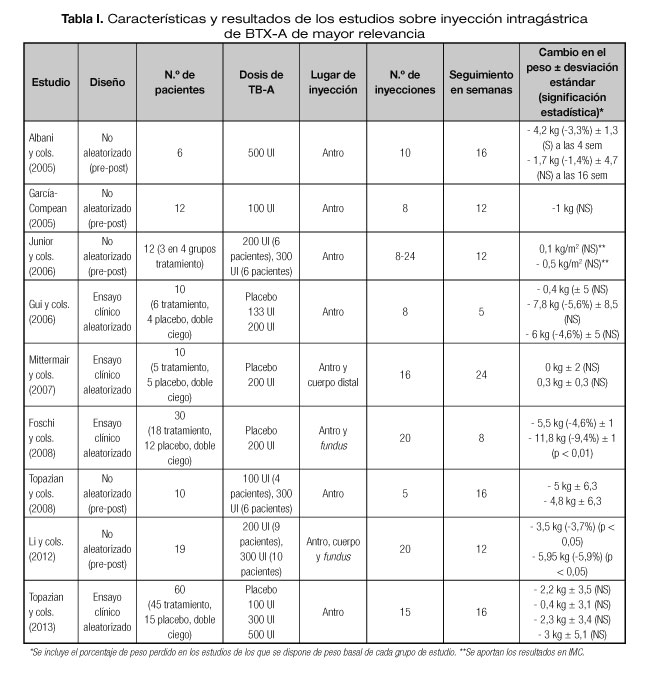
En la tabla I resumimos los resultados de los estudios de mayor relevancia.
Técnica de inyección
Según estudios previos (19), el efecto de la TB-A depende del volumen inyectado en cada lugar de punción y de la proximidad a terminaciones nerviosas colinérgicas. Esto motiva el hecho de que en los diversos estudios se hayan evaluado diferentes dosis y diferente número de punciones.
Actualmente no existe consenso sobre el mejor método de inyección ni sobre el número ni la distancia entre las inyecciones, si bien el reciente metaanálisis (34) concluye que una mayor área de inyección que incluya fundus o cuerpo proximal parece asociarse a una mayor pérdida de peso. Probablemente, la relación entre la alteración de la acomodación gástrica y la saciedad precoz pueda explicar el hallazgo de mejores resultados en los estudios que incluyen esta área gástrica en su técnica. Tampoco hay acuerdo en lo referente al número de inyecciones necesarias. El trabajo de Seok Bang (34) sugiere que habría una mayor pérdida de peso con un número superior a diez inyecciones, al potenciar la difusión de la toxina en la capa muscular.
La eficacia no parece depender de la dosis empleada, habiéndose encontrado resultados positivos de pérdida de peso con dosis de 200 UI (24,26). Por tanto, se piensa que no estaría justificado el uso de una dosis superior, sino de la distribución de esta dosis en un mayor número de localizaciones.
Respecto a la seguridad de la técnica, ninguno de los estudios realizados hasta hoy ha registrado efectos secundarios de relevancia con el uso de toxina botulínica.
Seguimiento a largo plazo y limitaciones de los estudios
Como se puede observar en la tabla I, el periodo de seguimiento de los pacientes osciló entre 5 y 24 semanas. Esto resulta coherente, teniendo en cuenta que el efecto de la toxina botulínica comprende entre las 2 y las 24 semanas, si bien algunos de los estudios demuestran escaso efecto en el peso más allá de los tres meses (24,25).
Por norma general, el número de pacientes incluidos en cada estudio fue pequeño, oscilando entre los 8 y los 60 pacientes.
Efecto sobre biomarcadores relacionados con la saciedad y el apetito
Se ha postulado la implicación de los marcadores de apetito y saciedad en la pérdida de peso de estos pacientes.
Mediadores del apetito, como leptina, colecistoquinina, insulina, PYY, GLP-1, o GIP, actúan como mediadores de saciedad a corto plazo y están íntimamente relacionados con la función motora del tracto gastrointestinal (36).
Las concentraciones séricas de PYY se relacionan con un retraso en el vaciado gástrico y una reducción en la ingesta calórica (37). Por otro lado, el GLP-1 también inhibe el vaciado gástrico y controla la ingesta calórica al producir saciedad (38).
La ghrelina, por su parte, es una hormona con un potente efecto orexígeno (39) secretada predominantemente en el fundus gástrico y que ha sido implicada en la modulación del apetito, ingesta calórica y gasto energético (40). Esta hormona se encuentra aumentada en los pacientes obesos en el momento preprandial, pero su descenso es menor después de las comidas, comparado con la población no obesa (41). Se ha postulado que un descenso en la ghrelina podría contribuir a una reducción en el apetito y la consecuente pérdida de peso, tras la cirugía bariátrica, aunque la evidencia no es concluyente (42).
Hasta el momento actual, únicamente dos autores (26,29) incluyeron determinaciones de este tipo de hormonas en sus trabajos con toxina botulínica intragástrica. En el estudio de Albani (29) no se encontraron diferencias significativas entre las hormonas evaluadas (ghrelina, gastrina y leptina), mientras que en trabajo de Li y cols. (26) se halló un descenso significativo de PYY en la semana 12, así como una disminución de ghrelina en la semana 4 al comparar de forma global los valores pre y postratamiento (26). La mayor implicación del fundus gástrico en la liberación de estos marcadores también justificaría la inclusión de esta zona en las áreas de inyección de TB-A.
CONCLUSIÓN
La toxina botulínica podría ser eficaz para el tratamiento de la obesidad, habiéndose constatado sus efectos a corto plazo, con una pérdida de peso de hasta el 5% respecto a placebo en algunas series. No se han reportado efectos secundarios relevantes en relación a la técnica, por lo que su empleo parece ser seguro.
No obstante, la calidad de los trabajos es aún muy baja. La mayor parte de los estudios no son aleatorizados ni doble ciego, incluyen un tamaño de muestra muy pequeño y tienen un seguimiento relativamente corto. Por otro lado, no existe una técnica estandarizada.
En conclusión, la inyección intragástrica de toxina botulínica mediante endoscopia se postula como una posible alternativa para la pérdida de peso únicamente a corto plazo, aunque son necesarios estudios con mejor diseño, controlados con placebo, de largo seguimiento y mayor tamaño muestral que permitan poder realizar recomendaciones basadas en la evidencia.
BIBLIOGRAFÍA
1. Finucane MM, Stevens GA, Cowan MJ, Danaei G, Lin JK, Paciorek CJ, et al. National, regional, and global trends in body-mass index since 1980: systematic analysis of health examination surveys and epidemiological studies with 960 country-years and 9·1 million participants. Lancet 2011;377(9765):557-567. DOI: 10.1016/S0140-6736(10)62037-5.
2. Gutiérrez-Fisac JL, Guallar-Castillón P, León-Muñoz LM, Graciani A, Banegas JR, Rodríguez-Artalejo F. Prevalence of general and abdominal obesity in the adult population of Spain, 2008-2010: the ENRICA study. Obes Rev 2012;13(4):388-392. DOI: 10.1111/j.1467-789X.2011.00964.x.
3. Di Angelantonio E, Bhupathiraju SN, Wormser D, Wormser D, Gao P, Kaptoge S, et al. Body-mass index and all-cause mortality: individual-participant-data meta-analysis of 239 prospective studies in four continents. Lancet 2016;388(10046):776-786. DOI: 10.1016/S0140-6736(16)30175-1.
4. Poirier P, Eckel RH. Obesity and cardiovascular disease. Curr Atheroscler Rep 2002;4(6):448-453.
5. ASGE Bariatric Endoscopy Task Force BKA; ASGE Technology Committee SA, Abu Dayyeh BK, Edmundowicz SA, Jonnalagadda S, Kumar N, Larsen M, Sullivan S, et al. Endoscopic bariatric therapies. Gastrointest Endosc 2015;81(5):1073-1086. DOI: 10.1016/j.gie.2015.02.023.
6. Elder KA, Wolfe BM. Bariatric Surgery: A Review of Procedures and Outcomes. Gastroenterology 2007;132(6):2253-2271. DOI: 10.1053/j.gastro.2007.03.057.
7. Choi HS, Chun HJ. Recent Trends in Endoscopic Bariatric Therapies. Clin Endosc 2017;50(1):11-16. DOI: 10.5946/ce.2017.007.
8. Cáncer E, Abilés V, Abilés J, Martínez Olmos MA, Bretón I, Peláez N, et al. Técnicas mínimamente invasivas emergentes en el tratamiento de la obesidad. Nutr Hosp 2012;27(4):1025-1030. DOI: 10.3305/nh.2012.27.4.5867.
9. Gui D, De Gaetano A, Spada PL, Viggiano A, Cassetta E, Albanese A. Botulinum toxin injected in the gastric wall reduces body weight and food intake in rats. Aliment Pharmacol Ther 2000;14(6):829-834.
10. Goonetilleke A, Harris JB. Clostridial neurotoxins. J Neurol Neurosurg Psychiatry 2004;75(suppl_3):iii35-iii39. DOI: 10.1136/jnnp.2004.046102.
11. Kaplan SE, Sherris DA, Gassner HG, Friedman O. The use of botulinum toxin A in perioral rejuvenation. Facial Plast Surg Clin North Am 2007;15(4):415-21, v-vi. DOI: 10.1016/j.fsc.2007.07.001.
12. Cherington M. Botulism: Update and Review. Semin Neurol 2004;24(2):155-163. DOI:10.1055/s-2004-830901.
13. Sand J, Nordback I, Arvola P, Pörsti I, Kalloo A, Pasricha P. Effects of botulinum toxin A on the sphincter of Oddi: an in vivo and in vitro study. Gut 1998;42(4):507-510. DOI: 10.1136/GUT.42.4.507.
14. James AN, Ryan JP, Parkman HP. Inhibitory effects of botulinum toxin on pyloric and antral smooth muscle. Am J Physiol - Gastrointest Liver Physiol 2003;285(2):G291-G297. DOI: 10.1152/ajpgi.00296.2002.
15. Friedenberg F, Gollamudi S, Parkman HP. The use of botulinum toxin for the treatment of gastrointestinal motility disorders. Dig Dis Sci 2004;49(2):165-175.
16. Zepeda-Gómez S, Valdovinos-Díaz MA. [Usefulness of botulinum toxin in gastrointestinal disorders]. Rev Gastroenterol Mex 67(2):126-133.
17. Ukleja A, Tandon K, Shah K, Alvarez A. Endoscopic botox injections in therapy of refractory gastroparesis. World J Gastrointest Endosc 2015;7(8):790-798. DOI: 10.4253/wjge.v7.i8.790.
18. Carruthers A, Kane MAC, Flynn TC, Huang P, Kim SD, Solish N, et al. The convergence of medicine and neurotoxins: a focus on botulinum toxin type a and its application in aesthetic medicine--a global, evidence-based botulinum toxin consensus education initiative. Dermatologic Surg 2013;39(3 Pt 2):493-509. DOI: 10.1111/dsu.12147.
19. Gracies J, Simpson DM. Botulinum Toxin Therapy. Neurologist 2000;(6): 98-115.
20. Osio M, Mailland E, Muscia F, Nascimbene C, Vanotti A, Bana C, et al. Botulinum neurotoxin-A does not spread to distant muscles after intragastric injection: A double-blind single-fiber electromyography study. Muscle Nerve 2010;42(2):165-169. DOI: 10.1002/mus.21662.
21. Cullen JJ, Kelly KA. Gastric motor physiology and pathophysiology. Surg Clin North Am 1993;73(6):1145-1160.
22. Quigley EM. Gastroduodenal motility. Curr Opin Gastroenterol 1999;15(6): 481-491.
23. Mundt MW, Hausken T, Smout AJPM, Samsom M. Relationships Between Gastric Accommodation and Gastrointestinal Sensations in Healthy Volunteers. A Study Using the Barostat Technique and Two- and Three-Dimensional Ultrasonography. Dig Dis Sci 2005;50(9):1654-1660. DOI:10.1007/s10620-005-2911-3.
24. Foschi D, Lazzaroni M, Sangaletti O, Corsi F, Trabucchi E, Bianchi Porro G. Effects of intramural administration of Botulinum Toxin A on gastric emptying and eating capacity in obese patients. Dig Liver Dis 2008;40(8):667-672. DOI: 10.1016/j.dld.2008.02.040.
25. Topazian M, Camilleri M, Enders FT, Clain JE, Gleeson FC, Levy MJ, et al. Gastric antral injections of botulinum toxin delay gastric emptying but do not reduce body weight. Clin Gastroenterol Hepatol 2013;11(2):145-50.e1. DOI: 10.1016/j.cgh.2012.09.029.
26. Li L, Liu QS, Liu WH, Yang YS, Yan D, Peng LH, et al. Treatment of Obesity by Endoscopic Gastric Intramural Injection of Botulinum Toxin A: a Randomized Clinical Trial. Hepatogastroenterology 2011;59(118):2003-2007. DOI: 10.5754/hge11755.
27. Coskun H, Duran Y, Dilege E, Mihmanli M, Seymen H, Demirkol MO. Effect on Gastric Emptying and Weight Reduction of Botulinum Toxin-A Injection into the Gastric Antral Layer: An Experimental Study in the Obese Rat Model. Obes Surg 2005;15(8):1137-1143. DOI: 10.1381/ 0960892055002275.
28. Rollnik JD, Meier PN, Manns MP, Göke M. Antral injections of botulinum a toxin for the treatment of obesity. Ann Intern Med 2003;138(4):359-360.
29. Albani G, Petroni ML, Mauro A, Liuzzi A, Lezzi G, Verti B, et al. Safety and efficacy of therapy with botulinum toxin in obesity: a pilot study. J Gastroenterol 2005;40(8):833-835. DOI: 10.1007/s00535-005-1669-x.
30. García-Compean D, Mendoza-Fuerte E, Martínez JA, Villarreal I, Maldonado H. Endoscopic injection of botulinum toxin in the gastric antrum for the treatment of obesity. Results of a pilot study. Gastroenterol Clin Biol 2005;29(8-9):789-791. DOI: 10.1016/S0399-8320(05)86349-3.
31. Júnior A, Savassi-Rocha P, Vaz Coelho L, et al. Botulinum A Toxin Injected into the Gastric Wall for the Treatment of Class III Obesity: A Pilot Study. Obes Surg 2006;16(3):335-343. DOI: 10.1381/096089206776116408.
32. Gui D, Mingrone G, Valenza V, Spada PL, Mutignani M, Runfola M, et al. Effect of botulinum toxin antral injection on gastric emptying and weight reduction in obese patients: a pilot study. Aliment Pharmacol Ther 2006;23(5):675-680. DOI: 10.1111/j.1365-2036.2006.02773.x.
33. Mittermair R, Keller C, Geibel J. Intragastric injection of botulinum toxin A for the treatment of obesity. Obes Surg 2007;17(6):732-736.
34. Bang CS, Baik GH, Shin IS, Kim JB, Suk KT, Yoon JH, et al. Effect of intragastric injection of botulinum toxin A for the treatment of obesity: a meta-analysis and meta-regression. Gastrointest Endosc 2015;81(5):1141-9.e1-7. DOI: 10.1016/j.gie.2014.12.025.
35. de Moura EGH, Bustamante FAC, Bernardo WM. Reviewing the reviewers: critical appraisal of "Effect of intragastric injection of botulinum toxin A for the treatment of obesity: a meta-analysis and meta-regression." Gastrointest Endosc 2016;83(2):478. DOI: 10.1016/j.gie.2015.08.029.
36. Monteiro MP, Batterham RL. The Importance of the Gastrointestinal Tract in Controlling Food Intake and Regulating Energy Balance. Gastroenterology 2017;152(7):1707-1717. DOI: 10.1053/j.gastro.2017.01.053.
37. Batterham RL, Cohen MA, Ellis SM, Le Roux CW, Withers DJ, Frost GS, et al. Inhibition of food intake in obese subjects by peptide YY3-36. N Engl J Med 2003;349(10):941-948. DOI: 10.1056/NEJMoa030204.
38. Flint A, Raben A, Astrup A, Holst JJ. Glucagon-like peptide 1 promotes satiety and suppresses energy intake in humans. J Clin Invest 1998;101(3):515-520. DOI: 10.1172/JCI990.
39. Wynne K, Stanley S, McGowan B, Bloom S. Appetite control. J Endocrinol 2005;184(2):291-318. DOI: 10.1677/joe.1.05866.
40. Ueno H, Yamaguchi H, Kangawa K, Nakazato M. Ghrelin: a gastric peptide that regulates food intake and energy homeostasis. Regul Pept 2005;126(1):11-19. DOI: 10.1016/j.regpep.2004.08.007.
41. English PJ, Ghatei MA, Malik IA, Bloom SR, Wilding JPH. Food Fails to Suppress Ghrelin Levels in Obese Humans. J Clin Endocrinol Metab 2002;87(6):2984-2984. DOI: 10.1210/jcem.87.6.8738.
42. García-Fuentes E, Garrido-Sanchez L, Garcia-Almeida JM, Garcia-Arnes J, Gallego-Perales JL, Rivas-Marin J, et al. Different Effect of Laparoscopic Roux-en-Y Gastric Bypass and Open Biliopancreatic Diversion of Scopinaro on Serum PYY and Ghrelin Levels. Obes Surg 2008;18(11):1424-1429. DOI: 10.1007/s11695-008-9560-5.
 Dirección para correspondencia:
Dirección para correspondencia:
Gabriel Olveira.
Servicio de Endocrinología y Nutrición.
Hospital Regional Universitario de Málaga.
Avda. Carlos Haya, s/n. 29010 Málaga
e-mail: gabrielm.olveira.sspa@juntadeandalucia.es
Recibido: 25/04/2017
Aceptado: 02/07/2017