INTRODUCCIÓN
El síndrome de intestino corto (SIC) se define como la insuficiencia del intestino para mantener la correcta absorción de macronutrientes, micronutrientes, agua y electrolitos, cuando dicha situación es secundaria a una resección intestinal 1,2. La causa más frecuente de intestino corto es la enterocolitis necrosante. También ocurre por defectos de la pared abdominal, íleo meconial, atresia intestinal, vólvulos, enfermedad de Hirschprung y enfermedad de Crohn 3. A consecuencia de la malabsorción crónica, suele manifestarse con diarrea, pudiendo aparecer secundariamente deficiencias nutricionales, alteraciones hidroelectrolíticas, retraso ponderoestatural, etc.
La acidosis D-láctica (ADL) es una entidad infrecuente, descrita habitualmente en pacientes con SIC 4,5,6,7,8,9, aunque también puede presentarse tras un bypass yeyuno-ileal 1,4.
Se caracteriza por un cuadro neurológico de rápida instauración, que se acompaña de niveles elevados de D-lactato en sangre y, con frecuencia, acidosis metabólica. La clínica es habitualmente superponible a una intoxicación alcohólica, en tanto que suele cursar con ataxia, disartria, agresividad, dificultad en la concentración, alteraciones de la memoria y la coordinación, confusión, disminución del nivel de conciencia e incluso coma 3,4,5. Pueden aparecer recurrencias, durando cada episodio desde horas hasta varios días.
Para el desarrollo de una ADL, es necesaria la presencia del colon, pues la fisiopatología de esta entidad comienza con la instauración de un sobrecrecimiento de bacterias productoras de L y D-lactato. Así, en los pacientes con SIC, los carbohidratos no absorbidos en el intestino delgado llegan al colon, donde son metabolizados por las bacterias en diferentes ácidos orgánicos (como lactato y ácidos grasos de cadena corta). Estos reducen el pH del colon, favoreciendo la proliferación anómala de bacterias ácido-resistentes, como Lactobacillus, que a su vez producen más lactato a partir de azúcares, generándose así un círculo vicioso 1,4. Esta disbacteriosis también puede instaurarse tras un tratamiento antibiótico oral o la ingesta de probióticos, ya que pueden alterar la flora colónica habitual 4,11. Cuando el paciente realiza una comida rica en carbohidratos, especialmente azúcares simples, estas bacterias los fermentan a L-lactato y D-lactato, que pasan a la circulación sanguínea en cantidades elevadas, dando lugar a acidosis metabólica con anión gap elevado, e iniciándose la clínica neurológica 4.
Dada la escasa incidencia de esta complicación, en la actualidad el tratamiento está poco estandarizado y se basa en la antibioterapia oral y la restricción de carbohidratos simples, desconociéndose tanto en qué medida se debe realizar dicha restricción como la duración óptima del tratamiento.
CASO CLÍNICO
Presentamos el caso de una niña de cinco años, con antecedente de SIC secundario a una resección desde yeyuno proximal a íleon distal realizada a los cuatro años de edad por un vólvulo de intestino medio y malrotación intestinal. La longitud del segmento yeyuno-ileal remanente era de 21 cm, con válvula ileocecal y colon íntegros. Recibía nutrición parenteral y enteral a través de gastrostomía en su domicilio. En el tránsito digestivo, presentaba dilatación del intestino delgado tras la última porción duodenal y gran antiperistaltismo. El vaciamiento del íleon estaba retrasado. El colon no presentaba alteraciones (Fig. 1)
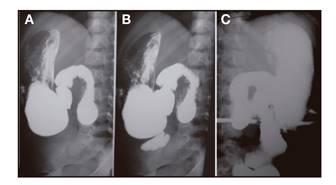
Figura 1 A. Buen vaciamiento gástrico con relleno del duodeno y dilatación ileal en la que se observa antiperistaltismo previa a la anastomosis del colon. B. El vaciamiento ileal está enlentecido, y se realiza a través de una anastomosis de pequeño calibre que permite la repleción total del colon (C).
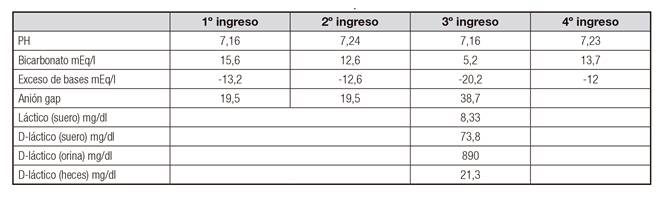
Consultó en cuatro ocasiones en un periodo de cinco meses por aumento del número de deposiciones diarreicas y clínica neurológica, coincidentes con aumento de la nutrición enteral. A la exploración presentaba decaimiento, deshidratación leve, cutis marmorata, disartria y ataxia. Se realizó analítica sanguínea con bioquímica y gasometría, donde se objetivó acidosis metabólica hiperclorémica con anión gap elevado. Ante la sospecha de acidosis D-láctica, se demostraron niveles de D-lactato en suero, orina y en heces claramente elevados (Tabla I), con L-lactato normal. En el coprocultivo se evidenció crecimiento prácticamente puro de bacilos grampositivos. Mediante técnica de MALDI-TOF se constató que se trataba de Lactobacillus spp.
En todos los episodios, se corrigió la acidosis metabólica con sueroterapia intravenosa con bicarbonato, y se suspendió la nutrición enteral (NE), manteniendo todo el aporte calórico con nutrición parenteral. En un intento de prevenir las recurrencias, inicialmente se combatió la disbacteriosis con metronidazol (30 mg/kg/día en tres dosis) y solución de descontaminación (nistatina, colistina sulfato y tobramicina sulfato) en ciclos de cinco días cada dos semanas. Tras la tercera recaída, se cambió la antibioterapia por una solución con vancomicina (100 mg cada 8h) y trimetoprim/sulfametoxazol (20/100 mg cada 8h) la primera semana de cada mes. En todos los casos, el progresivo aumento de la NE desencadenó un nuevo episodio de ADL. Por ello, se decidió restringir los aportes de NE de sacarosa y glucosa, sustituyendo un 25% de su fórmula habitual (Nieda Plus(r), Abbott Laboratories SA) por una fórmula con aporte exclusivo de fructosa (Galactomin 19 fórmula(r), SHS España SA, actualmente Nutricia SRL). Más tarde, al diversificar la alimentación, se le dieron recomendaciones para realizar una dieta baja en sacarosa y glucosa y se mantuvo el aporte de NE con la misma pauta, sustituyendo, en función de su disponibilidad en el comercio, la fórmula con aporte exclusivo de fructosa por una fórmula con bajo aporte de carbohidratos (almidón) (3232 A(r), Mead Johnson Nutrition) suplementada con fructosa.
La paciente recibió varios ciclos de antibióticos durante nueve meses, y se mantuvieron los aportes descritos de NE durante dos años y nueve meses. Posteriormente, se sustituyó de forma progresiva por fórmula polimérica pediátrica con aportes normales de carbohidratos. No volvió a presentar ningún nuevo episodio de ADL.
Precisó nutrición parenteral domiciliaria durante un total de dos años y un mes y NE por gastrostomía durante cinco años y diez meses. La evolución a los 16 años ha sido satisfactoria: ha mantenido una curva ponderoestatural adecuada, alcanzando una talla adulta en el momento del alta a los 20 años de edad de 154,1 cm (P8, -1,38 DE), e índice de masa corporal de 19,4 kg/m2 (p23, -0,73 DE), según patrón de la Organización Mundial de la Salud (OMS) ajustado a la edad. Recibe suplementos de vitaminas liposolubles, ácido fólico y calcio por vía oral y vitamina B12 intramuscular.
DISCUSIÓN
Son varias las circunstancias que pueden favorecer el desarrollo de una acidosis D-láctica: en primer lugar, el desarrollo de bacterias ácido-resistentes productoras de lactato en el colon secundario a la malabsorción de carbohidratos 4,5,9. Este hecho puede favorecerse por la ingesta de probióticos o de un antibiótico oral 2,11. Por otra parte, la dismotilidad intestinal puede aumentar el sobrecrecimiento bacteriano, y una ingesta rica en carbohidratos, en especial azúcares simples, supone un aporte del sustrato necesario para la síntesis de lactato 4,12.
Varios de estos factores estaban presentes en nuestra paciente: la malabsorción por su intestino corto, que aumenta el paso de nutrientes no digeridos al colon; la existencia de un asa dilatada, que produce sobrecrecimiento bacteriano; el tratamiento con volúmenes crecientes de nutrición enteral con la intención de retirar la nutrición parenteral; y la existencia de disbacteriosis a expensas de Lactobacillus, como está descrito en la literatura.
El lactato existe en forma de dos isómeros, L-lactato y D-lactato, que pueden ser metabolizados a piruvato o producidos a partir de él, mediante la L-lactato deshidrogenasa (LDH) y la D-LDH, respectivamente. En el hombre, el L-lactato, que se produce a partir de piruvato durante el metabolismo anaerobio de los carbohidratos, es el isómero predominante, mientras que el D-lactato se sintetiza en la vía del metilglioxal en cantidades prácticamente despreciables; por ello, en condiciones fisiológicas, los niveles de D-lactato son indetectables. Además, como el ser humano carece de D-LDH, se creía que durante la acidosis D-láctica, el L-lactato producido por las bacterias colónicas era rápidamente metabolizado por la L-LDH, mientras que el D-lactato permanecía elevado al carecer de un enzima capaz de eliminarlo. Sin embargo, se ha demostrado la existencia de un enzima con esta actividad, la D-2-hidroxi ácido deshidrogenasa, presente en abundancia en hígado y riñón 5. El exceso de D-lactato (se consideran niveles tóxicos aquellos superiores a 3 mmol/l) podría explicarse, entonces, por la inhibición de esta enzima en situación de acidosis, como se ha observado en estudios in vitro 4,5.
Es preciso puntualizar que, actualmente, se sospecha que el exceso de D-lactato per se no explica la encefalopatía que presentan los pacientes con acidosis D-láctica, ya que no parece existir correlación entre sus niveles y la intensidad de los síntomas 4,5. Se propone que la neurotoxicidad puede deberse a la producción de otros ácidos orgánicos en el colon (mercaptanos, aldehídos, aminas, etc.), que pasarían a la sangre y al líquido cefalorraquídeo (LCR) junto con el D-lactato, y que se comportarían como falsos neurotransmisores 4,5.
Los pacientes con ADL suelen presentar, además de altos niveles de ácido D-láctico en sangre, orina y heces, acidosis metabólica con anión gap elevado en sangre y orina 3,4. Sin embargo, se han descrito casos aislados de ADL con encefalopatía y ácido D-láctico elevado, y ausencia de acidosis metabólica 4. El electroencefalograma, en los casos en los que se ha realizado, muestra signos de encefalopatía durante la fase aguda, aunque no parece aportar datos específicos que sean útiles como herramienta diagnóstica 4.
El tratamiento inicial consiste en la corrección de la acidosis metabólica mediante sueroterapia intravenosa con bicarbonato. Se debe evitar el Ringer lactato por su contenido en L-lactato y D-lactato. Asimismo, se deben restringir o suspender los aportes enterales de carbohidratos, para reducir los sustratos fermentables por las bacterias productoras de lactato 1,4,5.
Para prevenir posibles recurrencias, es preciso tratar la disbacteriosis mediante ciclos de antibióticos orales con escasa absorción entérica (neomicina, vancomicina, metronidazol, clindamicina) y restricción de carbohidratos en la dieta (especialmente azúcares simples) 4,5. Dada la infrecuencia de la ADL, se desconoce la duración óptima del tratamiento 2. Los síntomas pueden reaparecer pocos días después de finalizar el antibiótico, o no presentarse durante años 2,9. En cuanto al uso de probióticos con bacterias productoras exclusivamente de L-lactato, no está clara su efectividad en el tratamiento de la ADL, por lo que no existe evidencia suficiente para recomendarlos como parte de la terapia de estos pacientes 3,4,5,10. Las modificaciones dietéticas han sido propuestas en la literatura como parte del tratamiento de la ADL. Mayne sostiene que es posible prevenir las recurrencias proporcionando los carbohidratos con el siguiente perfil: monosacáridos 1%, disacáridos 6%, trisacáridos 8%, tetrasacáridos 7% y pentasacáridos y el resto 78% 12. Ramakrishnan recomienda una dieta baja en carbohidratos (10%) como alternativa a los antibióticos en algunos pacientes 13 y Bongaerts propone dieta baja en carbohidratos y rica en grasas 14. En nuestra paciente, la dieta con aportes de fructosa y restricción de glucosa y sacarosa fue eficaz en el control de las recidivas. Nuestra hipótesis se basa en el mecanismo de absorción intestinal de los distintos monosacáridos: mientras que la glucosa y otros monosacáridos se absorben por trasporte activo, la fructosa es el único que lo hace por difusión facilitada. En los pacientes con SIC suele existir sobrecrecimiento bacteriano a nivel de intestino delgado, que deconjuga los ácidos y sales biliares provocando inflamación de la mucosa intestinal, de modo que fallan los mecanismos de trasporte activo. De esta forma, la glucosa y la sacarosa no se absorben correctamente y llegan al colon, donde pueden ser fermentadas a lactato por las bacterias. Esto no ocurre así con la fructosa, ya que se absorbe por difusión facilitada.
Para confirmar la correcta absorción de la fructosa, hubiera sido óptimo verificar nuestra hipótesis mediante pruebas complementarias. Sin embargo, la respuesta clínica tras el tratamiento dietético con aporte enteral parcial de fórmula con fructosa fue radical: no se produjeron recaídas posteriores, mientras que previamente se documentaron cuatro episodios en cinco meses a pesar de una correcta adherencia a la antibioterapia de escasa absorción entérica y restricción de carbohidratos simples (disminución de la cantidad de NE con la fórmula habitual que recibía la paciente y aumento de la nutrición parenteral), lo cual sugiere que la modificación de la dieta fue eficaz.
En el momento en que tuvieron lugar los episodios, hubiera sido atractivo estudiar la absorción de fructosa mediante un test de hidrógeno espirado tras sobrecarga oral con dicho monosacárido. Sin embargo, por entonces dicha prueba no se realizaba de rutina en nuestro medio. Por otra parte, en documentos de consenso recientes en pacientes adultos se concluye la falta de estandarización de esta prueba, sin que se hayan establecido la dosis de fructosa a administrar para realizar el test, así como los puntos de corte para establecer el diagnóstico de malabsorción de dicho monosacárido 15. En cualquier caso, la interpretación de estas pruebas en nuestra paciente hubiese sido poco esclarecedora, dado que la presencia de sobrecrecimiento bacteriano se traduce en un aumento de la detección basal del hidrógeno espirado superior a diez partes por millón.
Los autores exponemos el presente caso para que las modificaciones dietéticas realizadas con buen resultado en nuestra paciente sean tenidas en cuenta como opción terapéutica en otros pacientes con SIC.