INTRODUCCIÓN
Una de las principales limitaciones de la administración de la nutrición parenteral (NP) cuando se utilizan fuentes inorgánicas de calcio y fosfato es la imposibilidad de administrar cantidades suficientes de estos iones sin formación de precipitados. El problema de la precipitación calcio-fosfato resulta sustancialmente limitante en la elaboración de nutriciones parenterales pediátricas debido a los requerimientos elevados de calcio y fósforo 1,2 y a la mayor temperatura ambiente, especialmente en las incubadoras.
En abril de 1994 la Food and Drug Administration (FDA) publicó una alerta debido a la comunicación de dos muertes por distrés respiratorio en pacientes con nutrición parenteral cuyas autopsias revelaron embolia microvascular pulmonar con presencia de precipitados de fosfato cálcico. Las fuentes de calcio y fósforo utilizadas habían sido gluconato cálcico y fosfato potásico, respectivamente. A raíz de esta alerta, la FDA recomienda la administración de las nutriciones parenterales con filtro de 1,2 µm cuando las mezclas contengan lípidos (mezclas ternarias) y 0,2 µm cuando se trate de mezclas dos en uno que contienen solo glucosa y aminoácidos como macronutrientes (mezclas binarias) 3.
La formación de precipitados de fosfato cálcico depende de diversos factores como temperatura, pH, fuente de aminoácidos, concentración de aminoácidos y glucosa, presencia de otros electrolitos, orden de adición de los componentes y fuente de calcio y fosfato 4,5,6,7,8,9 10-11.
Diversos estudios han tratado de determinar la cantidad máxima de calcio y fosfato que puede añadirse a una nutrición parenteral sin que se produzca riesgo de precipitación; sin embargo, los trabajos son muy heterogéneos en cuanto a las fuentes de aminoácidos, las temperaturas de conservación de las nutriciones parenterales, los métodos para la detección de precipitados y las fuentes de calcio y, sobre todo, de fosfato. Los métodos de análisis mayoritariamente utilizados para la detección de precipitados son los visuales, recuento de partículas, espectrofotometría y microscopía óptica 6,7,8,9-10,12,13,14,15,16,17,18-19.
Las fuentes orgánicas de calcio y fosfato son menos proclives a precipitar ya que se disocian menos que las inorgánicas 15,17,20. Su introducción ha permitido aportar todas las necesidades de calcio y fósforo en las poblaciones pediátricas, lo que era imposible con fuentes inorgánicas. Existen diversos estudios que evidencian la estabilidad de estos compuestos en NP 10,13,17,18,20,21-22. Sin embargo, aunque estas sales orgánicas se introdujeron hace más de 20 años, el número de estudios es todavía pequeño y heterogéneo.
En el documento de consenso de preparación de nutrición parenteral pediátrica SENPE/SEGHNP/SEFH 2008 23 se incluyen aportes máximos de calcio y fosfato orgánico basados en la poca bibliografía que había en ese momento 10,13,20,21,24. Recientemente se han publicado más estudios que avalan esta estabilidad17,18,22, sin embargo, la mayoría de los artículos no utilizan los mismos productos que s
e utilizan actualmente en España. Otros artículos recientes sugieren que incluso a dosis habituales podría producirse precipitación 15,25.
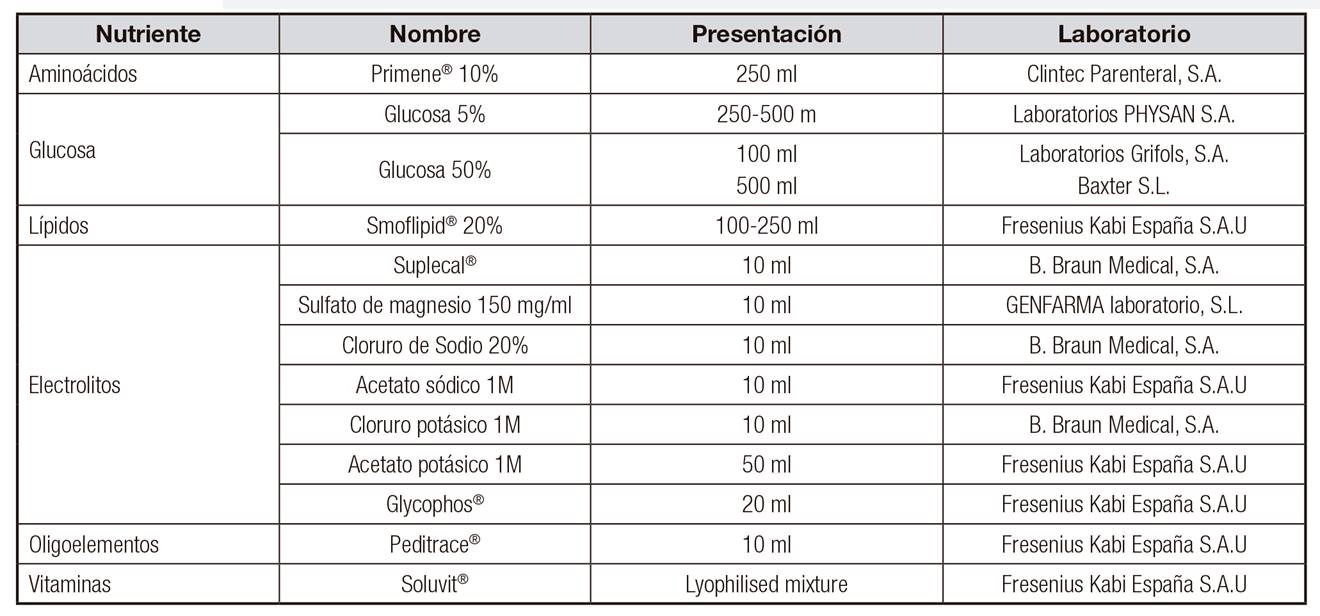
Debido a esa posible precipitación y a que pocos estudios han sido elaborados empleando las fuentes de aminoácidos, calcio y fósforo que se utilizan actualmente en nuestro país, se diseñó este estudio cuyo objetivo es conocer si se producen procesos de precipitación en soluciones de nutrición parenteral que contengan calcio y fosfato orgánicos en las cantidades límites del documento de consenso de preparación de nutrición parenteral pediátrica SENPE/SEGHNP/SEFH (Tabla 1).
MATERIAL Y MÉTODOS
ESTUDIO PRELIMINAR
Para conocer si los resultados de este estudio se podrían extrapolar a NP con lípidos, se realizó un estudio para comparar el pH de las NP con y sin lípidos (Tabla 2). Se prepararon cuatro NP, dos de ellas con lípidos y las otras dos sin lípidos, para estudiar la diferencia de pH entre ellas. Se tomaron 20 ml de cada una y se midió el pH por triplicado (Tabla 2) con un pHmetro Crison(r) micropH 2001 calibrado previamente a su uso.
ESTUDIO PRINCIPAL
Preparación de las mezclas de nutrición parenteral (NP)
Se prepararon NP de 100 ml con distintas concentraciones de aminoácidos, calcio y fósforo para que se asemejasen a las concentraciones máximas recogidas en el documento consenso de preparación. Las NP no contenían lípidos para poder detectar correctamente los precipitados. Se utilizaron dos soluciones control, una sin calcio y fósforo como "control sin precipitación" y otra con alto contenido de calcio y fósforo y baja concentración de aminoácidos como "control de precipitación". La preparación de las NP se realizó en cabina de flujo laminar siguiendo la normativa de trabajo de nuestro hospital. Los productos utilizados se pueden ver en la Tabla 3. Los componentes se fueron añadiendo en el siguiente orden: solución de aminoácidos, gluconato cálcico, glucosa, sulfato magnésico, sales de sodio, sales de potasio, vitaminas hidrosolubles, oligoelementos y glicerofosfato sódico. Como contenedor de la solución fueron utilizadas bolsas EVA(r) multicapa de 250 ml. Cada NP se elaboró por triplicado y posteriormente se midió el pH de cada una de ellas. La composición de las mezclas estudiadas se recoge en la Tabla 4.
Almacenamiento
Con el objetivo de simular una condición real de uso de las NP en neonatos dentro de incubadoras, se almacenaron a una temperatura ambiente media de 24,5 ± 0,7 °C durante 20 horas. Posteriormente se mantuvieron cuatro horas a 35 °C, que simula el tiempo que la NP pasa por el tramo del equipo de infusión que está dentro de la incubadora. Se utilizó un baño Julabo TW20(r) (Julabo GmbH), con una estabilidad de temperatura de ± 0,2 °C, para mantener la temperatura de las bolsas a 35 °C.
Filtración
Tras el periodo de almacenamiento, se filtraron las soluciones completas por caída libre con filtros Pall NEO96E(r) (Pall Corporation) de 0,2 µm. Posteriormente, estos filtros fueron etiquetados con un código ciego de letras aleatorias (A-U) y se transportaron a Pall Corporation para su posterior análisis.
Preparación de las muestras de filtros
Se introdujo aire en el conector de entrada de los filtros Pall NEO96(r) empleando una jeringa de 10 ml para eliminar cualquier residuo de líquido de la membrana. Posteriormente, se cortó una sección del filtro de 1 cm2.
Las muestras se montaron en chapas de carbono fijadas sobre una plataforma de aluminio para análisis mediante microscopio electrónico (SEM) y con la membrana por donde penetraba el flujo orientada hacia arriba. A continuación, el filtro se dejó secar durante un periodo de 24 horas en un desecador.
Análisis mediante microscopio electrónico y espectrometría por dispersión de rayos X (EDS)
Las muestras de filtros fueron examinadas empleando un microscopio electrónico de barrido (SEM Hitachi TM300) asistido por ordenador y equipado con un sistema de espectrometría de dispersión de rayos X (Quantax 70). Las muestras se recubrieron con oro antes del análisis mediante SEM y EDS. Una fina cubierta de oro fue depositada en la superficie de cada muestra empleando un sistema de recubrimiento mediante vacío (Gold Agar Sputter Coater) para aumentar la conductividad de las muestras. Todas las muestras se analizaron inicialmente en el punto con coordenadas 0,0 a 100 aumentos mediante SEM con el objetivo de tener un método más fiable y libre de sesgo para la identificación de precipitados. Las imágenes obtenidas mediante SEM se analizaron también a 500 y 1.000 aumentos en el campo de visión 0,0 con un voltaje de aceleración de 15 kv. El análisis mediante EDS se llevó a cabo a 1.000 aumentos.
Contaje de partículas
El número de partículas cristalinas observado en cada muestra a 100 aumentos se contabilizó de manera visual para dar una cifra aproximada del número de partículas. La superficie del filtro estudiada fue de 3,72 mm2, que se corresponde con un 2,25% de la superficie total del filtro.
ESTUDIOS COMPLEMENTARIOS
Ante la gran cantidad de precipitados encontrados, que no concordaban con los estudios publicados y en los que no intervenía el fósforo, se realizaron varios estudios complementarios:
Análisis de una NP por triplicado sin fósforo y otra sin calcio: para determinar si el fósforo tenía algún papel en la formación de los precipitados.
Análisis de una NP por triplicado, en cuya elaboración se filtraron todos los componentes con un filtro de cinco micras: para descartar que los precipitados proviniesen de los productos con los que se habían elaborado las nutriciones parenterales.
Análisis de una NP por triplicado elaborada añadiendo primero el glicerofosfato sódico y, al final de la preparación, el gluconato cálcico: para descartar que al añadir primero el glicerofosfato hubiera mayor formación de precipitados.
Análisis de una solución saturada de bifosfato cálcico: para asegurar que el sistema de espectrometría de dispersión de rayos X medía la cantidad de fósforo de la muestra.
Análisis de una NP por triplicado filtrada por un filtro de 1,2 micras y posteriormente por otro de 0,2 micras: para ver si el filtrado evitaba el paso al paciente de precipitados.
Análisis de una NP por triplicado en la que inmediatamente después de filtrar se infunde aire en el filtro: para descartar que los precipitados se formen posteriormente al filtrado, durante el transporte del filtro.
Análisis de una NP por triplicado donde el secado y la observación por microscopia electrónica se realizaron inmediatamente después de la filtración: para descartar que los precipitados se formasen posteriormente al filtrado.
RESULTADOS
En la Tabla 2 se puede ver el pH de las soluciones estudiadas con y sin lípidos. Las NP con lípidos presentaron un pH ligeramente más básico que las NP sin lípidos.
Los valores de pH de las distintas dietas se recogen en la Tabla 4. Todos los valores oscilaron entre 6 y 7, siendo el más ácido el control sin calcio y fósforo. Los valores más básicos fueron los registrados para la dieta 2 y el control de precipitación, con baja concentración de aminoácidos y elevado aporte de calcio y fósforo.
En la mayoría de los filtros observados se visualizaron gran cantidad de precipitados con 100 aumentos que tenían un tamaño entre 5 y 15 µm (Tabla 4).
Aunque en algún filtro se visualizaron partículas amorfas compatibles con restos de goma procedentes de viales, cristales procedentes de ampollas o fibras procedentes de gasas (Fig. 1), la mayoría de las partículas encontradas fueron precipitados cristalinos con forma rectangular (Fig. 2,,,,Fig. 6). En la NP control, sin calcio ni fósforo, no se observó precipitado alguno y en el control de precipitación se encontraron numerosos precipitados (Fig. 7). Por otra parte, en todos los casos en los que se observaron estos precipitados cristalinos, en los análisis de composición por EDS, se detectó la presencia de calcio y un aumento del porcentaje de oxígeno, pero no se detectó fósforo.
ESTUDIOS COMPLEMENTARIOS
Análisis de una NP sin fósforo y otra sin calcio: solo se encontraron precipitados en la NP que contenía calcio.
Análisis de una NP elaborada filtrando todos los componentes con un filtro de cinco micras: no se observaron partículas compatibles con fibras, cristales o goma. Se encontró igual número de precipitados en las NP en las que se filtraban los componentes que en las que no se filtraban.
Análisis de una NP elaborada añadiendo primero el glicerofosfato sódico y, al final de la preparación, el gluconato cálcico: se encontraron precipitados en ambas NP.
Análisis de una solución saturada de bifosfato cálcico: el sistema de espectrometría de dispersión de rayos X detectó fósforo y calcio.
Análisis de una NP filtrada por un filtro de 1,2 micras y, posteriormente, por otro de 0,2 micras: se detectaron precipitados en los dos tipos de filtros, pero en mayor cantidad en el de 1,2 micras.
Análisis de una NP en la que inmediatamente después de filtrar se infunde aire en el filtro: se encontraron muchos menos precipitados y de distinto tipo.
Análisis de una NP donde el secado y la observación por microscopia electrónica se realizaron inmediatamente después de la filtración: no se observaron precipitados cristalinos.
DISCUSIÓN
Aunque se han encontrado gran cantidad de precipitados de forma cristalina, estos se han formado, con mucha probabilidad, posteriormente a su filtración ya que, cuando se deseca y observa el filtro inmediatamente después de su filtración, estos cristales no aparecen. No podemos conocer la naturaleza de estos precipitados, pero en su composición están presentes el calcio y el oxígeno y, por la forma de los cristales, podría tratarse de oxalato cálcico.
La causa de la formación de estos precipitados requiere más estudio. Es posible que en la solución retenida en el filtro hubiera microprecipitados que, al evaporarse el agua lentamente en los 2-4 días que duró el transporte, diera lugar a la cristalización de las partículas observadas. Cuando se introduce aire en el filtro antes del transporte el número de cristales disminuye mucho. Aunque en su composición interviene el calcio, en ninguna muestra se ha encontrado fósforo, por lo que parece que los precipitados encontrados no son de fosfato cálcico, que era el objetivo de nuestro estudio.
MacKay y cols. 18 tampoco encontraron precipitados mayores de 5 µm a concentraciones de hasta 50 mEq/l de calcio y 50 mmol/l de fósforo empleando gluconato cálcico y glicerofosfato sódico y a concentraciones de aminoácidos de 4 y 1,5 %. Estas concentraciones de calcio, fósforo y aminoácidos son similares a las de nuestro estudio. Estos autores estudian la precipitación producida después de 24 horas a 37 °C para simular las condiciones de la incubadora, temperatura y tiempo superiores a los de nuestro estudio. A diferencia de nuestro estudio, en el que utilizamos como fuente de aminoácidos Primene(r), en este estudio utilizan Trophamine(r), con adición de cisteína en algunos casos, lo que hace que los pH de las soluciones sean en su mayoría más bajos que los nuestros 5,4,5,6, incluso cuando alcalinizan hasta el pH de las soluciones con lípidos (6,07-6,91).
Por otro lado, Chaieb y cols. 15 encuentran precipitados con glucosa-1-fosfato (40 mmol/l de fósforo y 31,5-60 mEq/l de calcio) utilizando microscopio óptico y analizando la concentración de calcio antes y después de la filtración.
Para evitar problemas con la detección de partículas por microscopia, no hemos incluido lípidos en las NP. La adición de lípidos a la NP aumenta el pH de la mezcla y, como ya hemos comentado, la precipitación calcio-fosfato aumenta en medio básico. En nuestro estudio, esta disminución de pH debida a los lípidos fue pequeña. Y, además, está descrito que los lípidos podrían aumentar la compatibilidad calcio-fosfato 25. Consideramos como hipótesis más probable que la adición de lípidos no tiene influencia en la precipitación.
Al no haber filtrado las NP en la elaboración, hemos encontrado partículas que podrían haberse generado en la preparación de la NP, como laFigura 1, que posiblemente se ha formado al perforar un vial con una aguja.
Generalmente, las soluciones intravenosas contienen partículas en suspensión y su infusión no produce síntomas graves inmediatos en la mayoría de los casos 27. Sin embargo, su infusión a largo plazo se ha relacionado con aumento del riesgo de flebitis 28 y se han encontrado lesiones de los capilares en necropsias que podrían ser la causa de hipertensión pulmonar 29. Recientemente, diversos estudios 30,31,32 han demostrado una disminución de complicaciones graves en pacientes pediátricos críticos con el uso de filtros para la retención de partículas, apoyando la hipótesis del efecto nocivo de infusión de las mismas.
Las NP analizadas en nuestro estudio estarían dirigidas a niños recién nacidos, en muchos casos prematuros. Como se indica en varios estudios, el diámetro de los capilares neonatales puede ser inferior a 10 µm 33,34, por lo que existe el riesgo de que pudieran ser obturados con partículas o precipitados de estos tamaños. Es por ello que se recomienda filtrar en la administración de la NP o, al menos, filtrar los productos en la preparación de la NP.
CONCLUSIONES
En nuestro estudio no hemos encontrado precipitados de fosfato cálcico en los límites actualmente recogidos en el documento consenso de preparación SENPE/SEGHNP/SEFH. Sin embargo, es posible que se formen microprecipitados de algún compuesto con calcio en su composición. Cuando no se filtran los componentes en la preparación, la NP puede contener partículas de goma, cristal, etc. Por ello es importante la utilización de filtros en la administración de NP y/o en la preparación de la NP para asegurar que este tipo de precipitados queden retenidos en la membrana y no pasen al niño.