INTRODUCCIÓN
La lactancia materna exclusiva (LME) es parte fundamental de la "Estrategia Mundial para la alimentación del lactante y del niño pequeño" de la Organización Mundial de la Salud (OMS), debido a los beneficios conocidos de la lactancia como la forma natural de proporcionar un alimento ideal 1. Por este motivo, la OMS recomienda que la lactancia materna (LM) debe ser exclusiva los primeros seis meses de vida, para lograr un crecimiento, desarrollo y salud óptimos, puesto que esta cumple a cabalidad los requerimientos nutricionales de esta etapa. Solo a partir de los seis meses de edad se recomienda introducir gradualmente alimentos sólidos como complemento a la LM. Esta estrategia mundial se soporta en que, además de los beneficios inmediatos, existe evidencia clínica que señala que los adolescentes y adultos que fueron amamantados tienen menor tendencia a desarrollar alteraciones cardiometabólicas 2.
Aunque la mayoría de los recién nacidos inician la lactancia temprana, la prevalencia mundial de LME oscila alrededor del 14% 3. Sin embargo, esta cifra varía entre países de 7,7% a 68,3%, ocurriendo lo mismo con la duración mediana de la lactancia, que varía de 6,3 a 21,7 meses 4. Las mayores tasas de LME las presentan los países del sur de Asia con un 60%, seguidos por el este y sur de África, con un 57%. No se conoce con detalle cuál es la situación en los países con mayores ingresos, pero la información disponible es preocupante. En el año 2010, en Australia, alrededor del 90% de las mujeres iniciaban LM, pero a los seis meses solo el 2% continuaba con LME. En Estados Unidos, en 2013, el inicio de la LM era del 76% y a los seis meses la LME se reducía hasta el 16%, mientras que en Europa, según datos de la Organización para la Cooperación y Desarrollo Económicos (OCDE) del año 2005, los mejores resultados de inicio de LM los presentaban los países nórdicos, con cifras cercanas al 100%, pero los porcentajes de LME a los seis meses disminuían por debajo del 20%, muy lejos del objetivo de la OMS (50% de LME a los seis meses) 5. Así mismo, según la Organización Panamericana de la Salud (OPS), de acuerdo a cifras disponibles para el año 2014, la prevalencia de LME en los países de América Latina y el Caribe era del 38,76%. Los países con mayores tasas fueron: Perú, con un 68%; Bolivia, con el 60%; y Argentina, con el 55%, contrario a los datos obtenidos en República Dominicana (7,7%), México (14,5%) y Cuba (26,4%) 4. En Colombia, los datos para el año 2015 indican un inicio temprano de lactancia en el 72,7% de los niños, con una prevalencia de LME del 36,1% y una mediana de duración de la lactancia de 14,4 meses 6.
Con base en estos datos epidemiológicos, es clave destacar el papel que tiene la LME en el desarrollo de alteraciones cardiometabólicas 7,8,9-10, tales como la resistencia a la insulina (RI). Los resultados basados en estudios observacionales han sido controversiales. Algunos investigadores han evidenciado la existencia de un efecto protector entre la LM y la prevención del desarrollo de RI, así como también se ha propuesto la relación entre la LM y el menor grado de desarrollo de sobrepeso u obesidad 8,9,11, siendo destacadas las publicaciones de Arenz y cols., en 2004 12, y la revisión de literatura de Dewey en el año 2001 13.
Con base en estos resultados, se han esbozado varias hipótesis acerca del papel que podría tener la LM en el desarrollo de alteraciones cardiometabólicas, las cuales incluyen mecanismos de comportamiento alimentario y mecanismos hormonales. En efecto, los lactantes alimentados con fórmulas artificiales presentan concentraciones más altas de insulina. Este factor se asocia a mayor depósito de tejido adiposo, que contribuye a la ganancia de peso, siendo las altas concentraciones de insulina el resultado de la mayor cantidad de proteínas en las formulas artificiales. Así mismo, entre las hormonas presentes en la leche materna que influyen en el metabolismo y desarrollo corporal, destacan la ghrelina, la adiponectina, la resistina, la obestina y la leptina; esta última, precisamente, se sintetiza en el tejido adiposo y en las glándulas mamarias y su función consiste en regular la ingesta y el gasto energético, además de tener adicionalmente un efecto anorexígeno ya que activa señales de saciedad y disminuye la sensación de hambre. Por lo tanto, los niños alimentados con leche materna presentan concentraciones más elevadas de leptina que los alimentados con fórmulas lácteas artificiales. De la misma manera, vale la pena mencionar la acción de la adiponectina, la cual es una hormona producida en el tejido adiposo cuya función consiste en aumentar la sensibilidad a la insulina e incrementar el metabolismo de los ácidos grasos, con posible implicación en el crecimiento y el desarrollo infantil 14.
De igual forma, es preciso destacar la contraparte en la relación bidireccional entre la obesidad y la RI, dados los mecanismos fisiopatológicos anteriormente descritos, ya que la obesidad se considera un estado proinflamatorio que genera una cantidad importante de radicales libres, los cuales incrementan a su vez el estrés oxidativo, llevando a la interrupción de las señales de traducción de la insulina, lo que finalmente puede dar como resultado el establecimiento de RI 15. En síntesis, la RI y particularmente la obesidad abdominal constituyen los principales factores de riesgo que contribuyen a las manifestaciones del denominado síndrome metabólico 7,16,17-18.
Por consiguiente, la creciente epidemia de obesidad infantil está asociada con un incremento en la prevalencia de enfermedades cardiometabólicas, puesto que los niños obesos con circunferencia de cintura elevada tienen un riesgo 2,3 veces mayor de desarrollar RI y, subsecuentemente, SM en comparación con los niños que tienen circunferencia de cintura en rango de normalidad 7,15. No obstante, la magnitud del SM en pediatría es variable, entre el 3 y el 4% 19, dependiendo de las características de la población estudiada y de los criterios diagnósticos considerados, que en su mayoría han sido propuestos por la OMS, el Programa Nacional de Educación sobre el Colesterol y el Panel III de Tratamiento del Adulto (National Cholesterol Education Program-Adult Treatment Panel III [NCEP-ATP III]) y la Federación Internacional de Diabetes (International Diabetes Federation [IDF]) 7,18.
Con base en lo anteriormente expuesto, el objetivo del presente estudio consiste en evaluar la relación entre la LME los primeros seis meses de vida y el desarrollo de RI, mediante los índices HOMA-IR y QUICKI 13.
MATERIAL Y MÉTODOS
TIPO DE ESTUDIO Y CRITERIOS DE SELECCIÓN
Se trata de un estudio de cohorte de tipo poblacional. La población de estudio incluyó niños y niñas con edades comprendidas entre los seis y los diez años residentes de la ciudad de Bucaramanga, que hace parte de la cohorte SIMBA I: "Prevalencia de síndrome metabólico en la población de seis a diez años residente en Bucaramanga, durante el periodo comprendido entre abril de 2006 y abril de 2007." En esta cohorte se incluyeron todos los niños y niñas entre seis y diez años con residencia mayor de un año en Bucaramanga. Además, tuvo los siguientes criterios de exclusión: antecedente de menarquia o estadio de Tanner ≥ 2, diagnóstico de diabetes mellitus u otra enfermedad endocrina y/o tratamiento hormonal en el último mes (excepto tratamiento con levotiroxina sódica).
Posteriormente, esta población fue recontactada con un 38,53% de éxito y evaluada nuevamente en el marco del estudio SIMBA fase II, "Ensamblaje de una cohorte para evaluar la aparición temprana de disfunción cardiovascular y metabólica en adolescentes con síndrome metabólico", durante el periodo comprendido entre el año 2012 y 2016. Su objetivo fue determinar la relación entre los criterios diagnósticos de SM y la aparición temprana de disfunción cardiovascular y metabólica en población adolescente, permitiendo el análisis de mayor número de factores de riesgo, tales como antecedente de LME y su relación con el desarrollo de RI asociado con el SM.
TAMAÑO DE MUESTRA
La población SIMBA fase II (2012-2016), objeto del presente estudio producto del recontacto de la muestra inicial de población en edad escolar (n = 1.282), correspondió a un total de 494 participantes en edad adolescente.
RECOLECCIÓN DE DATOS LÍNEA DE BASE
El proceso de recolección de datos se efectúo en dos fases por profesionales médicos, enfermeras y nutricionistas entrenados previamente por los investigadores del estudio.
Para la recolección de la muestra en su fase inicial (SIMBA I), se utilizaron mapas y estadísticas locales y se realizó un proceso de muestreo en dos etapas; en la primera se realizó una selección aleatoria de barrios con al menos 50 niños y en la segunda etapa se realizó una selección aleatoria de un máximo de 50 casas en cada barrio, con la debida invitación a participar en el estudio a todos los niños que cumplieron los criterios de inclusión.
Durante la primera fase (SIMBA I), llevada a cabo en el periodo comprendido entre el mes de julio de 2006 y octubre de 2007, se realizó una visita domiciliaria para la recolección de información con relación a variables sociodemográficas, nutricionales y de actividad física, y posteriormente, una segunda visita para la realización de una completa valoración clínica y toma y análisis de muestras sanguíneas (glicemia, perfil lipídico e insulina).
La segunda fase (SIMBA II) se llevó a cabo entre los años 2012 y 2016. En ella se realizó el recontacto telefónico o mediante visita domiciliaria de 494 participantes de la cohorte inicial de 1.282 niños, mediante el cual se obtuvo información sociodemográfica de seguimiento. Así mismo, se realizaron la respectiva valoración clínica y la toma y análisis de muestras sanguíneas (glicemia, perfil lipídico e insulina) en una institución de salud especializada en atención a eventos cardiovasculares en Bucaramanga, Colombia.
VARIABLES DE ESTUDIO
La variable dependiente de este estudio corresponde a la resistencia a la insulina, expresada mediante los índices:
HOMA-IR: fue obtenido de un modelo matemático usando la siguiente fórmula: ([IF*GF]/22.5), en donde IF representa los niveles de insulina en ayunas (por sus siglas en inglés) en µU/ml y GF, los niveles de glucosa en ayunas (por sus siglas en inglés) en mmol/l). Punto de corte riesgo cardiovascular ≥ percentil 90.
QUICKI: fue obtenido de un modelo matemático usando la siguiente formula: 1/(Log IF + Log GF), en donde Log IF representa el logaritmo de los niveles de insulina en ayunas (por sus siglas en inglés) en Ul/ml y Log GF, el logaritmo de los niveles de glucosa en ayunas en mg/dl (por sus siglas en inglés) en mg/dl. Punto de corte riesgo cardiovascular ≥ percentil 90.
Además, se analizaron los siguientes factores cardiometabólicos:
Glucosa alterada en ayuno ≥ 100; diabetes ≥ 126 mg/dl (Standards of Medical Care in Diabetes, ADA 2016).
Sobrepeso u obesidad: sobrepeso = IMC para la edad (IMC/E) entre los percentiles 85 a 95%; obesidad = ≥ percentil 95 del IMC/E (Expert Panel on Integrated Guidelines for Cardiovascular Health and Risk Reduction in Children and Adolescents. National Heart, Lung and Blood Institute, NHI. USA, 2012).
Hipertensión arterial: presión arterial sistólica (PAS) o diastólica (PAD) ≥ percentil 95 para la edad, género y talla medida en tres o más ocasiones.
Prehipertensión arterial: PAS o PAD ≥ percentil 90 < p95 para la edad, género y talla (The Fourth Report on the Diagnosis, Evaluation and Treatment of High Blood Pressure in Children and Adolescents).
Dislipidemia. Alteración de triglicéridos: 10-19 años, ≥ 130 mg/dl. Alteración en colesterol HDL: < 40 mg/dl. Alteración en colesterol LDL: ≥ 130 mg/dl (Expert Panel on Integrated Guidelines for Cardiovascular Health and Risk Reduction in Children and Adolescents. National Heart, Lung and Blood Institute, NHI. USA, 2012).
Índice cintura-talla (ICT): perímetro de la cintura (cm)/estatura (cm). Punto de corte obesidad abdominal ≥ 0,50.
La principal variable independiente de este estudio fue la duración de la lactancia materna exclusiva (meses). También se analizaron otras variables como:
Variables sociodemográficas: sexo, edad, nivel socio económico y lactancia materna total.
Variables antropométricas: peso, talla, IMC, circunferencia de cintura, circunferencia de la cadera, ICT e índice cintura-cadera (ICC).
CALIDAD DE LOS DATOS
La calidad de los datos fue revisada para asegurar que los datos estuvieran completos. Se realizó digitación por duplicado en el programa Excel (Microsoft Corp., Redmond, Washington) y las bases de datos fueron comparadas usando el programa Epi-Info 2000. Todas las discrepancias en las dos bases de datos fueron corregidas usando los formatos originales de captura de datos.
ANÁLISIS ESTADÍSTICO
Se realizó un análisis descriptivo en el cual las variables categóricas fueron presentadas como proporciones y las continuas, como mediana y rango intercuartílico, según la distribución que presentaban. Si las variables continuas tenían distribución normal, las diferencias fueron determinadas usando la prueba U de Mann-Whitney. La asociación entre las variables dependientes de este estudio y las independientes fue evaluada mediante modelos de regresión lineal múltiple, así como la bondad del ajuste de cada modelo. En los modelos multivariados se mantuvieron las variables que obtuvieron una p < 0,2 en el análisis bivariado. Todos los valores de p fueron considerados a dos colas, considerando significancia estadística a p < 0,05. Todos los datos fueron analizados en el programa estadístico Stata, versión 14.0 (College Station, TX: Stata Corporation).
CONSIDERACIONES ÉTICAS
Este estudio fue revisado y aprobado por los miembros del Comité de Ética en Investigaciones (CEI) de la Fundación Cardiovascular de Colombia. El consentimiento fue obtenido por parte de los participantes del estudio y/o los padres o cuidadores de los participantes y, adicionalmente, todos los menores de edad (menor de 18 años cumplidos en Colombia) dieron su asentimiento verbal y por escrito para la realización de las pruebas.
RESULTADOS
Fueron evaluados 494 participantes, producto del recontacto de la cohorte inicial de SIMBA I (n = 1282), de los cuales el 48,58% (n = 240) eran del sexo masculino y el 51,41% (n = 254) eran del sexo femenino, con una mediana de edad de 16,64 años (RI 3,08) (Tabla 1).
Tabla I. Descripción de las características sociodemográficas, estado nutricional y factores de riesgo cardiometabólico
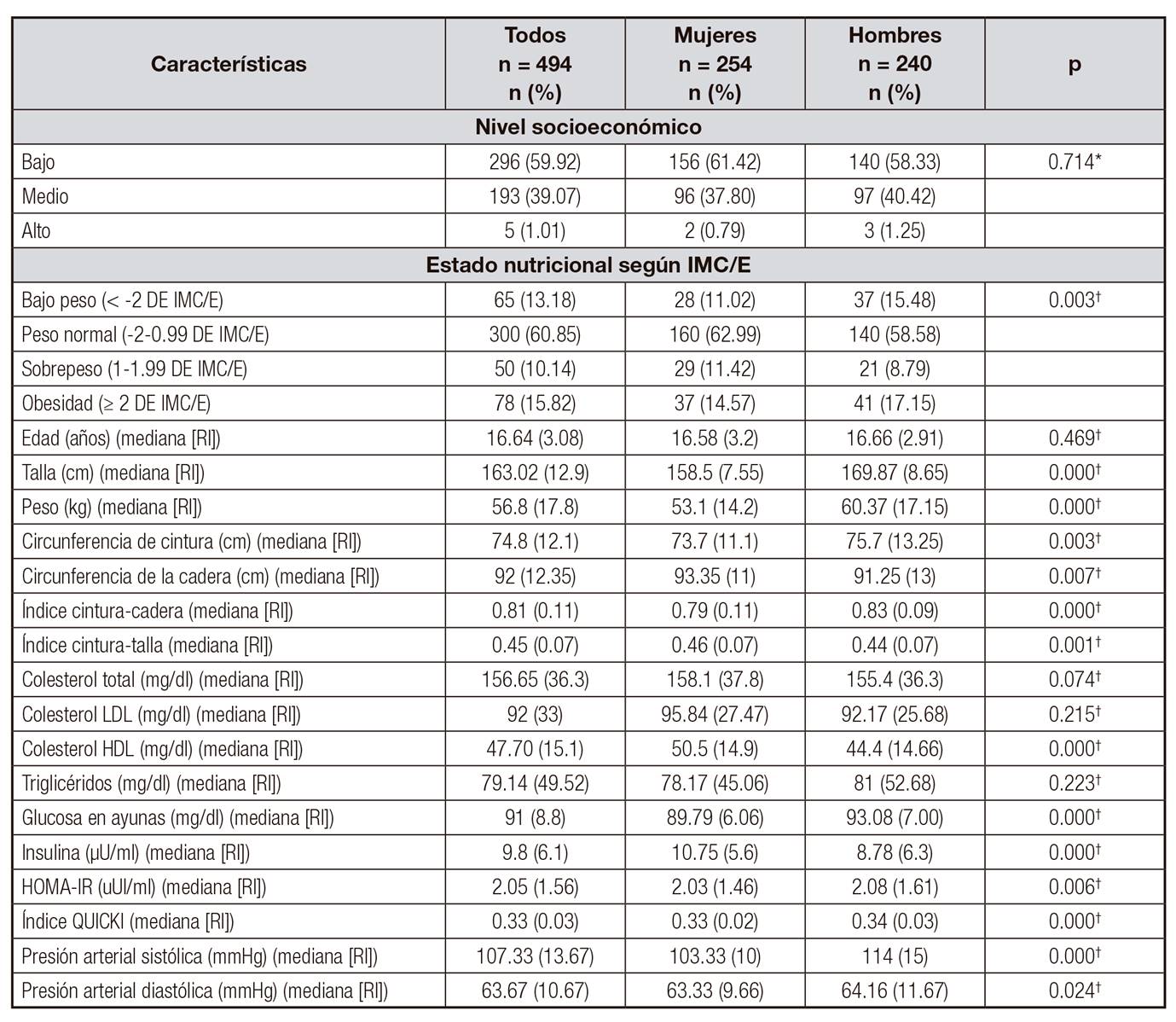
IMC/E: índice de masa corporal para la edad; RI: rango intercuartílico; LDL: lipoproteínas de baja densidad; HDL: lipoproteínas de alta densidad; HOMA: Homeostasis Model Assessment; QUICKI: índice cuantitativo de comprobación de la sensibilidad de la insulina.
*Valor p determinado mediante prueba exacta de Fisher.
†Valor p determinado mediante prueba U de Mann-Whitney.
Con relación a la antropometría y a los valores de presión arterial, el 10,14% (n = 50) del total de los participantes tuvieron IMC/E en rango de sobrepeso (percentiles 85 a 95%) y el 15,82% (n = 78) tuvieron IMC/E en rango de obesidad (≥ percentil 95), p 0.003. El 42,51% de la población (n = 210) presentó riesgo de ICT (≥ 0,5), p 0,001, del cual el 58,57% fue de sexo femenino (n = 123). La mediana de PAS (mmHg) fue de 107,33 (RI 13,67) y la de PAD (mmHg) fue de 63,67 (RI 10,67). La mediana obtenida de los biomarcadores evaluados como criterios diagnósticos fue: triglicéridos (mg/dl) 79,14 (RI 49,52), p 0.223; colesterol HDL (mg/dl) 50,5 (RI 14,9), p 0,000; glucosa en ayunas 91 (RI 8,8), p < 0,0001; e insulina (µU/ml) 9,8 (RI 6,1) (Tabla 1).
En cuanto al antecedente de LM, el 87% (n = 430) de las madres de los participantes respondió a esta pregunta (13% de la muestra sin información), de lss cuales el 43,27% (n = 209) respondió afirmativamente a la cuestión lactancia materna "exclusiva (primeros seis meses solo leche materna)", y el restante 45,76% (n = 221) respondió de forma negativa (Tabla 2).
Tabla II. Antecedente de lactancia materna exclusiva
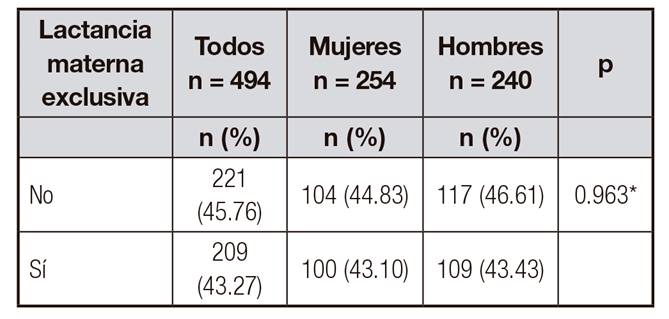
*Valor p determinado mediante prueba Chi-cuadrado.
En cuanto a los índices HOMA-IR y QUICKI, se obtuvieron las siguientes medianas y rango intercuartílico (RI): HOMA-IR 2,05 (RI 1,56) y QUICKI 0,33 (RI 0,03).
Finalmente, se encontró que por cada mes de duración de la lactancia materna exclusiva se disminuye en 0,32 el HOMA-IR y aumenta en un 0,70 el QUICKI. Para la circunferencia de cintura, el IMC y el ICT esta relación no fue significativa (Tabla 3).
DISCUSIÓN
Los resultados en una muestra de adolescentes colombianos residentes en la ciudad de Bucaramanga muestran una prevalencia de LME del 42%. La LME sugiere un efecto protector sobre la resistencia a la insulina; por cada mes más de duración de LME, disminuye en 0,32 (p = 0,005) el índice HOMA-IR y aumenta en 0,70 (p = 0,008) el índice QUICKI.
Nuestros resultados son similares a los obtenidos en otras poblaciones latinoamericanas y europeas 13,20,21,22. Resultados similares han sido recientemente publicados para población china, para la cual se encontró asociación como efecto protector entre la LME (por los primeros tres meses de vida) con el índice HOMA-IR y los bajos niveles de insulina 23. Así mismo, en una publicación realizada por Wang J y cols. derivada de un trabajo realizado en el sur de China, se concluyó una relación inversamente proporcional entre la LME mayor a seis meses y la asociación con SM, en una población de 1.770 de niños y adolescentes de entre siete y 17 años de edad 24.
El estudio SIMBA es una cohorte que ha sido evaluada durante más de diez años, condición que aporta mayor fiabilidad a los resultados obtenidos. Por otro lado, se emplearon los índices de medición de RI de mayor uso en la práctica clínica, por lo que los resultados pueden ser extrapolados a la práctica clínica. A pesar de no ser estos índices el estándar de oro para el diagnóstico de RI (clamp hiperinsulinémico-euglucémico), sí son los de mayor aplicación en la práctica clínica, por tratarse de métodos sencillos que se derivan de la interacción de la función de la célula β pancreática y la sensibilidad a la insulina en un modelo matemático donde se utilizan las concentraciones de glucosa e insulina en ayuno 25.
Dentro de las limitaciones del estudio, vale la pena mencionar que aún no existe consenso en cuanto a los puntos de corte en las mediciones y análisis del índice QUICKI. Además, existe la posibilidad de errores en la clasificación de LME debido al sesgo de memoria de la madre.
El presente estudio evidencia una asociación entre el efecto protector de la LME y la ausencia de desarrollo de RI soportada en la correlación con el índice HOMA-IR. Estos resultados soportan y ratifican la importancia en el desarrollo de políticas de salud pública encaminadas a favorecer la "Estrategia mundial para la alimentación del lactante y del niño pequeño" de la OMS. La LM es una opción natural y económica, susceptible de ser aplicada al 100% de los lactantes, favoreciendo el sano crecimiento y desarrollo y generando particularmente un efecto de protección contra el sobrepeso y la obesidad infantil, por lo que se considera que su ingesta es una medida preventiva efectiva contra esta epidemia global 26,27. Las campañas encaminadas a promover la práctica de la LM con énfasis en los beneficios para la salud pueden ser una medida salvadora, ya que, a pesar de existir algún grado de correlación entre el nivel de educación de las madres y la LM, la duración de esta se encuentra visiblemente afectada en poblaciones con mayor grado de escolaridad y ocupación laboral, contrario a las que no, que a su vez corresponden a poblaciones con menores ingresos económicos. Estadísticamente, estas poblaciones muestran mayores tasas de LM, posiblemente relacionadas con un modelo de crianza tradicional 5,28.
El incremento desmesurado de sobrepeso y obesidad en la infancia y en la adolescencia se estima en más de 110 millones de individuos de estas edades según cifras globales 3. Esto sugiere que la prevención del exceso de peso en la infancia es una estrategia muy importante contra el desarrollo de enfermedades crónicas a largo plazo 13 relacionadas con el síndrome metabólico, y más aún, si se tiene en consideración que, según la IDF, se estima que las cifras de síndrome metabólico y DM2 evolucionarán de 246 millones de individuos en el año 2007 a 380 millones en el año 2025. Es decir, la proyección estadística indica que el 30% de la población mundial va a presentar RI y sus complicaciones a lo largo de la vida 17.
Lo anterior ha llevado a evaluar las ventajas la LM en la prevención de afecciones en la edad adulta, ya que las enfermedades contribuyen a ser las causas más frecuentes de la morbimortalidad en la madurez. Diversos autores han relacionado la LM como un factor protector en la prevención de la hipertensión materna en el futuro, así como la hipertensión infantil en los diferentes periodos de la vida 29.
Así mismo, una revisión de artículos realizada en 2015, cuyo objetivo fue analizar los estudios que han investigado la LM como protección frente a los problemas cardiovasculares de la madre y el niño 30, menciona que, de un modo general, la LM en la infancia ha demostrado ser capaz de reducir la morbilidad y la mortalidad en la disminución de la incidencia de enfermedades infecciosas. Además, muestra que la LM exclusiva durante seis meses y el destete después de un año pueden representar para los países en desarrollo la prevención del 13% de la mortalidad de su infancia 31. La conclusión de esta revisión menciona que la LM por periodos de tiempo superiores a seis meses no solo proporciona a los niños numerosos beneficios para su salud, sino que también puede proteger a la madre de enfermedades graves como el cáncer de mama.
Por lo tanto, y teniendo en cuenta lo hasta aquí expuesto, nuestros resultados son un aporte útil en la profundización del estudio de los beneficios que la LM puede suponer en la prevención de factores de riesgo cardiometabólico, ya que los resultados sugieren una acción protectora de la LME en la disminución de la RI y el aumento del QUICKI.















