INTRODUCCIÓN
Durante las últimas décadas, las sociedades desarrolladas han experimentado un profundo cambio demográfico caracterizado por un aumento progresivo de la edad promedio de la población. Estadísticas recientes indican que el número de personas mayores de 50 años en España aumentará de casi 16 millones en la actualidad a más de 21 millones para el año 2025 1. El aumento de la esperanza de vida en la última década sitúa a España como el país con la media de edad más elevada entre los países de la Unión Europea: 83,2 años. Esta longevidad trae consigo discapacidad y enfermedades crónicas como es el caso de la demencia 2.
El proceso conocido como "envejecimiento del envejecimiento" aumenta el riesgo de que los pacientes desarrollen enfermedades neurodegenerativas como las demencias, lo que implica cronicidad, incapacidad y dependencia progresiva. La lucha contra los procesos neurodegenerativos para mantener la calidad de vida relacionada con la salud de los pacientes (CVRS) es un objetivo fundamental de la práctica asistencial 3: incluye aspectos como la función cognitiva, el estado nutricional y el patrón de sueño 4,5,6. Un enfoque multidisciplinario es necesario para responder a todas las necesidades. El deterioro cognitivo es la fase predemencia y se refiere a un grado de deterioro cognitivo anormal para la edad. Es un concepto que hace alusión a un estado transicional entre el envejecimiento normal y la demencia leve. Del mismo modo, determina a un grupo heterogéneo de personas que se hallan en un contexto de riesgo superior al objetado en la población general para el desarrollo de una demencia, fundamentalmente enfermedad de Alzheimer (EA) 7.
La calidad de vida en la demencia se ha definido como el resultado de la experiencia subjetiva de un individuo y la evaluación de las circunstancias personales relacionadas con el bienestar psicológico, el nivel de competencia y la interacción con el entorno 8. Si agregamos a esto las particularidades de la alteración cognitiva, encontramos que es muy complejo medir algo tan subjetivo e individual. Aunque la evaluación de la CVRS se vuelve compleja en pacientes con disfunción cognitiva 9, la capacidad de responder a los cuestionarios sobre la CVRS se correlaciona con las etapas tempranas de la enfermedad, que es equivalente a una puntuación de MMSE superior a 10 10,11. Por lo tanto, es posible analizar la CVRS en pacientes en las primeras etapas de la enfermedad 12,13.
Además, el estado nutricional está vinculado con una mayor CVRS en pacientes con deterioro cognitivo 14,15. De hecho, el estado nutricional está asociado con la capacidad funcional y la independencia de los pacientes para realizar las actividades diarias, que determinan la autopercepción de la CVRS 16,17. Por lo tanto, la relación entre la calidad de vida y el estado nutricional se basa en la evaluación psicológica que el paciente hace de su propia capacidad para preparar sus comidas y realizar otras tareas diarias. Esto se debe a que la calidad de vida en relación con la salud es un concepto complejo que abarca múltiples dimensiones, incluida la independencia para adquirir, preparar y comer alimentos 18.
Finalmente, el sueño es un factor que contribuye al bienestar físico y psicológico en las personas mayores 19,20. El sueño tiene un tremendo impacto en distintos ámbitos de la vida de las personas. Los pacientes con enfermedades neurodegenerativas tienen trastornos del sueño que afectan su capacidad para dormir, la capacidad de permanecer dormidos, su actividad motora durante el sueño, su comportamiento después de despertarse y su somnolencia diurna 21,22,23,24,25. Los trastornos del sueño afectan significativamente la CV en pacientes con enfermedades neurodegenerativas debido al daño a las estructuras neuronales del cerebro responsables de la regulación del ciclo sueño/ vigilia 26.
Por otro lado, los trastornos del sueño se han relacionado con trastornos en el estado nutricional. Una explicación plausible para esto sería que los pacientes con demencia sufren trastornos del ritmo del sueño 27,28 que implican dormir durante el día, lo que hace que se omitan las comidas regulares o que se altere el apetito de los pacientes. Por lo tanto, la relación entre el patrón de sueño y el estado nutricional se basa en la relación biológica y de comportamiento entre el sueño y la alimentación.
Sin embargo, pocos estudios han analizado la relación entre el patrón de sueño y la CVRS con el estado nutricional. En la mayoría de los casos, solo se ha analizado individualmente el patrón de sueño 29,30 o el estado nutricional 31.
Además, hay muy pocos estudios en España que analicen la CVRS en personas con deterioro cognitivo 32,33 e, incluso en las investigaciones existentes, el estado nutricional o la higiene del sueño no se tienen en cuenta 34,35).
En los pacientes con alteraciones en el estado cognitivo, el estado nutricional es más complicado de valorar, ya que implica conocer el peso y el historial de movilidad del paciente, lo que no siempre es posible 36,37.
Teniendo en cuenta la dificultad de medir el estado nutricional y establecer su relación con los patrones de sueño y la calidad de vida percibida, es útil analizar si el patrón de sueño y la CV percibida pueden ser predictores fiables del estado nutricional, ya sea por separado o conjuntamente.
El presente estudio tuvo como objetivo examinar la relación entre el patrón de sueño, la calidad de vida y el estado nutricional en una muestra de pacientes con deterioro cognitivo. Además, analizamos el papel del patrón de sueño y la calidad de vida en la predicción del estado nutricional en estos pacientes. Por lo tanto, se espera que la calidad de vida medie la influencia del patrón de sueño en el estado nutricional.
MATERIAL Y MÉTODOS
PARTICIPANTES Y DISEÑO
Se realizó un estudio epidemiológico observacional de corte transversal con un grupo de casos compuesto por 48 sujetos que vivían en su domicilio, mayores de 65 años y que presentaban deterioro cognitivo. Los datos se recopilaron entre septiembre y febrero de 2015 en los centros de día de la Asociación de Familiares de Alzheimer, en una zona rural cerca de Valencia, España. Los pacientes incluidos habían sido diagnosticados de deterioro cognitivo y cumplían con los criterios de inclusión: ser mayores de 65 años, haber sido diagnosticados con disfunción cognitiva, tener una puntuación en el MMSE de entre 26 y 10 puntos 38 y firma del consentimiento informado. Las personas diagnosticadas con depresión fueron excluidas del estudio porque en ese grupo de pacientes la pérdida de sueño puede llevar a cambios en el estado de ánimo. Las personas con depresión a menudo reportan una calidad de vida reducida y pérdida de interés y placer al hacer las cosas 39,40,41. Las variables de estudio fueron variables sociodemográficas, puntuación total del cuestionario Mini Nutritional Assessmnet (MNA), puntuación de EVA del Euro-Qol y puntuación total del cuestionario de Oviedo del sueño (COS). Los datos se obtuvieron mediante entrevista con pacientes en la cual cumplimentaron los cuestionarios seleccionados.
El EQ-5D es una medida estandarizada del estado de salud desarrollada por EuroQol Group para proporcionar una medida simple y genérica de salud para la evaluación clínica y económica. Este instrumento proporciona información sobre las preferencias de un individuo en relación con su salud. Está formado por dos partes. La primera parte corresponde a la descripción del estado de salud de un paciente en cinco dimensiones: movilidad, cuidado personal, actividades diarias, dolor/malestar y ansiedad/depresión. En la segunda parte del cuestionario, el sujeto debe marcar una puntuación de su estado de salud percibido en una escala visual analógica gráfica (EVA) en el momento en que se evalúa su condición 42,43.
El cuestionario de MNA es un método ampliamente utilizado para evaluar el riesgo nutricional. Esta prueba consiste en una evaluación antropométrica (peso, talla, magnitud de pérdida de peso a lo largo del tiempo), calificación general (estilo de vida, medicación y movilidad), titulación dietética (cantidad de comidas, ingesta de alimentos y líquidos, autonomía en el consumo de comidas) y breve cuestionario de autoevaluación, autopercepción de la salud y estado nutricional 13,14. Para la evaluación, cada respuesta tiene un valor numérico y contribuye a la puntuación final, que tiene un máximo de 30 puntos. Los valores ≥ 24 designan individuos bien nutridos; 17-23.5, aquellos con riesgo de malnutrición; y menos de 17, individuos desnutridos 44,45.
El cuestionario de Oviedo del sueño (COS) es un cuestionario de ayuda diagnóstica para los trastornos del sueño del tipo de insomnio e hipersomnio según los criterios del Manual diagnóstico y estadístico de trastornos mentales (DSM-V) y la Clasificación estadística internacional de enfermedades y problemas de salud relacionados (CIE-10). El COS se compone de tres subescalas: satisfacción subjetiva del sueño, insomnio e hipersomnia. El cuestionario también recopila información sobre el uso de ayudas para dormir o la presencia de eventos adversos durante el sueño. Todos los elementos se contestan utilizando la escala de Likert, con cada elemento calificado de 1 a 5. Es un cuestionario breve, simple y fácil de administrar 46.
Este estudio fue aprobado por el Comité de Ética de la Universidad CEU-Cardenal Herrera y siguió la Declaración de Helsinki. Todos los pacientes firmaron el formulario de consentimiento informado. No existieron conflictos de intereses que declarar.
ANÁLISIS ESTADÍSTICO
El análisis de los datos se realizó utilizando el paquete estadístico SPSS(r) 20.0. Las diferencias se consideraron estadísticamente significativas si p < 0,05. El índice de confianza establecido fue del 95%. Todas las variables cualitativas cumplían las premisas de normalidad (significación de la prueba Kolmogorov-Smirnov > 0,05) y de homogeneidad de varianzas (significación del estadístico Levene > 0,05).
Después de calcular la frecuencia absoluta y relativa de las variables demográficas, se calculó la correlación entre las tres variables. Finalmente, para verificar el papel y la capacidad predictiva de las dos variables juntas, se calculó un modelo de regresión con el estado nutricional como variable dependiente, el patrón de sueño como variable independiente y la CVRS como variable mediadora o supresora 44,45.
Para calcular si la relación entre el sueño y el estado nutricional es mediada por la de calidad de vida, se calculó la importancia del efecto indirecto utilizando los valores b y el error estándar, siguiendo a Holmbeck (2002) 47.
RESULTADOS
En las variables sociodemográficas, los resultados fueron los siguientes: el perfil promedio de los sujetos fue el de una mujer viuda de 81,5 ± 7,6 años, con educación primaria, con 2,40 ± 1,09 niños y diagnosticada con enfermedad de Alzheimer como demencia principal en el 16,7% de los casos. De la muestra global, el 18,5% eran hombres y la demencia vascular se registró en el 5,6% de los sujetos.
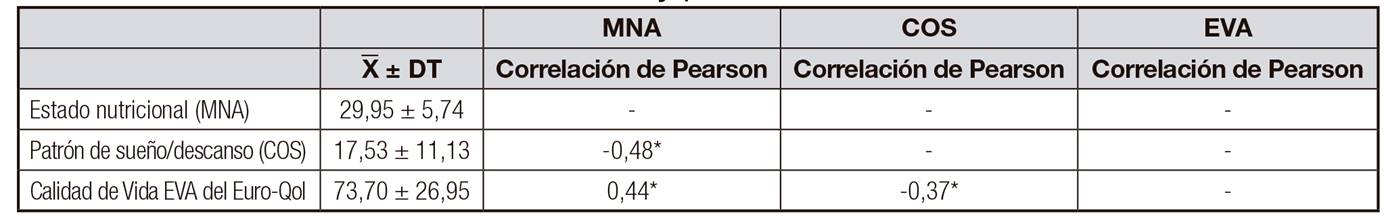
La Tabla 1 muestra los puntajes promedio de cada variable dependiente e independiente y las correlaciones de Pearson entre ellas. Los cuestionarios fueron puntuados siguiendo las indicaciones de los autores. Para facilitar la comparación de resultados se expresaron los resultados mediante porcentajes y desviación estándar.
Al realizar la predicción del estado nutricional a partir del patrón sueño, los resultados obtenidos indicaron que el 23% de la varianza se explicó por la percepción que los pacientes tienen de su ciclo de sueño. Este porcentaje de varianza fue estadísticamente significativo (F [1, 52] = 15,34, p < 0,01). Como se esperaba, el valor beta es el mismo que el obtenido en el cálculo de las correlaciones (β = -0,48; p < 0,001).
A continuación, se realizó el análisis de regresión por fases. En el primer paso, la EVA se introdujo como un predictor de puntuación MNA. En esta correlación, se encontró que la EVA era una variable significativa (β = -0,44; p < 0,01).
Finalmente, el COS se introdujo en la ecuación para verificar su relación con MNA. Después de la inclusión de VAS como una variable mediadora, COS siguió siendo un predictor significativo de MNA (β = -0,36; p < 0,01). Además, el porcentaje de varianza explicado aumentó de 20% a 31% después de la introducción de la puntuación COS. Este aumento en la varianza también fue estadísticamente significativo (F [1, 51] = 12,56; p < 0,01). La EVA fue igualmente significativa (β = -0,31; p < 0,05).
Por lo tanto, la calidad de vida de un paciente (evaluada mediante la puntuación EVA) media la relación entre el patrón de sueño (evaluado mediante la puntuación COS media) y el estado nutricional (evaluado mediante la puntuación MNA). Como el valor beta para el sueño disminuye (de β = -0,48 a β = -0,36) pero no desaparece, la mediación es parcial.
El valor del efecto indirecto del sueño en el estado fue β = -0,06, que representa el 13% de la relación entre el sueño y el estado. Los valores del efecto indirecto utilizando los valores β y el error estándar aparecen recogidos en la Tabla 2. El valor de la prueba z para el efecto indirecto fue 1,91 (p > 0,005), lo que indica que no hay importancia.
DISCUSIÓN
El presente estudio proporciona un nuevo enfoque para la atención interdisciplinar de los pacientes con deterioro cognitivo mediante la integración de diferentes variables en modelos estadísticos. Una mayor integración a través de estas áreas conceptualmente interrelacionadas puede proporcionar una comprensión multidisciplinaria del estado de salud de tales pacientes para guiar nuevas intervenciones clínicas que permitan mejorar su estado de salud.
Con respecto a los patrones de sueño, los resultados indican que un patrón de sueño más ajustado implica un mejor estado nutricional en los pacientes. Este resultado concuerda con la investigación de Yildiz y cols. 51, realizada con sujetos con demencia leve a moderada, donde la desnutrición se asoció con trastornos del sueño. Se ha demostrado que un mejor estado nutricional se correlaciona con una mayor calidad de vida, lo que está en línea con otras investigaciones 52,53. La explicación de esta asociación radica en la progresión de la enfermedad, que afecta a las funciones ejecutivas y produce disfagia, trastornos del sueño y agitación, lo que lleva a una alteración en la calidad de vida 54,55. Cuando se ve esta variable alterada, los pacientes pierden interés en varios aspectos de su entorno, incluida la nutrición. Además, los pacientes con demencia sufren trastornos del ritmo del sueño 54,55,56 que implican agitación y aumento de los despertares nocturnos y hacen que los pacientes necesiten dormir durante el día, lo que a su vez puede causar una disminución en la ingesta nutricional durante el día.
La CVRS y el COS explican por separado la puntuación de MNA en una muestra de pacientes, pero cuando se combinan en una sola ecuación, ambas mantienen su importancia ya que ninguna de ellas se anula en la regresión múltiple. Cada uno de ellos explica una parte del trastorno nutricional que sufren los pacientes con disfunción cognitiva. El trastorno del sueño implica que muchos pacientes están despiertos por la noche y duermen durante el día, por lo que consumen menos comidas de lo habitual. Este patrón de comida alterado puede deberse al hecho de que los cuidadores no prestan atención para ofrecer alimentos a los pacientes durante los periodos en que están despiertos, porque son nocturnos o porque la alteración de los biorritmos implica pérdida de apetito 51,52. Además, muchos pacientes experimentan desinterés por comer como una manifestación de síntomas depresivos 57,58 o debido a disfagia como resultado de la progresión de su enfermedad.
La contribución novedosa de la presente investigación reside en el hecho de que la CVRS media la relación entre el patrón de sueño y el estado nutricional. Nuestros resultados muestran que la relación del patrón de sueño con el estado nutricional se reduce si se elimina la influencia de la calidad de vida en la variable dependiente. Aunque el patrón de sueño está relacionado con el estado nutricional, como en investigaciones anteriores 52, esta relación se explica, en parte, por la CVRS.
Nuestros resultados indican la importancia de mejorar el patrón de sueño de los pacientes. Por lo tanto, una mejora en el patrón de sueño mejorará la CVRS. Además, la mejora en la CVRS implica un mejor estado nutricional. Hay pocos estudios que investigan explícitamente la relación entre la influencia del descanso y la calidad de vida en el estado nutricional de las personas con demencia, por lo que se deben realizar estudios adicionales con pacientes de demencia que viven en la comunidad que relacionen estos parámetros con el enfoque metodológico utilizado en este estudio.
Nuestros resultados parecen confirmar evidencia previa. La fatiga, que es un síntoma común en la disminución de la calidad de vida, y la pérdida de peso involuntaria son dos de los síntomas más comunes que experimentan las personas con enfermedades neurodegenerativas, como la demencia 58.
De acuerdo con los resultados obtenidos, tratar de mejorar la percepción de la calidad de vida de los pacientes significaría beneficios parciales con respecto al estado nutricional. De hecho, nuestra investigación indica la importancia de promover las rutinas y el comportamiento adecuado para dormir, lo que implica el doble beneficio de mejorar tanto la percepción de la calidad de vida como el estado nutricional.
Como en toda investigación, ha habido limitaciones de diferente naturaleza, una de ellas relacionada con el muestreo. En nuestro caso se realizó un muestreo de conveniencia no probabilístico; sin embargo, independientemente de si la muestra era o no representativa de la población, se obtuvieron p valores significativos y fue posible una predicción de interés.
En conclusión, la evaluación del sueño-reposo es fundamental en los ancianos, ya que se documentan alteraciones importantes que afectan otros aspectos de sus vidas. Los pacientes con peor puntuación en el COS tienen una puntuación de CVRS más baja, lo que también indica que la calidad del sueño afecta su percepción subjetiva de su estado de salud. La CVRS media la relación entre el patrón de sueño y el estado nutricional: la relación del patrón de sueño con el estado nutricional se reduce si se elimina la influencia de la calidad de vida en la variable dependiente.