INTRODUCCIÓN
El síndrome metabólico (SM) se describe como un conjunto de factores de riesgo cardiovascular relacionados con anormalidades metabólicas, vasculares, inflamatorias, fibrinolíticas y de coagulación 1, asociadas a factores genéticos y ambientales, siendo el estilo de vida un punto importante en su desarrollo. En población pediátrica, las prevalencias de SM son heterogéneas. Mientras en Estados Unidos la prevalencia de SM en adolescentes es de 6,1% en varones y de 2,2% en mujeres 2, en el contexto latinoamericano, estudios en escolares en Santiago de Chile señalan que la prevalencia puede llegar hasta un 43,6% en niños y adolescentes que consultan por obesidad. Al comparar las prevalencias del SM en niños y adolescentes de América, se encontró que existe una importante variabilidad entre los países, siendo las prevalencias menores del 6,0% para países como Argentina, Colombia, Guatemala, México y Paraguay, mientras que las mayores prevalencias fueron para Brasil, Canadá y Venezuela (> 12%) 2. En Colombia, los estudios de prevalencia de SM en la infancia son pocos; en Medellín, durante 2008 se reportó una prevalencia en niños y adolescentes del 6,1%; en Bucaramanga, en 2009 se documentó una prevalencia del 9,6% en niños de entre seis y diez años 3; y en Cali la prevalencia de SM fue del 8,7% en niños entre los cinco y los nueve años de edad 2. Algunos de los factores que conforman el SM son generados como consecuencia de estilos de vida adquiridos desde la niñez y que permanecen a lo largo de etapas posteriores de la vida (4.5.6).
El ácido úrico (AU), por su plausibilidad biológica, emerge como un biomarcador de riesgo 7. Aunque se ha encontrado una fuerte asociación entre el síndrome metabólico y cifras elevadas de AU en adultos, esta relación aún no ha sido claramente establecida en niños y adolescentes 8, en quienes la mayor evidencia se encuentra con niveles de AU elevado y el desarrollo de hipertensión arterial (HTA) en población pediátrica 7,8,9,10,11,12,13,14. En este sentido, el Moscow Children's Hypertension Study encontró una prevalencia de hiperuricemia (valores de AU > 8 mg/dl) de un 9,5% en niños con presión arterial normal, un 49% en aquellos que estaban a riesgo de tener hipertensión y un 73% con hipertensión moderada y grave 15. En contraste, el estudio de Feig y cols. 9 no encontró diferencia entre el promedio de ácido úrico de niños sanos y los que presentaban HTA inducida por estrés (por efecto del uso de la bata blanca) (3,6 ± 0,8 y 3,6 ± 0,7 mg/dl, respectivamente; p = 0,80). No obstante, este mismo estudio encontró diferencias entre los niveles de AU de adolescentes sanos versus los que presentaban HTA secundaria (4,3 ± 1,4 mg/dl; p = 0,008) e HTA esencial (6,7 ± 1,3 mg/dl; p < 0,0001) 9.
La importancia del ácido úrico radica en que puede representar un factor de riesgo independiente asociado a enfermedad cardiovascular. El aumento en los niveles de ácido úrico es un indicador de la sobrerregulación de la actividad de la xantina oxidasa, un poderoso sistema generador de especies de oxígeno reactivo en la fisiología humana. La acumulación de tales radicales contribuye a la disfunción endotelial, el deterioro metabólico y funcional, la activación inflamatoria y otros eventos de la fisiopatología cardiovascular 16.
El objetivo del presente estudio fue establecer la prevalencia de niveles séricos de ácido úrico alterados y su asociación con los componentes del síndrome metabólico en adolescentes de Bucaramanga, Colombia.
DISEÑO
Se realizó un estudio de corte transversal analítico, anidado en una cohorte poblacional.
Población y muestra
La muestra de este estudio estuvo constituida por 494 adolescentes 17 que corresponden a una submuestra recontactada del estudio original SIMBA, el cual corresponde a una cohorte poblacional de niños y niñas en edad escolar, residentes en Bucaramanga, Colombia (n = 1.282) 3. Para el tamaño de muestra disponible al recontacto, se estimó un poder estadístico de 0,7801 (78%), mediante el uso del comando sampsi del programa Stata 14. Este poder estadístico permite realizar un análisis de asociación entre AU, el SM y los criterios que lo componen de manera individual.
RECOLECCIÓN DE DATOS
Al momento del seguimiento de la cohorte, por medio de contacto telefónico, se invitó a los participantes del estudio original (n = 1.282) ya en edad adolescente (población de entre 14 y 19 años de edad) a una visita hospitalaria en la que se recolectó la misma información obtenida en la etapa escolar. Se les realizó la valoración clínica completa (incluyendo antropometría y toma de muestras sanguíneas para la medición de glucemia en ayunas, perfil lipídico, ácido úrico e insulina) 18. En 43 participantes, con recontacto telefónico exitoso, fue necesario realizar visita domiciliaria para la recolección de información y la toma de muestras sanguíneas y antropométricas, dado que los participantes tenían dificultades, por horarios, de asistir a la institución.
La recolección de datos fue llevada a cabo por profesionales enfermeras y médicos, que fueron previamente entrenados por los investigadores del estudio y utilizaron técnicas estandarizadas. La calidad de los datos fue revisada para asegurar que estos estuvieran completos. Se realizó digitación por duplicado en el programa Excel (Microsoft Corp., Redmond, Wash) y las bases de datos fueron comparadas usando el programa Epi-Info 2000. Todas las discrepancias en las dos bases de datos fueron corregidas usando los formatos originales de captura de datos.
DESENLACES DE INTERÉS DEL ESTUDIO
Los principales desenlaces fueron: síndrome metabólico (SM), de acuerdo a los criterios de la Adult Treatment Panel III (ATP III) 18,19, mediante los cuales se deben cumplir tres de los cinco criterios (cualquiera de ellos). Además, se usaron como desenlaces individuales cada uno de los factores que componen el síndrome metabólico: a) obesidad abdominal con perímetro de cintura > percentil 90 percentil ≥ 85 de índice de masa corporal (IMC); b) presión arterial > percentil 90; c) triglicéridos > 110 mg/dl o percentil > 95; d) HDL-colesterol < 40 mg/dl en ambos sexos o percentil < 5; y e) glucosa basal (GF) > 100 mg/dl o dos horas tras la sobrecarga > 140 mg/dl 18,19.
VARIABLE DE EXPOSICIÓN
Ácido úrico de riesgo con valores iguales o mayores a 5,5 mg/dl y ácido úrico elevado por encima de 6,5 mg/dl 8,9.
Se analizaron otras variables independientes como: sexo, edad en años, nivel socioeconómico (variables sociodemográficas), duración de la lactancia materna (meses), haber fumado al menos una vez en la vida (sí/no), haber consumido alcohol al menos una vez en la vida (sí/no), tiempo de exposición a pantallas (horas/semana), actividad física moderada e intensa (horas/semana) (antecedentes); talla (cm), peso (kg), índice de masa corporal (kg/m2), circunferencia de cintura (cm), circunferencia de la cadera (cm), índice cintura-cadera, índice cintura-talla (variables antropométricas); colesterol total (mg/dl), LDL-colesterol (mg/dl), insulina en ayunas (µU/ml) y HOMA (UI/ml) (variables clínicas y bioquímicas).
ANÁLISIS ESTADÍSTICO
Para dar cumplimiento a una parte del objetivo general y obtener así los resultados descriptivos, las variables categóricas fueron presentadas como proporciones y sus diferencias entre sí fueron establecidas usando las pruebas de Chi-cuadrado o la prueba exacta de Fisher, según correspondía. Las variables continuas han sido expresadas como medianas y rango intercuartílico (RIC), según su distribución. Se usó la prueba U de Mann-Whitney para establecer diferencias por sexo. La asociación entre las variables dependientes de este estudio y la variable independiente principal fue evaluada mediante modelos de regresión logística. Se reportan los OR crudos y ajustados y se realizó la evaluación de bondad de ajuste.
Se realizó un análisis complementario con las variables continuas que evaluó la forma de la asociación del síndrome metabólico con los niveles de ácido úrico en quintiles de acuerdo a la distribución en los individuos con cada uno de los criterios que lo componen.
Todos los datos fueron analizados en el programa estadístico Stata, versión 14.0 (College Station, TX: Stata Corporation).
CONSIDERACIONES ÉTICAS
El protocolo de investigación fue evaluado y aprobado por el Comité de Ética en Investigaciones de la Fundación Cardiovascular de Colombia en acta nº 396 de 9 abril de 2016. En los participantes menores de edad, el consentimiento informado por escrito fue otorgado por los padres o representantes legales de los participantes. Adicionalmente, en los menores de edad, pero con edad igual o mayor a 14 años de edad, se solicitó su asentimiento verbal y por escrito. Los participantes mayores de 18 años (adultos jóvenes), dieron el consentimiento informado por escrito para participar en el estudio.
RESULTADOS
CARACTERÍSTICAS DE LA MUESTRA
Se analizó un total de 494 adolescentes residentes de la ciudad de Bucaramanga, que también habían sido participantes de la cohorte original (2006-2007). La mediana de edad fue de 16,6 años (RIC: 3,0 años) sin diferencias por sexo. No hubo diferencias significativas entre el sexo de los participantes (Tabla 1).
El antecedente de haber fumado (38%) es menor comparado con el consumo de alcohol (72,1%), siendo este mayor en hombres (44,1%) que en mujeres (34,4%). Sobre el tiempo de exposición a pantallas (teléfonos móviles, tabletas, televisor y otros dispositivos), el 41,4% de los participantes dedica cuatro o más horas al día a esta actividad, sin diferencias significativas entre hombres y mujeres (Tabla 1).
Con respecto a las medidas antropométricas analizadas, se encontraron mayores valores de talla e índice cintura-cadera en hombres que en mujeres (p < 0,0001). De manera similar, la prevalencia de bajo peso también fue mayor en hombres que en mujeres (p < 0,003).
Además, el 27,6% de los adolescentes presentó un exceso de peso, distribuido en un 11,1% con sobrepeso, que fue ligeramente mayor en las mujeres (11,4%) comparado con los hombres (8,7%), mientras que el 16,5% presentó obesidad sin una diferencia significativa entre mujeres y hombres (14,5% versus 17,1%). No se encontraron diferencias significativas en cuanto a los valores de presión arterial diastólica según el sexo (Tabla 1).
No se hallaron diferencias significativas entre los niveles de colesterol total, colesterol LDL y triglicéridos al comparar los valores entre hombres y mujeres, en tanto que los niveles de colesterol HDL fueron significativamente mayores en las mujeres (p < 0,0001). Por otra parte, la mediana de ácido úrico fue de 4,9 mg/dl (RIC: 1,8) y fue mayor en hombres que en mujeres (p < 0,0001). También se observaron niveles de glucemia en ayunas mayores en los hombres (p < 0,0001), mientras que los niveles de insulina en ayunas y el índice HOMA fueron significativamente mayores en las mujeres (p < 0,0001 y p < 0,0002, respectivamente) (Tabla 1).
Tabla I Variables sociodemográficas, clínicas y de laboratorio de los participantes en el estudio, según el sexo

IMC/E: índice de masa corporal para la edad; RIC: rango intercuartílico. *Determinado por Cuestionario Internacional de Actividad Física (IPAQ). †Valor p determinado mediante prueba exacta de Fisher. ‡Valor p determinado mediante prueba de Chi-cuadrado. §Valor p determinado mediante prueba U de Mann-Whitney.
SÍNDROME METABÓLICO Y SUS COMPONENTES INDIVIDUALES
La prevalencia del síndrome metabólico (SM) en este estudio fue del 13,1% (IC 95%, 10,1 a 16,1). En cuanto a los componentes del SM, de manera individual se encontró que la obesidad abdominal es más prevalente en las mujeres que en hombres (p < 0,0001). El 17,3% (IC 95%, 13,6 a 20,3) de los adolescentes presentó hipertensión arterial, mayor en hombres que en mujeres (p < 0,0001). La prevalencia de triglicéridos elevados fue del 28,54% (IC 95%, 24,5 a 32,5), sin diferencias significativas por sexo. El 21,6% (IC 95%, 18,0 a 25,5) de los adolescentes tuvieron niveles de HDL bajo y esta proporción fue menor en las mujeres que en los hombres (p < 0,0001). La proporción de adolescentes con glucemias en ayunas elevadas fue del 16,5% (IC 95%, 13,3 a 19,8) y fue más prevalente en hombres que en mujeres (p < 0,0001) (Tabla 2).
Tabla II Prevalencias de síndrome metabólico, factores de riesgo cardiometabólico individuales y alteración de los niveles de ácido úrico en adolescentes colombianos
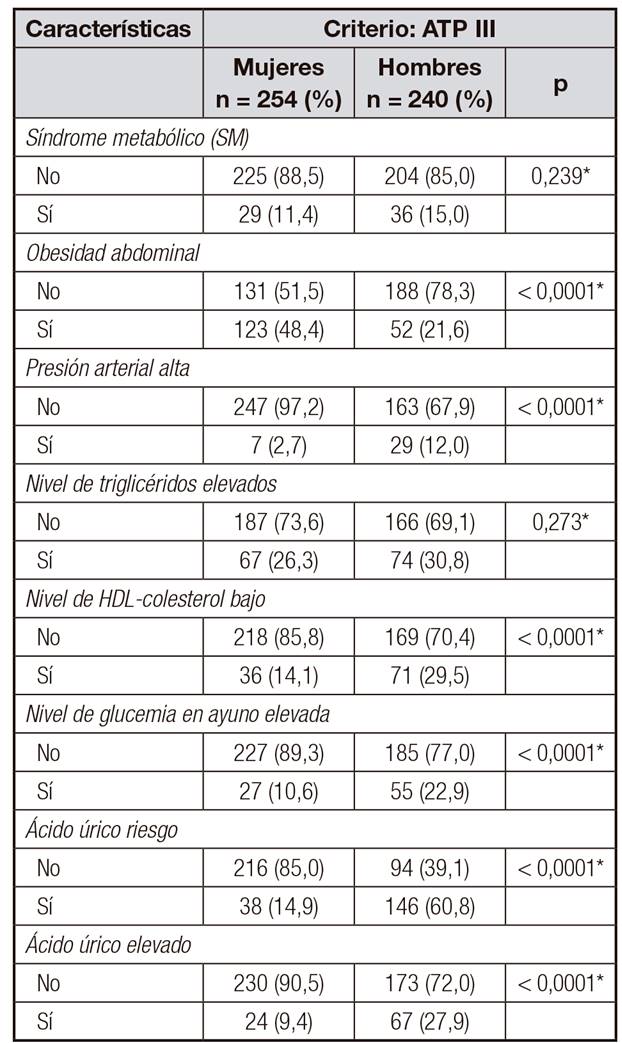
*Valor p determinado mediante prueba Chi-cuadrado. Criterio ATP III: Panel de Expertos del Programa de Educación Nacional de Colesterol de Estados Unidos. Obesidad abdominal con perímetro de cintura > percentil 90. Presión arterial > percentil 90. Triglicéridos > 110 mg/dl o > percentil 95. HDL-colesterol < 40 mg/dl en ambos sexos o < percentil 5. Glucemia basal > 110 mg/dl o dos horas tras la sobrecarga > 140 mg/dl. Ácido úrico de riesgo ≥ 5,5 mg/dl. Ácido úrico elevado ≥ 6,5 mg/dl.
ÁCIDO ÚRICO
La prevalencia de ácido úrico a riesgo fue del 37,2% (CI 95%, 32,9 a 41,5), 60,8% (IC 95%, 54,6 a 67,0) en hombres y 14,9% (IC 95%, 10,5 a 19,3) en mujeres (p < 0,0001). La proporción de ácido úrico elevado fue del 18,4% (IC 95%, 14,9 a 21,8), también significativamente mayor en hombres (27,9% [IC 95%, 22,2 a 33,6]) que en mujeres (9,4% [IC 95%, 5,8 a 13,0], p < 0,0001) (Tabla 2).
No se encontró asociación entre los niveles de ácido úrico a riesgo (≥ 5,5 mg/dl) y la presencia de síndrome metabólico en los participantes del estudio. Sin embargo, los adolescentes con niveles de ácido úrico a riesgo presentaron mayor probabilidad de tener obesidad abdominal (OR 1,94; IC 95%, 1,06 a 3,93), HTA (OR 1,48; IC 95%, 1,02 a 2,69), hipertrigliceridemia (OR 2,72; IC 95%, 1,68 a 4,40) y glucemia en ayunas alterada (OR 5,82; IC 95%, 3,11 a 10,90) (Tabla 3).
Tabla III Asociación entre ácido úrico de riesgo y factores de riesgo cardiometabólico en adolescentes

OR: odds ratio; IC 95%: intervalo de confianza del 95%; p: valor de p; Ref: referencia. *Modelos de regresión binomial ajustados por sexo, edad e índice de masa corporal.
Tampoco se halló asociación entre los niveles de ácido úrico elevado (≥ 6,5 mg/dl) y el síndrome metabólico. No obstante, el ácido úrico elevado se encontró asociado con un incremento de 5,15 veces la probabilidad de presentar glucemia en ayunas alterada, después de ajustar por edad y sexo (IC 95%, 3,42 a 11,05). También se registró una asociación entre los niveles de ácido úrico elevado y la hipertrigliceridemia (OR 4,94; IC 95%, 2,98 a 8,19), obesidad abdominal (OR 3,03; IC 95%, 1,38 a 6,64), HTA (OR 1,11; IC 95%, 1,05 a 2,07) y niveles séricos de HDL bajos (OR 1,76; IC 95%, 1,42 a 2,36) (Tabla 4).
Tabla IV Asociación entre ácido úrico elevado y factores de riesgo cardiometabólico en adolescentes
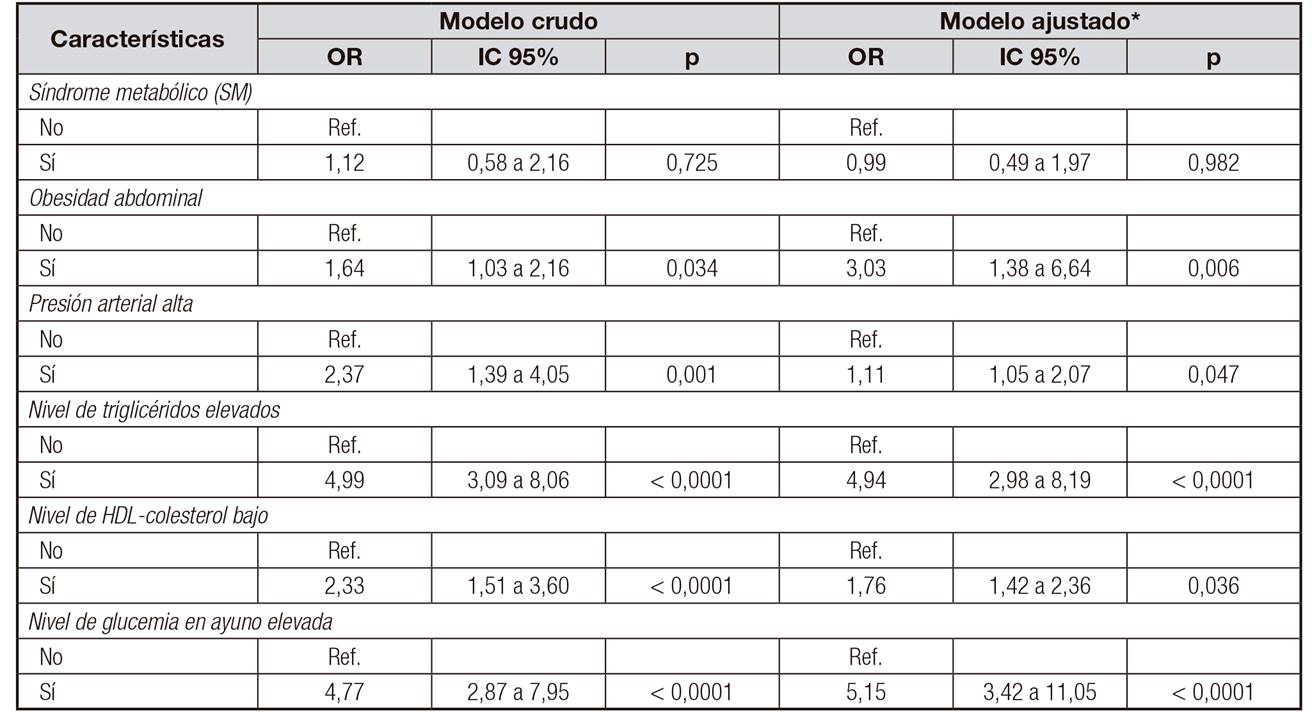
OR: odds ratio; IC 95%: intervalo de confianza del 95%; p: valor de p; Ref.: referencia. *Modelos de regresión logística ajustados por sexo, edad e índice de masa corporal.
Los resultados del análisis complementario sugieren una tendencia lineal para dos de los criterios que componen el síndrome metabólico, obesidad abdominal y triglicéridos elevados; para los tres componentes restantes el comportamiento fue diferente (Fig. 1).
DISCUSIÓN
Los resultados del presente estudio muestran una prevalencia de ácido úrico alterado (de riesgo o elevado) del 37,25% en los adolescentes estudiados. En este sentido, no se encontraron datos nacionales o regionales para comparar esta prevalencia. Además, al no haber consenso sobre los puntos de corte para hiperuricemia en adolescentes y niños, se podría subvalorar la prevalencia de esta condición, pues hay diversos estudios que proponen que niveles de ácido úrico sérico mayores a 5,2 mg/dl se asocian con enfermedad cardiovascular 9,20,21,22,23 y otros que afirman que concentraciones superiores a 4,5 mg/dl aumentarían el riesgo cardiovascular 7. En la actualidad no hay consenso para establecer puntos de corte que definan hiperuricemia en niños al igual que los criterios para definir el síndrome metabólico en esa misma población. Tang y cols. 24 han propuesto definir hiperuricemia como el promedio + 1 DE sobre las concentraciones de uricemia de una población normal, acorde a la edad.
Adicionalmente, estudios genéticos muestran una aparente asociación del ácido úrico con un polimorfismo del gen de la enzima metilenetetrahidrofolato reductasa, que regula las concentraciones de homocisteína plasmática, metabolito asociado al daño endotelial 25. Esta asociación aporta más aún al intento por explicar la fisiopatología del daño vascular propia del síndrome metabólico.
En nuestro estudio no se encontró una relación entre ácido úrico y síndrome metabólico, como sí lo demuestran estudios realizados en Perú 8, Brasil 23 y Chile 26,27. Se podría considerar que esta diferencia se debe principalmente a que estos estudios usaron los criterios de Cook y cols. 28, de De Ferranti y cols. 29 y de Brandão y cols. 30, mientras que en este estudio se utilizaron los criterios de ATP III, lo que podría disminuir la sensibilidad para establecer síndrome metabólico en adolescentes. Sin embargo, este estudio encontró una relación positiva entre los niveles de ácido úrico, tanto los valores a riesgo como los valores elevados, y el riesgo de obesidad abdominal, hipertensión arterial, glucemia en ayunas alterada, hipertrigliceridemia y niveles de HDL bajos.
A diferencia de los hallazgos de Quintanilla-Valentín y cols. 8, se evidenció una asociación fuerte entre los niveles de ácido úrico elevado y a riesgo con la probabilidad de presentar una glucemia en ayunas elevada e hipertrigliceridemia. Estos resultados pueden sugerir una estrecha relación entre ácido úrico y el desarrollo de resistencia a la insulina y diabetes mellitus, por lo que esto representa un área que requiere estudios más profundos para su análisis.
El presente estudio podría tener limitaciones relacionadas con la validez externa dado que la representatividad del grupo de adolescentes seleccionados en Bucaramanga hace referencia, principalmente, a adolescentes pertenecientes a niveles socioeconómicos bajos y medios, lo cual afecta la generalización de los resultados para otros niveles socioeconómicos u otras ciudades de Colombia, con diferentes bases genéticas poblacionales y diferentes patrones ambientales.
Una de las fortalezas de este estudio consiste en abrir perspectivas de investigación en el futuro, principalmente relacionadas con el impacto clínico de estas alteraciones durante las edades pediátricas y sus proyecciones a décadas posteriores. De manera adicional, el proceso de recaptura de los adolescentes participantes en el estudio original de cohorte poblacional siguió una metodología exhaustiva y rigurosa. Igualmente, la recolección de datos fue llevada a cabo bajo metodologías estrictas de estandarización de la toma de medidas antropométricas y variables clínicas.
En cuanto al impacto y pertinencia de este estudio, cabe resaltar que, a pesar de demostrarse que los cambios crónicos de la enfermedad cardiometabólica pueden comenzar desde la infancia o la adolescencia 4,5,6,20, los programas de promoción y prevención para enfermedad cardiovascular en Colombia recomiendan exámenes de tamizaje sobre los 45 años en personas asintomáticas 20 y no es considerada la medición de niveles de ácido úrico para la valoración del riesgo cardiovascular. Por esta razón, es importante incluir a los adolescentes en la detección de riesgo cardiovascular, pues los estilos de vida de los jóvenes suelen persistir en la edad adulta y provocar que la enfermedad cardiovascular se manifieste más tempranamente 21.
Los resultados de este estudio podrían contribuir al logro de un mayor impacto en términos de prevención de factores de riesgo y enfermedades cardiovasculares, desde edades tempranas, en la medida que se tomen decisiones en salud pública y en la práctica clínica relacionadas con la medición oportuna del ácido úrico como biomarcador predisponente de tales desenlaces.
Finalmente, los hallazgos de este estudio indican una asociación significativa entre los niveles de ácido úrico, tanto a riesgo como elevados, y los componentes individuales del síndrome metabólico, obesidad abdominal, hipertensión arterial, hipertrigliceridemia, glucemia en ayunas alterada y colesterol HDL.















