INTRODUCCIÓN
La frecuencia de la enfermedad renal crónica (ERC) en niños ha ido en aumento en los últimos años 1. Este tipo de pacientes presentan anorexia, náusea y vómito por la uremia, administración de medicamentos, trastornos hormonales, osteodistrofia, resistencia a la acción de la hormona del crecimiento, aporte calórico-proteico inadecuado, hipoalbuminemia, acidosis y gasto energético aumentado, lo que puede ocasionar la pérdida de masa muscular, retraso en el crecimiento y cambios en la composición corporal 2.
Aunado a lo anterior, existe un incremento en el riesgo de enfermedad cardiovascular, lo cual probablemente es secundario a una alta prevalencia de hipertensión, dislipidemia, obesidad y estilo de vida sedentario, además de factores relacionados con la uremia como hipervolemia, anemia, alteraciones del metabolismo calcio-fósforo, hiperparatiroidismo y acumulación de inhibidores endógenos de la síntesis de óxido nítrico, entre otros 3,4. En los pacientes con ERC la elevación de la concentración de triglicéridos (TGL) es la principal alteración del perfil de lípidos, ya que se presenta en estadios tempranos de la enfermedad, seguido por la disminución de los niveles de HDL (hipoalfalipoproteinemia), lo cual se observa hasta en un 40% de los sujetos. La dislipidemia está favorecida por el aumento de la lipoproteína C-III, resistencia a la insulina, un aclaramiento inadecuado de las lipoproteínas y microinflamación, lo que contribuye a las anomalías lipídicas en el entorno urémico 5. Si bien ni la diálisis peritoneal ni la hemodiálisis corrigen por completo el perfil de lípidos anormal, estas modalidades de tratamiento parecen tener efectos diferenciales sobre los niveles de lípidos. La diálisis peritoneal generalmente causa un perfil lipídico menos favorable que la hemodiálisis (principalmente hipertrigliceridemia), lo cual se atribuye al paso de glucosa del líquido de diálisis hacia la sangre 6.
Por otra parte, el exceso de tejido adiposo, particularmente la grasa visceral, se asocia con resistencia a la insulina, hiperglucemia, dislipidemia, hipertensión y un estado protrombótico y proinflamatorio 7,8. Específicamente en los pacientes con ERC, se ha demostrado que la composición corporal juega un papel importante en la presencia y el desarrollo de alteraciones cardiometabólicas como la dislipidemia, la hipertensión arterial sistémica y el infarto agudo al miocardio. Un aumento en la grasa corporal es un hallazgo común entre los pacientes sometidos a diálisis peritoneal que se caracteriza por un aumento en la masa grasa 7. Diferentes autores han encontrado asociaciones transversales entre la grasa androide (grasa abdominal ubicada alrededor del tronco del cuerpo) y la grasa ginecoide (depósito de grasa glúteo-femoral alrededor de la cadera y los muslos) y/o el cociente androide/ginecoide y diferentes factores de riesgo para enfermedad cardiovascular en niños y adolescentes 9,10. Los pacientes con ERC deben ser considerados como un grupo de alto riesgo cardiovascular, en quienes la identificación y el tratamiento de estos factores deben ser tempranos, agresivos y multifactoriales para intentar reducir las complicaciones cardiovasculares que presentan. Por este motivo resulta relevante evaluar de manera integral la composición corporal y su relación con el riesgo de presentar enfermedad cardiovascular. Así pues, el objetivo de nuestro estudio fue determinar si la composición corporal puede ser útil como marcador de dislipidemia a 12 meses de seguimiento en niños con ERC.
MATERIAL Y MÉTODOS
Se realizó un estudio observacional de una cohorte de niños y adolescentes con diálisis y hemodiálisis en el periodo de diciembre de 2015 a marzo de 2018. Se identificaron 23 pacientes de entre seis y 16 años de edad (12 [57%] de sexo masculino y nueve [43%] de sexo femenino) que se encontraban en seguimiento por el Servicio de Nefrología Pediátrica. Se excluyeron aquellos pacientes cuyos padres no autorizaran por escrito su participación (n = 2), pacientes que presentaran derrame pleural, con edema agudo pulmonar, insuficiencia cardiaca, anasarca o diabetes mellitus, que estuvieran en tratamiento con esteroides, que realizaran sus sesiones de hemodiálisis fuera del CMN Siglo XXI y pacientes con expedientes clínicos incompletos. Por consiguiente, para el análisis final solo se evaluó un total de 21 pacientes, a los cuales se les realizó medición inicial de la composición corporal, somatometría y determinación sérica de colesterol y TGL, con seguimiento de la somatometría completa, además de colesterol y TGL a los seis y 12 meses posterior a la primera evaluación. Del expediente clínico se recabaron edad, sexo, tiempo de evolución de la ERC y tipo de sustitución dialítica.
EVALUACIÓN ANTROPOMÉTRICA Y COMPOSICIÓN CORPORAL
El peso corporal seco se obtuvo utilizando una báscula digital Tanita® BMW-700, con capacidad de 200 g y sensibilidad de 0,1 g. La estatura se registró con un estadímetro Seca® 222 con un rango de 6-230 cm y divisiones de 1 mm. La composición corporal se determinó mediante absorciometría de energía dual de rayos X (DXA), con el equipo Luna Prodigy Advance(tm) (GE Medical Systems), por personal capacitado y certificado. La medición se realizó en posición anteroposterior, con el paciente inmóvil, sin objetos metálicos (aretes, pulseras, anillos, llaves, juguetes, cinturones, cadenas, etc.) y consistió en una serie de escaneos transversales desde la cabeza hasta la punta de los dedos del pie a intervalos de 0,6 a 1,0 cm del total del área escaneada. En el caso de los pacientes con diálisis peritoneal, se solicitó que acudieran el día de su cita programada en turno matutino, en ayuno, con cavidad peritoneal seca y con cuadernillo de apego a terapia dialítica para confirmar que se realizó su terapia basal en las últimas ocho horas, mientras que en los pacientes en hemodiálisis se realizó posterior a su segunda sesión de terapia (considerando que de las tres terapias que reciben a la semana, la segunda es en la que se encuentran metabólicamente más estables). La DXA mide la masa magra y el porcentaje de grasa del cuerpo total (% y kg de GC). La región androide se definió como el área entre las costillas y la pelvis que está totalmente encerrada por la región del tronco. El límite superior es el 20% de la distancia entre la cresta iliaca y el cuello y el límite inferior está en la parte superior de la pelvis. La región ginecoide incluye las caderas y la parte superior de los muslos y se superpone tanto a la pierna como a las regiones del tronco. La relación entre la masa grasa androide y ginecoide (cociente androide/ginecoide = CA/G) se calculó como la masa grasa androide dividida entre la masa grasa ginecoide 9,11. Para fines del estudio, el manejo del aparato fue operado por un solo técnico entrenado en el uso del equipo, la posición correcta que debe tener el paciente y la interpretación de los datos para obtener la información precisa de cada medición.
MÉTODOS ANALÍTICOS
Se obtuvieron muestras de sangre por venopunción previo ayuno de 12 horas. Posterior a la obtención de suero, se procedió a centrifugar a 3,500 rpm durante diez minutos a 4 °C y a almacenar en alícuotas a -80 °C hasta su análisis.
La cuantificación de TG y colesterol sérico se realizó mediante un método enzimático colorimétrico, utilizando un analizador automático Roche/Hitachi cobas® 6000, Modular E-501 (Roche Diagnostics, Indianapolis, Estados Unidos). Para el análisis de TG, este método utiliza una lipasa lipoproteica para hidrolizar triglicéridos a glicerol, con la oxidación posterior a dihidroxiacetonafosfato y peróxido de hidrógeno, el cual reacciona bajo la acción catalítica de la peroxidasa con la 4-aminofenazona y el 4-clorofenol para formar un colorante rojo en una reacción de punto final según Trinder. La intensidad cromática del colorante rojo formado es directamente proporcional a la concentración de triglicéridos y puede medirse fotométricamente. En cuanto al colesterol, por este método, los ésteres de colesterol se desdoblan por la acción de la colesterol esterasa a colesterol libre y ácidos grasos. La colesterol oxidasa cataliza entonces la oxidación de colesterol a colest-4-en-3-ona y peróxido de hidrógeno. En presencia de peroxidasa, el peróxido de hidrógeno formado produce una unión oxidativa de fenol y 4-aminofenazona para formar un colorante rojo de quinoneimina. La intensidad cromática del colorante formado es directamente proporcional a la concentración de colesterol. Se determina midiendo el aumento de la absorbancia.
Las técnicas de control de calidad que se emplearon en el laboratorio se realizaron con base en lo establecido para cada una de las mediciones mencionadas anteriormente y en cada corrida se incluyeron controles.
DEFINICIONES
Se consideró dislipidemia la presencia de hipertrigliceridemia (TGL plasmáticos ≥ 150 mg/dl) o hipercolesterolemia (colesterol total > 200 mg/dl) 12. Se consideró sobrepeso u obesidad cuando el IMC estaba en percentil ≥ 85 para la edad y el sexo 12. El %GC y el CA/G se consideró patológico cuando estaba en percentil ≥ 95 de acuerdo a la edad y el sexo de los pacientes 13,14.
El protocolo de investigación fue aprobado por el Comité de Investigación del Hospital de Pediatría, con número de registro R-2010-3603-27. Los padres firmaron la carta de consentimiento informado y los pacientes mayores de ocho años firmaron la carta de asentimiento de acuerdo con las recomendaciones de la Declaración de Helsinki.
ANÁLISIS ESTADÍSTICO
Los datos se analizaron utilizando el paquete estadístico Stata versión 12.0. En virtud de que no se encontró distribución normal para las variables cuantitativas, los datos se presentan como mediana, mínimo y máximo y las variables cualitativas, en frecuencia y porcentaje.
Para identificar si existía diferencia entre el score Z del IMC, los niveles séricos de triglicéridos y el colesterol total se aplicó la prueba de Friedman al inicio, seis meses y 12 meses. Para identificar diferencia entre las proporciones de obesidad, hipertrigliceridemia e hipercolesterolemia al inicio en comparación a los seis y 12 meses se aplicó prueba de Chi cuadrado o exacta de Fisher.
Se calculó la diferencia (delta) de los niveles séricos de TGL y del colesterol, restando los niveles a los 12 meses menos los iniciales. Esta misma operación se realizó para calcular el delta del score Z del IMC.
Utilizando el coeficiente de Spearman, se determinó la correlación del score Z del IMC, CA/G, grasa corporal y %GC con las concentraciones séricas de TGL, colesterol total al inicio, seis y 12 meses, así como con el delta de los TGL y colesterol total a los seis y 12 meses de seguimiento.
Mediante un modelo de análisis de regresión lineal múltiple se identificó la asociación entre el CA/G y el delta de los niveles de TGL, controlando por tipo de terapia dialítica, tiempo de evolución de la ERC y score Z del IMC.
RESULTADOS
De los 21 pacientes, nueve correspondieron al sexo femenino (43%), con una mediana de edad de 15 años (mín. siete años, máx. 16 años). Doce niños se encontraban en diálisis peritoneal (57%) y nueve, en hemodiálisis (43%), con una mediana de tiempo de evolución de la ERC de 19 meses (min. dos meses, máx. 144 meses). Con respecto al estado nutricional, la mediana del score Z del IMC fue de -0,66 (mín. -3,0, máx. 2,1) y solo tres pacientes (14,3%) presentaron obesidad. El porcentaje de grasa tuvo una mediana de 21,8% y se mostró alterado en la mitad de los pacientes, mientras que el CA/G estuvo elevado en el 28,5% de los casos (Tabla I).
Tabla I. Características demográficas, clínicas y composición corporal de los pacientes con enfermedad renal crónica terminal
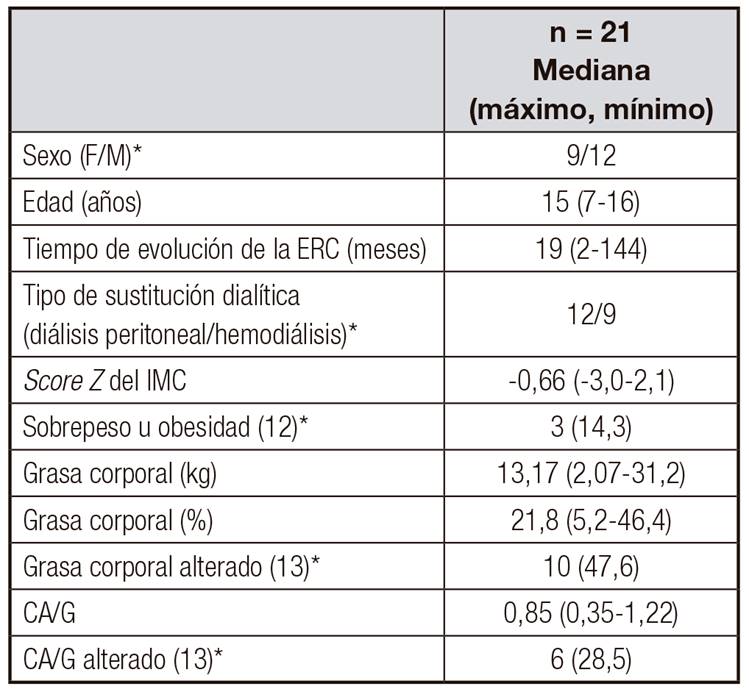
*Frecuencia (%). ERC: enfermedad renal crónica
IMC: índice de masa corporal; CA/G: cociente androide/ginecoide.
Durante el seguimiento de los pacientes a los seis y 12 meses, no se identificó una modificación significativa del score Z del IMC (basal -0,66 [-3,0-2,1] vs. seis meses -0,35 [-4,2-2,2] vs. 12 meses -0,14 [-3,0-3]; p = 0,822).
En relación al perfil de lípidos, el nivel de TGL no se modificó entre el inicial y los seis meses de seguimiento, pero entre los seis y 12 meses se detectó incremento (seis meses mediana: 108 mg/dl vs. 12 meses: mediana de 147 mg/dl; p = 0,05). Además, se observó que el 40% (n = 8) de los pacientes en la medición basal presentaron hipertrigliceridemia, que ascendió al 47,6% (n = 10) a los 12 meses. Los niveles de colesterol no presentaron modificación significativa durante los 12 meses de seguimiento; sin embargo, el número de pacientes con hipercolesterolemia pasó de dos pacientes (9,5%) a cuatro pacientes (19%) (Tabla II).
Tabla II. Seguimiento del perfil de lípidos y estado de nutrición de los pacientes con enfermedad renal crónica terminal durante 12 meses
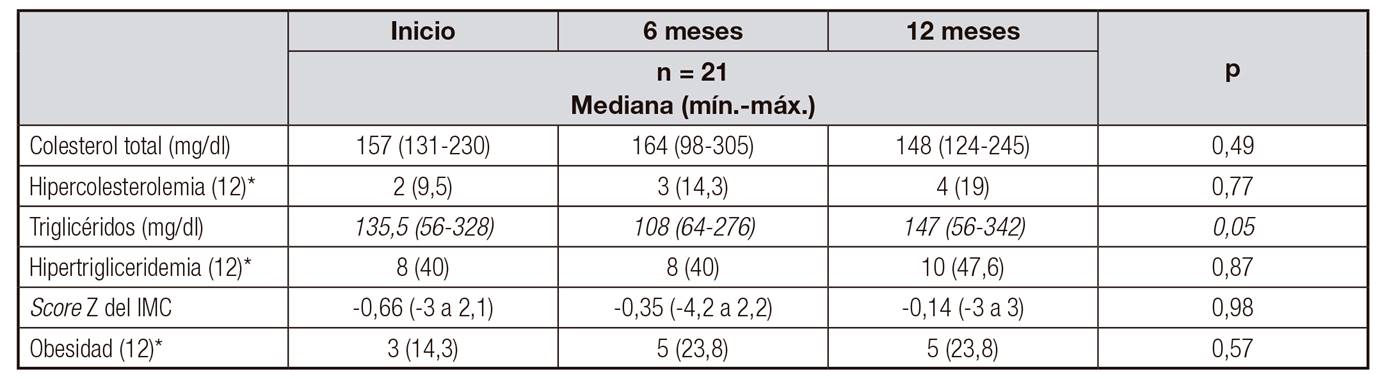
*Frecuencia (%).
IMC: índice de masa corporal.
En los análisis de correlación se identificó que a mayor CA/G, mayores niveles de TGL, lo cual fue estadísticamente significativo a los seis y 12 meses de seguimiento (Fig. 1 y Fig. 2). El resto de las variables de la composición corporal no se correlacionaron con los niveles de TGL y colesterol (Tabla III).
Tabla III. Correlación del cociente androide/ginecoide con el colesterol y triglicéridos al inicio, seis y 12 meses y con el delta del colesterol total y triglicéridos a los seis y 12 meses de seguimiento
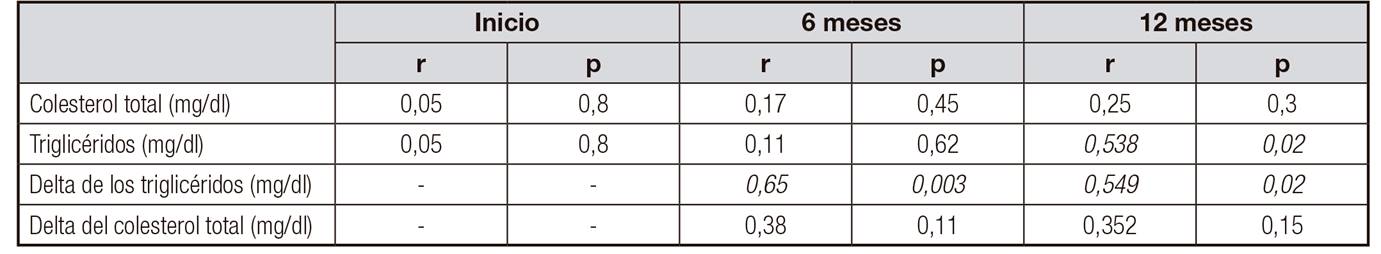
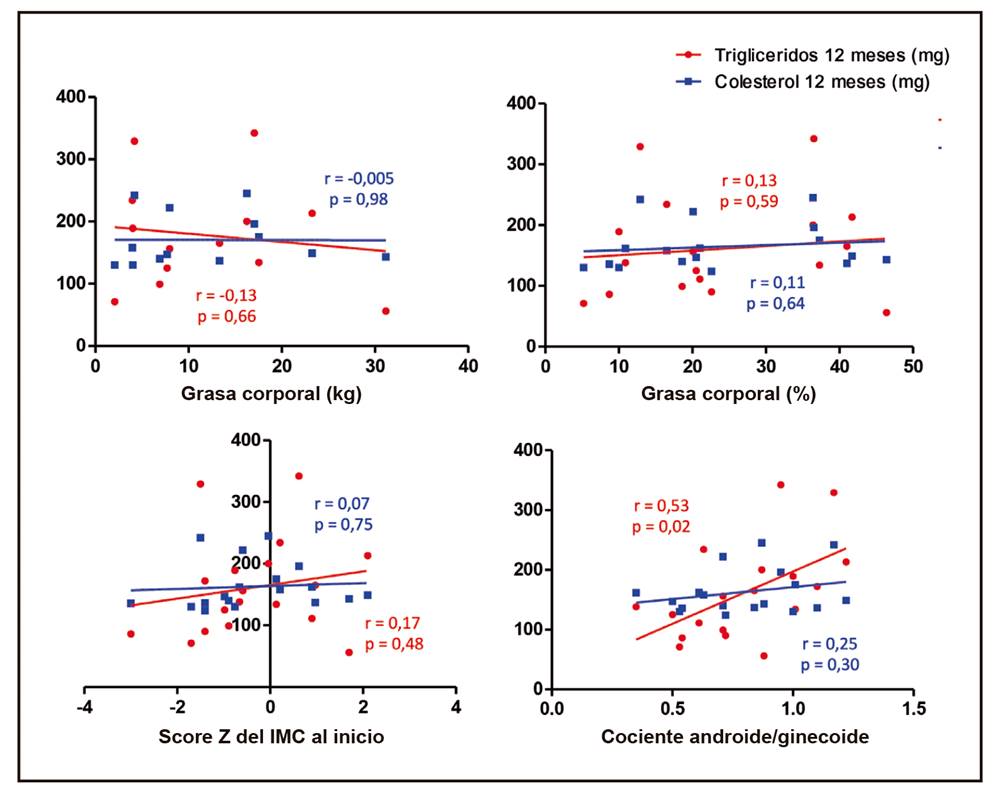
Figura 1. Correlación de diferentes características de la composición corporal al inicio del seguimiento con las concentraciones séricas del colesterol y triglicéridos a 12 meses de seguimiento.

Figura 2. Correlación de diferentes características de la composición corporal al inicio del seguimiento con el delta del colesterol y triglicéridos a 12 meses de seguimiento.
Por último, en el modelo multivariado para identificar el impacto del CA/G sobre la modificación de los niveles séricos de los triglicéridos a 12 meses de seguimiento se demostró asociación positiva, esto es, a mayor CA/G (coeficiente 216,4, p = 0,008), mayor incremento en las concentraciones de los triglicéridos, independientemente del score Z del IMC al inicio del estudio, el tiempo de evolución de la ERC y el tipo de sustitución dialítica (Tabla IV).
DISCUSIÓN
En el presente estudio, en pacientes pediátricos con ERC el CA/G se asoció con el incremento de las concentraciones séricas de triglicéridos, tras seis y 12 meses de seguimiento. Esto resulta clínicamente relevante dado que la dislipidemia es un factor de progresión, tanto de la ERC como de la enfermedad cardiovascular y el CA/G como marcador de riesgo metabólico 15,16. Actualmente, se reconoce que, independientemente de las características del paciente, la falla renal produce cambios en el perfil de lípidos 17. Estas modificaciones en el perfil de lípidos durante la evolución de ERC se caracterizan por niveles de C-LDL normales o discretamente elevados, C-HDL disminuido, TGL elevados y lipoproteínas aumentadas que se relacionan principalmente con el grado de daño renal, la etiología primaria de ERC, la presencia de síndrome nefrótico y la terapia sustitutiva utilizada 18,19. Estas alteraciones en el perfil lipoproteico son evidentes, incluso, en los niños con ERC moderada y se asocian con una disminución mayor del filtrado glomerular, la edad, la presencia de proteinuria y la obesidad 20. En nuestro estudio, solo el 14% presentó obesidad, mientras que el porcentaje de grasa corporal estuvo alterado en el 48% de los pacientes y en un 29% (n = 6) de los casos se identificó un CA/G elevado. En relación a las repercusiones negativas de la obesidad, estas no solo están relacionadas con la cantidad de grasa, sino también con su distribución y con un riesgo cardiovascular mayor. Un aumento de la acumulación de grasa abdominal, sobre todo en el compartimento visceral, se asocia a los factores de riesgo metabólico y ateroesclerosis. El tejido adiposo visceral (TAV) es metabólicamente activo y secreta adipocinas, que causan inflamación vascular y resistencia a la insulina. El TAV se asocia a la enfermedad cardiovascular y constituye un marcador del riesgo cardiometabólico 21.
En este estudio no se observaron cambios en la concentración de TGL entre la medición inicial y los seis meses de seguimiento. Sin embargo, entre los seis y 12 meses fue evidente un incremento significativo. Además, se observó que el 40% de los niños presentaron hipertrigliceridemia en la medición basal y el 48%, a los 12 meses. Los mecanismos por los que se producen estos cambios en el perfil lipídico se relacionan con la evolución de la enfermedad y el tipo de tratamiento sustitutivo renal. En estos pacientes, la acumulación de TGL se origina tanto por el exceso de producción de lipopartículas ricas en TGL, como por la disminución de su catabolismo, debido a un descenso en la actividad de la lipoprotein-lipasa (LPL) y de la lipasa hepática. Ello se debe a un incremento de los niveles de apoC-III, que provoca un aumento de la relación apoC-III/apoC-II, y a la disminución de la síntesis de LPL, que es secundaria a la presencia de hiperparatiroidismo o bien a la disminución de los niveles de insulina. Las alteraciones del C-HDL en la ERC disminuyen sus propiedades ateroprotectoras y pueden contribuir al exceso de mortalidad cardiovascular de los pacientes con ERC, aunque el efecto de la ERC avanzada sobre la composición y función de las HDL no está completamente esclarecido 17.
Algunos estudios han demostrado la asociación del CA/G con factores metabólicos y cardiovasculares en niños, principalmente en aquellos con sobrepeso y obesidad. Samsell y cols. determinaron en un grupo de niños de siete a 13 años de edad la asociación del CA/G con la resistencia a la insulina y la dislipemia, independientemente de la obesidad infantil, y reportaron que el CA/G se asoció con resistencia a la insulina y colesterol LDL y VLDL, lo que sugiere que este índice podría ser útil como una medición de riesgo de enfermedad metabólica y cardiovascular 22. En este estudio se pudo identificar una asociación fuertemente positiva del CA/G sobre los cambios de los niveles séricos de los triglicéridos a 12 meses de seguimiento, independientemente al score Z del IMC, el tiempo de evolución de la ERC y el tipo de sustitución dialítica. Esto es importante debido a que estudios previos han demostrado que la grasa de la parte superior del cuerpo, como la grasa del tronco, se asocia con un aumento de los factores de riesgo relacionados con la obesidad (enfermedad cardiovascular, niveles altos de TGL, colesterol HDL disminuido, presión arterial elevada), mientras que la grasa corporal inferior, que incluye la grasa del muslo y la pierna, está relacionada con una disminución de estos factores 23.
En un grupo de pacientes pediátricos urémicos en hemodiálisis (n = 18), González y cols., analizando los cambios en la grasa abdominal a lo largo de un año, evaluaron su posible asociación con los cambios en los niveles circulantes de adipocitocinas y la composición corporal, identificando una ganancia de grasa abdominal con el tiempo evidenciada por un aumento del CA/G, lo que podría explicar el aumento del riesgo cardiovascular que presentan 24. En contraposición con lo reportado por Gonzáles y cols., el nivel de triglicéridos, no el de colesterol, cambió significativamente entre los seis y los 12 meses de seguimiento. En relación al CA/G, el estudio tiene como limitación la falta de un análisis longitudinal de este indicador metabólico. Sin embargo, el CA/G presentó una asociación positiva con la modificación en las concentraciones séricas de triglicéridos a 12 meses de seguimiento, lo cual para nuestro conocimiento no ha sido descrito en otros estudios. No obstante, en forma indirecta se ha reportado una disminución del volumen de la masa muscular y el aumento de la masa grasa en pacientes con ERC 25,26.
Por su parte, Odamaki y cols. demostraron que el área de masa grasa abdominal visceral ajustada por el IMC fue significativamente mayor, mientras que el área de masa grasa subcutánea abdominal ajustada por IMC fue menor en pacientes con hemodiálisis cuando se comparó con un grupo control de niños sanos de la misma edad y sexo. También reportan una disminución en el área del músculo abdominal en los pacientes con hemodiálisis en comparación con los controles sanos. Los autores concluyen que la composición corporal es un factor relacionado con un aumento en la morbimortalidad en pacientes con ERC, asociado con una disminución en el músculo y aumento de la grasa corporal 26.
En relación a las limitaciones del estudio, es evidente el tamaño de muestra pequeño, lo que podría explicar que no se encontrara una correlación del colesterol con el CA/G. Sin embargo, a pesar de esta limitación del trabajo, los resultados obtenidos en relación al CA/G y la concentración de TGL, es necesario atender de forma temprana las complicaciones relacionadas con el acumulo de grasa abdominal y el riesgo incrementado de morbimortalidad en este grupo de pacientes.
No obstante, no está del todo claro si esta asociación en el paciente pediátrico con ERC es consistente a largo plazo, considerando la edad, la pubertad y la redistribución de la grasa corporal.
Para comprobar los datos obtenidos, se requiere realizar estudios futuros y dado los resultados obtenidos y recalculamos el tamaño de muestra, lo menos se requeriría incluir 30 sujetos.
En relación a las fortalezas del estudio, la adiposidad de los pacientes fue evaluada utilizando la técnica de absorciometría dual de rayos X, que se considera confiable y precisa en los niños y arroja mediciones duras de la distribución de la grasa, como las regiones androide y ginecoide del cuerpo, evaluadas en este estudio. La distribución androide y un CA/G alto se consideran factores de riesgo cardiovascular. No obstante, una segunda limitación del estudio se relacionada con el DXA, ya que esta técnica no permite separar entre la grasa visceral y la grasa abdominal subcutánea.
En conclusión, el CA/G se asocia fuertemente con los niveles de TGL a 12 meses de seguimiento en niños con ERC terminal.















