INTRODUCCIÓN
Hoy en día conocemos que tanto la obesidad como la DM-2 aumentan el riesgo de fractura, incluso aunque, paradójicamente, la densidad mineral ósea (DMO) se encuentre por encima del rango para la edad. Un metaanálisis que agrupó 12 estudios reportó un RR de 1.7 (IC 95%: 1.3-2.2) para fractura de cadera (con un 75% de hueso cortical en su composición) tanto en hombres como en mujeres con DM-2 1. En pacientes obesos son más frecuentes las fracturas a nivel del esqueleto apendicular (que contienen el 66% del hueso trabecular) tales como, húmero, pie y tobillo. A pesar de ello, la obesidad probablemente juegue un rol en la patogénesis de las fracturas asociadas a la DM-2.
Para el estudio de la microestructura ósea, desde hace algunos años contamos con el trabecular bone score (TBS), que se calcula a partir de un software que emplea datos de la densitometría ósea (DXA) corporal total y tiene una óptima correlación con la tomografía computarizada cuantitativa (QTC) y las biopsias óseas transiliacas en cuanto a parámetros como: volumen óseo, número de trabéculas y su espaciado 2,3. En sujetos con obesidad y DM-2 se ha podido constatar que el espaciado trabecular es menos uniforme, lo cual determina una menor calidad de hueso.
Por otro lado, el FRAX nos ayuda a estimar el riesgo de fractura a diez años y actualmente orienta el tratamiento de pacientes con osteoporosis. En pacientes DM-2 u obesos su utilidad disminuye, dado que este índice considera únicamente la DMO, la misma que, como anteriormente se indicaba, está elevada. En los últimos años se ha propuesto como mejor herramienta en estos grupos el FRAX ajustado a TBS 4.
Asimismo, tanto la obesidad como la DM-2 convergen en cambios a nivel muscular. Se han observado estados de presarcopenia o sarcopenia establecida que comparten mecanismos fisiopatológicos en común, como la inflamación crónica, la cual inhibe la síntesis proteica muscular. Además, existen otras hipótesis propuestas para explicar la susceptibilidad de los pacientes diabéticos y obesos a la sarcopenia, tales como la resistencia a la acción de hormonas anabólicas, las citocinas proinflamatorias y la disfunción mitocondrial, sobre todo en casos de hiperglucemia crónica 5.
Para evaluar la masa muscular se pueden utilizar numerosas técnicas validadas, como la tomografía axial computarizada (TAC), la resonancia magnética (RM), la activación de neutrones o técnicas isotópicas y la propia DXA. El inconveniente de la mayoría de estas herramientas es su elevado coste, el riesgo que conlleva la radiación y la dificultad de ejecución e interpretación. Dado que en la práctica clínica la antropometría es muy variable y operador-dependiente, el European Working Group on Sarcopenia in Older People (EWGSOP) recomienda usar como métodos la bioimpedancia (BIA) y la DXA.
Por último, un excesivo volumen de grasa visceral abdominal está asociado a inflamación crónica, intolerancia a la glucosa, hipercolesterolemia, disminución de la tasa de formación ósea, bajo TBS, así como disminución de la fuerza y la movilidad en ancianos. La interrelación entre hueso y grasa visceral parece tener su origen a partir de la célula madre mesenquimal que comparten osteoblastos y adipocitos, con su posterior diferenciación excluyente hacia la vía Wnt-catenina o la PPAR-, respectivamente. No obstante, la interconexión posterior como tejidos maduros es menos clara.
Dado que la obesidad es un factor de riesgo para el desarrollo de DM-2, ¿podría la osteosarcopenia (presente en ambas entidades) determinar qué sujetos son más proclives a ser diabéticos? O, desde otro punto de vista, ¿en qué medida la alteración del metabolismo glucídico nos alerta del deterioro de la masa musculoesquelética y en qué estadios?
Los objetivos del presente estudio son los siguientes:
Evaluar y comparar parámetros de composición corporal (compartimentos óseo, muscular y tejido adiposo visceral) en pacientes con sobrepeso u obesidad agrupados según presenten o no alteraciones del metabolismo glucídico.
Analizar si existen diferencias en cuanto al riesgo de fractura a diez años comparando FRAX vs. FRAX- TBS en los mismos grupos.
MATERIAL Y MÉTODOS
Se trata de un estudio prospectivo, transversal, en el cual participaron 16 pacientes de la consulta de Obesidad de una Unidad de Obesidad de un hospital de tercer nivel. Se incluyeron de forma aleatoria pacientes con índice de masa corporal (IMC) > 25, el 75% de los cuales tenía IMC > 30. Se incluyeron diez hombres y seis mujeres en seguimiento de pocos meses en dicha unidad, que seguían exclusivamente recomendaciones nutricionales y de actividad física. Se excluyeron, por tanto, los pacientes sometidos a tratamiento médico o quirúrgico de su obesidad, aquellos con osteoporosis o patología que hubiese supuesto inmovilidad en los últimos seis meses, pacientes con patologías digestivas que condicionen malabsorción de nutrientes o alguna comorbilidad relacionada que actuara como factor confusor al momento de evaluar los compartimentos corporales (distrofias musculares, enfermedades consuntivas como el cáncer, tuberculosis en tratamiento activo, VIH, cirrosis hepática, fallo renal crónico en fase prediálisis o superior al estadio 2, lipodistrofias, hiperparatiroidismo, osteomalacia, etc.), así como pacientes con DM tipo 1, LADA, MODY o con diabetes mitocondrial.
Tras acceder a su inclusión en el estudio mediante consentimiento informado, y con la aprobación del Comité Ético del hospital, todos fueron sometidos el mismo día a la realización de las siguientes pruebas: evaluación clínica y antropométrica con equipo Inbody 570 (bioimpedanciometría eléctrica tetrapolar), DXA corporal total (modelo Lunar iDXA- GE Healthcare), con software TBS insight v. 3.0 para calcular TBS y analítica basal.
Una vez realizadas las pruebas, se les agrupó según presentaran o no alteraciones glucídicas en sujetos con: a) glucemia normal; b) glucosa basal alterada en ayunas (GBA); y c) DM tipo 2.
De la anamnesis, se elaboró una plantilla de recolección de datos recabando antecedentes familiares de fractura de cadera, antecedentes personales de fracturas previas, comorbilidades, hábitos tóxicos (tabaquismo y enolismo) y toma de fármacos que predispongan a osteopenia, principalmente glucocorticoides. Todos estos datos sirvieron para realizar el score de riesgo FRAX-10. Los datos antropométricos obtenidos fueron: peso, talla e IMC.
De la BIA tetrapolar se emplearon: porcentaje de grasa, nivel de grasa visceral, minerales/IMC, masa musculoesquelética y masa magra en kg.
La DXA corporal total nos permitió contar con los datos de: porcentaje de grasa corporal total, tejido adiposo visceral (volumen en cm3 y masa en g), masa magra (porcentaje y total en kg), masa magra apendicular (kg), índice androide/ginoide, T y Z-score L1-L4, T y Z-score de cuello femoral y DMO de cuello femoral (para la estimación del riesgo FRAX-10).
Los parámetros analíticos evaluados fueron glucosa, HbA1c, perfil lipídico, creatinina, filtrado glomerular, calcio y fósforo.
Para la evaluación de la masa muscular por BIA, se emplearon la fórmula y los puntos de corte del EGWSOP (MM/T2 = masa muscular/T2, VN mujeres > 6,76 y varones > 10,76), y para DXA, los de la Foundation for the National Institutes of Health (ALM/IMC = apendicular lean mass/IMC, VN mujeres > 0,512 y varones > 0,789) 7.
Para el análisis estadístico se empleó el programa SPSS, versión 20.
RESULTADOS
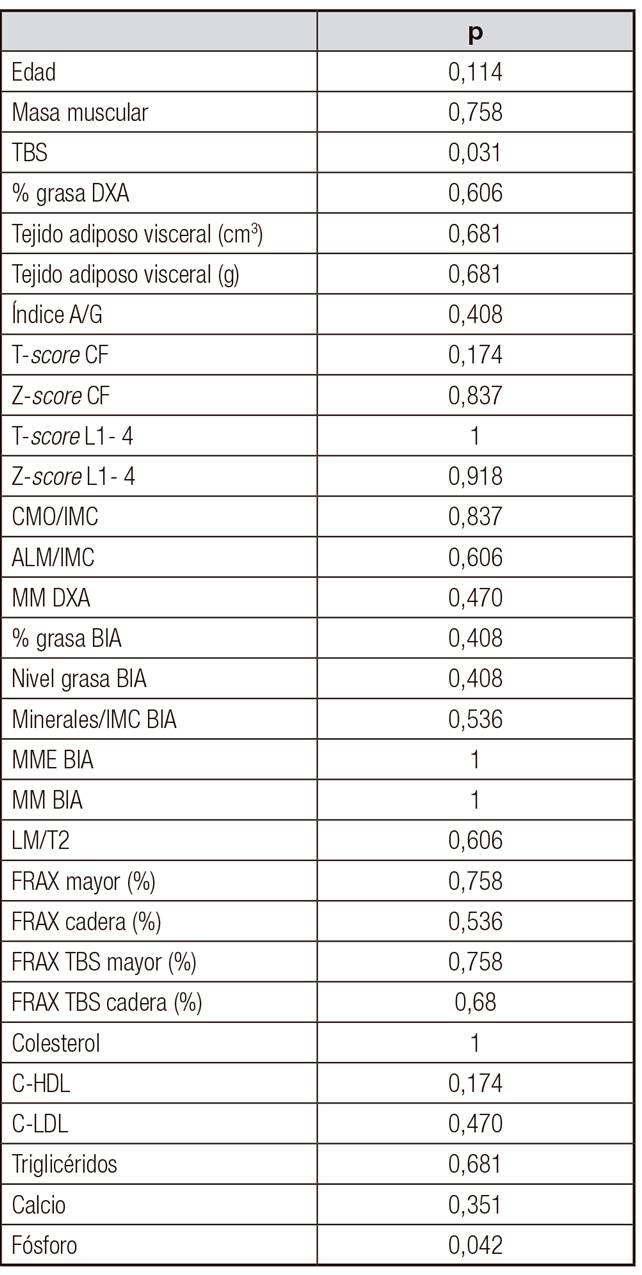
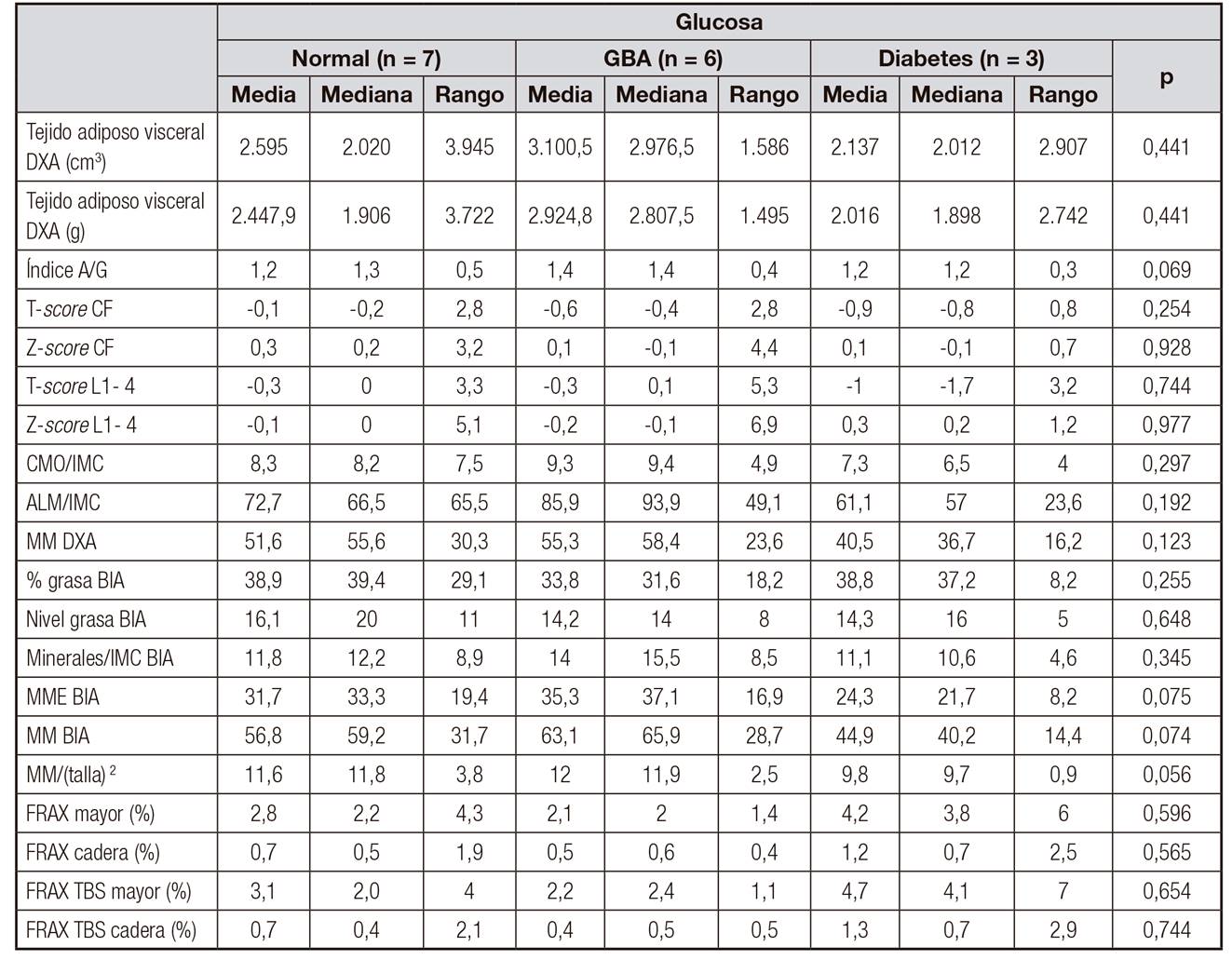
La media de edad de los 16 sujetos fue de 63 ± 15 años y el IMC, el porcentaje de grasa y el índice A/G, de 32 ± 12,2 kg/m2, 42% ± 25,9 y 1,26 ± 0,53, respectivamente. La HbA1c promedio según estuvieron los pacientes asignados a glucemia normal (n = 7), glucemia basal alterada en ayunas o GBA (n = 6) y DM-2 (n = 3) fue de 5,3 ± 0,9, 5,5 ± 1,3 y 8,1 ± 3,4%, respectivamente. Se detallan en las Tabla I y Tabla II otras de las características basales de los tres grupos.
Al aplicar los test de Kruskal-Wallis y ANOVA, no se encontraron diferencias estadísticamente significativas en cuanto a parámetros óseos, compartimentos adiposo visceral y muscular con respecto a ninguna de las técnicas empleadas.
Tabla I. Descripción de parámetros demográficos y bioquímicos según glucemia en tres grupos

IMC: índice de masa corporal; GBA: glucemia basal alterada en ayunas.
Tabla II. Descripción de parámetros de composición grasa, muscular y ósea en BIA y DXA según clasificación de glucemia en tres grupos
A/G: androide/ginecoide; ALM: appendicular lean mass; MM: masa muscular; MME: masa musculoesquelética.
No obstante, en el grupo de paciente diabéticos, la microarquitectura ósea es de peor calidad en relación a los otros grupos. Asimismo, los pacientes con glucosa normal tienden a presentar mejores cifras de TBS (1,41 vs. 1,29 vs. 1,3, respectivamente). En el caso de aquellos catalogados como GBA, el panorama es de alta variabilidad, sin presentar ningún patrón claro (Fig. 1).
El riesgo de fractura mayor ajustado a TBS (FRAX-TBS) se incrementó en diabéticos en un 0,4%, aunque no fue significativo. El FRAX-TBS en cadera sufrió pocas modificaciones.
La menor masa muscular la registraron los pacientes diabéticos (MM/T2 de 9,78 ± 0,88 frente a 11,56 ± 3,8 en individuos normales y 12,01 ± 2,47 en sujetos con GBA), sin diferencias estadísticamente significativas entre los grupos.
Contradictoriamente, el grupo de GBA, a pesar de tener el menor porcentaje de grasa, fue el que mayor volumen de grasa visceral presentó, con 3,100 ± 1,586 kg3 (2,924 ± 1,495 kg3), sin hallar diferencias estadísticamente significativas. Ambas mediciones fueron realizadas con DXA.
No hubo diferencias significativas entre los tres grupos en cuanto a parámetros analíticos de calcio, fósforo, función renal y perfil lipídico.
Dado el escaso tamaño muestral, recurrimos a la prueba U de Mann-Whitney, por lo que se realizó la reclasificación en solo dos grupos: glucemia normal en el grupo 1 y glucemia alterada (prediabetes y diabetes) en el grupo 2. Se encontraron diferencias significativas en cuanto a microarquitectura ósea a favor de una masa preservada en pacientes con glucemia normal (p = 0,031). Lo mismo sucedió en cuanto a niveles de fósforo, con cifras menores en individuos con prediabetes y diabéticos (p = 0,04) (Tabla III).
DISCUSIÓN
El TBS nos permite ir más allá del estudio tradicional del hueso cortical y profundizar en los cambios que se llevan a cabo en el entramado trabecular, el cual es mucho más activo metabólicamente que su colindante porque se remodela en mayor cuantía.
¿Podría la microarquitectura ósea deteriorarse precozmente en estados de prediabetes? A la luz de nuestros resultados en el grupo de pacientes prediabéticos, hay una gran disparidad y aunque no podemos establecer conclusiones a favor o en contra, sí que reviste interés de cara a conocer si reportaría beneficios la implementación de tratamiento médico de la diabetes en estadios tempranos 8,9.
Además, sería interesante ampliar investigaciones incluyendo como variable de estudio el tiempo de la evolución de la disglucosis, para establecer si juega algún papel propiciando en mayor medida estas alteraciones óseas. Como probable mecanismo, existe evidencia de que la insulinorresistencia afecta el remodelado óseo a través de efectos directos en los osteoblastos, osteoclastos y osteocitos, ya que todos ellos expresan receptores de insulina. Además, la hiperglucemia está asociada con la acumulación de productos avanzados de glicosilación (AGEs), los mismos que, al menos in vitro, inhiben la formación ósea. Este efecto parece mediado por el aumento de la producción de esclerostina en el osteocito 2.
La falta de congruencia al momento de contrastar TBS y el FRAX ajustado a TBS obtenido en nuestro estudio podría atribuirse al tamaño muestral y a algunos casos con IMC > 35 kg/m2 que podrían infraestimar el riesgo ajustado.
A pesar de ello, es posible que el FRAX-TBS en nuestro medio sea más preciso que el FRAX, considerando que este último parece infraestimar el riesgo de fractura global debido a que para su cálculo se han empleado las estadísticas suecas, por no contar con cifras propias de la población española.
La menor MM y MME encontrada en diabéticos, independiente de la presencia de neuropatía o enfermedad arterial periférica, podría estar relacionada con la infiltración grasa del músculo estriado. Los pacientes con GBA obtuvieron el mayor porcentaje de MM y MME, lo cual nos podría conducir al razonamiento de que el músculo, con su entorno metabólico, juegue un papel protector en el inicio de la diabetes. Aún nos quedaría por profundizar en el estudio funcional y morfológico muscular para dar por válida esta afirmación (14).
Por otra parte, el grupo con más tejido adiposo visceral también fue el de GBA, lo cual podría sugerir (junto a lo encontrado previamente acerca de la mayor MME en el mismo grupo) hasta qué punto existiría una proporción beneficiosa entre estos dos compartimentos corporales capaz de detener la evolución de la disglucosis.
Por otro lado, el fósforo se encontró significativamente más bajo en el grupo de pacientes con prediabetes/diabetes. Esto resulta concordante con las cifras de hipofosfatemia obtenidas por Zhong Nan Da Xue y cols. 13 en 162 pacientes diabéticos de una población total de 244 pacientes. Otros estudios han encontrado niveles similares y abren la puerta a pensar que este hallazgo podría tener relación con la insulinorresistencia.
Ninguno de nuestros hallazgos guarda relación con la edad ni el sexo. Nuestra mayor limitación es el escaso tamaño muestral, especialmente en el grupo con diabetes. No obstante, cabe resaltar el carácter prospectivo del estudio, excluyendo sujetos con osteoporosis al inicio del mismo.
Por todo lo mencionado, hacen falta más estudios con poblaciones más numerosas para establecer si existe correlación entre los cambios incipientes sobre la microestructura ósea, la masa muscular y las alteraciones del metabolismo hidrocarbonado en fase de prediabetes en pacientes con obesidad y para evaluar si estos podrían ser reversibles.
CONCLUSIÓN
En nuestro estudio, la microarquitectura ósea está deteriorada en pacientes con prediabetes/diabetes y sobrepeso u obesidad. Hacen falta estudios con mayor número de muestra para establecer si estos cambios se instauran precozmente o no en la evolución natural de la diabetes. No encontramos diferencias en cuanto a FRAX ajustado a TBS en ninguno de los grupos.