INTRODUCCIÓN
Las comorbilidades crónicas a largo plazo constituyen hoy en día uno de los principales retos en el seguimiento de los supervivientes de leucemia aguda infantil. Entre ellas, la obesidad y el sobrepeso son una de las primeras causas de morbimortalidad a largo plazo, con una prevalencia que varía del 25 hasta el 65 % según las series (1,2).
Dado que el exceso de masa grasa se asocia con mayor riesgo de enfermedad cardiovascular, resistencia insulínica y diabetes mellitus tipo 2 (2, 3, 4), resulta de especial relevancia una evaluación adecuada de la composición corporal que permita clasificar de forma correcta a estos sujetos y poder definir así la población de riesgo sobre la cual iniciar estrategias de prevención que permitan reducir su prevalencia.
Clásicamente, la evaluación de la obesidad se ha realizado mediante índices o medidas rápidas y accesibles como el índice de masa corporal (IMC). Sin embargo, el IMC evalúa el peso respecto a la talla sin diferenciar entre la masa muscular, la masa grasa o el hueso (5). Esto, en una población con riesgo de desarrollar secuelas como talla baja o descenso de la masa magra y aumento de masa magra secundariamente al tratamiento recibido (6,7), hace que no sea una medida precisa para evaluar la composición corporal. De tal manera que surge la necesidad de emplear otras técnicas que permitan una mejor evaluación tanto cuantitativa (porcentaje de masa grasa respecto a masa magra) como cualitativa (visceral o subcutánea) de la grasa corporal.
En este sentido, disponemos de otros índices y medidas antropométricas que nos permiten estimar la distribución de la grasa como: el perímetro de cintura, el índice cintura-cadera (ICC) o el índice cintura-talla (ICT), así como numerosas técnicas para la cuantificación de la misma. Dentro de estas podemos distinguir algunas como la tomografía axial computarizada (TAC), la absorciometría dual de rayos X (DXA) o la pletismografía, con alta precisión y especificidad pero también de alto coste, complejidad y limitada accesibilidad, lo que hace que sean poco aplicables en la práctica diaria (8). Otros métodos de mayor accesibilidad, reproductibilidad y simplicidad técnica (8,9) son la bioimpedanciometría (BIA) y los pliegues cutáneos. Ambos son considerados métodos indirectos accesibles y coste-efectivos, con buena sensibilidad y especificidad en la población adulta (10,11).
Los objetivos del presente estudio fueron: evaluar la frecuencia de obesidad según los diferentes métodos antropométricos y de evaluación de la composición corporal disponibles en la práctica clínica diaria y comparar su prevalencia con el método de evaluación globalmente empleado, el IMC. Además de evaluar la presencia de obesidad sarcopénica en esta población y analizar los posibles factores riesgo (demográficos y características tumorales y relacionadas con el tratamiento recibido), con el objetivo de proponer adecuadas estrategias de prevención primaria de forma precoz en el seguimiento de estos pacientes.
MATERIAL Y MÉTODOS
POBLACIÓN DE ESTUDIO
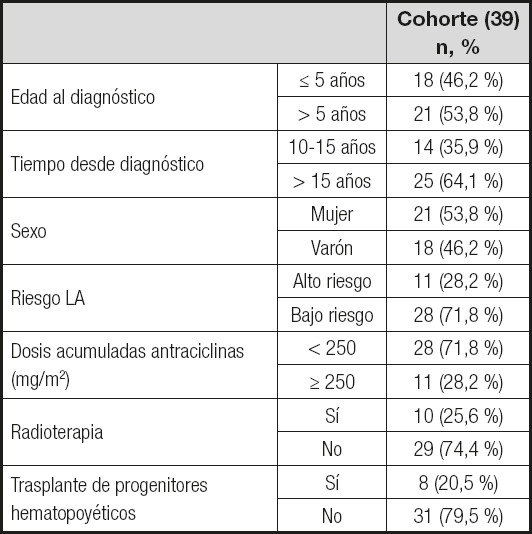
Estudio transversal de 39 supervivientes de leucemia aguda infantil (mieloblástica [LAM] y linfoblástica [LAL]), mayores de edad, diagnosticados entre los años 1995 y 2006, con una supervivencia de al menos diez años desde el diagnóstico. Se recogieron retrospectivamente los datos al diagnóstico (edad, tipo de cáncer, dosis acumuladas de quimioterápicos y terapias coadyuvantes). Todos los pacientes firmaron un consentimiento informado escrito para formar parte del estudio, el cual fue aprobado por el Comité de Ética (PI16/0191).
El tratamiento de la leucemia aguda (LA) incluyó regímenes de poliquimioterapia, establecidos según los protocolos: PETHEMA LAL BR01, LAL 96 y LAL 99 para las LAL y HIVH-LAM-2002 y SHOP-LANL 2001 en las LAM, con diferentes fármacos (citarabina, ciclofosfamida, metrotrexate, asparraginasa, antraciclinas: doxorrubicina en las LAL e idarrubicina en las LAM, y corticoides). Las dosis acumuladas de corticoides (dexametasona y prednisona) se calcularon en equivalentes a prednisona. Según la clasificación del riesgo tumoral, algunos de los pacientes precisaron trasplante de progenitores hematopoyéticos (TPH) (alogénico o autotrasplante) o RT (craneoespinal si afectación del sistema nervioso central o irradiación corporal total como régimen de acondicionamiento pretrasplante). Ambas incluyen el sistema hipotálamo-hipofisario como campo de irradiación, lo que implica mayor riesgo de anomalías neuroendocrinas, por lo que fueron evaluadas conjuntamente.
Los criterios de inclusión fueron: disponibilidad del historial médico e información completa del tratamiento recibido, haber completado el seguimiento clínico tras el tratamiento, firma de consentimiento informado y aceptación de entrada en el estudio, realización voluntaria de medidas antropométricas y bioimpedanciometría cumpliendo los criterios necesarios para realización de dichos estudios.
COMPOSICIÓN CORPORAL
La composición corporal se evaluó mediante:
-
1. Antropometría:
- Evaluación del peso (kg) y talla (cm), en ropa interior y descalzo mediante la báscula-tallímetro seca 711. Se calcularon asimismo sus Z-scores (12). El IMC se calculó mediante la relación entre el peso (kg) dividido por el cuadrado de la talla (cm) y se clasificó a los pacientes en: normopeso (18,5-24,9 kg/m2), sobrepeso (25-29,9 kg/m2), obesidad (x2265; 30 kg/m2) y bajo peso (< 18 kg/m2) (10). Se estimó el porcentaje de masa grasa según IMC mediante la ecuación de Deurenberg (13).
- Los pliegues cutáneos (bicipital, tricipital, subescapular y suprailiaco) se midieron siguiendo los criterios de Durnin (14) con un plicómetro de Harpenden. Se calculó el porcentaje de masa grasa corporal según la medición de estos cuatro pliegues mediante la ecuación de Siri-específica (15).
- Se evaluaron los perímetros de cintura (PC), cadera y brazo (PB) mediante cinta métrica semirrígida con precisión de 1 mm. El PC se realizó en el punto medio entre el margen costal inferior y la cresta iliaca (16). Se consideró obesidad PC x2265; 102 cm en hombres y x2265; 88 cm en mujeres (17). Se estimó el porcentaje de masa grasa según el PC mediante la ecuación de Lean (18). El PB se tomó en el punto medio entre el acromion y el olecranon con la cinta colocada perpendicularmente al eje longitudinal del húmero, con el brazo relajado a lo largo del cuerpo. Se calcularon los Z-scores del PB según os valores referencia para la edad (19) y se definió como sarcopenia un PB < 2 desviación estándar.
Según los datos obtenidos, se calcularon el ICC, considerando obesidad un ICC > 0,88 en mujeres y > 1 en varones, y el ICT, estableciendo obesidad como un ICT x2265; 0,5 en hombres y mujeres (20).
-
2. Bioimpedanciometría:
- Análisis con el monitor BIA 101 Anniversary (SMT medical, Alemania), que permite la evaluación de la composición corporal global y segmental en base a la conductividad del agua corporal en los diferentes compartimentos. Se obtuvieron la resistencia, la reactancia y el ángulo de fase, así como los valores calculados de masa grasa (MG), el porcentaje de masa grasa (% MG), la masa magra (MM) y el porcentaje de masa magra (%MM). En base a las recomendaciones de Van Italie (21) se obtuvieron los índices de masa grasa (IMG) y masa magra (IMM) ajustando la MG y MM según la talla. Se definió obesidad como % masa grasa x2265; 25 % en varones y x2265; 30 % en mujeres y se clasificó en diferentes grados mediante el índice de masa grasa según valores de la Organización Mundial de la Salud (OMS) (22). Se definió sarcopenia según BIA como un índice masa magra por debajo de los valores ajustados: < 6,58 kg/m2 en hombres y < 4,59 kg/m2en mujeres (23).
- La metodología estandarizada empleada fue: configuración tetrapolar en modo monofrecuencia de 50 Hz, según protocolo estándar de Lukaski (24). Los dos electrodos señal se colocaron en la línea media de muñeca y tobillo y los dos electrodos detectores, a 4-5 cm de los electrodos señal en las líneas metacarpofalángicas y metatarsofalángicas respectivamente, siempre homolaterales (hemicuerpo derecho). Las determinaciones se realizaron con el paciente en decúbito supino, sobre una camilla de material no conductor y con una separación entre las extremidades superiores de entre 20 y 30° e inferiores a 45°. Previa realización, los pacientes debían estar en ayunas desde hacía al menos cuatro horas, sin haber realizado ejercicio las 12 horas previas. Todos los sujetos estaban vestidos, a excepción de zapatos y calcetines, sin llevar ningún objeto metálico.
Todas las mediciones se realizaron por un mismo observador por triplicado y se consideró como definitiva la media de las tres lecturas.
ANÁLISIS ESTADÍSTICO
Se realizó un análisis descriptivo para caracterizar la muestra del estudio y evaluar la prevalencia de obesidad según las diferentes técnicas de antropometría y composición corporal. Se evaluó la reproductibilidad de las medidas obtenidas mediante el coeficiente de correlación intraclase a través de un modelo mixto de la variancia de dos factores. Se evaluó el grado de acuerdo entre las medidas antropométricas y de composición corporal como variables categóricas mediante el índice kappa. Se consideró grado de concordancia según el índice kappa: 0.2-0.4 débil; 0.41-0.6 moderado; 0.61-0.8 alto; y > 0.81 muy alto. En cuanto a las medidas cuantitativas de evaluación de la masa grasa (IMC, sumatorio de pliegues, perímetro cintura y BIA), se compararon con el análisis de la varianza (ANOVA) de un factor así como sus comparaciones múltiples post-hoc mediante análisis de Bonferroni. Se analizaron asimismo los coeficientes de correlación de Pearson para datos paramétricos para evaluar el grado de asociación entre ellas y los diagramas de Bland-Altman para establecer el grado de acuerdo entre los métodos de análisis de la composición corporal. Por último, se llevaron a cabo correlaciones bivariantes para evaluar los factores de riesgo asociados al desarrollo de obesidad (según los diferentes métodos de evaluación). Para evaluar la clasificación de la obesidad mediante la estimación del porcentaje de masa grasa por IMC respecto a los otros métodos de evaluación se calcularon la sensibilidad y especificidad de IMC respecto a cada una de ellas. Se define sensibilidad como la proporción de sujetos obesos adecuadamente clasificados mediante IMC y especificidad, como la proporción de no obesos adecuadamente clasificados como no obesos. El análisis estadístico se efectuó con el paquete estadístico SPSS versión 21.0. El límite mínimo de significación estadística aceptado en el cálculo estadístico fue del 95 % (p < 0,05).
RESULTADOS
MUESTRA
La edad media al diagnóstico fue de 5,7 ± 2,3 años (1,03-16,7), con una edad media en el momento del estudio de 23,3 ± 4,1 años (18,4-35,1) y un tiempo medio de seguimiento de 17,6 ± 4,6 (10,3-27,6). Las características de la cohorte se muestran en la tabla I.
PREVALENCIA Y CLASIFICACIÓN DE LA OBESIDAD
De acuerdo con la antropometría (Tabla II), la media de la cohorte a estudio se encontraría en sobrepeso según el IMC tanto en hombres como en mujeres. La prevalencia de obesidad (según IMC) fue del 23,07 % (9/39) y resultó mayor en mujeres que en hombres (28,5 %,6/21 vs. 16,6 %, 3/18; p > 0,05).
Tabla II. Datos antropométricos de la cohorte

IMC: índice de masa corporal; ICC: índice de cadera-cintura; ICT: índice de cadera-talla; DE: desviación estándar.
Si analizamos la distribución grasa, el 30,7 % es obeso según el ICC. El ICC medio en el sexo femenino se sitúa en rango de obesidad, que es tres veces más prevalente en mujeres que en hombres (33,3 % vs. 11,1 %, p < 0,05). El ICT clasificó como obesos al 35,8 % (14/39) de los supervivientes, con un ICT medio dentro del rango de obesidad (0,54 ± 0,07) y sin diferencias en cuanto al sexo.
En relación a la composición corporal, la distribución de la obesidad se muestra en la tabla III. Se pueden observar las diferencias en cuanto a la clasificación de la obesidad según la antropometría y la composición corporal (Tabla IV). Según el IMG, el 41 % de los supervivientes (el 42,8 % [9/21] de las mujeres y el 38,8 % [7/18] de los hombres son obesos, frente al 23,07 % (28,5 % [6/21] de mujeres y el 16,6 % [3/18] de hombres) según la clasificación por IMC (p < 0,05).
CONCORDANCIA ENTRE MÉTODOS DE EVALUACIÓN DE OBESIDAD Y ADIPOSIDAD
El grado de acuerdo en la estimación de la obesidad según el IMC con el resto de medidas antropométricas fue: alto con el PC (kappa 0,685; p = 0,000) e ICC (kappa 0,607, p = 0,000) y moderado con ICT (kappa 0,523; p = 0,001).
En relación a la composición corporal, se hallaron diferencias significativas entre la adiposidad estimada mediante el porcentaje de masa grasa por IMC respecto a la evaluación mediante perímetro cintura, BIA y pliegues (p < 0,05), a pesar de existir adecuadas correlaciones entre los diferentes métodos de evaluación ajustadas por sexo (Fig. 1). La concordancia entre los diferentes métodos de evaluación se muestra en la figura 2. Se observa que el IMC infraestima el grado de adiposidad en relación a la evaluación mediante el perímetro cintura, sumatorio de pliegues y BIA, siendo esta diferencia mayor a mayor obesidad de la cohorte (% masa grasa > 28 %). Mientras que si evaluamos la estimación del porcentaje de masa grasa entre el sumatorio de pliegues y la BIA, observamos cómo existe una leve sobrestimación del grado de adiposidad de ambos respecto a la evaluación mediante el perímetro cintura. El CCI de las sucesivas mediciones por BIA fue del 0,728 (IC 95 %: 0,309-0,791, p < 0,05) y 0,812 (IC 95 %: 0,357-0,898, p < 0,05) en los pliegues.
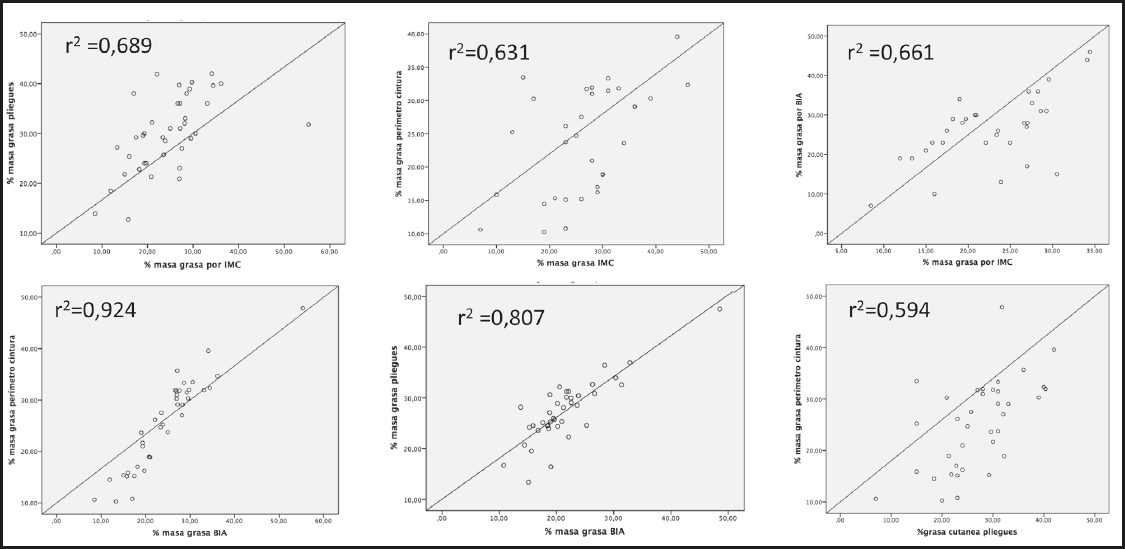
Figura 1. Correlación entre el porcentaje de masa grasa obtenida por los diferentes métodos (IMC, PC, sumatorio pliegues y BIA) de evaluación de la composición corporal (IMC: índice de masa corporal; PC: perímetro cintura; BIA: bioimpedanciometría).

Figura 2. Concordancia en el cálculo del porcentaje de masa grasa entre los diferentes métodos de evaluación de la composición corporal (IMC: índice masa corporal; PC: perímetro cintura; BIA: bioimpedanciometría).
La sensibilidad y especificidad del %MM estimado por IMC respecto al resto de las técnicas de evaluación de la composición corporal fue: 77,8 % de sensibilidad y 95,2 % de especificidad respecto al PC, 65 % y 89,4 % respecto sumatorio de pliegues y 63,6 % y 94,1 % respecto a la BIA.
SARCOPENIA Y OBESIDAD SARCOPÉNICA
Los valores medios de masa magra indexada según BIA de la cohorte fueron de 8,82 ± 4,26 (4,1-29), sin diferencia entre hombres y mujeres (9,97 ± 4,63 vs. 7,64 ± 3,9, p > 0,05).
El perímetro braquial medio fue de 28,51 ± 4,05 cm (19-41 cm), con Z-scores medios de 0,5 ± 1,3 (-3-5,1). Tres pacientes mostraron sarcopenia evaluada mediante BIA, de los cuales solo uno era obeso (varón). Según el perímetro braquial solo un paciente obtuvo valores < -2 DS, sin presentar obesidad. La correlación entre IMM y PB según el sexo fue del 0,57 (p = 0,047). El IMC no se correlacionó con la estimación de la composición muscular obtenida por BIA (r = 0,112, p > 0,05).
FACTORES DE RIESGO
Los factores de riesgo asociados al desarrollo de obesidad según los diferentes métodos de evaluación se muestran en la tabla V. El % grasa medio (pliegues) en pacientes que recibieron RT frente a los que no la recibieron fue del 29,1 ± 5,6 % vs. 25,1 ± 9,8 % (p < 0,05) y en las LA de AR frente a BR, del 30,2 ± 5,7 % vs. 24,6 ± 8,1 % (p < 0,05).
Tabla V. Factores de riesgo asociados a la presencia de obesidad evaluada mediante las diferentes técnicas de composición corporal

IMC: índice de masa corporal; PC: perímetro de cintura; BIA: bioimpedanciometría; OR: odds ratio; IC: intervalo confianza 95 %; p: nivel de significación estadística (< 0,05).
En relación al tratamiento, las dosis totales acumuladas de prednisona en los pacientes obesos frente a los no obesos fueron según: sumatorio de pliegues (368 ± 104,9 vs. 318,9 ± 92,2 g/m2), ICT (9,8 ± 98,8 vs. 328,8 ± 100,3 g/m2; p > 0,05) y BIA (32.342,4 ± 107,8 vs. 318,6 ± 90,9 g/m2, p > 0,05). Tampoco se halló relación significativa en cuanto a las dosis totales de corticoides con el descenso de la masa magra (IMG) (r = -0,196; p > 0,05).
En cuanto a los factores de riesgo cardiovascular, la adiposidad estimada mediante el PC fue el parámetro que mejor se correlacionó con la elevación de las cifras de LDL colesterol (R = 0,703, p < 0,05) y descenso de HDL colesterol (R = -0,612, p < 0,05) y con el ascenso de la TA (OR 4,17; IC 95 %: 1,012-19,3, p = 0,033), pero no con los niveles de colesterol (R = 0,297, p > 0,05). El único paciente que mostró hiperglucemia por resistencia insulínica presentaba obesidad según todos los métodos de evaluación.
DISCUSIÓN
La obesidad constituye una de las principales comorbilidades en los supervivientes de leucemia aguda infantil (1,2). En estudios previos se demostró cómo estos supervivientes presentan un incremento de la ganancia ponderal desde el diagnóstico, durante la fase de tratamiento y a lo largo del seguimiento (6,25,26) evaluado mediante IMC.
Sin embargo, a pesar de que el IMC es el método más empleado para definir obesidad en la población general, se trata de un índice que analiza el peso respecto a la talla, sin que se pueda evaluar la distribución de la grasa. Este parámetro, en una población como la de los supervivientes de cáncer infantil, que tienen como secuela la talla baja, podría infraestimar su prevalencia. Así, según los resultados obtenidos en el presente estudio, casi un 10 % de los supervivientes de LA son erróneamente clasificados como no obesos según su clasificación por IMC en lugar de su ICC, y hasta el 15 % si tomamos como referencia el ICT. Las prevalencias globales son superiores a la de la población española (17,27) y similares a las descritas en otras cohortes de supervivientes de LAL (17,28). Estas diferencias han sido también descritas por cohortes heterogéneas de supervivientes de cáncer infantil, como la del St. Jude Lifetime Study (29), quienes a pesar de mostrar prevalencias algo superiores a las de nuestra cohorte reflejan gran heterogeneidad según la técnica empleada, con un porcentaje de obesidad del 44 % según el IMC, del 62 % según ICT y hasta del 85 % mediante la evaluación por DEXA.
Estas diferencias en cuanto a la clasificación de la obesidad según el parámetro antropométrico empleado se obtuvieron en la misma proporción en la evaluación de la composición corporal. De tal modo que el grado de adiposidad es infraestimado según el IMC respecto al empleo de otros parámetros como el perímetro de cintura, el sumatorio de pliegues o la bioimpedanciometría. Además, estas diferencias son mayores en aquellos pacientes con un % masa grasa mayor al 25-30 %, lo cual indica que el IMC no es capaz de discriminar adecuadamente a aquellos supervivientes con obesidad grado I, en el que se encuentra un porcentaje importante de los sujetos obesos. De esta forma, a pesar de que todos los métodos analizados presentan una buena correlación entre ellos, la sensibilidad del IMC para estimar la adiposidad es menor del 70-80 % respecto al resto de métodos, con una excelente especificidad.
Así, de todos los métodos de evaluación de la composición corporal, fueron el sumatorio de pliegues y la bioimpedanciometría los que obtuvieron un mayor porcentaje de supervivientes obesos, con una excelente correlación ambos. Esta última técnica, además, permitió evaluar tanto la masa grasa como la masa magra, mostrando la escasa prevalencia de sarcopenia en nuestra cohorte a diferencia de lo descrito por otros autores como Marriott y cols. (30), con prevalencias del 43 %. Este hecho puede ser debido a la joven edad media de los supervivientes de nuestro estudio, los cuales se sitúan en la edad adulta precoz, ya que la sarcopenia es una condición de aparición más tardía y generalmente posterior al desarrollo de obesidad. La coexistencia de ambas, denominada como obesidad sarcopénica, fue descrita solo en uno de los supervivientes (30). Su desarrollo duplica la comorbilidad de estos pacientes, por un lado por las limitaciones físicas secundarias al descenso de la masa magra y, por otro lado, asociado al riesgo cardiovascular relacionado con la obesidad (31). En este sentido, el empleo de BIA mostró una mayor sensibilidad que el perímetro del brazo para evaluar la evaluación del descenso de masa magra en esta población (30,32) y pese a que se ha descrito como una técnica de dudosa reproductibilidad por la variabilidad de los resultados obtenidos, según la metodología empleada y las condiciones en el lugar de realización, una rigurosa metodología puede hacer que sea una técnica válida y reproductible para complementar el estudio sobre la composición corporal, como demuestran nuestros resultados.
A pesar de las diferencias en el porcentaje de sujetos obesos según el método de análisis de la composición corporal empleado, se observó mediante todas las técnicas empleadas una mayor frecuencia de adiposidad en el sexo femenino respecto al masculino (33), sin encontrar diferencias en relación a la edad al diagnóstico de la enfermedad, como muestran otros autores como Oeffinger y cols. (2). Al analizar factores de riesgo para el aumento de adiposidad en esta población se demostró que la exposición a radioterapia constituye de forma aislada uno de los principales factores para el desarrollo de obesidad (10,23,34,35), de tal modo que los supervivientes irradiados mostraron un porcentaje de masa grasa significativamente mayor, evaluado mediante todas las técnicas analizadas, y esta diferencia fue mayor en el estudio de la composición corporal mediante pliegues y BIA. Muchos autores describen este hecho en relación a la alteración del eje hipotálamo-hipofisario, la sensibilidad de la leptina y la producción de hormona de crecimiento, lo que sugiere que el efecto del tratamiento se mantiene a largo plazo (34,36,37). Asimismo, los supervivientes con leucemias de alto riesgo y que precisan tratamiento coadyuvante con trasplante de progenitores presentan un mayor riesgo de desarrollar obesidad (1,37) a largo plazo. Sin embargo, a pesar de que los supervivientes con leucemias de mayor riesgo implican protocolos de tratamiento más agresivos y reciben mayores dosis acumuladas de corticoides (prednisona y dexametasona), no se hallaron diferencias significativas entre las dosis totales acumuladas de corticoides en los sujetos con obesidad frente a los no obesos, hecho que difiere a lo publicado por la mayoría de las cohortes de supervivientes de LAL (23,37,38). Esta ausencia de significación puede ser debida a las limitaciones que implica el pequeño tamaño muestral sobre la reducción de la potencia de los resultados obtenidos.
Los factores de riesgo relacionados con el tratamiento se asociaron con la adiposidad global evaluada por los diferentes métodos. Sin embargo, los factores de riesgo cardiovascular se asociaron más a aquellos supervivientes con una distribución de la grasa a nivel central/abdominal, evaluada mediante el perímetro de cintura. De este modo, el porcentaje de masa grasa evaluada por PC obtuvo una mayor asociación con factores de riesgo cardiovascular como el descenso del HDL-c, el incremento del LDL-c y el aumento de la tensión arterial (39).
A pesar de las limitaciones que implica un estudio transversal sobre el desarrollo evolutivo de la obesidad, el presente trabajo muestra implicaciones importantes para los supervivientes del tumor más prevalente en la edad pediátrica. No obstante, resultan necesarios estudios prospectivos que permitan evaluar el desarrollo de obesidad en relación a factores de riesgo modificables como los hábitos de vida y la actividad física, los cuales pueden llegar a ser predictores importantes en el cambio de la composición corporal a largo plazo, así como estudios que incluyan diversos tipos tumorales para obtener resultados extrapolables al conjunto de los supervivientes de cáncer infantil (40).
Hasta la fecha, no existen estudios similares a nivel nacional que analicen las diferentes técnicas de evaluación de la composición corporal accesibles en la práctica clínica para evaluar la obesidad en supervivientes de leucemia aguda infantil y que permitan concluir que el empleo de índices clásicos como el IMC no es el parámetro más preciso para la evaluación de la adiposidad en esta población, ya que infraestima su prevalencia principalmente en los sujetos con obesidad grado I. Además, no aporta información sobre la distribución de la masa grasa ni permite cuantificar la masa magra, cuya evaluación resulta interesante en pacientes con riesgo de presentar sarcopenia, a pesar de la baja prevalencia obtenida en el presente estudio. Por último, cabe recalcar la asociación entre el desarrollo de adiposidad y el tratamiento recibido (radioterapia y trasplante), así como con el alto riesgo tumoral y el sexo femenino en los supervivientes de leucemia aguda infantil. En conclusión, conocer a los pacientes supervivientes de LA con mayor riesgo de padecer obesidad, así como una adecuada evaluación de los mismos, resultan de especial relevancia para establecer estrategias de prevención primaria o secundaria de forma precoz en el seguimiento de estos pacientes, con el fin de mejorar su salud cardiovascular a largo plazo.