INTRODUCCIÓN
Existe una correlación positiva entre la edad y la incidencia de cáncer, alcanzando un pico entre los 75 y 90 años que declina en pacientes de mayor edad 1,2.
En la última Encuesta Nacional de Salud en España (2017), la presencia referida de tumores malignos se situó en 3,71, 3,97 y 4,98% en personas de entre 65 y 74 años, entre 75 y 84 años y con 85 o más años, respectivamente, con una frecuencia mayor en hombres que en mujeres. Esta prevalencia fue superior a la descrita en más jóvenes (entre el 0,04 y el 1,46% por encima de los 14 años) 3. En nuestra experiencia, sobre 1.608 pacientes oncológicos ambulatorios recogidos en el hospital entre 2004 y 2009, un 46% fue mayor de 65 años 4.
La esperanza de vida al nacer en España es una de las más altas del mundo (86,2 años en mujeres y 80,4 años en hombres, con datos de 2016) 5, lo que justifica la necesidad de implementar estrategias de atención especializada en las enfermedades crónicas más prevalentes, como es el caso del cáncer.
Dentro de las actuaciones multidisciplinares en estos pacientes, el tratamiento nutricional juega un papel muy relevante. El cáncer es una de las causas más frecuentes de desnutrición relacionada con la enfermedad (DRE) en presencia de inflamación. Según un consenso reciente publicado bajo el ámbito de la European Society for Clinical Nutrition and Metabolism (ESPEN), esta entidad se define como un estado que resulta de una baja ingesta o de malabsorción de nutrientes y que conduce a una composición corporal alterada (disminución de la masa magra), con pérdida de masa celular, reducción de la función física y mental y un peor pronóstico clínico como consecuencia de la enfermedad 6. Además, el envejecimiento por sí mismo condiciona un estado de inflamación subyacente que, en presencia de inactividad física, precipita la pérdida de masa muscular. El mismo consenso equipara la "DRE crónica con inflamación" a la caquexia y menciona a la caquexia por cáncer como una de las entidades específicas de DRE con inflamación. En la Tabla 1 se muestran la definición y la clasificación de esta situación, según la contemplaron Fearon y cols. en 2011 7. Además, la sarcopenia (pérdida de masa muscular esquelética, de fuerza y de función, progresiva y generalizada, que aumenta el riesgo de eventos adversos) y la fragilidad (estado de vulnerabilidad con reserva limitada en órganos y sistemas) se recogen en el mismo consenso como situaciones relacionadas con la nutrición 6, las dos en conexión de forma bilateral con el envejecimiento y con el hecho de enfermar.
Tabla I. Definición y clasificación de la caquexia en cáncer

Fuente: Fearon y cols. Definition and classification of cancer cachexia: an international consensus. Lancet Oncol 2011;12(5):489-95.
En este capítulo se repasarán los conceptos básicos del abordaje nutricional en el paciente oncológico y se debatirán en relación con el envejecimiento.
CÓMO ESTABLECER EL RIESGOY EL DIAGNÓSTICO DE DESNUTRICIÓN, CAQUEXIA Y SARCOPENIA EN EL PACIENTE MAYOR CON CÁNCER
En las guías de ESPEN sobre el paciente oncológico, no concretamente geriátrico, se recomienda, a modo de cribado de desnutrición, una valoración precoz y periódica de la ingesta, de la evolución ponderal y del índice de masa corporal (IMC) 8. En un documento de expertos reciente también se recomienda tener en cuenta la localización del tumor y el tratamiento realizado, ya que ambos impactan de forma directa en la situación nutricional del paciente 9.
Con este fin se mencionan las siguientes herramientas, sin que exista un consenso claro para posicionarse por alguna de ellas: Nutrition Risk Screening 2002 (NRS-2002), Malnutrition Universal Screening Tool (MUST), Malnutrition Screening Tool (MST) y Mini-Nutritional Assessment Short Form (MNA-SF) 8. Estas herramientas también se recogen en las guías de la Sociedad Española de Oncología Médica (SEOM), que establecen la realización de cribado con un grado de recomendación "fuerte" pero con muy bajo nivel de evidencia 10. Otra prueba de cribado, derivada del MST (Nutriscore), ha mostrado mayor sensibilidad y especificidad que el original en la detección de desnutrición en el paciente oncológico (n = 394; edad media 61,5 años) 11. Incorpora, además de la pérdida involuntaria de peso y de la disminución de la ingesta, la localización del tumor y el tratamiento recibido.
Si el cribado es positivo, se aconseja un estudio objetivo y cuantitativo de la ingesta, de los síntomas que impactan en el estado nutricional, de la masa muscular (estudio de la composición corporal mediante DEXA, TAC en L3 o bioimpedancia), de la función física (WHO/Eastern Cooperative Oncology Group [ECOG], entre 0 y 5 [https://ecog-acrin.org/resources/ecog-performance-status]; índice de Karnofsky entre 0 y 100 [https://www.mdcalc.com/karnofsky-performance-status-scale]; dinamometría o valoración de la marcha) y del grado de inflamación sistémica (proteína C reactiva [PCR], albúmina y modified Glasgow Prognostic Score (mGPS) [https://www.mdcalc.com/modified-glasgow-prognostic-score-mgps-cancer outcomes]). Tradicionalmente, se han utilizado herramientas como la valoración global subjetiva (VGS), la valoración global subjetiva generada por el paciente (VGS-GP) y el MNA, pero de forma individual no recogen todos los subdominios sugeridos más arriba 8,10.
Las guías de la International Society of Geriatric Oncology (SIOG) sobre el manejo nutricional de los mayores con cáncer gastrointestinal recomiendan realizar una valoración del riesgo nutricional en el momento del diagnóstico y continuar más adelante, en función de la situación clínica del paciente. En ellas se mencionan como herramientas de cribado: MST, MUST, MNA-SF y NRS-2002, y si el riesgo es elevado, se sugiere valorar un MNA completo. No obstante, reconocen que no existe un acuerdo de expertos claramente definido en el paciente oncogeriátrico 12.
Recientemente se ha publicado un estudio multicéntrico francés que investiga factores de riesgo de muerte a 100 días en enfermos con cáncer de más de 70 años. La presencia de metástasis, una velocidad de la marcha < 0,8 m/s, la existencia de un tumor distinto al de mama, una puntuación de ECOG > 2 y un valor de MNA < 17 o ≤ 23 sirvieron para crear un score predictivo de muerte y ayudar así en la toma de decisiones terapéuticas. Un valor de 11 en esta puntuación se asoció a un riesgo de morir del 67% 13. Así, el valor del MNA se configura como una herramienta integrada, tanto de valoración nutricional como de predicción de curso clínico, por lo que aportaría más valor en esta situación.
Sin embargo, las herramientas utilizadas para definir la desnutrición han sido muy variadas en otros estudios relevantes. Así, en el estudio NutriCancer, sobre más de 2.000 pacientes, se emplearon los siguientes criterios: pérdida ponderal ≥ 5% en un mes o ≥ 10% en seis meses, IMC ≤ 18,5 kg/m2 en menores de 70 años o ≤ 21 kg/m2 en mayores, y/o hipoalbuminemia < 3,5 g/dl en enfermos de 70 o más años 14.
La nueva propuesta de diagnóstico de desnutrición realizada tras consenso de las más importantes sociedades científicas en nutrición (Global Leadership Initiative on Malnutrition [GLIM]), basada en criterios fenotípicos y etiológicos, pretende convertirse en la herramienta universal de diagnóstico de DRE. Aún ha sido poco explorada y, hasta donde alcanza nuestro conocimiento, en el momento actual solo se ha empleado en un estudio sobre pacientes oncológicos ingresados (n = 282; edad media 60,4 años). Utilizando la fuerza prensora de la mano o el valor de masa libre de grasa corregido por la altura como criterios fenotípicos, la presencia de desnutrición se asoció a un aumento del riesgo de muerte en seis meses tras ajustar por varios factores de confusión 15.
Las guías de ESPEN recomiendan monitorizar y auditar el proceso nutricional. De esta forma, se sugiere necesario cumplir los siguientes indicadores: tanto el cribado de desnutrición como la valoración posterior, así como la estimación de la masa muscular, deberían realizarse en más del 80% de los enfermos. Igualmente, más del 80% de los mismos deberían ser reevaluados en un periodo de tiempo definido 8.
También se han desarrollado herramientas de estadiaje de la caquexia en pacientes con cáncer. Una de ellas (Cachexia Score [CASCO] y mini-CASCO [https://www.ub.edu/cancerresearchgroup/index.php]) tiene en cuenta la pérdida de peso y de masa magra; los estados de inflamación (PCR e IL-6), de alteración metabólica (niveles plasmáticos de albúmina, prealbúmina, lactato, triglicéridos, especies reactivas de oxígeno y urea, anemia y alteración de la tolerancia a la glucosa [HOMA]) y de inmunosupresión (número de linfocitos); la capacidad funcional; la anorexia; y la calidad de vida relacionada con la salud (CVRS). Su puntuación permite clasificar la caquexia como leve 15,16,17,18,19,20,21,22,23,24,25,26,27,28,moderada 29,30,31,32,33,34,35,36,37,38,39,40,41,42,43,44,45,46 o grave 47,48,49,50,51,52,53,54,55,56,57,58,59,60,61,62,63,64,65,66,67,68,69,70,71,72,73,74,75,76,77,78,79,80,81,82,83,84,85,86,87,88,89,90,91,92,93,94,95,96,97,98,99,100) (16. La herramienta Cachexia Staging Score (CCS), que tiene en cuenta la pérdida de peso, la existencia de sarcopenia, la puntuación ECOG, la disminución del apetito y las anormalidades bioquímicas, distingue precaquexia, caquexia y caquexia refractaria, así como su relación con el pronóstico clínico 17. Sin embargo, aún se han utilizado poco en la práctica clínica habitual.
Pero en el terreno oncogeriátrico, fragilidad y sarcopenia no pueden dejarse a un lado. La fragilidad se abordará en otro capítulo del monográfico, acompañando a la valoración geriátrica integral (VGI). En cuanto a la sarcopenia, el nuevo consenso europeo (European Working Group on Sarcopenia in Older People [EWGSOP2]) la define como una situación probable si se detecta baja fuerza muscular (se equiparan fuerza prensora de la mano y el test de la silla), presente si se suma una masa muscular disminuida o de baja calidad y grave si se asocia alteración de la función física (velocidad de la marcha, Short Physical Performance Battery [SPPB], timed-up-and-go test o caminata de 400 m). Aunque la valoración de la masa muscular puede realizarse por diferentes técnicas de composición corporal, en el caso concreto del cáncer el consenso propone la medida en L3 mediante tomografía axial computarizada (TAC) en estos pacientes 18. Para el diagnóstico de sarcopenia con esta técnica, en enfermos con cáncer se han definido diferentes puntos de corte de índice de masa muscular esquelética (skeletal muscle index [SMI]: área muscular [cm2]/talla2 [m2]) para hombres y mujeres. Para una lectura detallada de los mismos, se remite al lector a la bibliografía recomendada 19. Algunos de los softwares empleados para este fin son FatSeg, OsiriX, ImageJ y sliceOmatic 20. En el trabajo cotidiano sería admisible comenzar utilizando una herramienta de cribado de sarcopenia como el cuestionario autorreferido SARC-F (strength, assistance with walking, rise from a chair, climb stairs, and falls), cuya versión en lengua española ha sido recientemente validada 21. Otras formas de cribado pueden consultarse en la literatura referenciada 18,22.
EPIDEMIOLOGÍA: DESNUTRICIÓN, CAQUEXIA Y SARCOPENIA EN EL PACIENTE MAYOR CON CÁNCER
La prevalencia de desnutrición en pacientes oncológicos se ha recogido en varios estudios clínicos que no siempre han definido esta frecuencia por grupo de edad. En este apartado se reseñan los que han comparado los datos en mayores con un grupo control joven.
En el estudio observacional francés NutriCancer sobre enfermos agudos y ambulantes (578 pacientes con más de 69 años y 1.517 menores), la prevalencia de desnutrición fue superior en los mayores (44,9 vs. 36,7%). La pérdida ponderal fue mayor en los ancianos y los síntomas que resultaron significativamente más referidos por los enfermos de más edad fueron la anorexia, las náuseas, los vómitos y la astenia 14.
Los enfermos hospitalizados de más de 69 años con cáncer también presentaron riesgo de desnutrición (herramienta NRS-2002) con una frecuencia mayor que los jóvenes con la misma patología en el estudio español Predyces (n = 401). Mientras que las prevalencias globales al ingreso y al alta fueron de 33,9 y 36,4%, respectivamente, en los mayores estas cifras alcanzaron el 38,3 y el 50% 23. También en un trabajo multicéntrico brasileño, sobre más de 4.000 pacientes ingresados, la prevalencia de desnutrición estimada mediante la VGS-GP fue del 55% en mayores de 64 años, superior a la descrita entre los 51-64 y los 20-50 años (45,5% y 36,1% en cada caso). Los síntomas que más impactaron en la situación de desnutrición en los mayores fueron la anorexia y la xerostomía 24.
Nuestro grupo describió una probabilidad dos veces mayor de desnutrición en pacientes ambulantes con cáncer de 65 o más años tras ajustar por género, localización del tumor, tratamiento previo con quimioterapia, estadio tumoral y diagnóstico de diabetes mellitus. La prevalencia de desnutrición moderada y grave (VGS-GP) fue del 38,9 y 23,8% en mayores y del 28,4 y 16,4% en jóvenes. En los primeros, la pérdida estimada de masa grasa y masa muscular esquelética fue mayor, así como la presencia de edema. La ingesta de energía y nutrientes fue más baja. Los síntomas que más refirieron los mayores con respecto a los jóvenes fueron la falta de apetito, el dolor y la saciedad precoz. Más enfermos por encima de 64 años refirieron depresión y problemas dentales 4.
Sin embargo, en un estudio multicéntrico francés con más de 2.000 pacientes oncológicos agudos y ambulantes valorados, la edad, referida como variable continua, no se asoció con la presencia de desnutrición 25.
En cuanto a la caquexia asociada a cáncer, pocos estudios la han definido en población oncogeriátrica. En un trabajo sobre 100 pacientes de más de 65 años (en su mayoría tumores del tracto gastrointestinal y cáncer de pulmón), la caquexia se detectó en el 65% de los pacientes 26.
Con respecto a la sarcopenia, cada vez más trabajos se centran en este ítem para describir asociaciones entre estado del paciente y pronóstico tras diversas intervenciones desde una perspectiva observacional. Los estudios se han centrado en la descripción de frecuencias en cohortes de mayores, sin claras comparaciones con jóvenes y con estrategias diagnósticas distintas. Así, se ha observado una prevalencia de sarcopenia de: 12,5-57,7% tras gastrectomía por cáncer 27,28, 80,7 y 83,6% antes y durante el tratamiento con quimioterapia en tumores gastrointestinales 29, 18,5% precirugía por cáncer de pulmón 30, 48,2% en cáncer de cabeza y cuello 31, 38,5% en cáncer rectal avanzado en tratamiento quimioterápico (32) y 24,3% antes de cirugía colorrectal por cáncer 33.
DESNUTRICIÓN, CAQUEXIA Y SARCOPENIA EN EL PACIENTE MAYOR CON CÁNCER. FISIOPATOLOGÍA Y PRONÓSTICO CLÍNICO
Varios son los procesos que llevan al paciente mayor con cáncer al desarrollo de desnutrición, sarcopenia y/o caquexia. Estos pueden resumirse en: factores derivados del propio tumor, efectos relacionados con el tratamiento antineoplásico y presencia de síndromes geriátricos que impactan en el estado nutricional del paciente (fragilidad, demencia y depresión, entre otros) 34. En la Figura 1 se muestran, de forma genérica, los factores implicados en el síndrome caquexia-anorexia asociado al cáncer. También se han descrito factores asociados al paciente (hábitos personales, factores psicológicos), al equipo sanitario (escaso conocimiento y entrenamiento para detectar la desnutrición, retraso en iniciar nutrición enteral [NE] o nutrición parenteral [NP] en situaciones adecuadas) y a las autoridades sanitarias (ausencia de planificación de recursos humanos, deficiencia de dietistas en los organigramas de los hospitales) 9.

Figura 1. Fisiopatología del síndrome de caquexia-anorexia asociado al cáncer. Modificado de Suzuki H y cols. (Cancer cachexia-pathophysiology and management. J Gastroenterol 2013;48:574-94) y de Zhang X y cols. (Malnutrition in older adults with cancer. Curr Oncol Rep 2019;21(9):80) (FoxO: forkhead box protein O (factor de transcripción que regula de forma negativa la adipogénesis); NF-kβ: nuclear factor- kβ factor de transcripción que regula genes relacionados con proliferación celular y tumorogénesis); Akt: V-akt murine thymoma viral oncogene homolog; mTOR: mammalian target of rapamycin).
La existencia de tumor condiciona cambios metabólicos relevantes que conducen a la pérdida de la masa muscular. En el músculo, la degradación proteica da lugar a aminoácidos (Ala y Gln) que se utilizarán en la ruta neoglucogénica en el hígado y en la síntesis proteica y de DNA dentro del tumor. Se activará la vía lipolítica en el tejido adiposo, liberando ácidos grasos libres que serán oxidados en el tumor o bien servirán como sustrato para la síntesis de membranas celulares. La glucosa circulante será metabolizada por las células tumorales hacia la producción de lactato, vía de menor eficiencia energética. Desde un punto de vista molecular, la interacción de mediadores inflamatorios (como citoquinas y miostatina) y de factores derivados del tumor (factor inductor de la proteólisis [PIF]) con su receptor activan vías que condicionan pérdida de masa muscular (apoptosis, autofagia y degradación proteica y aumento de proteínas desacopladoras [UCP] dentro de la mitocondria). La disminución de los niveles circulantes de IGF-1 limita la vía del m-TOR en la síntesis proteica. A la alteración metabólica (aumento de la proteólisis, disminución de la síntesis proteica, alteración del transporte de aminoácidos y preferencia por la oxidación de aminoácidos de cadena ramificada) se suma el efecto de mediadores inflamatorios que inducen la apoptosis de los miocitos. Además, la regeneración de masa muscular activa se deteriora 35. En la línea de la alteración metabólica, se ha descrito una disminución de la cetogénesis hepática inducida por el tumor. La respuesta compensadora posterior, con elevación de los niveles de glucocorticoides circulantes, además de disminuir la respuesta a la inmunoterapia podría condicionar mayor pérdida muscular 36.
La edad, en cualquier caso, también es un factor que contribuye a potenciar la pérdida de tejido muscular. Así, en TAC prospectivos tras cirugía colorrectal electiva, ha podido observarse que el índice de masa muscular esquelética lumbar evoluciona negativamente en cirugías abiertas (vs. laparoscópicas), en estadios tumorales III-IV, en mujeres, con valores de la American Society of Anesthesiologists (ASA) más altos, en presencia de respuesta inflamatoria sistémica y en mayores de 65 años 37.
Pero los fármacos antitumorales también tienen un impacto sobre el desarrollo de desnutrición y sarcopenia. Una descripción pormenorizada de dichos efectos, por grupos terapéuticos, excede los objetivos de este capítulo, pero pueden consultarse en la bibliografía recomendada 38,39. Además, debe tenerse en cuenta que los efectos con las nuevas terapias biológicas han sido aún poco estudiados. Los datos recogidos de ensayos clínicos son muy escasos porque estos pacientes generalmente se encuentran infrarrepresentados (protocolos que limitan la edad, restricciones impuestas por los propios investigadores ante pacientes más frágiles con mayor probabilidad de efectos adversos, etc.). En algunos ensayos se ha descrito una frecuencia similar de eventos no deseables en jóvenes y en mayores 40, pero la tolerancia a dicha toxicidad puede ser menor en los últimos, ya que esta desencadena una cascada de acontecimientos enlazados no deseables que limitan en mayor medida al anciano 41. Algunos eventos con repercusión nutricional descritos con más frecuencia en mayores son diarrea tras tratamiento con Folfiri 42, perforación gastrointestinal con bevacizumab 43, vómitos con cetuximab 44, anorexia con sunitinib 45, efectos gastrointestinales con sorafenib 46 y diarrea con everolimus 47. Menos ensayos han descrito cambios en la composición corporal tras las intervenciones. En uno de ellos, el tratamiento con sorafenib se asoció al desarrollo de sarcopenia 48. Los efectos de la radioterapia (RT) y del tratamiento sistémico se describen en otros capítulos de este monográfico en mayor profundidad.
En cuanto al valor pronóstico de los diagnósticos de desnutrición, sarcopenia y/o caquexia en los mayores, una revisión sistemática reciente sobre más de 4.000 ancianos con cáncer ha descrito que la desnutrición se asocia con un aumento del riesgo de mortalidad por todas las causas 49, así como con interrupción precoz del tratamiento con quimioterapia en otra revisión sistemática en mayores de 65 años que recibían este tratamiento 50. Asimismo, un valor bajo de MNA se ha asociado a toxicidad no hematológica en pacientes ancianos que inician quimioterapia 51. También en mayores, la presencia de sarcopenia se ha asociado a menor supervivencia 27 y a complicaciones posquirúrgicas tras gastrectomía por cáncer 28, a peor pronóstico quirúrgico en cáncer de pulmón 30, a mortalidad en cáncer de cabeza y cuello 31 y en cáncer rectal avanzado con tratamiento quimioterápico antes y después de la cirugía 32 y a la aparición de delirio durante el postoperatorio de cirugía colorrectal por cáncer 33. De forma global, y previsiblemente también extrapolable a los mayores con cáncer, la sarcopenia se ha relacionado con toxicidad limitante de dosis 52, con astenia 53 y con costes sanitarios 54 derivados, por ejemplo, de la toxicidad. En un estudio sobre población oncogeriátrica, la presencia de caquexia se asoció a disminución de la capacidad funcional y a menor supervivencia 26.
Puede consultarse información adicional en el capítulo de este monográfico dedicado al tratamiento sistémico de los pacientes oncológicos.
TRATAMIENTO NUTRICIONAL Y MULTIMODAL DEL MAYOR CON CÁNCER
Las guías más recientes establecen que los objetivos del tratamiento nutricional en cáncer, de forma general, se centran en el tratamiento de la desnutrición, el mantenimiento o la mejora de la masa muscular y el abordaje de las anomalías metabólicas que enturbian la recuperación y la supervivencia de estos pacientes 8,9,10. Estos objetivos pueden ser también adecuados para población anciana con cáncer.
En un sentido práctico, este abordaje puede llevarse a cabo desde una estrategia multimodal: consejo dietético y tratamiento médico nutricional cuando sea preciso; ejercicio físico; control de los órganos y sistemas que impactan en la situación nutricional del paciente; y tratamiento antiinflamatorio, orexígeno, modulador de la disfunción endocrina y regulador del gasto energético. Las últimas propuestas se encuentran, en gran medida, en fase de investigación.
En la Tabla 2 se resumen las recomendaciones sobre tratamiento vertidas en guías y documentos de expertos recientes 8,9,10,55,56,57,58,58). Solo en dos de ellas se abordan aspectos específicos del paciente oncogeriátrico 12,55. De momento, es prudente ceñirse a las recomendaciones presentadas en dichas guías, a la espera de evidencias firmes en mayores con cáncer. Como se verá más adelante, la discusión sobre tratamiento nutricional se ha abordado tanto desde la perspectiva de las vías de acceso como desde la de la fórmula más adecuada a emplear.
Tabla II. Guías y consensos de expertos: resumen de las recomendaciones sobre tratamiento nutricional en pacientes con cáncer








aa: aminoácidos; AINE: antiinflamatorios no esteroideos; ASCO: American Society of Clinical Oncology; CVRS: calidad de vida relacionada con la salud; ERAS: Enhanced Recovery After Surgery; HMB: hidroxy-metil-butirato; IMC: índice de masa corporal; NE: nutrición enteral; NP: nutrición parenteral; QT: quimioterapia; SEOM: Sociedad Española de Oncología Médica; SIOG: International Society of Geriatric Oncology; SNG: sonda nasogástrica; SO: suplementos orales; RT: radioterapia; SNC: sistema nervioso central.
Se muestran sombreadas las recomendaciones dirigidas de forma específica al paciente mayor con cáncer.
TRATAMIENTO NUTRICIONAL
Globalmente, el proceso de atención nutricional al paciente mayor con cáncer debe seguir las premisas básicas del proceso de atención nutricional general, progresando desde el consejo dietético y la suplementación oral (SO) hasta formas más complejas de tratamiento nutricional como la NE y la NP.
Consejo dietético
Un primer metaanálisis sobre la intervención basada en consejo dietético en pacientes con cáncer (cinco estudios) solo mostró una tendencia hacia una mejoría en la CVRS tras dicho tratamiento 59. Un metaanálisis posterior (13 estudios; n = 1.414) sí describió mejoría en algunos de los dominios de CVRS tras el consejo dietético, sin repercusión sobre mortalidad 60.
En el anciano con cáncer pocos estudios han abordado este asunto. En un ensayo aleatorizado sobre mayores en tratamiento quimioterápico, el consejo dietético sirvió para mejorar la ingesta dietética, sin repercusión sobre mortalidad o toxicidad asociada a la quimioterapia. La SO se empleó en menos del 30% de los pacientes en los dos grupos de tratamiento (convencional y consejo dietético) 61.
Suplementación oral
Los ensayos clínicos realizados sobre SO solo en pacientes mayores son pocos y, generalmente acotados por tipo de tumor o por modo de terapia.
Una revisión sistemática y metaanálisis sobre pacientes con cáncer en tratamiento con quimioterapia (QT)/RT, donde solo en cuatro estudios (de los once incluidos) la edad media/mediana superaba los 65 años, observó un efecto positivo sobre el peso corporal tras la intervención con consejo dietético y SO, pero asociado al consumo de fórmulas hiperproteicas enriquecidas con ácidos grasos omega-3. Los autores reconocieron la heterogeneidad de los estudios y la falta de poder estadístico para detectar diferencias en mortalidad o en toxicidad asociadas al tratamiento. Finalmente, incluyeron un listado de recomendaciones para el futuro diseño de ensayos clínicos de calidad 62.
A continuación, se detallan los datos de los estudios en los que es posible vislumbrar si existe un efecto diferencial, o no, en función de la edad y los de aquellos en los que la edad media o mediana de los pacientes incluidos supera los 65 años. Sin tratarse de una revisión sistemática, puede entreverse que los estudios son heterogéneos y no estrictamente dirigidos a población oncogeriátrica.
En un estudio sobre pacientes en el preoperatorio de cáncer de colon (n = 101; edad media: 68,9 en el grupo control y 70,5 en el de intervención; mediana de duración de tratamiento: ocho días), con pérdida de peso en los 3-6 meses previos, el empleo de SO (500 kcal, 24 g de proteínas, sin omega 3) se asoció a menor incidencia de infecciones en el postoperatorio (solo análisis ajustado) y a menor pérdida ponderal antes y después de la intervención. No se hallaron diferencias en la fuerza prensora de la mano, en la puntuación de la VGS-GP ni en las medidas de composición corporal valoradas mediante bioimpedancia, salvo en el índice de masa libre de grasa en el preoperatorio (mayor disminución en el grupo de intervención) 63. Sin embargo, en una revisión sistemática sobre el mismo tópico (seis estudios incluidos, cuatro con edad media por encima de los 64 años), el empleo de SO preoperatoria no fue eficaz para reducir la incidencia de complicaciones, si bien los trabajos resultaron muy heterogéneos y con una calidad moderada 64. En uno de ellos, cuando se realizó análisis de subgrupos, pudo observarse que, en los pacientes con pérdida ponderal antes de la cirugía, la intervención con SO redujo de forma significativa la infección de la herida quirúrgica utilizando una de las definiciones para este diagnóstico 65.
Otro trabajo con 120 pacientes (edad mediana superior a los 68 años) mostró que el empleo de una solución hidrocarbonada (400 ml) dos horas antes de la cirugía por cáncer de colon, junto con SO (1,5 kcal/ml) desde la cirugía hasta el alta, se asoció a mejoría de la sensibilidad a la insulina, de la función pulmonar y de la fuerza prensora de la mano. Además, las complicaciones clínicas fueron menos que cuando no se pautó ningún tipo de tratamiento. No se describieron diferencias en el retorno a una función intestinal normal ni en la estancia media hospitalaria 66.
En 358 pacientes con una edad mediana de 66 años que recibían QT paliativa por cáncer gastrointestinal, cáncer de pulmón no de células pequeñas o mesotelioma (un año de seguimiento), ni el consejo dietético por sí solo ni la SO acompañada o no de aquel se asociaron a diferencias en el peso corporal, en la CVRS o en la supervivencia entre grupos. Al comienzo de la intervención todos los pacientes habían perdido peso en los tres meses previos 67.
En varios ensayos aleatorizados se ha estudiado la eficacia de SO enriquecida con ácidos grasos omega-3 y otros inmunonutrientes.
En un ensayo realizado sobre 159 pacientes con cáncer de cabeza y cuello pendientes de iniciar RT, el grupo de intervención fue tratado con SO (500 kcal, 23 g de proteínas, 1,9 g de omega-3 diarios) y consejo dietético (frente a solo consejo dietético) durante tres meses (59 y 45,7% en grupo de intervención y control, respectivamente, con más de 64 años). En el grupo con SO la pérdida ponderal fue menor, incluso tras ajustar por la edad de los participantes. También se observó una mejoría estadísticamente significativa en la CVRS y en la ingesta calórica-proteica, con una tendencia al aumento de la fuerza muscular medida con dinamometría de mano. No pudo demostrarse un efecto sobre ángulo de fase. Además, los pacientes en el grupo aleatorizado a SO requirieron disminuir la dosis o suspender la RT con menos frecuencia. Como crítica, la inclusión en el estudio no se ciñó a criterios de desnutrición 68.
En un trabajo con 148 enfermos remitidos para cirugía electiva por cáncer de colon (edad media: 71 años), aleatorizados a un SO enriquecido con eicosapentaenoico (EPA) y docosahexaenoico (DHA) o a un SO estándar con una cantidad equivalente de nitrógeno durante siete días antes y después de la cirugía, no se observaron diferencias en complicaciones postoperatorias, estancia media, ingreso en la unidad de intensivos o reingreso en función del SO empleado, aunque la cantidad de estos ácidos grasos aumentó en las membranas de los granulocitos 69.
En otro estudio realizado durante el perioperatorio de gastrectomía total por cáncer gástrico (edad mediana 65 años en ambos brazos de tratamiento; n = 123), la SO con una fórmula enriquecida con 2,2 g de EPA durante siete días antes y 21 días después del postoperatorio, no se asoció a menor pérdida ponderal tras la cirugía cuando se comparó con una dieta estándar sin SO. Tampoco a disminución de complicaciones tras la cirugía, ni a cambio en los parámetros de inflamación. Debe decirse que los enfermos fueron incluidos en el estudio independientemente de su situación nutricional (70). En un subanálisis posterior los investigadores tampoco pudieron demostrar una diferencia estadística en el cambio de masa libre de grasa hasta tres meses después de la cirugía 71.
Una intervención basada en SO enriquecida con EPA en pacientes con cáncer colorrectal avanzado en tratamiento con QT (edad media 68,2 años; n = 13), se asoció a mayor aumento ponderal y a mejoría en algunos dominios de la CVRS cuando se comparó con la ausencia de SO. Los autores refirieron una menor frecuencia de interrupción del tratamiento por toxicidad, aunque sin diferencias estadísticas 72.
En cáncer de páncreas irresecable (n = 200; edad media 67 y 68 años en grupos de intervención y control) la SO enriquecida con 2,2 g de EPA y antioxidantes (620 kcal; 32 g de proteínas) durante ocho semanas fue efectiva para aumentar el peso corporal y la masa libre de grasa, sin diferencias estadísticas con el grupo control (SO isocalórico e isoproteico). Puesto que el cumplimiento de la toma de SO no fue correcto, se analizó la correlación entre la cantidad consumida de ambos SO y dichos eventos. Aquella solo fue significativa para aumento de peso y de masa libre de grasa en el grupo experimental. El incremento ponderal se asoció a mejoría de la CVRS solo en el grupo que consumía EPA 73. En un subanálisis del mismo estudio, el cumplimiento (consumo de al menos 1,5 envases de SO), independientemente del tipo de SO empleada, se relacionó con aumento de la ingesta de proteínas y calorías y del peso corporal, y con una mejoría no significativa de la CVRS. No pudieron describirse diferencias en la cantidad de masa libre de grasa entre cumplidores y no cumplidores 74. También en pacientes con cáncer de páncreas avanzado y una edad media de 68 años (n = 24), la toma de SO enriquecida con EPA se asoció, después de ocho semanas, a aumento del gasto energético total a expensas de una elevación de la actividad física, que no se observó en los pacientes sometidos a SO no enriquecida 75.
En una cohorte con cáncer gastrointestinal (n = 128; edad mediana: 71 años) analizada de forma retrospectiva, los pacientes que recibieron nutrición suplementada con aceite de pescado mejoraron las cifras de PCR y aumentaron la masa libre de grasa y la masa muscular esquelética con respecto a sus cifras basales. Dicho tratamiento no se asoció a cambios en la tolerancia a la QT, pero sí a la supervivencia en enfermos con mGPS de 1-2 tras ajustar por género, edad, tipo de tumor gastrointestinal y estadio tumoral 76.
En el perioperatorio de cistectomía radical por urotelioma vesical (cuatro semanas antes y después de la cirugía) se aleatorizó a los pacientes a dos grupos de tratamiento: SO enriquecida con omega-3 e hidroximetilbutirato (HMB) y complejo multivitamínico/multimineral (n = 61; edad mediana: 68 años). La toma de SO se asoció a menor pérdida ponderal de forma significativa y a menor número de complicaciones y de reingresos, en este caso, sin diferencias estadísticas. La estancia media fue similar entre grupos. La prevalencia de sarcopenia, valorada mediante TAC, aumentó en el grupo con multivitamínicos y no se modificó en el brazo de intervención 77. En el mismo tipo de pacientes, el empleo de una fórmula con inmunonutrientes (Arg, nucleótidos y omega-3) cinco días antes y después de la cirugía, frente a SO convencional (n = 60; edad media: 69,6 y 68,1 años en grupo de intervención y de control), se asoció a unos niveles más bajos de IL-6, sin diferencias en el cambio de la masa muscular apendicular. Solo un 27,6% de la muestra estaba desnutrida al inicio del tratamiento 78.
Nutrición enteral
De nuevo, pocos estudios se han centrado de forma específica en el paciente mayor con cáncer. En España, en el último registro de NE domiciliaria (2016-2017), un 17,6% tenía tumores de cabeza y cuello y un 7,2%, cáncer esofagogástrico, pero no se detalla la edad media de estos pacientes (la de la cohorte completa fue de 65 años para los varones y de 73 años para las mujeres) 79.
En pacientes candidatos a cirugía de tracto digestivo superior (n = 79; edad mediana: 69 y 67 años en grupo control y de intervención), con un cribado de desnutrición positivo, el mantenimiento de NE en domicilio mediante yeyunostomía al menos durante dos meses tras las cirugía se asoció, después de seis meses de seguimiento, a mantenimiento ponderal (con pérdida en el grupo control), a mayor ingesta de energía y a una tendencia a mayor probabilidad de completar la QT tal y como se había planeado al inicio. La CVRS no empeoró con la NE, pero tampoco se observaron diferencias en otros parámetros como fuerza prensora de la mano 80.
Un ensayo clínico valoró la eficacia de una NE enriquecida en DHA y EPA perioperatoria (siete días antes y siete después de la cirugía) en sujetos con cáncer esofagogástrico, comparada con NE estándar en el mismo periodo o con SO solo durante el postoperatorio (n = 195; edad mediana: 67, 60 y 66 años en cada grupo). No se observaron diferencias en mortalidad, morbilidad o estancia media entre grupos. Tampoco pudieron demostrarse diferencias en la expresión de HLA-DR en monocitos o en linfocitos T activados 81.
Nutrición parenteral
Las guías sobre nutrición clínica e hidratación en ancianos, auspiciadas por ESPEN, establecen de forma general que aquellos mayores con un pronóstico razonable en los que se espera un beneficio clínico deben recibir NP si la ingesta oral o enteral se prevé imposible durante más de tres días, o si se espera un consumo menor de la mitad de los requerimientos de energía durante más de una semana, con el fin de mantener o mejorar el estado nutricional 82.
En nuestro medio, el diagnóstico más frecuente de NP domiciliaria es el cáncer en tratamiento paliativo, que supuso un 25,6% de los sujetos recogidos en el registro nacional en 2017 (n = 308), una indicación que ha aumentado en frecuencia con respecto a años previos. Sumando estos pacientes a aquellos con tratamiento activo y a los que presentan enteritis rádica, el total de NP domiciliarias asociadas a cáncer alcanza el 44,4% de los adultos registrados, si bien la edad mediana de toda la muestra es de 52,5 años 83.
En cáncer se han publicado pocos estudios randomizados, pero algunos son prometedores. Un ensayo clínico sobre 304 pacientes con cáncer avanzado (la mayor parte gastrointestinales) los aleatorizó a recibir tratamiento nutricional, especializado o no, una vez que ya estaban recibiendo terapia antiinflamatoria con indometacina, y eritropoyetina y hierro en función de la presencia de anemia y del estado férrico (edad media: 68 años en ambos grupos de tratamiento). La intervención nutricional progresó desde el consejo dietético al empleo de SO (450-600 kcal/día) y, finalmente, NP nocturna a través de catéter central de inserción periférica (PICC) si la ingesta disminuía por debajo del 70-80% de sus requerimientos (50% de los enfermos en el grupo de intervención; 20-25 kcal/kg/día; 0,10-0,15 g de N/kg/día; 12-18 horas de infusión). Esta se mantuvo hasta la situación de terminalidad o hasta que fue suspendida por motivos médicos. En ningún caso se empleó NE por sonda. En el análisis por intención de tratar se observó una mejoría en el balance energético de los pacientes tratados, sin otras diferencias estadísticas. Cuando se eliminaron los pacientes del grupo control que habían recibido de forma no intencionada tratamiento nutricional, la intervención se asoció a supervivencia más prolongada, mejoría en el balance energético, aumento de la masa grasa y a una capacidad de ejercicio máximo más alta 84.
En otro estudio sobre 47 pacientes con cáncer avanzado (edad mediana: 66,9 años), aleatorizados a recibir tratamiento nutricional basado en las mejores prácticas sin NP, o consejo dietético con NP complementaria durante 24 semanas, el empleo de NP se asoció de forma significativa a un aumento de la masa libre de grasa, con diferencias entre grupos tras 12 semanas de intervención, y a una mejoría de la CVRS. No se observaron diferencias en la fuerza prensora de la mano ni en la supervivencia 85.
Para una lectura más detallada sobre este tópico, se remite al lector a la bibliografía referenciada 9,86.
EJERCICIO FÍSICO
El ejercicio físico mejora la capacidad funcional y el pronóstico en pacientes con cáncer. Algunos de los mecanismos implicados tienen relación con cambios en la composición corporal, niveles de hormonas sexuales, disminución de la inflamación sistémica y mejoría de la función inmune. Por este motivo muchos autores se refieren a él no como una propuesta preventiva, sino terapéutica 87. Se recomienda que los mayores con cáncer sean supervisados para prevenir la aparición de lesiones por el ejercicio o caídas 88.
En pacientes mayores deben comentarse los resultados del estudio CAPADOGE sobre 301 pacientes de más de 70 años en tratamiento curativo por linfoma o carcinoma (cirugía, QT o RT). Una intervención con consejo personalizado sobre ejercicio físico (llamadas telefónicas quincenales y mensuales durante 12 meses), frente a recomendaciones escritas en el momento de la valoración, sin seguimiento exhaustivo, no se asoció a cambios en la funcionalidad medida por SPPB, ni en la velocidad de la marcha, la actividad física o la fluencia verbal. La frecuencia de caídas, de hospitalización e institucionalización o muerte fue similar entre grupos. Tras dos años de seguimiento, el análisis de subgrupos mostró un mayor declinar en la puntuación del SPPB en cáncer de mama y en sujetos normononutridos asignados al grupo control 89.
Puede consultarse información complementaria en los capítulos dedicados al tratamiento antineoplásico sistémico y a la VGI en este mismo monográfico.
TRATAMIENTO FARMACOLÓGICO
El objetivo final del tratamiento farmacológico es evitar o revertir los fenómenos asociados al desarrollo de caquexia.
Desde un punto de vista académico, pueden distinguirse fármacos destinados a control sintomático (analgésicos, antieméticos, antidiarreicos, procinéticos, antidepresivos); moduladores de la acción de citoquinas TNF-α (factor de necrosis tisular alfa), IL-1 (interleucina-1), IL-6 (interleucina-6) e IFN- (interferón-gamma) (etanercept, infliximab, tocilizumab, ruxolitinib, talidomida, xilonix, etc.); moduladores del apetito (acetato de megestrol, ghrelina y agonistas del receptor de ghrelina [anamorelina, macimorelina], cannabinoides); y otros (formoterol [agonista adrenérgico β-2], eritropoyetina, inhibidores del enzima convertidor de angiotensina [IECA], bloqueantes del receptor de la angiotensina II, betabloqueantes [espindolol, propranolol], inhibidores de COX-2 [etodolac], moduladores selectivos no esteroideos del receptor de andrógenos [enobosarm], inhibidores de la miostatina, inhibidores del sistema ubiquitin-proteasoma en músculo, sensibilizadores de la acción de la insulina [metformina] y estatinas).
Salvo aquellos destinados a control de síntomas y el acetato de megestrol, los fármacos mencionados se encuentran en fase de investigación y requieren más datos antes de ser recomendados en la práctica clínica habitual. Una revisión exhaustiva de todos ellos excede los objetivos de este capítulo, por lo que se remite al lector a la bibliografía recomendada 90,91. Una hipotética integración en el tratamiento multimodal se muestra en la Figura 2.
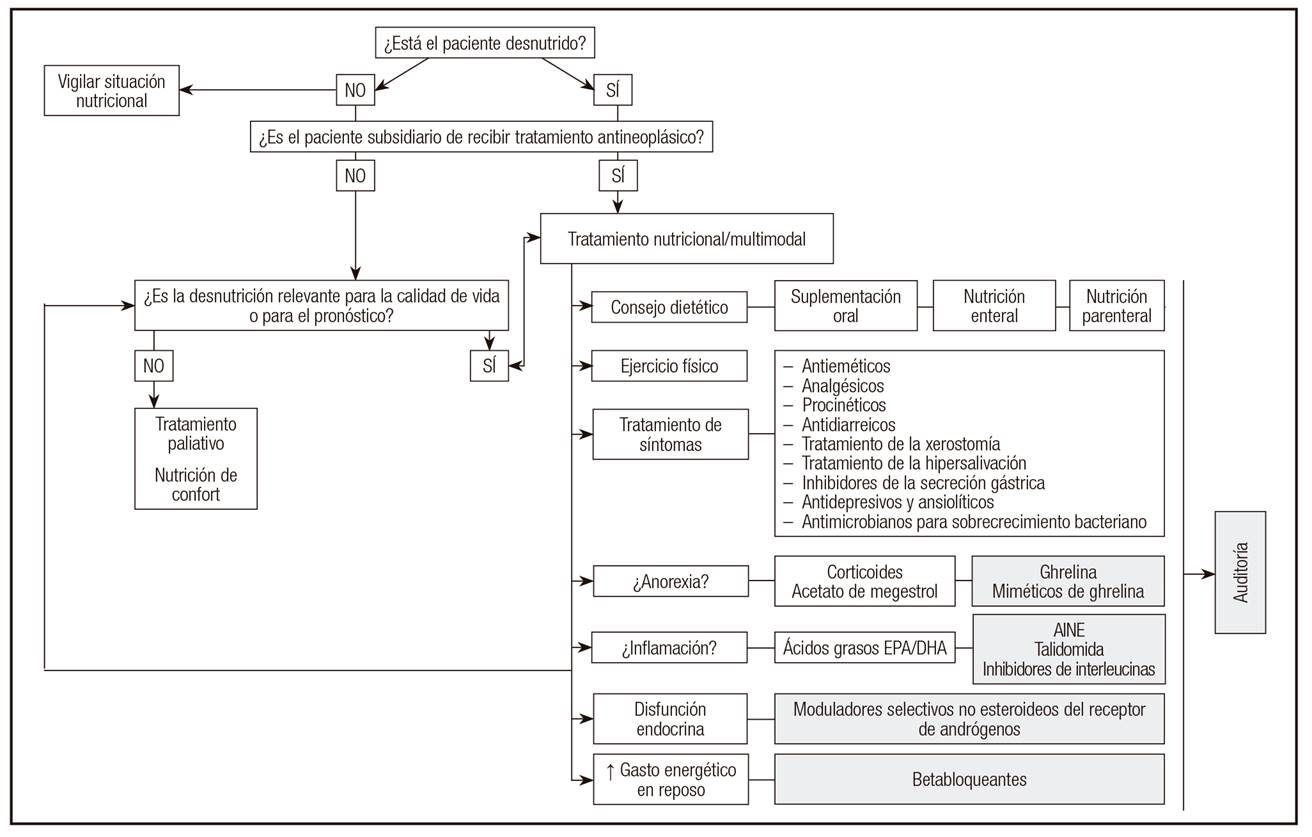
Figura 2. Algoritmo de tratamiento nutricional/multimodal en mayores con cáncer. Modificado de Mislang y cols. (Nutritional management of older adults with gastrointestinal cancers: An International Society of Geriatric Oncology (SIOG) review paper. J Geriatr Oncol 2018;9(4):382-92) y de Del Fabbro E (asco.org/edbook - 2015 ASCO educational book. Disponible en: https://media4.asco.org/156/edbook/pdfs/EdBookAM201535e229.pdf; último acceso el 11 de octubre de 2019) (AINE: antiinflamatorios no esteroideos; EPA: ácido eicosapentaenoico; DHA: ácido docosahexaenoico. En color gris se describen las estrategias aún no reconocidas como práctica clínica habitual).
AVANCES EN EL CONOCIMIENTO DEL MICROBIOMA
Actualmente, como en otras áreas de la medicina, el estudio de la microbiota ha alcanzado relevancia en el cáncer. Esta puede influir en la respuesta al tratamiento o en la tolerancia al mismo, así que se están estudiando estrategias de manipulación que contribuyan al tratamiento de precisión en estos pacientes 92, para valorar más adelante en qué medida este tratamiento podría condicionar la evolución clínica de los mayores con cáncer.
UNA APROXIMACIÓNAL TRATAMIENTO MULTIMODAL
El concepto de tratamiento multimodal fue propuesto por vez primera por Fearon y cols. con especial énfasis en el tratamiento nutricional especializado, la disminución de la inflamación y el estrés hipermetabólico y el aumento de la actividad física 93.
Las evidencias de calidad en pacientes mayores son también escasas. En un ensayo clínico en enfermos con cáncer gastrointestinal (edad media: 68 y 69 años en ambos grupos de tratamiento; n = 137), un tratamiento combinado con intervención nutricional especializada (consejo dietético, con o sin SO, alcanzando la NE en dos pacientes) y rehabilitación, frente a seguimiento convencional, se asoció tras 24 meses a mayor ganancia ponderal (sobre todo en los pacientes que habían perdido peso antes de la intervención), a puntuaciones más altas en CVRS global y en ítems de astenia, con una tendencia hacia menor mortalidad 94.
Puede considerarse una forma particular de tratamiento multimodal la prehabilitación quirúrgica cuando combina tratamiento nutricional y ejercicio físico. Se ha publicado una revisión sistemática sobre prehabilitación en mayores (60 o más años) que iban a ser sometidos a cirugía electiva de cáncer colorrectal 95. En dos de los estudios incluidos la intervención consistió en tratamiento nutricional (1,2 g de proteínas/día; SO una hora después de la sesión de ejercicio físico), entrenamiento domiciliario (tres sesiones a la semana) y estrategias para reducir la ansiedad. No se observaron diferencias ni en la estancia media, ni en las complicaciones posquirúrgicas, pero sí una mejoría en la prueba de la marcha de seis minutos ocho semanas después de la cirugía en el grupo de intervención. El desarrollo de esta prueba empeoró en el grupo control. No pudieron describirse diferencias en la CVRS 96,97.
Pendientes de valoración están los resultados que se obtengan del ensayo clínico NEXTAC-TWO, que valora, en mayores de 69 años con cáncer de pulmón y de páncreas recién diagnosticado, la eficacia de una intervención basada en consejo dietético, suplementación oral con aminoácidos ramificados y un programa de ejercicio físico sobre supervivencia libre de discapacidad 98. De momento, los autores han publicado datos preliminares sobre 30 pacientes, los cuales muestran que dicha intervención es posible y segura, con una alta tasa de adherencia entre los enfermos incluidos 99,100.
HIDRATACIÓN EN EL MAYOR CON CÁNCER
Debe prestarse especial atención a la hidratación de los mayores con cáncer. Además del riesgo de deshidratación e hipovolemia relacionado con el envejecimiento (disminución de la sensación de sed, aumento de la saciedad, elevación de la eliminación renal de líquidos e incremento de la evaporación corporal de agua [menor sensibilidad de los termorreceptores]), se asocian otros factores que pueden aparecer en el curso clínico del cáncer o del tratamiento oncológico (fiebre, náuseas, vómitos, mucositis, diarrea, presencia de ostomías y obstrucción intestinal, hiperglucemia e hipercalcemia).
Además, la disfagia orofaríngea, tanto por la edad de los pacientes como por el tratamiento quirúrgico o radioterápico, o por la localización del tumor, aumenta su prevalencia en este contexto. Debe cribarse su riesgo, valorarse adecuadamente e instaurar el tratamiento adecuado en cada caso (modificaciones en la textura de la dieta y empleo de espesantes si es preciso) 101.
CÁNCER AVANZADO SIN TRATAMIENTO ANTINEOPLÁSICO. CONSIDERACIONES ÉTICAS
En las guías de ESPEN dedicadas a aspectos éticos, se explica que la nutrición "artificial" ya es parte del tratamiento paliativo en pacientes con cáncer y potencialmente puede aumentar la supervivencia y la calidad de vida en enfermos seleccionados. Con este fin deben considerarse programas a largo plazo con NE y con NP 102.
Al final de la vida no hay evidencia concluyente sobre el beneficio de la hidratación. En una revisión sistemática se recogieron pocos estudios sobre este tópico, generalmente de baja calidad. Los autores no pudieron realizar recomendaciones definitivas, aunque no se observaron beneficios clínicos en los trabajos analizados 103. Otra revisión posterior ha constatado las mismas conclusiones 104.
SUPERVIVIENTESTRAS LA CURACIÓN DEL CÁNCER
Las guías sobre nutrición y ejercicio para personas supervivientes recomiendan: evitar la obesidad, mantener la actividad física (actividades habituales de la vida diaria, 155 min/semana de ejercicio físico incluyendo ejercicios de fuerza, al menos dos veces a la semana) y consumir alimentos saludables, sobre todo de fuentes vegetales (limitar la cantidad de carne roja y procesada, tomar dos raciones y media [o más] de verduras y fruta cada día, elegir cereales no refinados) 88.
RECURSOS ON-LINEY ENLACES DE INTERÉS PARA PACIENTES
Como material útil para manejar en la práctica diaria, se ofrecen una serie de recursos que pueden compartirse con enfermos y familiares con el fin de facilitar su autocuidado:
- Recomendaciones básicas para pacientes en relación a la toxicidad por quimioterapia. Información útil para los pacientes y sus familiares: http://www.gepac.es/multimedia/gepac2016/pdf/GU%C3%8DA_TOXICIDAD_QUIMIOTERAPIA.pdf
- Todo lo que empieza cuando "termina" el cáncer: http://gepac.es/multimedia/gepac2016/pdf/Todo-lo-que-empieza-cuando-termina-el-c%C3%A1ncer.pdf
- Nutrición y tumores neuroendocrinos: https://fundacionmasqueideas.org/portfolio/nutricion-y-tumores-neuroendocrinos/
- Consejos de alimentación: antes, durante y después del tratamiento del cáncer: https://www.cancer.gov/espanol/cancer/sobrellevar/consejos-de-alimentacion.pdf
- Guía de ejercicio físico y nutrición para pacientes con cáncer de mama localizado y avanzado (SEOM): https://seom.org/es/informacion-sobre-el-cancer/publicaciones/105202-guia-de-ejercicio-fisico-y-nutricion-para-pacientes-con-cancer-de-mama-localizado-y-avanzado
- Recomendaciones generales sobre la alimentación durante el tratamiento del cáncer: http://ico.gencat.cat/web/.content/minisite/ico/ciutadans/documents/arxius/Guia-1.-REcomendaciones-Generales_CAST.pdf
- Aula virtual de la SEEN para pacientes y cuidadores: https://www.seen.es/portal/inicio.aspx (desnutrición relacionada con la enfermedad, disfagia, nutrición enteral domiciliaria y nutrición parenteral domiciliaria).
CONCLUSIONES
La incidencia de cáncer aumenta a medida que avanza la edad. Una atención personalizada, considerando las características propias del paciente mayor, cada vez cobra más interés en un intento de optimizar el tratamiento antineoplásico y mejorar el resultado clínico. Dentro de la VGI, el estudio de la situación nutricional se ha recomendado por los consensos de expertos. Aunque no existe un acuerdo firme en la herramienta a emplear, la más utilizada en este campo ha sido el MNA. También se recomienda monitorizar masa y fuerza muscular, así como la posible aparición de caquexia. Las causas que conducen a estos procesos, así como su fisiopatología, dependen del propio tumor, del tratamiento antineoplásico empleado y de la edad de los enfermos. Las guías y recomendaciones de expertos insisten en un tratamiento precoz de la desnutrición, en un proceso que no difiere en líneas generales del proceso nutricional global (consejo dietético-SO-NE-NP), pero con matices diferenciales en función de la situación clínica (cirugía, QT, RT, tratamiento paliativo) y de la localización del tumor, sin olvidar el tratamiento de los síntomas que impactan en la capacidad para alimentarse. Cada vez hay más evidencias que apoyan un tratamiento multimodal (nutrición, ejercicio físico, tratamiento antiinflamatorio y orexígeno entre otros), pero la mayoría de las ayudas farmacológicas aún se encuentran en fase experimental. No debe descuidarse la atención a la hidratación y a la posibilidad de disfagia asociada en estos enfermos, sin olvidar que el cuidado nutricional debe prolongarse una vez el cáncer ha sido superado. Sin embargo, falta cuerpo de evidencia en mayores con cáncer, por lo que se requieren más estudios, bien diseñados, centrados únicamente en esta población y que distingan, posiblemente, entre estrategias para el paciente frágil y el que no lo es.














