INTRODUCCIÓN
La obesidad es una enfermedad crónica caracterizada por un almacenamiento excesivo de tejido adiposo en el organismo que se acompaña de alteraciones metabólicas que predisponen a la presentación de trastornos que deterioran el estado de salud (1). Se estima que es responsable del 1 al 3 % del total de los gastos de atención médica en la mayoría de los países (2), generando importantes costes al sistema de salud (directos e indirectos) debido a su complejidad y tratamiento (3).
En la mujer madura, particularmente en el periodo alrededor de la menopausia denominado perimenopausia, los cambios hormonales que implica el descenso de la concentración circulante de estrógenos traen como consecuencia un incremento de la adiposidad, principalmente de tipo central (4,5).
También durante esta etapa el metabolismo en la mujer se transforma, generando cambios físicos, psicológicos y sociales a través de alteraciones vasomotoras, genitourinarias, psicosexuales, metabólicas y de los sistemas nervioso central y cardiovascular (6,7), además de modificaciones en el mecanismo que regula los procesos oxidativos del organismo, cuyo desequilibrio se denomina estrés oxidativo (EO). El EO es propiciado por la producción excesiva de especies oxidantes, que provoca daño oxidativo en las biomoléculas y que no puede ser contrarrestado por los sistemas antioxidantes (8). Diversos estudios han relacionado la disminución del nivel de estrógenos durante la perimenopausia con cambios en el comportamiento oxidante/antioxidante de la mujer (9). A este respecto, nuestro grupo de investigación reportó que la menopausia es un factor de riesgo de estrés oxidativo (10), reforzando esta posible relación.
Por otro lado, se ha señalado que la obesidad es un factor prooxidante que aumenta el EO en los sujetos obesos (11); de ahí que, si durante la perimenopausia comienza el incremento del EO y la grasa corporal, es factible que la mujer con sobrepeso que esté en este proceso tenga un EO elevado, aunque significativamente menor que el de las mujeres premenopáusicas.
Las medidas antropométricas, como el índice de masa corporal (IMC), el índice cintura-cadera (ICC) y, más recientemente, el índice cintura-talla (ICT), señalan de forma indirecta el contenido de grasa abdominal, lo que permite obtener resultados que dan una idea de cómo repercute el contenido graso visceral sobre diferentes parámetros metabólicos y cardiovasculares (3). Sin embargo, la relación entre la adiposidad central y el EO no está bien caracterizada, encontrándose estudios que muestran fuertes asociaciones con las medidas de adiposidad central (11,12) mientras que en otros no existe evidencia de esta relación (13). Una posible razón de esta controversia es que no se ha establecido cuál de las medidas antropométricas es la más apropiada para describir la asociación de la obesidad y el EO (14).
Por tal motivo, el objetivo de este trabajo fue evaluar la asociación entre la obesidad central y el EO en mujeres premenopáusicas en comparación con mujeres posmenopáusicas utilizando diferentes indicadores para medir la adiposidad.
MATERIAL Y MÉTODOS
DISEÑO Y PARTICIPANTES
Este fue un estudio transversal en una muestra por conveniencia que incluyó 492 mujeres perimenopáusicas (40-60 años) de la zona oriental de la Ciudad de México, a las que se invitó a participar en el proyecto Menopausia y Estrés Oxidativo por medio de volantes que contenían la información de los objetivos del estudio y los criterios de inclusión. El reclutamiento se llevó a cabo de marzo de 2016 a marzo de 2018, obteniéndose una muestra basal de 565 mujeres de las que 71 fueron excluidas por diferentes razones (Fig. 1).
Las participantes incluidas se dividieron en dos grupos: a) 237 premenopáusicas (con sangrado menstrual, niveles de estradiol 25 pg/mL y FSH < 50 mU/mL); b) 255 posmenopáusicas con al menos 12 meses sin sangrado menstrual y/o niveles de estradiol ≤ 25 pg/mL y FSH ≥ 50 mU/mL, con un promedio de 3,0 ± 2,1 años de posmenopausia. Todas las mujeres firmaron el consentimiento informado y carecían de enfermedades cardiovasculares, renales, hepáticas y oncológicas conforme a la valoración médica. Tampoco habían recibido previamente terapia hormonal con estrógenos, ni habían tomado suplementos antioxidantes o fármacos en los últimos 6 meses previos a su ingreso en el estudio. El protocolo de investigación fue aprobado por el Comité de Ética de la Facultad de Estudios Superiores Zaragoza (FESZ/DEPI/CI/004/17).
ESTADO DE SALUD
El estado de salud fue evaluado por un médico ginecólogo a través del interrogatorio y la exploración, asentando los datos en el expediente clínico abreviado orientado por problemas, además de la biometría hemática, la medición de la glucosa, el perfil de lípidos y la presión arterial. Los resultados se interpretaron de acuerdo con los valores de referencia obtenidos para la población mexicana (15). Los niveles de estradiol se determinaron por radioinmunoensayo (Siemens, Pensilvania, EE. UU.) y los de FSH por quimioluminiscencia (Siemens) para confirmar el estado pre/posmenopáusico. La precisión intraensayo fue del 3,1 % y del 7,4 %, respectivamente, y la sensibilidad analítica para el estradiol fue de 5 pg/mL.
Se obtuvieron muestras sanguíneas por punción venosa entre las 7 y las 9 horas de la mañana, con un ayuno mínimo de 8 h, en tubos al vacío con heparina como anticoagulante y sin anticoagulante. La biometría hemática se realizó con la muestra sanguínea con heparina en un analizador Celly 70 (Chronolab, Ciudad de México, México). Los niveles de glucosa, colesterol total, triglicéridos y colesterol de alta densidad (HDLc) se midieron en el suero separado de las muestras sin anticoagulante mediante un analizador Cobas C111 (Roche Diagnostics, Basilea, Suiza). Los coeficientes de variación intraensayo fueron menores del 5 % en todas las determinaciones.
MEDICIONES ANTROPOMÉTRICAS
El peso se obtuvo con las participantes en ropa interior, en ayunas y después de vaciar la vejiga en una báscula Torino (Tecnológica Mexicana, TLM, México) calibrada antes de cada medición. La estatura se midió con un estadímetro de aluminio graduado en milímetros, para lo cual cada participante fue colocada de pie y con la espalda y la cabeza en contacto con el estadímetro en un plano Frankfurt horizontal. El perímetro de la cintura se midió con una cinta métrica, graduada en 0,5 cm, rodeando la cintura a la altura del ombligo y sin hacer presión sobre la piel; la circunferencia de la cadera, rodeando con la cinta la cadera a la altura de la parte superior de los huesos iliacos, en un plano horizontal a la altura de la máxima protuberancia de los glúteos, sin presión sobre la piel.
Se calculó el índice de masa corporal (IMC) dividiendo el peso (en kilogramos) entre la estatura (en metros y centímetros) al cuadrado; el índice cintura-cadera (ICC), dividiendo ambos perímetros en centímetros, y el índice cintura-talla (ICT), dividiendo el perímetro de la cintura entre la estatura, ambos en centímetros.
MEDICIÓN DEL ESTRÉS OXIDATIVO
En las muestras sanguíneas con heparina se obtuvieron las actividades eritrocitarias de las enzimas superóxido-dismutasa (SOD) y glutatión-peroxidasa (GPx), y en el plasma la capacidad antioxidante total (CPAT) y el nivel de malondialdehído (MDA). Todos los métodos fueron validados por nuestro laboratorio de investigación, con una precisión intraensayo del 3,8 %, 4,6 %, 4,3 % y 6,0 %, respectivamente. La autoxidación de las muestras plasmáticas se previno añadiendo 10 mL de butiril-hidroxitolueno (BHT) 2 mM en etanol al 95 % inmediatamente después de centrifugar.
El nivel de MDA se obtuvo con el método descrito por Jentzsch y cols. (16), midiendo las substancias reactivas de tiobarbitúrico (TBARS). La actividad enzimática de SOD se obtuvo por el método que utiliza xantina y xantina-oxidasa para producir radicales superóxido que reaccionen con clorhidrato de 2-(4-iodofenil)- 3-(4-nitrofenol)-5-feniltetrazolio, produciendo formazán rojo (Randox Laboratories, Ltd., Crumlin Co., RU). La actividad de GPx se midió a través de la oxidación del glutatión con hidróxido de cumeno en presencia de glutatión-reductasa y NADPH; el glutatión oxidado se convierte inmediatamente en la forma reducida, con la subsiguiente oxidación de NADPH a NADP+ (Randox Laboratories, Ltd.). La medición de CPAT se llevó a cabo utilizando la cinética de formación del radical ácido 2,2-azino-bis (3-etilbenztiazolina-6-sulfónico) (ABTS+) (Randox Laboratories Ltd.). Todas las determinaciones se realizaron en un espectrofotómetro UV-visible Shimadzu UV-1601 (Kyoto, Japón). También se obtuvo el nivel de ácido úrico por el método colorimétrico de la uricasa, y el de albúmina por la técnica del verde de bromocresol con un analizador Cobas C111, con coeficientes de variación intraensayo menores al 5 %. Se calculó la razón SOD/GPx como otro marcador más de oxidación (17).
Adicionalmente se aplicó a todas las participantes un cuestionario estructurado sobre factores prooxidantes, considerando como hábitos no adecuados los siguientes: tabaquismo (≥ 2 cigarrillos/d), consumo de alcohol y bebidas con cafeína (≥ 2 copas o tazas/día), y sedentarismo (< 30 min de ejercicio físico/d). Además, las participantes contestaron a la Escala Atenas de Insomnio (EAI, versión en castellano), diseñada y validada para cuantificar la dificultad para dormir, conformada por ocho preguntas cuyo valor de corte es ≥ 8 puntos para considerar la presencia de insomnio (18,19).
ANÁLISIS ESTADÍSTICO
Se calcularon el promedio y la desviación estándar, o la mediana y el rango, para las variables cuantitativas con distribución normal o de libre distribución, respectivamente. Como pruebas de comparación se utilizaron la t de Student para grupos independientes para los datos con distribución normal y la U de Mann-Whitney para los de libre distribución. Las variables categóricas se describieron con frecuencias y porcentajes, y se compararon con la prueba del χ2 de Pearson para muestras independientes. Las participantes se estratificaron de acuerdo con su estado menopáusico y de nutrición considerando el valor de corte establecido por las guías internacionales (20), que señalan un IMC igual o superior a 25,0 kg/m² para esa condición, conformándose 4 subgrupos: 1) premenopáusicas con peso normal; 2) premenopáusicas con sobrepeso/obesidad; 3) posmenopáusicas con peso normal; y 4) posmenopáusicas con sobrepeso/obesidad. Se compararon las medias con la prueba del análisis de la varianza de un solo factor con prueba de Tukey como post hoc, al corroborarse que las variables analizadas tenían distribución normal. También se tomó en cuenta el valor de corte del IMC igual o mayor de 30,0 kg/m2 para la obesidad (20).
Como pruebas de asociación obtuvimos la correlación y la regresión lineal simple entre los índices de nutrición y los marcadores de estrés oxidativo.
Finalmente se calcularon los cuartiles del ICT de las mujeres con peso normal, al ser el índice con la mejor correlación, y las participantes se estratificaron para comparar los marcadores de EO, utilizándose el análisis de la varianza de un solo factor con prueba de Dunnett como post hoc y el primer valor de corte (< 0,54) como control. Un valor de p < 0,05 se consideró estadísticamente significativo. Los datos se analizaron con el paquete estadístico SPSS V. 20,0 (IBM SPSS Statistics, Armonk, NY, EE. UU.).
RESULTADOS
CARACTERÍSTICAS DE LAS PARTICIPANTES
Los grupos de estudio fueron semejantes en cuanto a mediciones bioquímico-hematológicas, tensiones arteriales e índices antropométricos, solo diferentes en edad y niveles de estradiol y FSH (p < 0,05) (Tabla I). Se observó que 70 (31 %) de las mujeres premenopáusicas y 96 (36 %) de las posmenopáusicas tenían obesidad (IMC ≥ 30,00 kg/m2), y que el 50 % de ambos grupos presentaban sobrepeso (IMC = 25,01-29,99 kg/m2). En relación con los factores prooxidantes, la proporción de mujeres posmenopáusicas con insomnio fue mayor que la de mujeres premenopáusicas, del 64 % y el 48 %, respectivamente (p < 0,05). Los demás factores analizados no mostraron ninguna diferencia (Tabla II).
Tabla I. Características bioquímicas y antropométricas de las mujeres premenopáusicas y posmenopáusicas

HDLc: colesterol de alta densidad. Se presenta como media ± desviación estándar.
aMediana (rango).
*Prueba de la t para grupos independientes, p < 0,0001.
†prueba de la U de Mann Whitney, p < 0,0001
ESTRÉS OXIDATIVO, MENOPAUSIA E ÍNDICES ANTROPOMÉTRICOS
El nivel de MDA y el de ácido úrico son más altos en las mujeres con sobrepeso/obesidad, tanto en las pre como las posmenopáusicas. Los demás marcadores de EO no mostraron ninguna diferencia al estratificarse por estado menopáusico y condición de peso (Tabla III).
Tabla III. Marcadores de estrés oxidativo por estado menopáusico y sobrepeso/obesidad
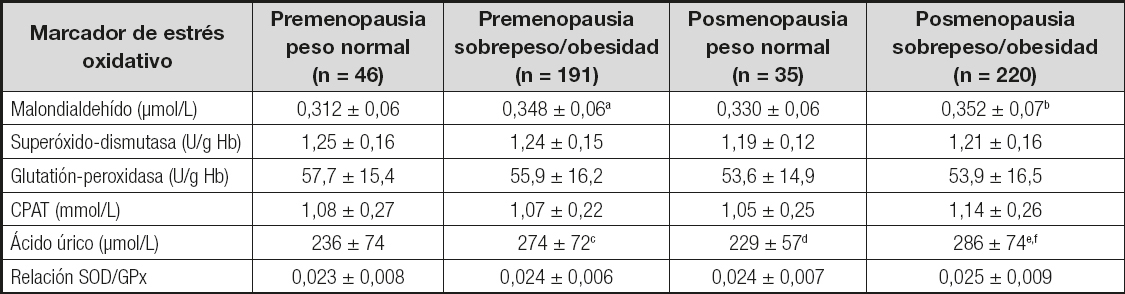
CPAT: capacidad plasmática antioxidante total. Análisis de la varianza de un factor con prueba de Tukey como post hoc.
aPremenopausia con peso normal vs. premenopausia con obesidad, p < 0,01;
bpremenopausia con peso normal vs. posmenopausia con obesidad, p = 0,001;
cpremenopausia con peso normal vs. premenopausia con obesidad, p < 0,01;
dpremenopausia con obesidad vs. posmenopausia con peso normal, p < 0,01;
epremenopausia con peso normal vs. posmenopausia con obesidad, p < 0,0001;
fposmenopausia con peso normal vs. posmenopausia con obesidad, p < 0,0001.
De los tres índices antropométricos, el ICT fue el que mejor correlación tuvo con los marcadores de EO en las mujeres estudiadas, encontrándose asociación con el nivel de MDA (r = 0,298, p < 0,0001), con el de ácido úrico (r = 0,263, p < 0,0001) y con la actividad de GPx (r = -0,148, p < 0,01) (Fig. 2). El IMC solo tiene una correlación positiva con el nivel de ácido úrico (r = 0,325, p < 0,0001) y el ICC no mostró correlación con ningún marcador de EO.

Figura 2. Correlación entre el índice cintura-talla y diferentes marcadores de estrés oxidativo. A. Lipoperóxidos, r = 0,298, r2= 0,089, p < 0,0001. B. Ácido úrico, r = 0,263, r2= 0,069, p < 0,0001. C. Glutatión-peroxidasa (GPx), r = -0,148, r2= 0,022, p = 0,002.
Estratificando por estado menopáusico, el nivel de MDA se asocia estadísticamente con todos los índices antropométricos menos el ICC en las mujeres posmenopáusicas. De los marcadores antioxidantes, el nivel de ácido úrico tiene una buena correlación con el IMC y el ICT en ambos grupos estudiados, y la actividad de GPx tiene una leve asociación con el ICT y el ICC, independientemente del estado menopáusico (Tabla IV).
ÍNDICE CINTURA-TALLA Y ESTRÉS OXIDATIVO
Al estratificar por cuartiles de ICT se observó que el nivel de MDA es más alto en los dos últimos valores de corte, indistintamente del estado menopáusico, y que el ácido úrico se incrementa con cada valor de corte, aunque solo es estadísticamente significativo cuando el ICT es > 0,64 en la posmenopausia. La actividad de GPx disminuye a partir de la mediana en ambos grupos, aunque la asociación no es estadísticamente significativa (Tabla V).
Tabla V. Marcadores de estrés oxidativo en los grupos de estudio de acuerdo con el cuartil del índice cintura-talla

Los datos muestran la media ± desviación estándar. Análisis de la varianza de un solo factor con prueba de Dunnett como post hoc usando el grupo < 0,54 como control;
*p < 0,0001
†p < 0,05,
‡p < 0,01. Hb: hemoglobina; CPAT: capacidad plasmática antioxidante total.
DISCUSIÓN
Es reconocido que el depósito de tejido adiposo en la mujer se incrementa durante el período perimenopáusico, probablemente debido a que en esta etapa los ciclos anovulatorios producen una disminución de los niveles de progesterona y estrógenos, provocando un desequilibrio androgénico por efecto suprarrenal; además, hay una disminución de la tasa metabólica, por lo que la utilización de calorías también decae, llevando a una ganancia de peso (21,22). En este trabajo corroboramos que el sobrepeso/obesidad es un evento altamente frecuente en la transición menopáusica, con depósito de grasa abdominal que se determinó con el ICC y el ICT. Al respecto, se señala que existe un incremento de la lipogénesis visceral debido a una mayor cantidad de receptores de glucocorticoides a causa de la pérdida de la inhibición competitiva con la progesterona, lo que se debe a que esta última hormona ha disminuido (21).
Por otro lado, la obesidad se asocia con elevados niveles de marcadores de daño oxidativo debido posiblemente a alteraciones metabólicas en la mitocondria (23,24) y a otros mecanismos, como la baja defensa antioxidante, la inflamación crónica y la generación postprandial de especies reactivas de oxígeno (25). Así mismo, se sabe que los estrógenos funcionan como moléculas antioxidantes por lo que, al disminuir, la mujer posmenopáusica es propensa a los incrementos del EO (10).
Como se mencionó anteriormente, el EO es el resultado del desequilibrio entre las especies oxidantes y los sistemas de defensa antioxidante, empleándose diferentes marcadores para establecerlo (8). En este trabajo utilizamos como marcadores de oxidación el nivel de MDA y la razón SOD/GPx, y como antioxidantes las enzimas, la capacidad plasmática antioxidante total y el nivel de ácido úrico, observando que los niveles de MDA y ácido úrico se encuentran elevados en las mujeres con sobrepeso/obesidad tanto premenopáusicas como posmenopáusicas. Esto nos indica un incremento de la oxidación de los lípidos con respuesta antioxidante únicamente del ácido úrico, ya que los demás marcadores antioxidantes no muestran ninguna diferencia. A este respecto, es posible que el aumento del ácido úrico represente un mecanismo compensatorio para la prevención o corrección del daño oxidativo (26); además, aparentemente, el estado menopáusico no es un factor determinante para observar EO sino que es posible que el sobrepeso y la obesidad sean los que expliquen su aumento. En este sentido, estudios previos han mostrado incremento de moléculas oxidadas y disminución de antioxidantes, tanto intracelulares como extracelulares, pero en mujeres jóvenes o delgadas (14,27,28), y nuestro interés fue conocer si estos cambios también se observan en las mujeres posmenopáusicas obesas, concordando los resultados parcialmente.
La información sobre el efecto de la distribución de grasa y el EO es inconsistente, muy probablemente por la diferencia que existe entre los índices utilizados para establecer esta distribución. El IMC, la circunferencia de la cintura, el ICC y el ICT son herramientas de mucha utilidad para el diagnóstico del sobrepeso, la obesidad, el síndrome metabólico y los factores de riesgo cardiovascular, pero parece que el mejor índice para establecer estos estados es el ICT (29,30).
En este trabajo, observamos que el ICT y el ICC muestran que la mayoría de las mujeres tienen una acumulación de grasa de tipo central, pero no se relacionan de igual manera con el EO. En este sentido, diversos estudios han demostrado que el ICT valora mejor la acumulación central de la grasa que el aumento global del peso corporal. El ICT pone la circunferencia abdominal en función de la altura de la persona y se encuentra menos afectado por la pérdida de masa muscular durante el envejecimiento (14), por lo que se considera que en la clínica podría ser de utilidad ya que el IMC no permite discriminar esta acumulación de grasa (31). En nuestro estudio, el ICT fue el índice mejor asociado con los niveles de ácido úrico, MDA y actividad de GPx, pudiendo predecir el EO.
Cabe señalar que en diversos estudios se ha reportado que un factor importante para observar el incremento del EO no radica en el aumento de la grasa total sino en la acumulación de grasa abdominal, encontrándose que, a pesar de tener un peso saludable, si hay presencia de grasa abdominal se corre un mayor riesgo de que se incremente el proceso oxidativo (32 33-34), por lo que este efecto prooxidante será más dañino en la posmenopausia que en la premenopausia (32).
La transición de un patrón de distribución grasa ginecoide a uno androide, muy frecuente en las mujeres durante la transición menopáusica, permite que el estado redox se encuentre en situación potencialmente desfavorable, propiciando el daño por EO (34), y como en esta etapa de la vida la acumulación de grasa se da principalmente de forma abdominal, es posible que la obtención del ICT permita evaluar más adecuadamente el EO en las mujeres con obesidad y sobrepeso central, por encima de otros índices como el IMC o el ICC.
Al establecer los valores de corte a través de los cuartiles del ICT encontramos que, por arriba del valor de 0,6, se observa un aumento de la oxidación de los lípidos con una leve respuesta antioxidante del ácido úrico independientemente del estado menopáusico, lo que sugiere que al aumentar la obesidad central se incrementa el EO. Estos resultados son semejantes a los observados utilizando otros marcadores de oxidación de lípidos en mujeres chinas delgadas (14) y el MDA en sujetos con síndrome metabólico (35), y el ICT parece ser el mejor indicador para evaluar esta asociación.
Es importante considerar que este estudio tiene como límite metodológico el diseño transversal; sin embargo, la paridad del tamaño de la muestra en los grupos estudiados y el uso de diferentes índices para evaluar el depósito central adiposo nos permiten sugerir una posible asociación entre la obesidad central, obtenida con el ICT, y el EO en la mujer madura con independencia del estado menopáusico. Este hallazgo no se había reportado anteriormente y deberá corroborarse en estudios longitudinales.

















