INTRODUCCIÓN
El fallo intestinal (FI) se define como una reducción de la función intestinal por debajo del mínimo necesario para la absorción de macronutrientes y/o de agua y electrolitos, de manera que se precise su suplementación intravenosa para mantener la salud y/o el crecimiento adecuados (1). La causa más frecuente de FI crónico es el síndrome de intestino corto (SIC), que ocurre cuando el intestino delgado remanente es inferior a 200 cm de longitud. Aproximadamente el 50 % de los pacientes con SIC presenta FI y requiere tratamiento mantenido con nutrición parenteral y/o fluidoterapia (2).
La teduglutida es un análogo del péptido-2 similar al glucagón (GLP-2) humano aprobado para el tratamiento de pacientes mayores de 1 año de edad con SIC que se encuentren estables tras el periodo de adaptación intestinal posquirúrgico y que reciben nutrición parenteral domiciliaria o fluidoterapia intravenosa. Los resultados de ensayos clínicos en fase III, estudios post hoc y experiencia de vida real, han probado su eficacia, reduciendo volumen y días de administración de nutrición parenteral y fluidoterapia cuando se administra diariamente. Sin embargo, son muy escasas las publicaciones que evalúan los efectos sobre la función intestinal a largo plazo en pacientes respondedores tras la suspensión de la teduglutida.
Se describe el caso de un paciente con SIC tipo I (yeyunostomía terminal) debido a múltiples intervenciones quirúrgicas por enfermedad de Crohn, que recibió tratamiento con liraglutida un año y teduglutida secuencial durante 21 meses. Se analiza su respuesta al tratamiento y su evolución 2 años tras la suspensión del análogo de GLP-2.
CASO CLÍNICO
Varón de 55 años, con hipertensión arterial en tratamiento dietético y enfermedad de Crohn desde 1994, de localización inicial ileocolónica, derivado a consulta en octubre de 2014 para evaluación nutricional. Debido al curso tórpido de su enfermedad, había sido intervenido de una ileocolectomía derecha en 1994, y entre los años 2001 y 2014 había precisado varias resecciones intestinales amplias por complicaciones secundarias a fístulas, abscesos y suboclusiones, la última en mayo de 2014. Tras estas intervenciones, la longitud del intestino delgado remanente, recogida en el informe de la última intervención, era de 130 cm, con una yeyunostomía terminal. Secundaria a su patología intestinal de base había desarrollado una enfermedad renal crónica (ERC) moderada.
Ante la existencia de un FI tipo III (FI crónico que por su gravedad requiere soporte parenteral (SP) durante meses o años) secundario a SIC, comenzó un estrecho seguimiento en nuestras consultas.
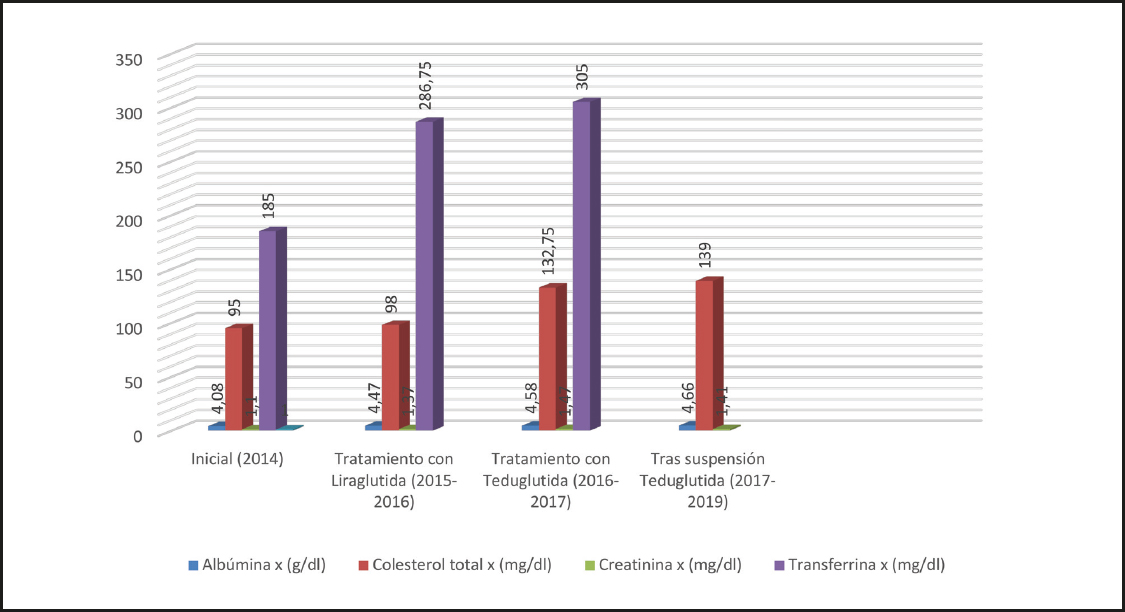
En su primera valoración nutricional, el paciente pesaba 72,1 kg (talla: 173 cm; IMC: 24,1 kg/m2), con leves edemas en piernas. Con entradas diarias de 3500-4000 ml de líquido, mantenía salidas estimadas en torno a 4000 ml y diuresis diaria constante de 450-500 ml. Analíticamente mostraba normoalbuminemia, hipocolesterolemia, transferrina de 185 mg/dl y creatinina 1,10 mg/dl.
Desde octubre de 2014 mantuvo tratamiento con dieta para SIC sin colon, suplementos nutricionales peptídicos, 1 litro de suero fisiológico intravenoso nocturno y tratamiento farmacológico optimizado. Este último incluía antisecretores y antidiarreicos a dosis máximas (esomeprazol, loperamida y codeina), vitaminas y micronutrientes (cobalamina, retinol, tocoferol, calcio, magnesio, colecalciferol y zinc), ajustados por analíticas secuenciales.
Durante el seguimiento se planteó el tratamiento con nutrición parenteral domiciliaria, pero optó por mantener fluidoterapia nocturna. En los primeros meses de control, ingresó varias veces por complicaciones relacionadas con el catéter venoso central (trombosis e infecciones) y episodios de deshidratación con reagudización de su ERC.
Antes de su derivación, se había barajado un tratamiento futuro con teduglutida. Aunque este fármaco estaba aprobado por la FDA (Food and Drug Administration), no se encontraba disponible para su uso en España. Por ello, dada la analogía química parcial, se propuso liraglutida (análogo del péptido similar a glucagón tipo 1) como alternativa terapéutica (3).
En enero de 2015 se inició dicho tratamiento en dosis ascendente hasta 1,8 μg diarios y permaneció con esta terapia durante un año. En este intervalo mantuvo un peso medio de 73,2 kg, con ganancia media de 1 kg. Con liraglutida pudieron reducirse 1 litro las entradas y el débito por yeyunostomía disminuyó de 4000 ml a 2500 ml diarios (Fig. 1), sin cambios en la diuresis. Esto permitió una reducción de la sueroterapia nocturna a 1-1,5 litros semanales. Además, los parámetros nutricionales mejoraron globalmente respecto a la evaluación inicial (Fig. 2).
En enero 2016 se aprobó el tratamiento con teduglutida a través del Programa de Uso Compasivo, a dosis de 0,05 mg/kg/día (3,5 mg/día), mediante administración subcutánea diaria. Desde el primer mes de terapia se alcanzó un peso en torno a 79,4 kg, que se mantuvo estable durante el periodo de tratamiento, con ganancia ponderal media de 6,2 kg, respecto al alcanzado con el tratamiento previo. En relación al balance hídrico, las entradas se redujeron hasta 2000 ml y los débitos por yeyunostomía se estabilizaron en torno a 1800 ml diarios. Globalmente se consiguió una reducción media de 850 ml y 700 ml en las entradas y salidas, respectivamente, adicionales al efecto previo obtenido con liraglutida. Pudo suspenderse la sueroterapia nocturna intermitente sin modificaciones en la diuresis e interrumpir gran parte de la medicación sintomática. Los parámetros analíticos continuaron mejorando con teduglutida.
En junio de 2016, por restricciones en la financiación del fármaco, se cambió la posología a días alternos hasta su suspensión definitiva en octubre de 2017. Desde entonces hasta la actualidad, el paciente ha mantenido un peso en torno a 80 kg, sin cambios en el balance hídrico, en la diuresis ni en la bioquímica, con una gran mejoría en la calidad de vida.
En las figuras 1, 2 y 3 se muestra la evolución de los parámetros antropométricos, nutricionales y el balance hídrico durante las etapas de tratamiento.
DISCUSIÓN
Teduglutida fue aprobado por la FDA en 2012 en base a resultados de ensayos clínicos en fase III (Teduglutide 004 y STEPS). En el estudio STEPS se constató que el 63 % de los pacientes con FI que precisaban SP > 3 veces/semana durante más de 12 meses, tras 24 semanas de tratamiento con teduglutida 0,05 mg/kg/día lograban una reducción significativa (superior al 20 %) del volumen del SP frente al 30 % de los tratados con placebo (4,5). Se comprobó que aquellos pacientes con exposición más duradera a teduglutida presentaban mayores reducciones en SP (6). Estos ensayos se han complementado con estudios de práctica clínica recientemente recopilados (7). El paciente presentado cumplía criterios de FI tipo III por SIC sin colon en continuidad y recibía sueroterapia nocturna diariamente para mantener una hidratación adecuada, lo que le convertía en un candidato idóneo para esta terapia.
No se han logrado identificar las características predictoras de respuesta al tratamiento en cuanto a reducción del volumen de SP con teduglutida, ya que se ha observado beneficio terapéutico en pacientes con diferentes enfermedades de base y anatomía intestinal remanente. Según un subanálisis del STEPS, a las 24 semanas de tratamiento con teduglutida se observaron beneficios en pacientes con SIC, independientemente de la longitud intestinal remanente, así como de la presencia o ausencia de colon en continuidad (4,8).
En estudios post hoc con el mismo objetivo, se ha constatado la correlación entre la reducción absoluta de volumen de SP por efecto de teduglutida y los requerimientos basales de SP. Las reducciones de volumen han sido mayores en aquellos pacientes con más necesidades iniciales (6,9). Asimismo, se analizó la relación entre la reducción de SP y la etiología subyacente de la resección intestinal, y se obtuvieron mayores respuestas en pacientes con enfermedad inflamatoria intestinal que recibieron tratamiento teduglutida frente a otras etiologías (9,10).
En referencia a la anatomía intestinal, las reducciones absolutas del débito intestinal con el fármaco fueron mayores en los portadores de yeyunostomías e ileostomías en comparación tanto con placebo como con los pacientes que tenían > 50 % de colon en continuidad y ausencia de ostomías. Se ha postulado que esta circunstancia pudiera deberse a la mayor respuesta al teduglutida en pacientes con resecciones intestinales que incluyen las células secretoras de GLP-2, como ocurre en pacientes con yeyunostomías o ileostomías (10,11).
Tampoco se han establecido factores predictores para lograr la independencia de SP con el análogo de GLP-2 (4,5). En el ensayo STEPS, una gran variedad de pacientes lograron desligarse del SP con el fármaco, pero el número fue insuficiente para correlacionarlo con algún factor predictivo. El análisis global de ensayos en fase III mostró que los que lo lograban tenían en común la presencia de colon en continuidad o menores requerimientos basales de SP (4,5,8,12). Una revisión reciente concluye que el 12 % de los pacientes alcanzaron independencia completa del SP tras una mediana de 5 años de tratamiento parenteral y 89 semanas con teduglutida (6).
Sobre la evolución tras la suspensión del análogo de GLP-2, un ensayo clínico objetivó un aumento en los requerimientos de volumen de soporte nutricional al mes de la suspensión de un tratamiento de 52 semanas con teduglutida (13). Según Jeppesen y cols. (8), hay evidencia de que, cuando se suspende el tratamiento, algunos pacientes requieren un aumento inmediato en su SP, mientras otros mantienen las reducciones logradas hasta 1 año. A este respecto, los resultados de los estudios post hoc muestran aumento en los requerimientos tras la finalización del tratamiento en la mitad de los pacientes que han respondido al fármaco, con una reducción > 20 % en el volumen de SP. Comparado con los respondedores que mantuvieron o disminuyeron el volumen SP tras acabar la terapia, aquellos que precisaron aumento de SP tenían un intestino delgado remanente más corto y no tenían colon en continuidad, pero ninguna de estas diferencias obtuvo significación estadística (2,12). Aunque los resultados obtenidos tras la interrupción del tratamiento son limitados, se plantea que los efectos del fármaco sean reversibles y que puedan necesitarse indefinidamente (8,12,14,15).
En el caso presentado, con el análogo del GLP-1 se objetivó una drástica reducción en la necesidad de aporte y en el débito por la yeyunostomía. Posteriormente, el análogo del GLP-2 consiguió mayor reducción en el desequilibrio hídrico que permitió suspender la sueroterapia nocturna, con una llamativa ganancia ponderal. Los parámetros nutricionales evolucionaron favorablemente y de forma adicional con ambas terapias. Liraglutida se había iniciado 7 meses tras la última resección intestinal y teduglutida a los 19 meses, por lo que no podemos obviar que la evolución favorable puede estar en parte justificada por el proceso de adaptación intestinal, que puede durar hasta más de 2 años tras la resección intestinal. Una limitación importante para diferenciar estos efectos es la ausencia de biopsias intestinales seriadas, excusable por la situación clínica del paciente.
El tratamiento con análogos de GLP-1 para el tratamiento de FI por SIC ha sido evaluado en diversos estudios (3). Pese a que la evidencia científica obtenida para recomendar su uso es de menor calidad que aquella con teduglutida, es factible que este fármaco se considere una alternativa terapéutica más barata a los análogos de GLP-2 o como un potenciador del efecto demostrado por la teduglutida (16).
La posología recomendada del análogo de GLP-2 es de 0,05 mg/kg/día. En nuestro caso, la indicación fue por uso compasivo, por lo que, cuando finalizó la financiación, se mantuvo el tratamiento durante días alternos antes de su suspensión definitiva tras un breve periodo de tiempo. El fármaco mantuvo su eficacia pese a la posología inadecuada y, tras su cese definitivo, el paciente se ha mantenido clínica y analíticamente estable, en contraste con la evolución habitual descrita en casos similares.
En conclusión, el presente caso evidencia y confirma la eficacia de teduglutida para conseguir reducción en el volumen y/o en los días de infusión de soporte parenteral en el SIC. En consonancia con estudios previos, la espectacular respuesta en la reducción del volumen de SP coincide con altos requerimientos basales debido a la yeyunostomía, y pudiera tener un papel la presencia de enfermedad inflamatoria intestinal como etiología subyacente. Destaca el efecto sostenido superior a dos años tras su finalización en la respuesta a poco más de un año de teduglutida, y el posible papel adyuvante o potenciador del tratamiento previo con liraglutida. Estos aspectos merecen una evaluación de forma sistematizada ante la creciente prevalencia de estos pacientes, cuyo manejo es complejo y requiere abordaje multidisciplinar en centros con experiencia.