INTRODUCCIÓN
En la práctica clínica hospitalaria nos enfrentamos a algunas patologías que tienen origen nutricional, pero son inhabituales. O tenemos "en mente" la posibilidad diagnóstica de estos procesos tratables o el retraso en el diagnóstico empobrecerá el pronóstico. Previamente revisamos algunas enfermedades neurológicas relacionadas con las vitaminas hidrosolubles 1. No obstante, las alteraciones neurológicas relacionadas con vitaminas liposolubles son menos conocidas e igualmente graves.
OBJETIVOS
En esta ocasión nuestro objetivo es exponer las alteraciones neurológicas por desequilibrio de las vitaminas liposolubles, concretamente las vitaminas E (vitE) y A (vitA), y nos apoyaremos en dos casos clínicos ilustrativos.
PRIMER CASO CLÍNICO
Varón de 74 años.
Antecedentes personales:
- Cardiopatía: fibrilo-flutter auricular lenta (portador de marcapasos) e insuficiencia mitral leve-moderada.
Consulta inicialmente por edemas en extremidades. Se realiza un extenso estudio ambulatorio: analíticas con hipoalbuminemia y genética positiva para la enfermedad celiaca, pero anticuerpos negativos, tomografía computarizada (TC) toracoabdominal que descarta la presencia de tumores, entero-TC que no aprecia malabsorción y gastroscopia no concluyente porque el tejido a biopsiar era friable y no se pudieron obtener muestras.
El paciente continúa empeorando, con aumento de edemas e hipotensión, por lo que ingresa en nuestro centro. El deterioro continúa hasta una situación de coma que le lleva a ingresar en Unidad de Cuidados Intensivos (UCI).
Durante el ingreso desarrolló un cuadro de rigidez generalizada con postura y temblor distónicos en miembro superior derecho, que no mejoraban tras administrar levodopa y anticolinérgicos. No era esperable en el contexto de un síndrome malabsortivo severo. Descartamos síndrome de la persona rígida con electromiograma, estatus epiléptico con electroencefalograma (EEG), un TC craneal no mostró alteraciones y pudimos excluir porfiria aguda intermitente, enfermedad de Wilson y de Whipple, hemocromatosis, procesos autoinmunes, oncológicos y síndrome neuroléptico maligno-like.
Los niveles de albúmina, colesterol, vitA y vitE se muestran en la tabla (Tabla 1). Los de ácido fólico y vitamina B12 fueron normales. Durante la evolución, la hipoalbuminemia se corrigió parcialmente. Se nutrió al paciente específicamente con vitaminas liposolubles y se reforzó aún más al no obtenerse niveles normales, que se consiguieron en la última analítica, lo que produjo una mejoría marcada de la rigidez y la distonía del paciente.
Tabla I. Niveles de albúmina, colesterol, vitA y vitE
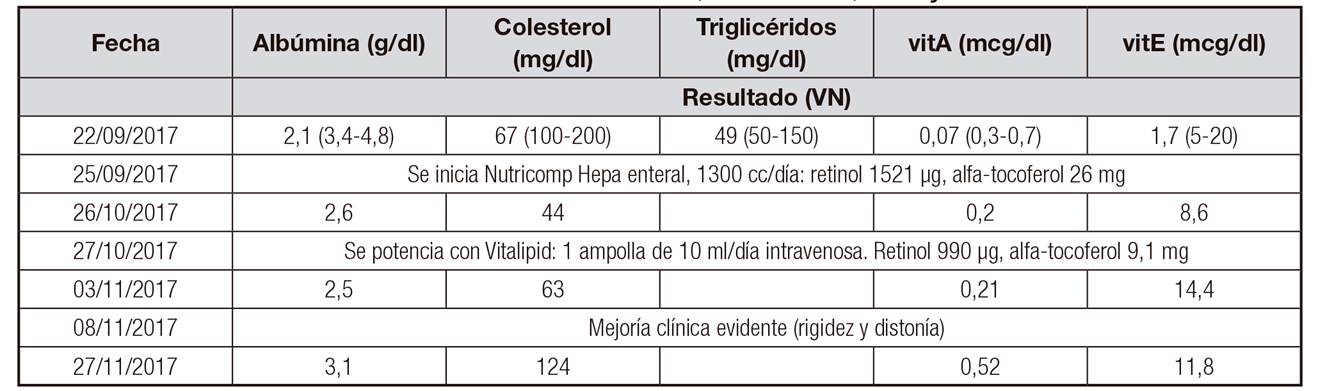
Se muestra una hipovitaminosis tanto E (vitE) como A (vitA) que se resuelven tras el tratamiento nutricional. Se exponen, además, los valores de albúmina, colesterol y triglicéridos, que igualmente se encuentran inferiores a los valores normales (VN).
Los cuidados del paciente no impidieron que este falleciera por fallo multiorgánico.
VITAMINA E
Fuentes
Se obtiene de almendras, aceites vegetales y cereales. La forma bioactiva primaria es el alfa-tocoferol (en aceites de oliva y girasol). Tiene ocho isómeros; el más importante, conocido como la "fuente natural" de vitE, es el RRR-. Los demás son menos activos, pero contribuyen por igual a la toxicidad. Al conjunto de los ocho isómeros se le denomina "all racemic". En la dieta americana es abundante en forma de gamma-tocoferol, en aceites de soja y maíz.
Tanto los isómeros como otras formas naturales se cuantifican en su relación con RRR-alfa-tocoferol 2.
Ingesta recomendada
El aporte es directamente proporcional al de aceite vegetal. La ingesta diaria recomendada (RDA) en población sana para adolescentes y adultos es 15 mg/día de alfa-tocoferol dietario, que equivalen a 22 unidades internacionales (UI) de RRR-alfa-tocoferol o 33 UI de "all-racemic" alfa-tocoferol. Para niños, oscila entre 6 mg (1-3 años) y 15 mg (14-18 años).
Debe realizarse un ajuste al alza en casos de malabsorción, fibrosis quística y trastornos genéticos con carencia de la proteína portadora de la vitE (raros) 2.
Claves de absorción y metabolismo
La biodisponibilidad del alfa-tocoferol depende de la fisiología de digestión y absorción de grasas. Formará parte de los quilomicrones, de los cuales, en el hepatocito, se liberará al torrente sanguíneo preferentemente RRR-alfa-tocoferol, incluido en lipoproteínas de muy baja densidad (VLDL), mediante la proteína transportadora del alfa-tocoferol 3,4.
Mecanismo de acción
El tocoferol protege de la peroxidación a los ácidos grasos poliinsaturados, componente estructural mayor de las membranas celulares, y de este modo las estabiliza 3.
A nivel del sistema nervioso, en estudios en ratas se demostró que era precisa la vitE para manifestar genes relacionados con procesos de mielinización, sinaptogénesis, células gliales y oligodendrocitos 5,6.
Deficiencia
El déficit es raro, incluso en vegetarianos o veganos, a no ser que estemos ante una malnutrición proteica severa. Asimismo, cualquier enfermedad que curse con malabsorción de grasas pondrá al paciente en riesgo de déficit de vitE. El grado de deficiencia será proporcional al tiempo y la magnitud de la esteatorrea. La lista de procesos incluiría los que lleven a déficit de lipasa (procesos pancreáticos), déficit de bilis (colestasis), linfangiectasia intestinal, resecciones gástricas e intestinales extensas y varias alteraciones genéticas infrecuentes, entre las que destacan la ataxia con deficiencia de vitE y la abetalipoproteinemia 7,8.
Medición
Debe hacerse en pacientes con riesgo de déficit (patología digestiva), pero también a pacientes con neuropatía espinocerebelosa o ataxia no explicadas. Ante niveles normales de lípidos séricos y proteínas, el alfa-tocoferol sérico estima bien los niveles de vitE, y se considerarán bajos < 0,5 mg/dl (5 µg/ml o 11,5 µmol/l).
En caso de hiperlipidemia marcada (frecuente en pacientes con colestasis), hay que ajustar con fórmula:
Alfa-tocoferol (mg)/lípidos totales (g)
(Lípidos totales = colesterol + triglicéridos)
Normal > 0,8
En la sangre solamente se encuentra el 1 % del alfa-tocoferol del organismo; es este el que cuantificamos en suero en el laboratorio. Debido a que la medición depende de sus transportadores, en casos de hipoproteinemia se asume que la proteína transportadora está disminuida y no podremos saber si verdaderamente hay déficit 9.
Patología asociada al déficit
En niños y adultos se presentan alteraciones neuromusculares y hemólisis. Las alteraciones neuromusculares son especialmente neuropáticas y miopáticas:
- Neuropatía: síndrome espinocerebeloso, con afectación variable de los nervios periféricos. Incluye ataxia, hiporreflexia, pérdida de sensibilidades propioceptiva y vibratoria.
- Miopatía esquelética.
- Posible reducción de la esperanza de vida de los eritrocitos; anemia hemolítica en prematuros. Y al revés: las anemias hemolíticas congénitas, como la drepanocitosis o talasemia, pueden dar lugar a exceso de estrés oxidativo y déficit de vitE. La ventaja de la suplementación de estos pacientes no está demostrada 10,11.
Tratamiento
Ante un déficit documentado deben pautarse dosis orales prolongadas:
- Lactantes y niños con colestasis: 17-35 mg/kg/día de RRR-alfa-tocoferol (25-50 UI/kg/día).
- En algunos casos pueden ser necesarios 70-130 mg/kg/día (100-200 UI/kg/día) para normalizar los niveles de alfa-tocoferol o la ratio alfa-tocoferol/lípidos totales.
- Puede usarse vitE hidrosoluble (RRR-alfa-tocoferol polietilenglicol-1.000-succinato [TPGS]); para colestasis, 15-25 UI/kg/día 12,13.
En pacientes con malabsorción por colestasis, insuficiencia pancreática o resección intestinal puede no requerirse suplemento. Si hace falta, se suele empezar con 50-500 mg/día (75-800 UI/día). Si la colestasis es severa, puede no haber respuesta incluso a dosis altas. Se puede recurrir a la vía intramuscular, pero no está ampliamente disponible y es poco practicable porque requiere dosis semanales.
Para colestasis e insuficiencia pancreática la suplementación tiene evidencia de grado 1A 12,13,14.
Beneficios potenciales de la suplementación
Degeneración macular asociada a la edad: las vitaminas liposolubles y el zinc parecen retrasar la enfermedad. Dosis: 180 mg/día (400 UI/día) de alfa-tocoferol sintético; esta dosis parece segura. Evidencia débil. No se ha demostrado que las vitaminas antioxidantes prevengan de esta enfermedad. Se recomienda dosis ≤ 270 mg/día de RRR-alfa-tocoferol.
Conviene que los pacientes sin indicaciones especiales eviten tomar suplementos diarios que contengan dosis altas (≥ 400 UI/día) de vitE (evidencia de grado 2B) 15,16.
Toxicidad
Si bien no se ha definido un síndrome por intoxicación aguda, en adultos sin malabsorción se recomienda una ingesta ≤ 1.000 mg/día de cualquier forma de alfa-tocoferol (1.500 UI de "fuente natural" o 2.200 UI de vitE sintética). En niños de 1-3 años, ≤ 200 mg/día, y de 9-13 años, ≤ 600 mg/día.
No se recomienda la toma si no hay indicación específica 2,17,18,19,20.
CONCLUSIONES DEL CASO CLÍNICO
El mecanismo podría ser por el daño oxidativo en la sustancia negra provocado por el déficit de antioxidante. En los pocos casos publicados, pacientes con déficit específico de vitE y distonía, se sugiere que el tratamiento temprano puede mejorar los síntomas. La distonía asociada a déficit de vitE podría ser más frecuente de lo pensado pero estar oculta bajo los síntomas típicos: ataxia y síndrome cordonal posterior 21,22,23,24,25.
SEGUNDO CASO CLÍNICO
Varón de 18 años que acude por segunda crisis epiléptica.
Antecedentes familiares:
Primera crisis epiléptica cuatro años antes: sensación de mareo breve, desconexión, giro cefálico, generalización tónico-clónica, poscrítico. Estaba en tratamiento con isotretinoína (derivado de vitA) por acné. Exploración neurológica, EEG y vídeo-EEG normales; resonancia magnética (RM) craneal con alteración menor: malrotación del hipocampo izquierdo (Fig. 1).
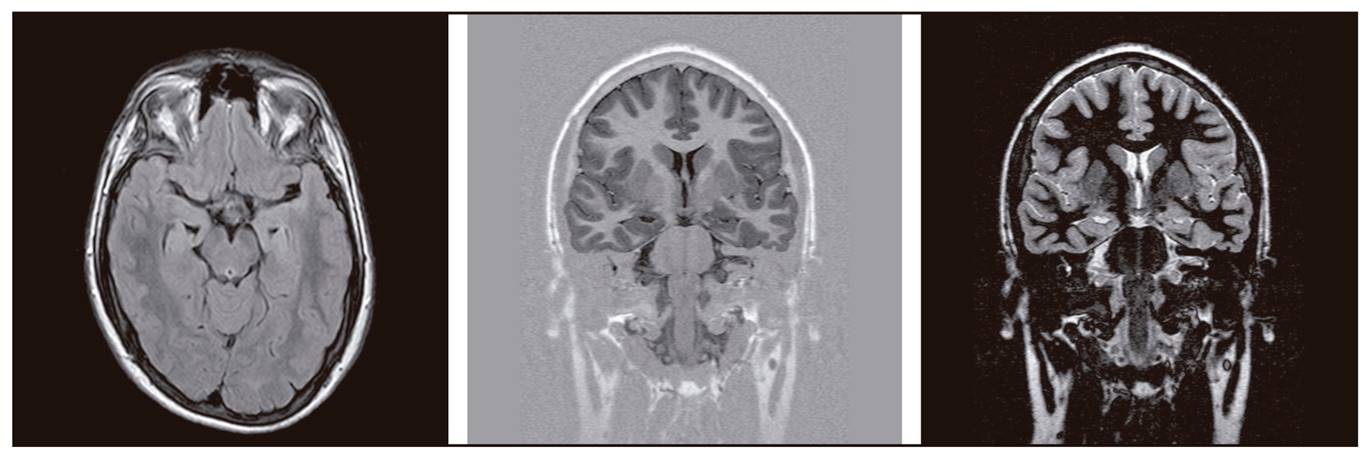
Figura 1. RM cerebral con secuencias de recuperación de la inversión atenuada de fluido axial (izquierda) y doble inversión recuperación coronal (centro y derecha), donde se ve la malrotación hipocampal izquierda.
Se retiró isotretinoína como posible factor provocador (no descrito previamente) y se inició tratamiento antiepiléptico con levetiracetam. A los tres años se retiró el tratamiento.
Tras diez meses de la retirada del levetiracetam tuvo la segunda crisis tónica-clónica generalizada. Había retomado la isotretinoína 20 días antes. Se reinició el tratamiento antiepiléptico (Fig. 2).
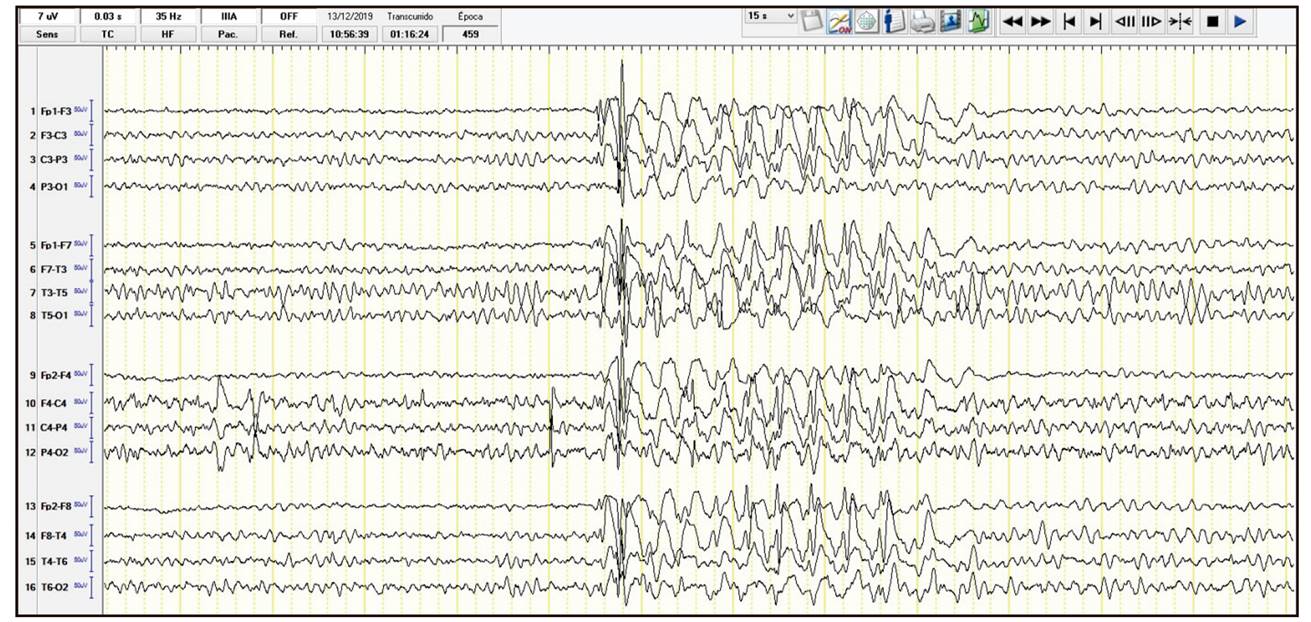
Figura 2. Electroencefalograma (EEG) que muestra punta-polipunta-onda a unos 4 Hz de distribución generalizada.
VITAMINA A
Fuentes
Subclase de los ácidos retinoicos con dos formas principales:
- Carotenoides pro-vitA (especialmente betacarotenos, alfacarotenos y beta-criptoxantinas): en plantas. No es una vía de intoxicación dado que los mamíferos la autorregulan adecuadamente.
- vitA preformada: (retinol, retinal, ácido retinoico, ésteres de retinilo): fuentes animales y la utilizada para suplementación. Algunos suplementos combinan beta-carotenos y vitA preformada. Es la forma más activa; esta sí puede ser una vía de intoxicación 2.
Ingesta recomendada 26
La RDA se mide en actividad equivalente de retinol (RAE):
1 RAE = 1 µg = 3,3 UI.
Población general:
Poblaciones especiales:
- Malabsorción: varias veces la RDA.
- Pancreatitis crónica: no suele producirse malabsorción que requiera suplementos de vitaminas liposolubles hasta estadios finales.
- Hepatopatía crónica: se suele tratar con polivitamínicos que incluyen vitA. Si se detecta déficit, es preciso tratarlo específicamente. El consumo de alcohol puede potenciar la hepatotoxicidad por vitA.
- Colestasis severa: pueden requerir dosis altas de vitA.
Claves de absorción y metabolismo
El proceso de absorción es común al de la vitE. Tras la llegada al hígado, se liberarán los ésteres de retinilo, que se unen a las proteínas de unión al retinol (RBP) antes de almacenarse en glóbulos lipídicos que contienen vitA en las células estrelladas del hígado, que se encargan del 50-85 % de la vitamina almacenada.
De los almacenes a los órganos diana se desplaza unida a RBP como complejos retinol-RBP 27.
Mecanismo de acción
La vitA es crucial en el funcionamiento de la vista. Está implicada en la fototransducción, la diferenciación celular y la integridad del ojo. Todas las células conjuntivales y retinianas tienen RBP 28.
Deficiencia
Es rara en países desarrollados, excepto casos de malabsorción. Sin embargo, en países en vías de desarrollo es frecuente:
- Aproximadamente el 30 % de los menores de cinco años del mundo.
- Cerca del 50 % de los niños en el sur de Asia y en África subsahariana.
- Se calcula que alrededor de 500.000 preescolares cada año quedan ciegos por este motivo 29.
Medición
El diagnóstico suele ser clínico, pero está disponible la cuantificación de retinol en suero. Se considera déficit < 20 µg/dl (0,7 µmol/l) en ayunas. En individuos con déficit en tratamiento y tras la primera dosis los niveles pueden ser falsamente altos. Por el contrario, en casos de déficit de RBP pueden ser falsamente bajos (enfermedad inflamatoria intestinal, malnutrición severa) 2,30.
Patología asociada al déficit
Patología oftalmológica:
- Xeroftalmia: malfunción de glándulas lacrimales que conduce a sequedad de conjuntiva y córnea (manchas de Bitot, con proliferación de células escamosas y queratinización de la conjuntiva). Puede progresar a xerosis corneal (sequedad) y keratomalacia.
- Nictalopia (ceguera nocturna) y retinopatía: la vitamina A es sustrato para los pigmentos visuales fotosensitivos de la retina.
Los casos severos pueden ser irreversibles.
Tratamiento 26
Xeroftalmia:
Niños: tres dosis orales (el día del diagnóstico, el siguiente y a las dos semanas):
En adolescentes y adultos: 200.000 UI orales.
En mujeres fértiles o embarazadas con ceguera nocturna es mejor dosis bajas y frecuentes de vitA, a no ser que tengan xeroftalmia activa.
Beneficios potenciales de la suplementación
Se recomienda suplementación oral periódica en poblaciones con déficit endémico y en niños con sarampión donde la mortalidad de esta enfermedad es elevada:
- Pacientes de 6-12 meses: 100.000 UI en monodosis (30 mg de retinol).
- De 12-59 meses: 200.000 UI (60 mg de retinol) cada 4-6 meses.
- Las embarazadas en zonas de alto riesgo de déficit: para evitar teratogenicidad ≤ 10.000 UI/día o 25.000 UI/semana, durante ≥ 12 semanas y hasta el parto 31.
Se puede requerir suplemento para niños con diarrea, enfermedades respiratorias o malnutrición severa.
Toxicidad
Casi siempre se tratará de toxicidad crónica por exceso de ingesta de la vitA preformada (aproximadamente diez veces la RDA, o 50.000 UI). Por ello, no están recomendados los suplementos de forma generalizada en países donde no hay carencia 26,32. Puede haber toxicidad con niveles no elevados en sangre 33.
Síntomas y signos de toxicidad:
- Efectos teratogénicos: abortos espontáneos, malformaciones (microcefalia y anomalías cardiacas). Especialmente tóxico en el primer trimestre de embarazo. El límite superior de ingesta seguro: 10.000 UI/día (3.000 µg/día aproximadamente) (2,34.
- Náuseas, cefalea, fatiga, irritabilidad, edema de papila (pseudotumor cerebri), ataxia.
El tratamiento consiste en suprimir los suplementos causantes y en el manejo específico de los síntomas. El pronóstico es bueno, pero puede quedar fibrosis hepática.














