INTRODUCCIÓN
El estrés quirúrgico predispone a los pacientes a la disfunción inmune y a un mayor riesgo de infección. Este riesgo es aun mayor cuando el paciente está desnutrido antes de la agresión quirúrgica (1-2). Un estado nutricional subóptimo predice, de manera independiente, peores resultados posquirúrgicos, y los pacientes quirúrgicos desnutridos presentan una mayor morbimortalidad posoperatoria, mayores tasas de reingreso y costes hospitalarios más elevados (3).
A lo largo de las últimas décadas se han estudiado diversas estrategias nutricionales con la finalidad de paliar los efectos de la desnutrición sobre la función inmunitaria y prevenir la aparición de complicaciones en el paciente quirúrgico. Una de estas aproximaciones es la inmunonutrición.
La inmunonutrición se define como "la administración de nutrientes que tienen efectos tanto nutritivos como farmacológicos, con la finalidad de contrarrestar la desnutrición y la disfunción inmune" (4). Cuando esos nutrientes se administran en cantidades superiores a las fisiológicas con el objetivo de inducir efectos farmacológicos, pasan a ser denominados inmunonutrientes (4). Los inmunonutrientes que se han estudiado con mayor profundidad aparecen en la tabla I.
Tabla I. Inmunonutrientes más estudiados en la bibliografía y su principal mecanismo de acción. Adaptada de Grimble y cols., 2005 (4)

Sin embargo, es importante tener presente, además de los inmunonutrientes y para asegurar el beneficio clínico, otros factores como el momento de la administración (pre-peri-posoperatorio) o la duración del tratamiento, que también van a influir en la eficacia de la intervención (3). Al mismo tiempo, los inmunonutrientes administrados de manera aislada no han logrado el mismo nivel de eficacia clínica que los estudios que combinan varios inmunonutrientes en una concentración determinada, sugiriendo: a) que se produce una acción sinérgica entre ellos (3,5) y b) que algunas formulaciones son más eficaces que otras en la prevención de complicaciones posteriores a la cirugía.
Toda esta complejidad inherente a la inmunonutrición se suma a la ya existente para mantener al paciente adecuadamente nutrido en el entorno perioperatorio; por ejemplo, en sus dos primeras semanas de estancia en la UCI, el paciente crítico quirúrgico recibe tan solo el 50 % de las calorías pautadas por su médico (6).
Se ha demostrado que una terapia nutricional perioperatoria adecuada mejora específicamente los resultados de la cirugía gastrointestinal oncológica, donde se dan las tasas más elevadas de desnutrición basal (aparece hasta en un 65 % de los casos). Las guías ESPEN recomiendan la administración perioperatoria, o al menos posoperatoria, de fórmulas específicas enriquecidas con inmunonutrientes (arginina, ácidos grasos omega-3 y ribonucleótidos) a los pacientes desnutridos sometidos a una cirugía mayor oncológica. Y el uso de una fórmula inmunomoduladora se asocia a una reducción significativa de los problemas de cicatrización de las heridas, de los fallos de las suturas y de las complicaciones infecciosas y globales (7).
Las intervenciones nutricionales (pre y posoperatorias) tienen un papel clave en todos los pacientes quirúrgicos en general, y pueden mejorar los propios resultados quirúrgicos, así como reducir la morbilidad infecciosa y la mortalidad (8), y mejorar la cicatrización de la herida quirúrgica (9). También se ha identificado la ingesta oral precoz como determinante independiente de la recuperación temprana después de numerosos tipos de cirugía mayor abdominal (3).
Varios autores han sugerido que, dado que la mayoría de los ensayos clínicos que evalúan la eficacia de la inmunonutrición se han realizado en un entorno perioperatorio tradicional, sería interesante investigar su eficacia en un entorno más controlado, como es el caso del protocolo ERAS (Enhanced Recovery after Surgery).
En nuestro país, en el año 2007 se creó el grupo multidisciplinar español de rehabilitación multimodal (GERM), cuyo principal propósito ha sido la realización de una guía de práctica clínica perioperatoria amparada en la medicina basada en la evidencia científica, y que ha desarrollado la vía clínica de la recuperación intensificada en cirugía abdominal (RICA), al amparo del Ministerio de Sanidad (10).
Según las recomendaciones emitidas recientemente por las guías de cuidados perioperatorios en cirugía colónica electiva, según el protocolo ERAS, publicadas en la revista World Journal of Surgery en 2019, hay numerosos aspectos del protocolo que tienen que ver con la valoración e intervención nutricional, como el cribado y la valoración, y el soporte preoperatorio si se precisa, el ayuno preoperatorio y la sobrecarga de carbohidratos, el inicio precoz de la ingesta oral y el soporte posoperatorio y al alta, si es necesario (11).
El objetivo del trabajo de este grupo multidisciplinar compuesto por cirujanos, anestesistas y endocrinólogos expertos en nutrición, todos ellos con conocimiento y experiencia previa en los protocolos ERAS o fast-track, es triple:
Definir el papel que debe jugar la inmunonutrición en los protocolos ERAS sobre la base de la mejor evidencia científica.
Analizar las dificultades que siguen existiendo en la práctica clínica real para realizar el cribado del riesgo nutricional del paciente.
Proponer unos algoritmos adaptados a las características de nuestro entorno para el cribado, la valoración y el tratamiento nutricional del paciente quirúrgico en modalidad fast-track.
MATERIAL Y MÉTODOS
El presente trabajo ha sido realizado por un equipo multidisciplinar de 8 miembros, especialistas en anestesiología y reanimación, en cirugía general y en endocrinología y nutrición. A continuación se detallan las fases que se han seguido a fin de conseguir los objetivos propuestos.
ESTRATEGIA DE BÚSQUEDA BIBLIOGRÁFICA
Se realizó una búsqueda en la base de datos PubMed® con el objetivo de identificar aquellos artículos relevantes publicados en los 10 años anteriores al momento de la búsqueda (periodo: julio de 2009 a julio de 2019). La búsqueda incluía los términos "immunonutrition", "ERAS", "enhanced recovery" y "fast track" como palabras clave, así como Medical Subject Headings (MeSH), resultando en 161 resultados. Se incluyeron también en el análisis 13 guías de práctica clínica relevantes de las principales sociedades científicas implicadas.
SELECCIÓN DE ESTUDIOS
Se realizó un cribado de los resultados a partir de los títulos y resúmenes, excluyendo aquellos resultados duplicados o correspondientes a publicaciones fuera del alcance de la revisión, resultando en 86 publicaciones. Los criterios de inclusión y exclusión de estudios fueron los especificados en la tabla II.
Se obtuvo el texto completo de todas las publicaciones y se eliminaron 2 por corresponder a análisis retrospectivos, incluyéndose finalmente en el análisis 84 publicaciones. El esquema correspondiente al flujo de selección y exclusión de publicaciones se muestra en la figura 1.

Figura 1. Esquema resumen de la selección y exclusión de los resultados bibliográficos de la revisión.
Los ensayos clínicos aleatorizados incluidos en la revisión pueden consultarse en el anexo I.
ANÁLISIS Y EVALUACIÓN DE LA BIBLIOGRAFÍA
Se examinaron, revisaron y calificaron las publicaciones resultantes, tabulando la información y las características de todos los candidatos mediante un formulario de extracción de datos que contenía: características básicas de cada estudio (primer autor, año de publicación, tamaño de la muestra, edad de los participantes), diseño del estudio (aleatorización, control, cegamiento, brazos del ensayo), intervención (elementos incluidos en la fórmula de inmunonutrición, duración del soporte nutricional, momento pre, peri o posoperatorio), resultados de interés (resultados clínicos, indicadores inmunológicos y bioquímicos, etc.) y, finalmente, sesgos y limitaciones del estudio. La calidad metodológica de los ensayos clínicos se evaluó cuantitativamente según el sistema de puntuación de calidad Jadad-Oxford (12). Para la evaluación cualitativa de las recomendaciones se siguieron las pautas de adaptación del sistema de calificación de recomendaciones, evaluación, desarrollo y evaluación (GRADE) formuladas por la ASPEN (13).
REFLEXIÓN EN EL CONTEXTO SANITARIO Y CREACIÓN DEL ALGORITMO
El análisis de las dificultades que siguen existiendo en la práctica clínica real para realizar el cribado del riesgo nutricional del paciente y la propuesta de algoritmos adaptados se llevaron a cabo usando la metodología Design Thinking, que ya se ha utilizado anteriormente en el diseño y optimización de intervenciones y flujos clínicos (14). En concreto, se utilizó la técnica del Journey Mapping para identificar los puntos de mejora en el viaje que realiza el paciente y los puntos de encuentro (y desencuentro) con los profesionales médicos, y se empleó el Concept Development para diseñar un algoritmo (15) que permitiera conseguir una valoración/intervención nutricional del paciente quirúrgico desde el mismo momento en que se decide la intervención, y continuar el proceso en la estrategia del protocolo fast-track.
METODOLOGÍA DE CONSENSO
La búsqueda de consenso entre los autores se sistematizó según una metodología Delphi mixta (16), exigiendo un porcentaje de consenso mínimo del 85 %.
RESULTADOS
RESULTADOS EN EL USO DE INMUNONUTRIENTES EN LA FASE PREOPERATORIA
Resultados obtenidos
Parámetros analíticos
Los parámetros analíticos en los que se mostraron beneficios se relacionaban con la inflamación y la respuesta inmune. Acerca de la inmunidad celular, se describió un menor descenso posoperatorio de los linfocitos CD4 (17) y una mayor proliferación estimulada de linfocitos y de diferenciación Th1/Th2 (18), sin evidencia de beneficios para la inmunidad humoral. En cuanto a la inflamación en los distintos momentos del posoperatorio, se han reportado niveles menores de PCR (19), prostaglandina E2 e interleuquinas en algunos, aunque no en todos los estudios (20). También se observaron mayores niveles de resolvina E1, mediador derivado de los omega-3 con efecto antiinflamatorio (21).
En el estudio con inmunonutrición asociada a polifenoles se evaluaba la capacidad antioxidante in vitro, objetivándose una mejoría en el grupo tratado (22).
Cuando se evaluó el perfil sérico de ácidos grasos, se demostró un mayor nivel de ácido eicosapentaenoico (EPA) y de la ratio EPA/ácido araquidónico (AA) (18,21) asociado a la inmunonutrición.
Otros beneficios observados aisladamente fueron unos niveles posoperatorios de transferrina mayores (22) y de transaminasas menores (19).
Parámetros clínicos
-
a)Infección
En cinco de los trabajos se ha mostrado algún beneficio estadísticamente significativo en cuanto a la reducción de las complicaciones infecciosas (7 vs. 28 %, p = 0,034 (17); 13,6 vs. 50 %, p = 0,028 (23); 40 vs. 75 %, p = 0,025 (21); 28 vs. 60 %, p = 0,023 (18); riesgo relativo (RR) = 0,5; intervalo de confianza: 0,31-0,93; p = 0,031 (24)), contemplándose dentro del total la infección del sitio quirúrgico y también los focos respiratorios y de cavidad abdominal y, solo en un caso, flebitis, infección urinaria o bacteriemia (23). Dentro de estos, en el trabajo de Fujitani y cols. (24), este beneficio significativo solo era aplicable a la infección de la herida quirúrgica y al subgrupo de pacientes con pérdida de peso superior al 5 % en 3 meses. En el estudio de Manzanares y cols. (23), la significación solo se alcanzó para las complicaciones menores y los pacientes con cirugía rectal. Además de estos resultados, se observó una tendencia no significativa hacia una menor necesidad de antibióticos para la infección de la herida quirúrgica en el estudio de Barker y cols. (25).
En los trabajos de Ruiz Tovar y cols. (19) y de Nagata y cols. (22), en cirugía bariátrica y donantes de hígado, respectivamente, no se produjeron complicaciones infecciosas en ninguno de los grupos. En el estudio de Hübner hubo una mayor tasa de infecciones en el grupo de inmunonutrición (20), sin significación estadística, y en los restantes dos estudios (26,27) no hubo diferencias significativas.
En cuanto a la duración del SIRS (Systemic Inflammatory Response Syndrome), solo el estudio de Okamoto y cols. (17) en el ámbito de la gastrectomía mostró beneficios del uso de las fórmulas (0,77 ± 0,90 días vs. 1,34 ± 1,45, p = 0,04). En los otros tres estudios que analizaron este dato en los ámbitos de la cirugía gastrointestinal, la gastrectomía y la duodenopancreatectomía (18,20,24), no se encontraron diferencias significativas.
-
b)Complicaciones posquirúrgicas
En ninguno de los estudios se demostró una reducción significativa de las complicaciones no infecciosas (17,18,21,25-27) o totales asociada a la inmunonutrición, incluyendo la fuga anastomótica. Sin embargo, en el estudio de Uno y cols. (21) se objetivó un beneficio en cuanto a la gravedad de las complicaciones totales según la clasificación de Clavien-Dindo (28).
-
c)Estancia hospitalaria
La estancia hospitalaria fue un parámetro evaluado en todos los estudios revisados. Únicamente en el estudio de Uno y cols. (21), en el campo de la cirugía hepatobiliar, se mostró una reducción significativa de la estancia para el grupo de inmunonutrición frente al grupo no suplementado (36,9 ± 3,3 días vs. 53,9 ± 5, p = 0,006). En los restantes no se demostraron diferencias estadísticamente significativas.
-
d)Morbimortalidad y supervivencia
Los estudios describieron la mortalidad posoperatoria (no a largo plazo) y no se mostraron diferencias significativas en relación al tratamiento con inmunonutrición. Cabe mencionar que solo en cuatro de los trabajos se produjo alguna muerte (20,25-27), estando el dato más elevado en la cirugía pancreática, con 6 de 16 pacientes en el grupo de control y ninguno en el grupo de inmunonutrición, sin significación estadística.
-
e)Costes
Dos trabajos han evaluado los costes (23,25), sin encontrar diferencias significativas.
Resultados en relación con el estado nutricional
El estado nutricional de los pacientes analizados varió entre estudios y se reportó de manera desigual.
Entre aquellos que han mostrado beneficios clínicos o analíticos, la información es variable. En el trabajo de Okamoto y cols. (17) no se describía el estado nutricional, si bien el estudio recogía a pacientes con carcinoma gástrico, en los que el riesgo de desnutrición es elevado. En el de Fujitani y cols. (24), también en el campo de la gastrectomía por carcinoma gástrico, los beneficios se demostraron solo en el subgrupo de pacientes con pérdida de peso reciente mayor del 5 %. En el de Aida y cols., el índice de masa corporal (IMC) medio fue cercano a 22 kg/m2, y 4 de 50 pacientes habían perdido más del 10 % de su peso; además, no presentaban alteraciones significativas de los valores medios de albúmina, prealbúmina, transferrina o retinol binding protein (RBP). En el estudio de Manzanares y cols. (23), el 64,3 % de la muestra se encontraba en riesgo nutricional según el Nutritional Risk Screening 2002 (NRS-2002), y la prevalencia de la alteración de las proteínas viscerales y de los datos interpretados como desnutrición calórica fue del 31 y 60,7 %, respectivamente. Sin embargo, en el estudio de Nagata y cols. (22), el perfil de la población (donantes de hígado) no era a priori susceptible de alteraciones nutricionales y en ellos sí se demostraron beneficios analíticos. Lo mismo sucede con los datos favorables obtenidos en pacientes obesos sometidos a cirugía bariátrica (19). En el estudio de Uno y cols. (21) no se reflejaron datos antropométricos y la albúmina media basal fue de 3,6 a 3,7 g/dL.
En uno de los cuatro estudios en los que no se observaron beneficios se incluyó una mayoría de pacientes normonutridos según la Valoración Global Subjetiva (VGS), con una clasificación A en el 76 % y el 81,6 % en los grupos de tratamiento y control, respectivamente (25). En otro se incluyó por protocolo solo a pacientes normonutridos (26). En el estudio de Gade y cols. (27) hubo un 40 % de pacientes clasificados como "en riesgo nutricional" según el NRS 2002. En el estudio de Hubner y cols. (20), los pacientes incluidos tenían desnutrición grave conforme al un cribado NRS-2002 mayor o igual que 3. No obstante, este fue el estudio en el que la adherencia a la suplementación fue más baja.
En definitiva, no se puede deducir una estratificación de los beneficios según el estado nutricional, si bien es cierto que, en los pacientes normonutridos, no se ha logrado demostrar ningún beneficio a nivel clínico, a excepción de la pérdida de peso en la cirugía bariátrica.
Como conclusión, los datos apuntan a posibles beneficios de la inmunonutrición preoperatoria, fundamentalmente en términos de complicaciones infecciosas y de parámetros relacionados con la respuesta inmune y la inflamación. No obstante, la extracción de conclusiones se ve limitada por la heterogeneidad en factores como las patologías evaluadas, los resultados para una misma patología o el estado nutricional de los pacientes, así como la duración de la intervención, el tratamiento de los grupos de control y los resultados evaluados. Cabe reseñar que en cinco de los siete trabajos donde se reflejaba algún beneficio en relación con la administración de suplementos nutricionales orales, la comparación se realizó con la ausencia de suplementación, lo cual dificulta la atribución del efecto a la presencia de inmunonutrientes en la fórmula. Por último, el tamaño muestral de las publicaciones fue generalmente pequeño.
RESULTADOS DEL USO DE INMUNONUTRIENTES EN LAS FASES PERI Y POSOPERATORIA
Numerosos ensayos clínicos se centraron en el uso de inmunonutrientes en el periodo peri (29-41) y posoperatorio (42-45) (Anexo I). Únicamente en el trabajo de Moya y cols. se empleó la inmunonutrición dentro de un protocolo ERAS (34).
Resultados obtenidos
Parámetros analíticos
Muchos de los estudios mostraron datos bioquímicos sugestivos de mejoría de la función inmunitaria, sin que se encontrase ninguna traducción clínica. Los estudios sugerían que la reducción del recuento linfocitario y de las células T ocurre ya desde el momento de la inducción anestésica, y que estas variables disminuyen en los primeros 5 días del posoperatorio. La optimización de estos parámetros podría jugar un papel protector frente a las complicaciones infecciosas, y la reducción de linfocitos se asocia a una mayor morbimortalidad. Hamza y cols. (31), Hamilton y cols. (33) y Klek y cols. (43-45) evidenciaron un aumento del recuento linfocitario: en concreto, de los linfocitos CD4 (30,31). Las cifras de TNF-α e IL-6 fueron menores, pero sin alcanzar la significación estadística (salvo Mudge y cols. [32]). Existe cierta tendencia a mantener o incrementar, sin significación estadística, los niveles de albúmina plasmática, prealbúmina y transferrina (salvo el aumento de la prealbúmina (29) y el aumento de las proteínas en los pacientes desnutridos con tratamiento prolongado [41]). Adicionalmente, la inmunonutrición podría modificar favorablemente otros parámetros bioquímicos como la concavalina (Con A), la fitohemaglutinina (PHA) y los niveles de EPA y ácido descosahexaenoico (DHA) (36,39,41).
Parámetros clínicos
-
a) Infección
En general, hay una tendencia hacia la disminución de la tasa de infecciones que alcanza significación estadística (11,7 % vs. 31,3 %, p = 0,021 (29); 0-11,5 %, p = 0,006 (34); 28,3 % vs. 39,2 %, p = 0,04 (43-45); 23,5 % vs. 56,3 %, p = 0,05 (40)). En este apartado se incluye fundamentalmente la infección del sitio quirúrgico, aunque algunos trabajos recogieron una disminución de infecciones pulmonares y urinarias (29).
-
b) Complicaciones posquirúrgicas
Las publicaciones quedan divididas en resultados favorables (29,30,33,38,42-45) o no significativos (34,36,37,39-41) en cuanto a morbilidad. Factores que podrían influir en el resultado son el estado nutricional y el momento del posoperatorio en que se midió la presencia de complicaciones; dos trabajos encontraron diferencias solo en el posoperatorio tardío (30,33). Por otro lado, el trabajo de Miyauchi y cols. no mostró diferencias en la tasa de complicaciones ni en la gravedad de las mismas analizando el manejo pre o perioperatorio (36). En cuanto a la dehiscencia anastomótica, en general se incluyó en el apartado de las complicaciones posquirúrgicas, aunque en algún caso se englobó dentro de las infecciosas. Dos trabajos mostraron una disminución significativa de la tasa de fugas (29,30), aunque en la mayoría no se hallaron diferencias (34,36,39). Por último, Scislo y cols. objetivaron un menor número de complicaciones por paciente y una menor tasa de complicaciones respiratorias (42).
-
c) Estancia hospitalaria
Se halló una disminución significativa de la estancia media en 5 de los trabajos (29,30,37,40,44), no así en el resto (32,34,35,39,41). Habría que destacar que los estudios con mayores tamaños muestrales no mostraron diferencias significativas (32,34).
-
d) Mortalidad y supervivencia
Tres ensayos clínicos hallaron una disminución de la mortalidad posoperatoria (42,44,45). Otros trabajos no encontraron diferencias en la mortalidad precoz (30,32,34) ni a largo plazo (35).
Resultados en relación con el estado nutricional
Los resultados obtenidos varían en función del estado nutricional de los pacientes incluidos. En relación al uso de inmunonutrición en los pacientes normonutridos existe controversia. De hecho, muchos de los estudios en los que la inmunonutrición no mostró efectos clínicos significativos fueron realizados en pacientes bien nutridos, mientras que aquellos estudios realizados en pacientes con desnutrición de moderada a grave mostraron una reducción de las complicaciones (42-45). En el estudio de Klek y cols. de 2014 no hubo diferencias estadísticamente significativas en cuanto a la morbilidad posquirúrgica (44). Sin embargo, el análisis del subgrupo desnutrido reveló el impacto positivo de la inmunonutrición enteral en la reducción de las complicaciones (28,3 vs. 39,2 %, respectivamente; p = 0,043) y la estancia hospitalaria.
Algunos autores consideran que, en los pacientes normonutridos, la suplementación a corto plazo en el posoperatorio sería por sí sola inútil pero que, sin embargo, el manejo perioperatorio durante 7 días podría ofrecer ciertas ventajas en términos de disminución de las complicaciones posquirúrgicas. Por otro lado, Hamza y cols. sugieren que el abordaje preoperatorio es preferible en los pacientes normonutridos, mientras que el abordaje perioperatorio sería más adecuado para los pacientes desnutridos, asociando una reducción relativa del 50 % en las complicaciones posoperatorias en comparación con el uso aislado preoperatorio (31).
Como conclusión, parece claro que el estado nutricional influye en los resultados posoperatorios, beneficiándose fundamentalmente los pacientes con desnutrición y no quedando claro cuál es la estrategia óptima (tratamiento pre, peri o posoperatorio, duración y dosis). La opción de que los pacientes normonutridos también puedan beneficiarse de este tipo de soporte nutricional todavía no se ha demostrado de manera convincente.
RESUMEN DE LOS RESULTADOS DE LOS METAANÁLISIS
Se incluyeron en la presente revisión 17 metaanálisis publicados entre los años 2010 y 2018. Los metaanálisis incluidos en la revisión pueden consultarse en el anexo II.
En general, la mayoría de estudios no se realizaron dentro de protocolos fast-track. En los dos trabajos que incluían en dicho protocolo la inmunonutrición se observó una reducción de las infecciones de la herida quirúrgica, de modo que sus autores sugieren que dicho soporte nutricional podría ser más efectivo en caso de emplearse en los protocolos fast-track.
En todos los estudios revisados, el aporte de la inmunonutrición por vía oral/enteral se comparaba frente al soporte nutricional estándar o la alimentación oral. La composición de la inmunonutrición, en la mayoría de los estudios, era una mezcla de arginina, ácidos omega-3 y nucleótidos en diferentes concentraciones, dependiendo de la fórmula nutricional, aunque en algunos trabajos analizados por los metaanálisis se administraban los inmunonutrientes de forma aislada. No se reflejaba el estado nutricional en todos los estudios incluidos y los criterios de diagnóstico nutricional empleados eran heterogéneos. Respecto al momento de administración del soporte nutricional, este se indicaba preoperatoriamente y/o posoperatoriamente.
Algún trabajo sugería el empleo de la inmunonutrición al menos 3 días antes y preferiblemente 5-7 días antes de la intervención quirúrgica, así como su continuación posoperatoria si fuera posible. El trabajo publicado en 2010 por Marik y cols. (46), y que incluye pacientes malnutridos y con alto riesgo nutricional que se intervienen de cáncer gastrointestinal, de cabeza y cuello, de cirugía abdominal y de cirugía cardíaca, recomiendan el inicio preoperatorio puesto que, tras la intervención quirúrgica, pueden surgir problemas de tolerancia gastrointestinal.
El metaanálisis más relevante respecto al momento de administración es el de Osland de 2014, que incluye 20 estudios en pacientes con neoplasia gastrointestinal y hepática, y concluye que la administración perioperatoria y posoperatoria reduce las complicaciones infecciosas y la estancia hospitalaria (47). No se especifica durante qué intervalo de tiempo debe administrarse la inmunonutrición, si bien las vías de administración son heterogéneas (vía oral, enteral) y los actuales protocolos de fast track no incluyen la administración rutinaria de nutrición enteral en el posoperatorio.
En el metaanálisis de 2012 de Casas y colaboradores, de pacientes con cáncer de cabeza y cuello, se observó una disminución significativa del número de fístulas en los pacientes tratados con dosis altas de arginina si se comparaban con los receptores de una nutrición con dosis medias de la misma (48). Uno de los trabajos incluidos en el metaanálisis concluía que la inmunonutrición prolongaba la supervivencia, siendo esta de 34,8 meses para los pacientes suplementados con inmunonutrición frente a 20,7 meses en el grupo de control. El metaanálisis posterior de 2014 de Vidal Casariego (49) y la revisión Cochrane de Howes de 2018 (50) respaldan también la reducción de las fistulas y la estancia hospitalaria en el grupo tratado con inmunonutrientes, aunque no todos los estudios incluidos eran de alta calidad metodológica.
La mayoría de los metaanálisis concluyen que la inmunonutrición reduce la estancia hospitalaria. Los trabajos como el de Song y colaboradores de 2015 (51) y el de Cheng de 2018 (52) muestran mejorías de los parámetros inmunológicos con la inmunonutrición, aunque no mejora la estancia hospitalaria. En ambos, la población incluida era de pacientes con cáncer gástrico.
El cociente de coste-efectividad de la inmunonutrición se analizó en el trabajo de Reis de 2016 (que incluía 6 estudios), encontrándose resultados positivos en cuanto al coste-efectividad y reduciéndose la estancia hospitalaria (53).
El metaanálisis que incluía más estudios es el publicado en 2017 por Probst y cols., que incluía 83 ensayos aleatorizados y controlados, y 7116 pacientes analizados, intervenidos de cirugía mayor abdominal (resección de hígado, páncreas o cirugías que implicaban anastomosis del tracto gastrointestinal). Concluía que la inmunonutrición reduce las complicaciones totales e infecciosas y la estancia hospitalaria con un grado de evidencia moderado-bajo. No demostró efectos sobre la mortalidad con un grado de evidencia alto (54).
El metaanálisis de Cerantola de 2011 incluyó 21 trabajos, 12 de los cuales fueron de alta calidad metodológica; concluyó que, tras excluir los estudios de baja calidad, la inmunonutrición administrada antes y después de la intervención quirúrgica (o únicamente después) había reducido las complicaciones posoperatorias y la estancia hospitalaria (55). Por tanto, los autores recomiendan su uso rutinario.
Como conclusión, tras revisar los 17 metaanálisis, las principales limitaciones encontradas son la falta de registro del estado nutricional de los pacientes y, en los casos en que se ha registrado, el hecho de que se han empleado diferentes métodos de diagnóstico nutricional. Además, no se suele hacer alusión al estadio tumoral del paciente o a la administración de tratamiento neoadyuvante. En los aspectos relacionados con la inmunomodulación, habitualmente se han administrado fórmulas comercializadas con combinaciones de inmunonutrientes por vía oral o enteral, pero en algunos estudios esta se ha administrado de forma aislada. En general, en los estudios se han registrado pocos datos sobre los abandonos y en pocos trabajos se ha reflejado la participación de la industria.
RECOMENDACIONES SEGÚN LAS GUÍAS DE PRÁCTICA CLÍNICA
En relación con la indicación de suplementación con fórmulas inmunomoduladoras en el ámbito de la cirugía, encontramos recomendaciones en distintas guías de práctica clínica (GPC):
ESPEN
La Sociedad Europea de Nutrición Clínica y metabolismo (ESPEN) ha publicado recientemente sus GPC sobre el soporte nutricional en la cirugía (7) y en el paciente con cáncer (56).
Para el paciente quirúrgico en general, la ESPEN recomienda, con el grado B de la escala SIGN (Scottish Intercollegiate Guidelines Network), la administración perioperatoria o al menos posoperatoria de fórmulas orales/enterales específicas, enriquecidas en inmunonutrientes (arginina, ácidos grasos omega-3 y ribonucleótidos), en los pacientes desnutridos candidatos a cirugía mayor oncológica (7). En lo que respecta al uso exclusivo en el preoperatorio, añade que no existe una clara evidencia que respalde su uso frente a las fórmulas estándar (grado de recomendación B/O de la escala SIGN (57), 89 % de consenso). Aunque no se presenta como una recomendación al uso, en esta GPC se recoge (dentro de un apartado de "indicaciones especiales") la integración de las fórmulas inmunomoduladoras en los protocolos ERAS sobre la base de un ensayo clínico aleatorizado en pacientes con cáncer colorrectal (34).
En el paciente oncológico, la ESPEN (56) recomienda la administración perioperatoria de fórmulas orales/enterales específicas enriquecidas en inmunonutrientes (arginina, ácidos grasos omega-3 y ribonucleótidos) en el contexto de protocolos quirúrgicos tradicionales del tubo gastrointestinal alto, con un nivel de evidencia alto y un grado de recomendación fuerte. No se hace referencia explícita al estado nutricional del paciente como requisito para la prescripción del tratamiento. Asimismo, se recomienda que el protocolo quirúrgico de elección en el paciente oncológico siga las directrices ERAS (Enhanced Recovery After Surgery) (recomendación fuerte, nivel de evidencia alto). Como cuestiones a resolver plantean el papel de los inmunonutrientes en el manejo de los pacientes candidatos a cirugía gastrointestinal alta dentro de los protocolos ERAS.
Sociedad ERAS
En relación a las vías ERAS®, la ESPEN, en colaboración con la Sociedad ERAS, ha publicado GPC de soporte nutricional para la cirugía colónica (58), pélvico-rectal (59), duodeno-pancreática (60) y urológica (cistectomía) (61). La propia sociedad ERAS ha publicado varias GPC, algunas de las cuales se han actualizado recientemente. Así, disponemos de GPC publicadas en los últimos 7 años para las cirugías colónica (11), onco-ginecológica (62), esofágica (63), pulmonar (64), hepática (65), bariátrica (66) y gástrica (67).
En la reciente actualización (11) de la GPC de cirugía colónica ERAS (58) se recomienda ofrecer comida y suplementos nutricionales orales desde el día de la cirugía (recomendación fuerte, nivel de evidencia moderado). La inmunonutrición perioperatoria de los pacientes malnutridos es beneficiosa para los pacientes con cáncer colorrectal (recomendación fuerte, nivel de evidencia bajo). En la guía de cirugía ERAS pélvico-rectal (59) no se recoge una recomendación específica sobre el uso de fórmulas inmunomoduladoras.
En la cirugía duodeno-pancreática, la Sociedad ERAS recomienda (con grado débil y evidencia moderada) que el soporte nutricional con fórmulas inmunomoduladoras durante 5-7 días perioperatorios se considere sobre la base de la reducción de la tasa de complicaciones infecciosas. Si bien añade que no existía en el momento de la publicación de la GPC (2012) ningún estudio que analizara los efectos de la inmunonutrición en el contexto de la cirugía ERAS.
En el caso de la cirugía urológica, la ERAS no hace ninguna recomendación específica sobre la base de la evidencia disponible. Su papel en la reducción de la morbimortalidad de estos pacientes no se conocía cuando se publicó la guía (2013) (61).
En el caso de la cirugía onco-ginecológica (62), en las guías ERAS se hace alusión a la inmunonutrición en el apartado de "nutrición perioperatoria", en su mayoría por extrapolación del estudio sobre el colon, y se cita un único estudio realizado en pacientes con neoplasias ginecológicas (37), con resultados positivos. No se hace recomendación específica sobre el uso de las fórmulas inmunomoduladoras en el contexto de la cirugía ERAS de pacientes con neoplasias ginecológicas. Tampoco se hace recomendación específica en el caso de la cirugía bariátrica (66).
Las GPC para el manejo perioperatorio de la esofaguectomía de la sociedad ERAS (63) afirman que la evidencia en torno al uso de las fórmulas inmunomoduladoras en pacientes candidatos a cirugía oncológica esofágica es conflictiva y su uso rutinario no puede recomendarse en la actualidad (recomendación fuerte, evidencia moderada).
En el caso de la cirugía torácica ERAS (64), el posicionamiento es similar, es decir: no se dispone de suficiente evidencia para recomendar las fórmulas inmunomoduladoras frente a las fórmulas estándar, pero se cree que podrían tener algún papel en el posoperatorio de los pacientes malnutridos (recomendación débil para el posoperatorio, evidencia baja y extrapolada).
En los pacientes candidatos a cirugía hepática ERAS (65), la evidencia sobre el uso de fórmulas inmunomoduladoras es limitada (recomendación débil, evidencia baja). A este respecto se hace referencia al estudio PROPILS (68) (Clinicaltrial.gov: NCT02041871), un estudio prospectivo, aleatorizado, controlado con placebo y doble ciego en fase IV que compara dos tratamientos nutricionales (inmunomodulador y estándar) en pacientes candidatos a cirugía hepática y cuyos resultados no se han publicado aún.
Las GPC de cirugía gástrica ERAS (67) sostienen que no existe suficiente evidencia para recomendar el uso rutinario de fórmulas inmunomoduladoras en los pacientes candidatos a gastrectomía (recomendación débil, evidencia moderada). Añade que el posible efecto beneficioso sobre la tasa de infecciones y de complicaciones de la herida quirúrgica en los pacientes candidatos a cirugía mayor abdominal no se ha reproducido en ensayos de alta calidad metodológica y centrados en la gastrectomía.
VÍA RICA
A nivel nacional contamos con la vía clínica de recuperación intensificada en cirugía abdominal (RICA) (10), elaborada en 2015 y posteriormente actualizada en 2018. No se recoge ninguna recomendación específica sobre el uso de fórmulas inmunomoduladoras en este contexto clínico.
En la tabla III se resumen las recomendaciones sobre el uso de la inmunonutrición en las guías de práctica clínica analizadas.
LIMITACIONES Y FUENTES DE HETEROGENEIDAD CLÍNICA Y METODOLÓGICA
Como se ha visto, el análisis y la revisión de la bibliografía (tanto de los metaanálisis como de los ensayos clínicos) realizados ponen de manifiesto que la calidad metodológica de los estudios revisados es con frecuencia baja o muy baja según las escalas de valoración de la calidad. A su vez se constata que, en el análisis de las revisiones sistemáticas, muchas de estas agrupan y comparan estudios heterogéneos clínica y metodológicamente.
Si bien la heterogeneidad estadística se analiza y considera en todos los metaanálisis revisados, las diferencias a nivel clínico y metodológico entre los estudios incluidos no se han tenido suficientemente en cuenta en los resultados de cada trabajo. De un modo parecido, las revisiones metaanalíticas examinadas no detallaban sistemáticamente cuáles eran los fallos metodológicos de los estudios que revisaban, ni ponderaban su posible impacto sobre los resultados. En esta sección se detallan las principales fuentes de heterogeneidad a nivel clínico y metodológico halladas durante el análisis. Se describen a continuación aquellas que están frecuentemente relacionadas con el campo de la inmunonutrición y la nutrición enteral, a fin de que futuras investigaciones puedan tenerlas en cuenta (tanto en el diseño de los ensayos como en la ponderación en las revisiones metaanalíticas). Además de las mencionadas, toda nueva investigación debería considerar aquellos aspectos metodológicos o de diseño del estudio que son comunes a cualquier estudio científico y/o revisión sistemática (p. ej., la CONSORT checklist [69]).
Se han clasificado en tres categorías (Tabla IV):
ALGORITMOS BASADOS EN LOS RESULTADOS Y EN LA PRÁCTICA CLÍNICA
Considerando toda la revisión realizada de la bibliografía, así como las experiencias clínicas de los autores, se trabajó en consensuar un algoritmo sencillo, compartido por los diferentes especialistas implicados y que fuera viable en la práctica clínica habitual, sin requerir un aumento de los recursos humanos para su puesta en práctica (lo cual lo haría inviable en el contexto actual de escasez de recursos en la sanidad pública). El algoritmo resultante se muestra en las figuras 2 y 3.

Figura 2. Algoritmo para el periodo preoperatorio. En el Anexo III se pueden encontrar unas recomendaciones nutricionales adaptadas.

Figura 3. Algoritmo para el periodo posoperatorio y el alta. En el Anexo III se pueden encontrar unas recomendaciones nutricionales adaptadas.
Algunas consideraciones previas en relación con el diseño del algoritmo:
1) Teniendo en cuenta las características del paciente se identifican cuatro perfiles principales según la patología de base (oncológica o no oncológica) y según la programación de la cirugía (diferida o urgente).
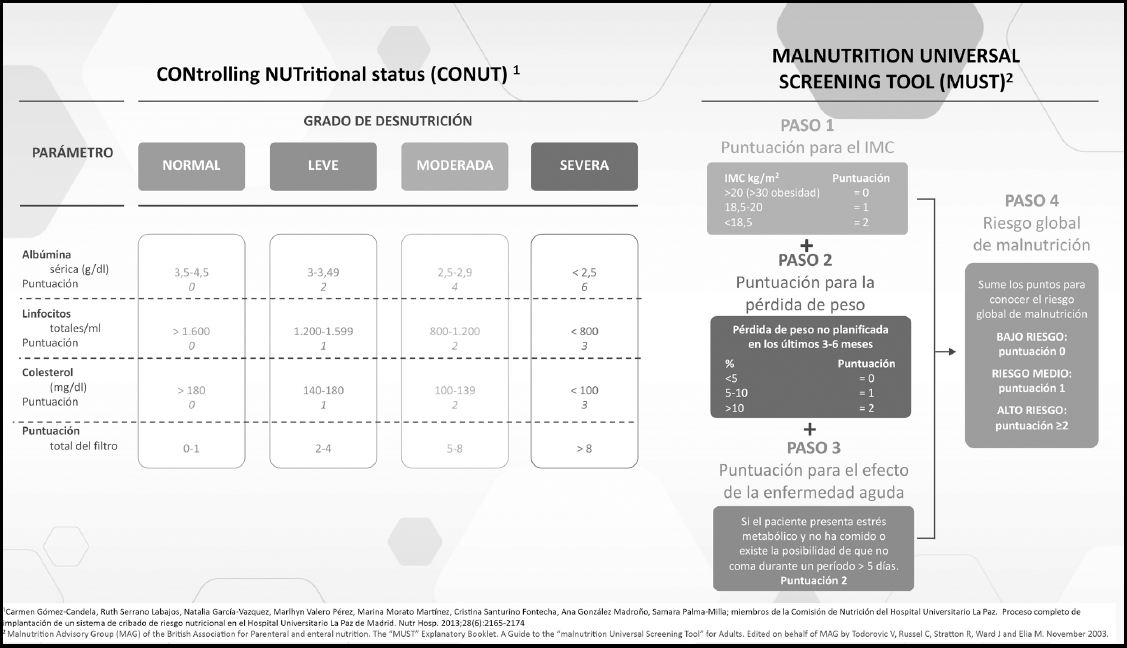
2) En nuestro entorno, si bien se reconoce el uso esporádico de la escala MUST por parte de algunos de los equipos de cirugía (que puede ser aplicada tanto por el médico como por la enfermería), su uso no está extendido ni es sistemático, y el criterio de derivación a Nutrición no está bien establecido.
3) Desde el colectivo de cirugía y anestesia se comenta que principalmente y de forma voluntaria se utiliza la escala MUST (70) (Fig. 4) para la valoración nutricional en la fase preoperatoria del paciente no hospitalizado candidato a una cirugía programada, tanto benigna como maligna. Esta escala está enfocada principalmente en valorar la variación del peso en un periodo de tiempo. Pese a no precisar pruebas analíticas y exigir muy poco tiempo para su aplicación en la visita médica, la tasa de cumplimiento por parte del equipo de cirugía y anestesia es en general bajo.
4) También se considera clave la determinación de la albuminemia para disponer de una imagen más fidedigna del estado nutricional de este tipo de paciente y de su riesgo de sufrir complicaciones. Sin embargo, también se reconoce que, generalmente, no se solicita este parámetro de forma rutinaria en la analítica preoperatoria, ni por los cirujanos, ni por los anestesistas.
5) Si bien se reconoce que la responsabilidad original del cribado nutricional debe recaer en los servicios de cirugía, también es importante reconocer que, en este sentido, el servicio de anestesia actuaría como un doble filtro y se trataría de una responsabilidad compartida por igual por ambos colectivos.
6) En el caso del paciente hospitalizado con cirugía programada, cada centro debería usar su propio método de cribado del riesgo nutricional (71,72). Los diferentes equipos deberían solicitar una valoración nutricional completa mediante una interconsulta a Nutrición con suficiente antelación cuando sea preciso, de tal forma que se pueda iniciar la re-nutrición del paciente entre 7 y 10 días antes de la cirugía, o retrasar la cirugía en caso de desnutrición grave. Harían falta protocolos consensuados en cada centro hospitalario.
7) En el caso del paciente oncológico que precisa cirugía programada podría ser muy interesante diseñar una estrategia en los numerosos comités de tumores de los centros, para que exigieran una valoración nutricional previa del paciente y la constancia de que, nutricionalmente, el paciente es apto para esa cirugía. Y si no lo fuera o no estuviera valorado, poner en marcha una valoración y un tratamiento nutricional de urgencia para llevarlo a cabo. En todo caso, consideramos y reconocemos que es técnicamente imposible que un representante de Nutrición pueda estar incorporado en todos los comités.
DISCUSIÓN
La inmunonutrición ha demostrado que es capaz de reducir las complicaciones totales, las complicaciones infecciosas y la estancia hospitalaria en los pacientes quirúrgicos.
A fin de poder determinar cuáles serían las condiciones óptimas de la intervención inmunonutricional (duración, momento de inicio, tipo de intervenciones quirúrgicas favorables/desfavorables, efecto de inmunonutrientes específicos, etc.), es necesario tener presente, no obstante, que la extracción de conclusiones generales se ve limitada por la heterogeneidad en factores como las patologías evaluadas, los resultados divergentes para una misma patología, el estado nutricional de los pacientes y los protocolos empleados. En algunos contextos (p. ej., el preoperatorio), estamos limitados para asumir una atribución de los resultados favorables a la presencia de inmunonutrientes en las fórmulas y descartar que se deban a otros factores (p. ej., una suplementación nutricional hiperproteica per se). En cualquier caso, las GPC actualmente recomiendan la administración perioperatoria de fórmulas orales/enterales específicas, enriquecidas con inmunonutrientes, en determinados contextos: p. ej., en los protocolos quirúrgicos tradicionales del tubo gastrointestinal superior (grado de recomendación fuerte) (56) o en los pacientes malnutridos intervenidos por cáncer colorrectal (grado de recomendación fuerte) (62).
Sería necesario llevar a cabo estudios adicionales pero que en su diseño tuvieran en cuenta, además de lo comúnmente exigible a un ensayo clínico (uso de procesos robustos de enmascaramiento y control, tamaños muestrales adecuados, etc.), las peculiaridades y fuentes de heterogeneidad propias del campo de la inmunonutrición (pacientes estratificados según su estatus nutricional, uso de controles isocalóricos e isoproteicos, registro adecuado del cumplimiento de tomas, etc.), cuya omisión ha limitado, en la revisión de la literatura, la determinación de conclusiones y recomendaciones sólidas en varios puntos del proceso que todavía hoy no se han esclarecido.
También es necesario tener presente la barrera que supone el hecho de que los aspectos nutricionales parecen ser secundarios, especialmente en el colectivo de cirujanos o anestesistas. La esfera nutricional dispone de una consideración menor tanto en la fase preoperatoria como en la fase posoperatoria. Se asocia este fenómeno a falta de conocimientos adecuados, de protocolos y de interacciones apropiadas entre estos servicios y el de nutrición. También se considera importante la escasez de personal en los diferentes servicios. Esta situación todavía se agrava más en los procedimientos fast-track, de implementación parcial o incompleta en muchos centros, y donde se tiene que vigilar con mayor precisión que la intervención de todos los actores se realice en el tiempo y la forma adecuados. Así, y fruto de la comprensión de la situación actual con respecto al soporte nutricional en el paciente quirúrgico, y especialmente en el modelo fast-track, las posibles actuaciones a llevar a cabo pasarían por aumentar el conocimiento específico en esta materia de todos los profesionales implicados, principalmente en las área de cirugía, anestesia y nutrición. En este sentido, en el recientemente publicado documento de recomendaciones de cuidados perioperatorios, el grupo de expertos de la ESPEN afirma que los programas ERAS son apropiados para todos los pacientes, pero que sus beneficios dependen del cumplimiento de las recomendaciones por parte de todo el equipo implicado (73).
Para una óptima validez de los resultados sería necesario que todas las posibles investigaciones futuras en este campo evaluasen a pacientes sometidos a procedimientos quirúrgicos equiparables en cuanto a parámetros clínicos, bioquímicos y analíticos en relación con el estado nutricional; y la morbilidad posoperatoria debería registrarse según clasificaciones previamente definidas en la literatura, como la clasificación Clavien-Dindo (28) (1), las guías del International Council for Harmonisation Good Clinical Practice (ICH-GCP) (74) (2), las definiciones de los Centers for Disease Control (CDC) (75,76), etc. Y de un modo parecido, deberían incluirse como variables la estancia hospitalaria, los costes y los reingresos.
El cumplimiento de un protocolo estandarizado como el ERAS ayudaría a que estuvieran objetivamente definidos muchos de los otros parámetros no nutricionales que también se tienen que controlar (como una profilaxis antibiótica correcta, la hipotermia, etc.).
Finalmente, es necesario implicar al paciente y trabajar para que tanto él como sus familiares conozcan la importancia que tiene un adecuado estado nutricional en el éxito de la cirugía y en la recuperación tras la misma, para que sean más colaboradores y se hagan más demandantes de medidas de valoración y de soporte nutricional, y por supuesto, para que estén más satisfechos.