INTRODUCCIÓN
El síndrome metabólico (SM), que afecta aproximadamente al 30 % de la población femenina mayor de 50 años y que en la posmenopausia se asocia con un aumento destacado del riesgo cardiovascular (1), se ha definido como un grupo de factores de riesgo cardiometabólico y comorbilidades que transmiten una alta probabilidad de enfermedad cardiovascular y diabetes de tipo 2 (2). Entre las medidas a llevar a cabo para combatir este síndrome está sin duda realizar una alimentación más saludable. Se ha estudiado que una mayor cantidad circulante de ácidos grasos poliinsaturados omega 3 (AGPI ω-3) está inversamente asociada al riesgo de desarrollar el SM (3), y por esta causa, desde hace unos años se está recomendando mejorar la proporción de AGPI dentro del consumo diario de grasas (4).
Por otra parte, el síndrome metabólico se ha asociado con la obesidad (5) y esta se ha relacionado con un aumento del estrés oxidativo y un estado proinflamatorio que aumenta los requerimientos de antioxidantes, entre ellos el selenio (6). La ingesta diaria recomendada de este microelemento en adultos está regulada en la Unión Europea por el Reglamento 1169/2011, que establece en su ANEXO XIII la cantidad de 55 µg diarios (7); no obstante, esta cifra no asegura que se cumplan los estándares mínimos entre las diferentes poblaciones. Es de destacar la opinión de los expertos (8), que eleva esta recomendación para adultos hasta 70 µg/día, aunque este valor también se ha considerado conservador e insuficiente (9). En España se han realizado pocos estudios sobre los niveles poblacionales de selenio y se ha considerado que el 25 % de la población no alcanzan el valor recomendado (10). Por este motivo se puede considerar beneficioso el consumo de alimentos que contengan una cantidad significativa de este esencial oligoelemento.
Por los argumentos anteriormente mencionados, el objetivo del presente estudio fue evaluar si el consumo de productos lácteos, enriquecidos de forma natural con AGPI ω-3 y selenio (11), aumenta los niveles en plasma del mismo y consigue mejorar los factores de riesgo cardiovascular en una muestra de mujeres posmenopáusicas con síndrome metabólico.
MATERIAL Y MÉTODOS
DISEÑO, ÁMBITO Y PACIENTES
El estudio se ha diseñado como un ensayo clínico aleatorizado (ECA), triple ciego y controlado por placebo. La investigación se ha realizado en el ámbito de la atención primaria, en tres centros de salud urbanos. Las mujeres participantes fueron captadas por el personal médico de dichos centros durante los meses de abril, mayo y junio de 2018, teniendo en cuenta los criterios de inclusión y exclusión. Una vez firmado el consentimiento informado, en el mes de julio todas las mujeres se sometieron a diferentes mediciones.
Como criterios de inclusión se contemplaron: mujeres posmenopáusicas (con más de 12 meses de amenorrea espontánea) de edades comprendidas entre los 50 y 65 años de edad, con capacidad de decidir, que tomasen habitualmente lácteos y estuviesen diagnosticadas de síndrome metabólico, según la definición de este síndrome (12), que requiere cumplir al menos tres de los cinco criterios siguientes: 1) Perímetro de cintura ≥ 88 cm. 2) Glucemia ≥ 100 mg/dl o recibir fármacos antidiabéticos. 3) Presión arterial sistólica (PAS) ≥ 130 mmHg o presión arterial diastólica (PAD) > 85 mmHg o recibir fármacos antihipertensivos. 4) Trigliceridemia ≥ 150 mg/dl. 5) c-HDL en suero < 50 mg/dl. Los criterios de exclusión fueron tener antecedentes de enfermedad cardiovascular y/o trombosis, y un diagnóstico establecido o sospecha clínica de insuficiencia renal o hepática, infecciones crónicas, enfermedades hemáticas, enfermedad tiroidea o diabetes de tipo I. También se excluyeron las mujeres en tratamiento con estatinas y/o terapia hormonal sustitutoria, las que consumían suplementos alimenticios del tipo de los AGPI ω-3, las intolerantes y/o alérgicas a la lactosa y/o a las proteínas de vaca, las que tuviesen una enfermedad o situación psíquica que desaconsejase su participación o imposibilitase el desplazarse de forma autónoma, las que en el último año hubiesen participado en otro ensayo clínico con medicamentos o en otros estudios experimentales, y por último las mujeres que no firmasen el consentimiento informado.
INTERVENCIÓN
Las mujeres del estudio, además de ser instruidas para mantener su dieta habitual, recibieron en su domicilio en la primera semana de septiembre de 2018, y luego cada 15 días y durante tres meses, un lote de productos lácteos compuesto de leche, yogures y queso fresco. Así mismo se adjuntaba un folleto informativo con instrucciones para consumir estos alimentos dentro de las pautas dietéticas recomendadas (8): una ración diaria de 200 ml de leche en el desayuno, 1 yogur diario en el almuerzo o la cena y 250 g de queso fresco repartido en dos o tres veces a la semana. Las mujeres del grupo de control recibieron productos lácteos elaborados con leche entera convencional (queso y yogur) y semidesnatada (leche), mientras que las mujeres del grupo intervención recibieron productos lácteos elaborados con la leche a estudio, rica en selenio y en AGPI ω-3, entera (queso y yogur) y semidesnatada (leche). Un miembro del equipo investigador se encargó de monitorizar el seguimiento, llamando por teléfono una vez a la semana a las participantes.
Finalizado el periodo de intervención de 3 meses se repitieron las determinaciones iniciales.
La leche a estudio, marca Ünicla, comercializada desde el año 2009, nació como resultado de la colaboración de la empresa Feiraco con la Universidad de Santiago de Compostela en el desarrollo de un proyecto financiado por el gobierno autonómico gallego (13). El objetivo de dicho proyecto era conseguir un nuevo tipo de leche que tuviese una composición más saludable. Para ello, los investigadores alimentaron al ganado con raciones equilibradas que incluyeran una cantidad significativa de semillas de lino, que constituyen una fuente de AGPI ω-3, y con levadura selenizada, como fuente de selenio orgánico. De este modo, el producto final, la leche, estaba enriquecida de forma natural con selenio y AGPI ω-3 (11). Con el aporte diario de productos lácteos Ünicla, las mujeres del grupo experimental suplementaban la dieta con una media de 52,4 µg/día de selenio, 39,6 µg/día por encima de la media que las mujeres del grupo de control; 500,5 mg de AGPI ω-3, 393,8 mg más que los controles, y 15,5 g de grasas saturadas, -3,2 g por debajo de los controles. La composición de ambas leches puede observarse en la tabla I.
RESULTADOS Y CÁLCULO DEL TAMAÑO MUESTRAL
La variable a valorar primaria fue el nivel de selenio en plasma; como variable de valoración secundaria se consideró la mejora de los criterios del síndrome metabólico. Por tanto, el tamaño de la muestra se calculó esperando encontrar diferencias positivas de selenio en plasma y, asumiendo que estas diferencias fuesen de en torno al 50 % entre el grupo control y el grupo experimental, se incluyeron 20 sujetos en cada grupo para un nivel de confianza del 95 %, con una potencia del 83 % para detectar diferencias estadísticamente significativas entre los grupos. Debido a los posibles abandonos o pérdidas durante el seguimiento, finalmente se incluyeron 23 pacientes por grupo.
ALEATORIZACIÓN, ASIGNACIÓN Y ENMASCARAMIENTO
Una vez finalizadas las mediciones basales de todas las mujeres, la muestra se dividió de forma aleatoria en dos grupos paralelos: grupo de control y grupo de intervención. Para la asignación aleatoria de los sujetos a cada uno de los dos grupos se utilizó una secuencia generada por un software específico manejado por un técnico ajeno al estudio. El proceso de enmascaramiento fue de triple ciego, es decir, ni las mujeres participantes, ni el personal investigador (incluyendo el encargado de entregar los productos y el que realiza e interpreta las mediciones), ni el analista supieron en ningún momento a qué grupo pertenecían las pacientes.
Todos los productos del estudio (lácteos Ünicla y lácteos convencionales) mantuvieron un formato y etiquetado similar. El enmascaramiento finalizó en el momento en que se realizó la última interpretación de los datos del último sujeto incluido y antes de iniciar el análisis estadístico.
MEDICIONES
A todas las pacientes se les tomó basalmente información relacionada con aspectos sociodemográficos y del estilo de vida. Las variables antropométricas se midieron en dos ocasiones con los mismos sistemas de medición y por el mismo personal. Se estudiaron: talla en cm (estadiómetro SECA 217), peso (kg) y porcentaje de grasa corporal (Tanita SC-240MA), siguiéndose el protocolo establecido para las mediciones por bioimpedancia (14); el índice de masa corporal (IMC) se calculó como el peso en kg dividido por la altura en metros al cuadrado (kg/m2). El perímetro de la cintura se midió con cinta antropométrica en el punto medio entre la última costilla y la cresta ilíaca en espiración. Se recogieron también parámetros hemodinámicos, PAS, PAD y frecuencia cardíaca (FC), con el tensiómetro Omrom M-2, siguiendo las recomendaciones del protocolo internacional (15).
A todas las mujeres se les tomaron muestras de sangre en el laboratorio del hospital de referencia tras 12 horas de ayuno. Se estudiaron: c total (mg/dl), c-LDL (mg/dl), c-HDL (mg/dl), colesterol unido a lipoproteínas de muy baja densidad (c-VLDL) (mg/dl), triglicéridos (mg/dl), glucosa (mg/dl), insulina (µUI/ml), evaluación del modelo homeostático de resistencia a la insulina (HOMA-IR), nivel de selenio en plasma (µg/L) y AGPI ω-3 (mg).
ANÁLISIS ESTADÍSTICO
Se realizaron análisis descriptivos (expresando las variables continuas en forma de media e intervalo de confianza del 95 % (IC 95 %) y desviación estándar (DS), y las cualitativas en frecuencias absolutas y porcentajes; como test de comparaciones se usó la t de Student para muestras independientes y apareadas. Para las variables que no seguían una distribución normal (test de Shapiro-Wilks) se usaron los test no paramétricos de la U de Mann-Whitney y de Wilcoxon. Se realizó el test ANOVA de medidas repetidas de dos factores para evaluar la interacción entre el tiempo de la intervención (pre y postintervención) y el tipo de intervención (control frente a experimental). Se realizaron análisis por intención de tratar para mantener las ventajas de la aleatorización respecto a las variables, conocidas o no, que pudiesen influir en los resultados, y análisis por protocolo. Las pérdidas del estudio se analizaron separadamente.
Para el análisis de la información se elaboró una base de datos con el programa Data-entry 4.0, que fue analizada con el programa informático SPSS 19.0.
RESULTADOS
CARACTERÍSTICAS BASALES DE LAS PARTICIPANTES
De las 688 mujeres diagnosticadas de SM en los tres centros de salud participantes, 558 (81,5 %) no cumplían los criterios de inclusión, 22 (3,2 %) no pudieron ser contactadas y 62 (9 %) no aceptaron participar. Por último, fueron 46 las mujeres que iniciaron el estudio, finalizándolo 44 (tasa de abandono del 4,3 %), 23 en el grupo control y 21 en el grupo experimental. Los 2 casos perdidos en el grupo experimental no quisieron continuar el estudio una vez finalizada la toma de los datos basales. En la figura 1 se muestra el diagrama de flujo del estudio según CONSORT.
En la tabla II se pueden observar las características epidemiológicas de ambos grupos antes de iniciar la intervención, así como su homogeneidad, no existiendo diferencias estadísticamente significativas entre las mujeres de ambos brazos, excepto para la variable de presión arterial sistólica.
Tabla II. Comparación de las características sociodemográficas y epidemiológicas basales (T0) de ambos grupos con su valor p
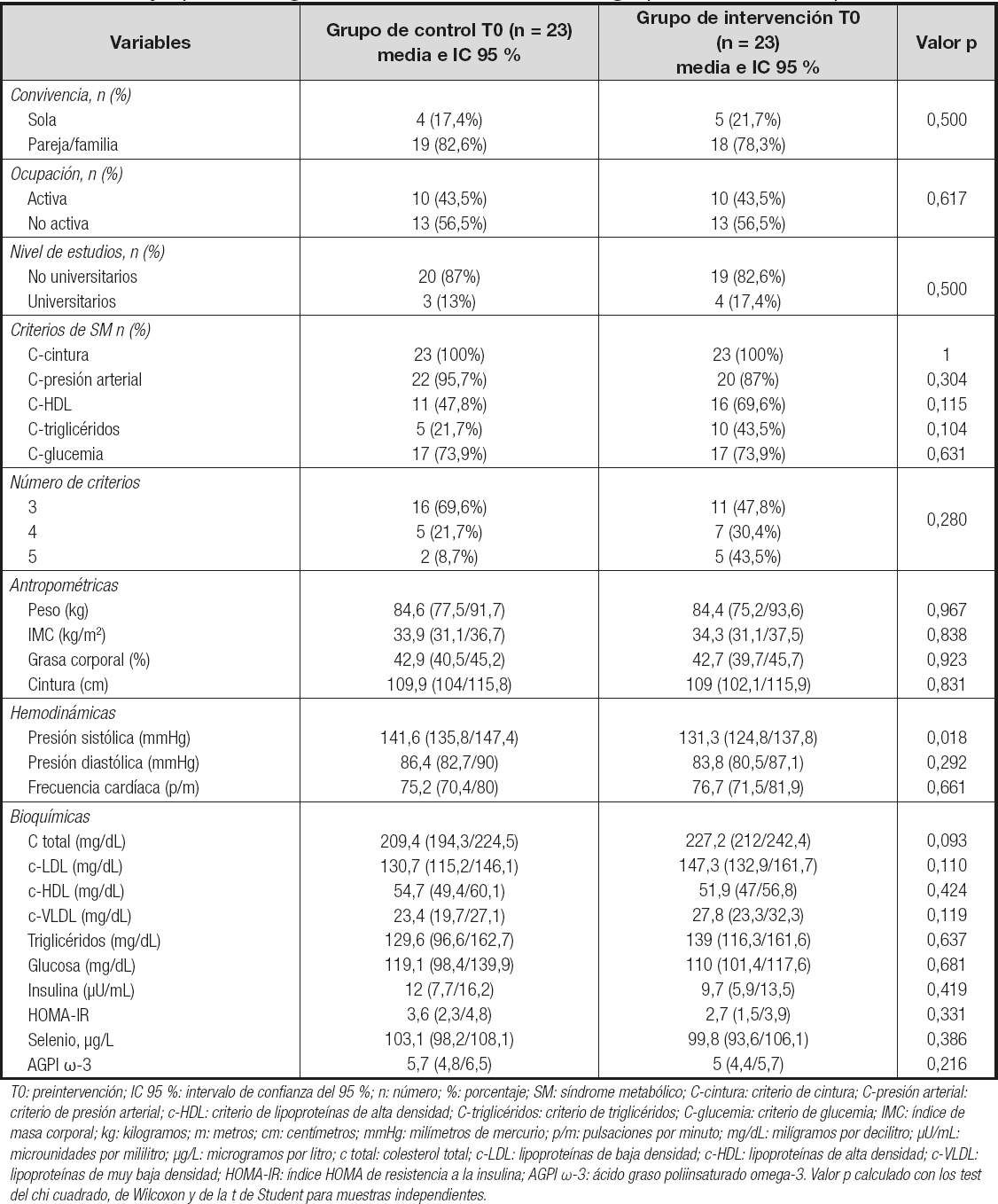
T0: preintervención; IC 95 %: intervalo de confianza del 95 %; n: número; %: porcentaje; SM: síndrome metabólico; C-cintura: criterio de cintura; C-presión arterial: criterio de presión arterial; c-HDL: criterio de lipoproteínas de alta densidad; C-triglicéridos: criterio de triglicéridos; C-glucemia: criterio de glucemia; IMC: índice de masa corporal; kg: kilogramos; m: metros; cm: centímetros; mmHg: milímetros de mercurio; p/m: pulsaciones por minuto; mg/dL: milígramos por decilitro; µU/mL: microunidades por mililitro; µg/L: microgramos por litro; c total: colesterol total; c-LDL: lipoproteínas de baja densidad; c-HDL: lipoproteínas de alta densidad; c-VLDL: lipoproteínas de muy baja densidad; HOMA-IR: índice HOMA de resistencia a la insulina; AGPI ω-3: ácido graso poliinsaturado omega-3. Valor p calculado con los test del chi cuadrado, de Wilcoxon y de la t de Student para muestras independientes.
RESULTADO PRIMARIO
Al analizar la variable primaria del estudio, el nivel de selenio en plasma, hemos observado que este ha aumentado de forma significativa en el grupo experimental, pasando de 99,8 µg/L (IC 95 %: 93,6/106,1) a 107,5 µg/L (IC 95 %: 102/113) (p ≤ 0,001). En los controles se observa así mismo una reducción también significativa, pasando de 103,1 µg/L (IC 95 %: 98,2/108,1) a 98,6 µg/L (IC 95 %: 93,5/103,7) (p = 0,014). Del mismo modo, al comparar la diferencia de medias de selenio en plasma entre los controles (-4,5 µg/L; IC 95 %: -8/-1) y el grupo experimental (7,2; IC 95 %: 3,7/10,8), la diferencia también resulta significativa (p ≤ 0,001) (Tablas III y IV).
Tabla III. Variables analizadas en los grupos de control e intervención antes y después de la intervención, con su valor de p. ANOVA de medidas repetidas. Datos expresados en medias e intervalos de confianza del 95 %

T0: preintervención; T1: postintervención; IC 95 %: intervalo de confianza del 95 %; aANOVA de medidas repetidas; η2: tamaño del efecto; n: muestra; IMC: índice de masa corporal; kg: kilogramos; m: metros; cm: centímetros; mmHg: milímetros de mercurio; p/m: pulsaciones por minuto; mg/dl: milígramos por decilitro; µU/ml: microunidades por mililitro; µg/L: microgramos por litro; c total: colesterol total; c-LDL: lipoproteínas de baja densidad; c-HDL: lipoproteínas de alta densidad; c-VLDL: lipoproteínas de muy baja densidad; HOMA-IR: resistencia a la insulina; AGPI .-3: ácido graso poliinsaturado omega-3. Valor de p calculado utilizando el test de la t de Student para muestras relacionadas.
Tabla IV. Contraste de las diferencias de medias entre ambos grupos al finalizar la intervención (T1- T0) y sus valores de p. Datos expresados en medias e intervalos de confianza del 95 %

Δ: media; T0: preintervención; T1: postintervención; IC: intervalo de confianza del 95 %; n: muestra; IMC: índice masa corporal; kg: kilogramos; m: metros; cm: centímetros; mmHg: milímetros de mercurio; p/m: pulsaciones por minuto; mg/dL: milígramos por decilitro; µU/mL: microunidades por mililitro; µg/L: microgramos por litro; c total: colesterol total; c-LDL: lipoproteínas de baja densidad; c-HDL: lipoproteínas de alta densidad; c-VLDL: lipoproteínas de muy baja densidad; HOMA-IR: resistencia a la insulina; AGPI ω-3: ácido graso poliinsaturado omega-3. Valor de p calculado utilizando el test de la t de Student para muestras independientes y el test de la U de Man-Whytney*.
RESULTADOS SECUNDARIOS
Niveles de AGPI ω-3
Ambos grupos aumentaron sus niveles de AGPI ω-3 de forma significativa; el grupo de control pasó de 5,7 mg (IC 95 %: 4,8/6,5) a 8,2 mg (IC 95 %: 7,3/9,1) (p = 0,001) y el grupo experimental de 5 mg (IC 95 %: 4,4/5,7) a 8,3 mg (IC 95 %: 7,4/9,1) (p < 0,001). No hubo diferencias significativas entre ambos grupos una vez finalizada la intervención (Tablas III y IV).
Variables antropométricas
Respecto a la grasa corporal, en las mujeres del grupo experimental no se observaron cambios después de la intervención; sin embargo, sí ha disminuido el perímetro de la cintura, siendo antes de 109 cm (IC 95 %; 102/115,9) y después de 106,1 cm (IC 95 %: 100,1/112,2) (p = 0,010). Del mismo modo, también se ha reducido de forma significativa el IMC, presentando antes 34,3 m/kg2 (IC 95 %: 31,1/37,5) y después 33,4 m/kg2 (IC 95 %: 30,7/36,1) (p = 0,047). Por otra parte, las mujeres del grupo de control no presentaron cambios en las mismas variables al observar las mediciones de los dos periodos (Tabla III). Al comparar estos datos entre ambos grupos una vez finalizada la intervención, estos no han presentado cambios significativos (Tabla IV).
Variables hemodinámicas
En la evolución de las variables hemodinámicas no se han observado cambios ni en la PAD ni en la FC (Tablas III y IV). Tampoco se ha observado variación en la PAS del grupo experimental. Sin embargo, en el grupo de control ha disminuido significativamente después de la intervención, pasando de 141,6 mmHg (IC 95 %: 135,8/147,4) a 131,4 mmHg (IC 95 %: 124,9/137,8), p < 0,001. Por otra parte, el resultado de la comparación de la PAS entre ambos grupos no se ha tomado en consideración al no ser estos basalmente homogéneos (Tablas III y IV).
Variables bioquímicas
Respecto al perfil lipídico, se han encontrado cambios significativos en el c-HDL, que ha aumentado en las mujeres de ambos grupos, siendo mayor la diferencia en el caso de las mujeres del grupo de intervención, siendo antes de 51,9 mg/dL (IC 95 %: 47/56,8) y después de 57 mg/dL (IC 95 %: 51,9/62) (p < 0,001), que en los controles, antes con 54,7 mg/dL (IC 95 %: 49,4/60,1) y después con 57,4 mg/dL (IC 95 %: 52,3/62,4) (p = 0,025) (Tabla III). Al comparar las diferencias de medias en el perfil lipídico entre ambos grupos, el c-VLDL ha disminuido en el grupo experimental de forma significativa (controles: 1,9; IC 95 %: -0,7/4,5 y experimental: -2,3; IC 95 %: -5,6/1) (p = 0,043) (Tabla IV).
No se han observado cambios significativos en las variables relacionadas con el metabolismo de la glucosa, ni en la evolución de cada grupo (Tabla III), ni entre ambos grupos una vez finalizada la intervención (Tabla IV).
DISCUSIÓN
El objetivo del presente estudio fue evaluar si el consumo de productos lácteos enriquecidos de forma natural con selenio y AGPI ω-3, en una muestra de mujeres posmenopáusicas con síndrome metabólico, aumentaba los niveles de este oligoelemento a nivel plasmático (resultado principal) y conseguía mejorar los factores de riesgo cardiometabólico, objetivos que se han conseguido. Las mujeres del grupo experimental mejoraron con respecto a ellas mismas el perímetro de la cintura, el IMC, el c-HDL y el selenio, y este último parámetro, junto con el c-VLDL, también lo mejoraron con respecto a los controles.
Hace algunos años se realizó un estudio para comprobar si había deficiencia de selenio en la población española (16), estudio que situaba a la comunidad autónoma de Galicia entre las posibles afectadas. Atendiendo a estos antecedentes, se produce en Galicia (España) y comercializa en la Unión Europea y terceros países una leche enriquecida de forma natural con selenio y AGPI ω-3 que se ha utilizado en el presente estudio (13). En nuestro trabajo, las mujeres del grupo experimental presentaban basalmente una media de selenio en plasma de 98,4 µg/L (IC 95 %: 92,3/104,4), similar a la reportada por Lu y cols. en su trabajo de casos y controles sobre el síndrome metabólico (17). Tres meses después de tomar los lácteos que aportaban una cantidad media de selenio de 52,4 µg/día, estas mujeres han pasado a tener en plasma 9,1 µg/L más, resultado que está en línea con el trabajo de Hurts y cols. (18). Estos autores suplementaron uno de los brazos de su ECA con harina de cebollas cultivadas en suelos enriquecidos con selenio y mostraron, al igual que el presente estudio, que el incremento de este oligoelemento en la dieta puede mejorar los niveles plasmáticos del mismo. Curiosamente, las mujeres del grupo de control de nuestro trabajo disminuyeron su media tras la intervención, aspecto también observado en los controles del ECA de Faghihi y cols. (19). En ese trabajo, los autores estudiaban en una muestra de 70 sujetos con diabetes de tipo II el comportamiento de una suplementación de 200 µg/día de selenio (mediante tabletas), pero en este caso, el placebo suministrado a los controles no contenía selenio. Este aspecto difiere de nuestro estudio, ya que los lácteos convencionales suministrados a las mujeres del grupo control aportaban una media de 12,7 µg/día del microelemento, cantidad que, si bien podría ser limitada para producir incrementos relevantes del mismo a nivel plasmático, no tendría por qué ocasionar un descenso de la media una vez finalizado el estudio. Se podría argumentar ante este hecho que las mujeres participantes estaban diagnosticadas de síndrome metabólico y que en este síndrome la obesidad, que cursa como un estado proinflamatorio, resulta prevalente (20). También se sabe que, en circunstancias de inflamación sistémica, se pueden ver reducidas las concentraciones plasmáticas de selenio (21). No obstante, este infrecuente hallazgo requiere más investigación por parte de los autores.
Por otra parte, al estudiar el perímetro de la cintura y el IMC, nuestros resultados reflejan una mejora de ambas variables en las mujeres del grupo experimental, pues los dos parámetros se han reducido de forma significativa desde el inicio del estudio. Sin embargo, las mujeres del grupo de control no han variado en cuanto a estos mismos parámetros una vez finalizada la intervención. En la literatura se pueden encontrar resultados no coincidentes con los nuestros (22). No obstante, el trabajo de Wang y cols. (23) sí está en la misma línea. Estos autores observaron que una mayor ingesta de selenio, tanto en hombres como en mujeres, se asociaba inversamente a un menor perímetro de la cintura, IMC y porcentaje de grasa corporal. Así mismo, en el estudio de Zhong y cols. (24) también encontraron una asociación inversa entre la concentración del micronutriente con el IMC y la grasa corporal. Actualmente, como hemos comprobado, no hay consenso sobre la asociación entre el selenio y determinados parámetros indicativos de obesidad. No obstante, en el presente estudio, las mujeres del grupo experimental alcanzaron una mayor concentración plasmática de selenio y en este grupo disminuyeron el perímetro de la cintura y el IMC, aspecto que coincide con una reciente revisión sistemática (25) en que parece que el selenio y las selenoproteínas juegan un papel esencial en la fisiología del tejido adiposo.
Respecto a los parámetros hemodinámicos, tanto la PAD como la FC no mostraron cambios después de la intervención, resultados coincidentes con otros estudios (26). Sin embargo, la PAS del grupo de control, que era en su medición basal significativamente superior a la del grupo de intervención, ha visto disminuido su valor de forma significativa tomando leche convencional. Este hecho se ha observado en diferentes trabajos y concretamente en una revisión sistemática (27) que informa de la inversa relación existente entre el consumo de productos lácteos y la hipertensión. Por otro lado, después de la intervención, la PAS de las mujeres del grupo experimental no se ha visto modificada y esta circunstancia podría deberse a que, aun partiendo de cifras patológicas, al estar estas próximas al rango de normalidad, este efecto reductor de los lácteos puede resultar limitado. Por último, la PAS de ambos grupos después de la intervención no se puede comparar, al no ser esta basalmente homogénea.
La relación entre selenio y perfil lipídico ha sido estudiada por diferentes investigadores y presenta resultados no concluyentes tanto en estudios longitudinales (28,17, 29) como en ECA (30-32). En el presente trabajo, las modificaciones del perfil lipídico se presentaron en dos parámetros. El c-HDL mejoró significativamente en ambos brazos del estudio, aunque el aumento fue superior en el grupo experimental. El otro parámetro, el colesterol VLDL, ha disminuido en las mujeres del grupo de intervención de forma significativa con respecto al grupo de control. En esta línea, es interesante recordar que muchos de los efectos beneficiosos de la leche y los derivados lácteos se deben a las interacciones entre los nutrientes y no solo a la acción de cada uno de esos nutrientes por separado (33); quizás por este motivo, la mejora de las cifras de c-HDL y VLDL ha podido producirse por estar enriquecida la leche con AGPI ω-3. No obstante, no hemos observado diferencias relevantes entre las mujeres de ambos grupos y ante este extraño hallazgo podríamos sugerir la siguiente explicación: por una parte, hemos elegido el perfil de ácidos grasos en las membranas de los eritrocitos y no en el suero sanguíneo por ser igualmente fácil de obtener y porque, en general, se acepta que son representativos de lo que ocurre en otras membranas en relación con la acumulación de omega-6 (ω-6) y ω-3 en su estructura. La funcionalidad a partir de la incorporación de los ácidos grasos ω-3 a las membranas celulares se ejerce a través de segundos mensajeros (eicosanoides) a partir de transformaciones enzimáticas (34). Una de ellas transforma el ω-3 de la leche (en su mayoría ácido linolénico) en sus derivados EPA y DHA para su posterior incorporación a la membrana. Esta ruta enzimática es compartida por ω-6 y ω-3, y su “entrada” a la transformación es por concurrencia competitiva, en función de la proporción entre ambos y la distinta afinidad enzimática por unos u otros. Esta cascada de transformación enzimática puede discriminar negativamente a los ω-3 como consecuencia del metabolismo alterado, y esto podría explicar el pobre incremento de este ácido graso en las membranas eritrocitarias de las mujeres del grupo experimental. No obstante, los resultados positivos se podrían justificar porque existen otras vías de funcionalidad de los ω-3, como la vía epigenética, en la cual los ácidos grasos interactuarían directamente con los receptores nucleares, ejerciendo una modulación del metabolismo más específica que como elementos estructurales o reserva energética (34).
Por otra parte, y según sugieren Li y cols. (35), en el reemplazo de grasas saturadas por grasas no saturadas se observa una asociación inversa con las enfermedades cardiovasculares, siendo consistente esta observación con el trabajo publicado por Soto-Méndez y cols. (36), que han planteado que la fortificación de productos lácteos con fitosteroles y AGPI ω-3 parece ser un buen enfoque para mejorar los biomarcadores de riesgo cardiometabólico. Este hallazgo y otros en la misma línea (37) han supuesto que algunas importantes asociaciones, como la American Heart Association, planteen en sus guías sustituir los ácidos grasos saturados por los no saturados y, mejor aun, por los poliinsaturados (4).
Al igual que ocurre con las mediciones somáticas y con los lípidos en sangre, la asociación entre la suplementación con selenio y el metabolismo de la glucosa actualmente se considera controvertida (38). Esta variabilidad, e incluso contradicción, en los resultados obtenidos por diferentes investigadores podría tener su causa, entre otras, en el origen de la fuente de selenio utilizada (levadura selenizada, selenito de sodio o selenometionina sintética), los heterogéneos niveles basales de selenio en plasma de las poblaciones estudiadas o la variabilidad en las suplementaciones aportadas (38). En nuestro trabajo no hemos observado cambios significativos en los parámetros relacionados con el metabolismo de la glucosa, y estos se han mantenido en similares niveles después de la intervención, aspecto que coincide con otro reciente trabajo (39).
En cuanto a las fortalezas del presente estudio, destacaremos que la muestra era homogénea y con unas particularidades muy concretas, ya que el perfil de la mujer en la etapa posmenopáusica resulta muy diferente al de otras fases de la vida y en él se hacen patentes riesgos para la salud que necesitan estudiarse en profundidad (40). Además, debemos tener en cuenta que en gran parte de las investigaciones que tratan las patologías de la esfera cardiovascular se incluyen mayoritariamente varones y esta práctica dificulta un mejor conocimiento de esta enfermedad en las mujeres.
Otra particularidad a destacar del presente trabajo, es la característica especial del producto ensayado, que además de llevar más de 10 años comercializado, no se trata de un suplemento alimenticio sino de leche, un alimento completo, que además se distingue de otras leches por una alimentación específica aportada a las vacas y que estas incorporan de forma natural a los propios nutrientes de la leche.
Por otra parte, hasta el momento no se han realizado trabajos que valoren el efecto de una intervención alimentaria con lácteos enriquecidos de forma natural en selenio y AGPI ω-3 en mujeres posmenopáusicas con síndrome metabólico. Si bien está reconocido el beneficioso efecto que supone el consumo de grasas con un perfil metabólicamente más saludable como los AGPI ω-3 (4), los suplementos de selenio han planteado cierta controversia. No obstante, la cantidad de selenio suplementada con los lácteos Ünicla en este ensayo ha conseguido que las mujeres del grupo experimental alcanzasen cifras de selenio en plasma consideradas óptimas (8) e incluso pudiesen mejorar dos de los cinco criterios diagnósticos del síndrome metabólico.
Entre las limitaciones encontradas en el presente trabajo hemos de señalar que la muestra era pequeña y que, aunque permitió detectar diferencias significativas, el efecto de la intervención debe considerarse con cautela. Así mismo, al tratarse de una población local, la posibilidad de generalizar los hallazgos es limitada, ya que solo hubo un entorno de estudio. Por ello sería interesante realizar nuevos trabajos con muestras mayores y con participantes de lugares geográficos diversos. Por otra parte, aunque inevitable en los ECA, el posible sesgo de atrición, por el abandono de los sujetos a estudio durante la recolección de datos (dejar de participar, rehusar seguir colaborando, fallecimiento, cambio de ciudad, etc)., en nuestro estudio la tasa de abandono se situó en el 4,3 %, pudiéndose considerar este un valor aceptable.
CONCLUSIONES
Con este estudio se ha evidenciado que, en una muestra de mujeres posmenopáusicas con síndrome metabólico, una intervención alimentaria con lácteos enriquecidos de forma natural con selenio y AGPI ω-3 puede resultar una estrategia eficaz para mejorar el nivel plasmático de selenio y de c-VLDL, así como algunos de los parámetros definitorios del síndrome metabólico, como el perímetro de la cintura y el colesterol unido a HDL. Sería interesante comprobar si en una muestra más amplia se pueden confirmar estos resultados.
















