INTRODUCCIÓN
Una cepa nueva de coronavirus se describió en Wuhan (China) en diciembre de 2019. Desde entonces, este virus se ha diseminado por prácticamente la totalidad de los países del mundo. El espectro de la enfermedad es muy variable: va desde la infección asintomática hasta la neumonía complicada con síndrome respiratorio agudo severo (SARS), el shock séptico y el fallo multiorgánico. Las personas de edad avanzada o con enfermedades crónicas presentan un cuadro clínico más grave (1). Aproximadamente, 1 de cada 5 individuos que padecen la enfermedad desarrollan insuficiencia respiratoria aguda, con necesidad de ingreso en una unidad de cuidados intensivos (UCI) (2).
Una terapia nutricional precoz en el paciente crítico, preferiblemente utilizando la vía enteral, ha demostrado ser una estrategia terapéutica que puede reducir la severidad de la enfermedad y disminuir las complicaciones y el tiempo de estancia en la UCI (3). Algunos enfermos requieren nutrición parenteral (NP) cuando la nutrición enteral (NE) está contraindicada o no es capaz de cubrir la totalidad de las necesidades nutricionales. La NP no está exenta de riesgo: se asocia a diferentes complicaciones, como hiperglucemia, alteración del perfil lipídico, infección asociada al catéter venoso central (IAC) y enfermedad hepática asociada a la NP (4). Se han descrito diferentes factores de riesgo relacionados con estas complicaciones, como la presencia de obesidad, diabetes mellitus (DM) o sepsis; el uso de fármacos, como corticoides, inhibidores de la bomba de protones, benzodiacepinas y antibióticos, y el tipo de lípidos aportado en la NP (5). Además, los pacientes críticos por SARS-CoV-2, debido a la respuesta inflamatoria sistémica y al uso de fármacos concomitantes, pueden presentar resistencia a la insulina, aumento de la lipólisis y alteración del metabolismo de las proteínas, con mayor riesgo de complicaciones asociadas a la NP (6). Se desconoce el papel que tienen estas complicaciones en la evolución de los enfermos con SARS-CoV-2.
El objetivo de este estudio fue conocer la incidencia, los factores de riesgo relacionados y el efecto sobre la mortalidad de las complicaciones asociadas a la NP en los pacientes ingresados con infección por coronavirus en la UCI durante la pandemia de 2020.
MATERIAL Y MÉTODOS
TIPO Y ÁMBITO DEL ESTUDIO
Estudio observacional, analítico, longitudinal, prospectivo, de cohortes, según la práctica clínica habitual, que incluyó a todos los pacientes mayores de 18 años diagnosticados de infección por SARS-CoV-2 con distrés respiratorio (7) y necesidad de ventilación mecánica, ingresados en la UCI de un hospital terciario, a cargo del servicio de anestesia y reanimación, durante la primera ola de la pandemia de primavera de 2020.
POBLACIÓN ESTUDIADA
Se incluyeron todos los pacientes atendidos por la unidad de nutrición clínica que presentaron intolerancia gastrointestinal a la dieta oral o a la NE. La indicación de NP fue la presencia de íleo adinámico, diarrea intratable, ausencia de acceso enteral o intolerancia gastrointestinal durante la pronación. Ningún paciente tenía diagnóstico de error congénito del metabolismo lipídico, ni gestación. Los enfermos terminaban el estudio cuando presentaban tolerancia gastrointestinal a la dieta oral o la nutrición enteral o fallecían.
COMPOSICIÓN DE LA NP
La formulación de la NP fue individualizada. Los requerimientos calóricos se calcularon mediante la fórmula de Harris Benedict, multiplicado por un factor de enfermedad de 1,3. En los pacientes obesos se utilizó el peso ajustado para el cálculo energético según la fórmula:
Peso ajustado = (peso actual – peso ideal) x 0,25 + peso ideal
La composición de la NP se ajustó a las recomendaciones para el soporte nutricional del paciente crítico según el consenso de la Sociedad Española de Medicina Intensiva (SEMICYUC) y la Sociedad Española de Nutrición Clínica y Metabolismo (SENPE) (8). Todos los pacientes recibían una mezcla de NP 3 en 1 por vía central, a través de la vena yugular derecha, colocada en condiciones de máxima asepsia. En todos los casos se utilizó una emulsión lipídica que contiene aceite de pescado: SMOFlipid® (Fresenius Kabi), teniendo la mezcla un 30 % de aceite de soja, 30 % de MCT, 25 % de aceite de oliva y 15 % de aceite de pescado, o Lipoplus® (Braun), teniendo la mezcla un 40 % de aceite de soja, 50 % de MCT y 10 % de aceite de pescado. Los electrolitos se ajustaron de acuerdo con las necesidades diarias del paciente. Todas las bolsas aportaron diariamente oligoelementos (Supliven®, Fresenius) y vitaminas (Cernevit®, Baxter). El volumen final de la NP fue de aproximadamente 1 ml/kcal, salvo que el paciente necesitara una restricción hídrica. La NP se administró diariamente durante 24 h mediante un catéter conectado a un filtro de 1,2 micras para limitar la infusión de partículas extrañas, siguiendo las recomendaciones de la Federal Drug Addministation (FDA) (9).
En los pacientes que lo necesitaron, se añadió insulina regular en la bolsa de NP a razón de 1 unidad por cada 10 g de glucosa aportados, con la idea de mantener un rango de glucosa de entre 140 y 180 mg/dl. Dos tercios de la insulina regular subcutánea extra requerida en las 24 h anteriores para mantener la glucemia dentro del rango se añadían a la bolsa de NP al día siguiente.
VARIABLES CLÍNICAS
Las variables del estudio fueron: edad (años), sexo (hombre/mujer), antecedentes de DM, dislipemia u obesidad (sí/no), índice de masa corporal (IMC, definido como peso en kilos/talla2 en metros), composición de la NP por kg de peso del paciente en kilocalorías (kcal), aminoácidos en gramos (g), glucosa (g), lípidos (g), dosis de insulina (unidades/día) y necesidad de tratamiento con propofol (Fresenius Kabi) (sí/no), tocilizumab (Roactemra®, Roche) y lopinavir/ritonavir (Kaletra®, Abbvie Farmacéutica) (sí/no). También se recogieron los días de duración de la NP, la presencia de complicaciones asociadas a la NP (hiperglucemia, hipertrigliceridemia, IAC y hepatopatía secundaria a NP) (sí/no) y la mortalidad (sí/no).
Se definió la hiperglucemia como la presencia de al menos un valor de glucemia plasmática o capilar > 180 mg/dl; la hipertrigliceridemia, como al menos un valor de triglicéridos (TG) plasmáticos > 400 mg/dl; la IAC como la presencia de cualquier episodio de cultivo positivo de la punta del catéter en caso de retirada o hemocultivos simultáneos positivos por el mismo germen de una vena periférica y de sangre extraída del catéter venoso central en los pacientes con clínica de sepsis, y en ausencia de otra causa de infección; y la hepatopatía secundaria a NP, como el aumento de ambas enzimas de colestasis, gamma-GT y fosfatasa alcalina, dos veces por encima del límite superior de la normalidad señalado por el laboratorio. Se calculó la tasa de incidencia de cada una de estas complicaciones por separado, definida como el número de pacientes que desarrolló la complicación dividido por el número total de pacientes por 100 días de NP en el caso de la hiperglucemia, la hipertrigliceridemia y la hepatopatía, y por 1000 días de utilización del catéter de NP en el caso de la IAC.
VARIABLES BIOQUÍMICAS
Según el protocolo habitual, en todos los pacientes se realizó la extracción de una muestra de sangre venosa al menos una vez al día. El análisis incluía hemograma, creatinina, iones, perfil hepático, albúmina, ferritina y proteína C-reactiva. Semanalmente se midieron los niveles plasmáticos de TG en plasma mediante espectrometría, utilizando un método enzimático (autoanalizador Roche/Hitachi Cobas 8000, modelo c70, Roche Diagnostics®).
CRITERIOS ÉTICOS
El estudio se llevó a cabo de acuerdo con la práctica clínica habitual, sin realizar ninguna intervención diagnóstica o terapéutica diferente de las habituales, buscando una mejora en la asistencia a los pacientes con COVID-19. Los datos se analizaron de forma anónima en todo momento.
ANÁLISIS ESTADÍSTICO
Se realizó una estadística descriptiva, calculándose la media y la desviación estándar para las variables cuantitativas y la frecuencia relativa para las variables cualitativas. Las diferencias entre los grupos se compararon empleando el test de la "t" de Student para variables cuantitativas y la prueba del chi2 para las variables cualitativas. Se estimaron las odds ratios (OR) de presentar cada una de las complicaciones estudiadas, con sus correspondientes intervalos de confianza al 95 % (IC 95 %), para los diferentes factores de riesgo considerados, utilizándose un análisis de regresión logística multivariante.
Los datos se procesaron mediante el programa SPSS, versión 18.0. Se consideró significativa toda p < 0,05.
RESULTADOS
Las características de los 87 pacientes incluidos en la cohorte, los fármacos utilizados y las variables relacionadas con la NP se señalan en la tabla I. El 66,7 % eran varones (59,1 ± 11,4 años, 28,4 ± 4,7 kg/m2) y el 33,3 %, mujeres (62,2 ± 9,5 años, 30,5 ± 6,9 kg/m2). La relación pO2/FiO2 en el primer día de la estancia en la UCI fue de 180 ± 62. El índice de estrés al ingreso en la UCI, medido por los niveles plasmáticos de albúmina (2,9 ± 0,3 g/dl), ferritina (2069 ± 291 g/dl) y proteína C-reactiva (15,2 ± 12,6 mg/dl), fue elevado. Los valores iniciales de gama GT y fosfatasa alcalina fueron 127 ± 125 UI/L y 94 ± 60 UI/L, respectivamente.
Tabla I. Características de la población y composición de la NP al inicio del tratamiento

DE: desviación estándar; IMC: índice de masa corporal; NP: nutrición parenteral.
La tasa de incidencia de la hiperglucemia fue de 33 x 100 pacientes por día de NP y la de hipertrigliceridemia de 37 x 100 pacientes por día de NP. De los pacientes con perfil hepático normal al ingreso, únicamente 2 (2,3 %) presentaron elevación de la gamma-GT y la fosfatasa alcalina por encima de dos veces el límite superior de la normalidad, definido por el laboratorio, durante el seguimiento. Treinta y siete pacientes tuvieron un hemocultivo positivo por IAC, lo que equivale a una tasa de incidencia de 4,25 x 1000 pacientes por día de utilización del catéter. El germen aislado más común fue un Staphyloccocus coagulasa-negativo (Fig. 1).
Los pacientes con IMC elevado presentaron más frecuentemente hiperglucemia, hipertrigliceridemia o IAC, mientras que el uso de propofol o de lopinavir/ritonavir se asoció a una mayor frecuencia de hipertrigliceridemias o de IAC (Tabla II). No existían diferencias en la composición de la NP, ni en la dosis de insulina, ni en el uso de SMOFlipid® o Lipoplus® en cuanto al desarrollo de complicaciones (Tabla III). La duración de la NP fue mayor en los enfermos que presentaron hiperglucemia frente a los que no la presentaron (11,9 ± 4,6 vs. 7,5 ± 4,2, p = 0,000), hipertrigliceridemia (10,7 ± 4,6 vs. 7,2 ± 4,2, p = 0,001) o IAC (10,7 ± 4,1 vs. 7,0 ± 4,0, p = 0,000).
Tabla II. Factores relacionados con las complicaciones de la nutrición parenteral

IAC: infección asociada al catéter; DE: desviación estándar; IMC: índice de masa corporal; *p < 0,05, hiperglucemia frente a sin hiperglucemia; †p < 0,05, hipertrigliceridemia frente a sin hipertrigliceridemia; ‡p < 0,05, IAC frente a sin IAC..
Tabla III. Composición y duración de la nutrición parenteral y desarrollo de complicaciones

IAC: infección asociada al catéter; DE: desviación estándar; *p < 0,05, hiperglucemia frente a sin hiperglucemia; †p < 0,05, hipertrigliceridemia frente a sin hipertrigliceridemia; ‡p < 0,05, IAC frente a sin IAC..
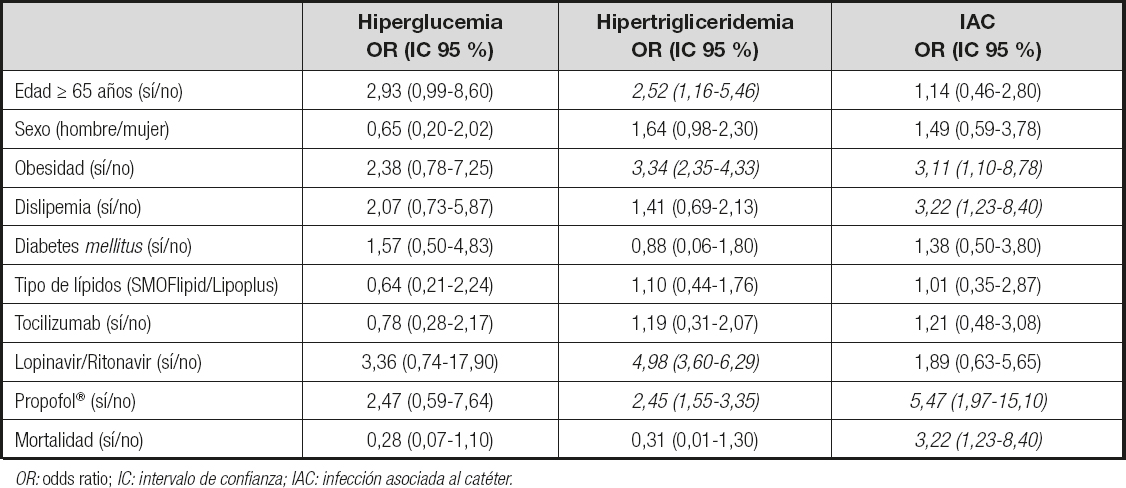
En el análisis multivariante (Tabla IV), ningún factor de riesgo analizado se asoció al desarrollo de hiperglucemia. La edad ≥ 65 años (OR: 2,52, IC 95 %: 1,16 a 5,46), el antecedente de obesidad (OR: 3,34, IC 95 %: 2,35 a 4,33) y el tratamiento con propofol (OR: 2,45, IC 95 %: 1,55 a 3,35) o lopinavir/ritonavir (OR: 4,98, IC 95 %: 3,60 a 6,29) se asociaron al desarrollo de hipertrigliceridemia. De igual forma, los pacientes con historia previa de obesidad (OR: 3,11, IC 95 %: 1,10 a 8,75) o dislipemia (OR: 3,22, IC 95 %: 1,23 a 8,40) y los tratados con propofol (OR: 5,47, IC 95 %: 1,97 a 15,1) presentaron mayor riesgo de IAC.
Tabla IV. Factores de riesgo y mortalidad para cada una de las complicaciones mediante el análisis de regresión logística
OR: odds ratio; IC: intervalo de confianza; IAC: infección asociada al catéter.
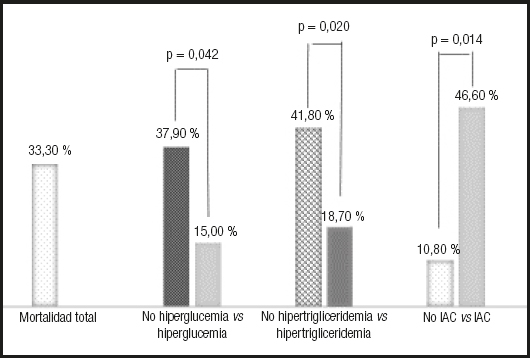
La mortalidad total fue del 33,3 % (29 pacientes). La mortalidad fue menor en los enfermos que desarrollaron hiperglucemia frente a aquellos otros con normoglucemia (15,0 % vs. 37,3 %, p = 0,042) o hipertrigliceridemia frente a normotrigliceridemia (18,7 % vs. 41,8 %, p = 0,020). La mortalidad fue mayor en presencia de IAC (46,7 % vs. 10,8 %, p = 0,014) (Fig. 2). No existieron diferencias en cuanto a mortalidad entre los pacientes que recibieron SMOFlipid® y aquellos que recibieron Lipoplus® (29,3 % vs. 31,0 %, p = 0,478). Sin embargo, en el análisis multivariante, la mortalidad se asociaba únicamente con la edad ≥ 65 años (OR: 2,74, IC 95 %: 1,08 a 6,95) o con la IAC (OR: 3,22, IC 95 %: 1,23 a 8,40).
DISCUSIÓN
Entre las complicaciones asociadas a la NP, la hiperglucemia, la hipertrigliceridemia, la hepatopatía y la IAC son las más frecuentes. Este estudio prospectivo demuestra que los pacientes diagnosticados de infección por SARS-CoV-2 desarrollan frecuentemente complicaciones asociadas a la NP, especialmente hiperglucemia, hipertrigliceridemia e IAC. La prevención y detección precoz de estas complicaciones tiene relevancia en la práctica clínica, dado que su control asegura una mejor evolución, especialmente en el paciente crítico.
La incidencia de la hiperglucemia en los pacientes sometidos a NP es del 50 % (10). En los enfermos con SARS-CoV-2 de nuestro estudio fue de 33 x 100 días de NP. Un adecuado control glucémico ha demostrado reducir la morbimortalidad (11), así como las complicaciones cardiovasculares asociadas (12). Para controlar la glucemia se recomienda disminuir el aporte de glucosa en la NP a 3 g/kg/día y añadir insulina al tratamiento (13), medidas ambas que se garantizaron en nuestra población. Se ha descrito que el riesgo de hiperglucemia está incrementado en los enfermos de ≥ 65 años, obesos o con historia previa de DM (14). En nuestro estudio, entre el 25 y el 35 % de los enfermos tenían un diagnóstico de obesidad, dislipemia o DM, pero ninguna de estas patologías ni la edad ≥ 65 años se asoció con el desarrollo de hiperglucemia.
La hipertrigliceridemia asociada a la NP tiene una frecuencia de entre el 6 y el 60 %. Este porcentaje tan amplio se debe al punto de corte utilizado para su definición, a las características de la población estudiada y a la composición de la NP (15,16). Los expertos de la ASPEN sugieren que el riesgo de efectos adversos es mayor cuando los niveles de TG en plasma superan los 400 mg/dl (17). Considerando este punto de corte, en nuestro estudio, la incidencia de hipertrigliceridemia fue de 37 x 100 pacientes-días de NP. Esta complicación se ha relacionado con factores como la obesidad y la DM (18), la composición de la NP, especialmente la cantidad y el tipo de emulsión lipídica utilizada (19), y el uso de fármacos como el propofol (20), el tolicilizumab (21) y el lopinavir/ritonavir (22). En nuestro estudio, la edad mayor o igual a 65 años (OR: 2,52, IC 95 %: 1,16-5,46), la obesidad (OR: 3,34, IC 95 %: 2,35-4,33) y el tratamiento con propofol (OR: 2,45, IC 95 %: 1,55-3,35) o lopinavir/ritonavir (OR: 4,98, IC 95 %: 3,60-6,29) se asociaron a un mayor riesgo de desarrollar hipertrigliceridemia. No se encontraron diferencias significativas en cuanto al tipo de emulsión lipídica utilizada, estando ambas enriquecidas con aceite de pescado.
Otra complicación relacionada con la NP es la IAC (23). En nuestro estudio, la incidencia de la IAC fue de 4,25 x 1000 pacientes-día de NP, que es similar a la descrita en la literatura (24). El factor principal relacionado con la IAC es la falta de medidas estrictas de asepsia cutánea durante la colocación y manipulación del catéter venoso central. Otros factores son el lugar de inserción, el número de luces, el tipo y el tiempo de permanencia del catéter insertado, la existencia de focos adicionales de infección, la hiperglucemia, la edad, el sexo y la inmunosupresión (25). En nuestro estudio, factores como la edad, el sexo, la composición de la emulsión y la necesidad de insulina en la NP no demostraron aumentar el riesgo de infección. Los antecedentes de obesidad o dislipemia o el uso de propofol se asociaron a las IAC. Probablemente esto sea debido, al menos en parte, a que los pacientes obesos presentan mayor riesgo de infección y a que el uso del propofol puede suponer un aumento del número de veces que se manipula el catéter.
La duración de la NP es un factor de riesgo descrito para el desarrollo de complicaciones. En nuestra población, el número de días con NP fue mayor en los pacientes que presentaban hiperglucemia, hipertrigliceridemia o IAC.
La mortalidad del paciente hospitalizado por SARS-CoV-2 es elevada, en torno al 28 % (26). En nuestra serie, la mortalidad fue similar, del 33 %. El riesgo de mortalidad fue superior en los enfermos mayores de 65 años y en aquellos que presentaban IAC, con una odds ratio de exitus dos y tres veces superior, respectivamente.
Este estudio tiene algunas limitaciones. En primer lugar, el escaso tamaño de la muestra, que puede dificultar la validación externa de los resultados. En segundo lugar, no existe un grupo de control de pacientes críticos sin infección por coronavirus. Nuestro estudio se diseñó como un estudio de cohortes prospectivo, válido para analizar la asociación pero no la causalidad, como base para generar hipótesis. En tercer lugar, aquellos enfermos que fallecieron precozmente tuvieron menos tiempo para desarrollar las complicaciones asociadas a la NP. Esto puede explicar por qué se observó menor mortalidad en los pacientes con hiperglucemia e hipertrigliceridemia. Por último, en relación a la IAC hay que tener en cuenta que, probablemente, en los primeros días de la oleada de la pandemia, el acceso y la manipulación de los catéteres venosos los realizó personal menos experto y con medidas de asepsia menos estrictas que las de las unidades de críticos habituales.
En conclusión, los pacientes con SARS-CoV-2 que reciben NP tienen un riesgo elevado de desarrollar hiperglucemia, hipertrigliceridemia e IAC. La mortalidad de los enfermos que presentan alguna de estas complicaciones está incrementada. Estos eventos son detectables y tratables en la mayoría de los casos. Por este motivo, es importante diseñar e implementar protocolos de actuación para monitorizar la glucemia y los niveles de TG en plasma, así como colocar y manipular los catéteres venosos con las máximas condiciones de asepsia y vigilar los signos de infección para prevenir y tratar precozmente el desarrollo de estas complicaciones.