INTRODUCCIÓN
El sobrepeso y la obesidad se han convertido en uno de los problemas de salud pública más relevantes en el mundo occidental (1). El peso elevado es un factor de riesgo para numerosas patologías, destacando el síndrome metabólico y las enfermedades cardiovasculares, entre otros (2). Por ello es importante buscar estrategias que ayuden a la reducción del peso corporal, que repercutiría positivamente en la incidencia de las enfermedades metabólicas.
Entre las causas que provocan el aumento de peso se encuentran la reducción de la actividad física y la alimentación inadecuada (3). En España existe un abandono del patrón de alimentación mediterráneo, evidenciándose una reducción en el consumo de fruta, verdura y legumbres, que tiene como consecuencia un menor consumo de fibra (4). El bajo consumo de fibra repercute sobre la sensación de saciedad percibida tras las comidas (5).
Actualmente existen diferentes productos enriquecidos con fibra. Una de las fibras más utilizadas por la industria alimentaria son los fosfofructooligosacáridos (FOS), un tipo de fibra vegetal de tipo soluble, perteneciente al grupo de los fructanos, con actividad prebiótica. Una de las propiedades de los FOS es que promueven la sensación de saciedad, asociándose a un peso corporal más bajo y mejorando las comorbilidades del sobrepeso (6).
La ingesta de alimentos es clave en la regulación del apetito, al liberar diferentes hormonas y sustancias saciantes (7). Las hormonas más relevantes implicadas en estos mecanismos son la glucosa y la insulina (8), además de la leptina, la ghrelina (9), el GLP-1 (10) y el PYY (9). Todas ellas actúan como reguladores del apetito a corto y largo plazo, siendo relevantes para prevenir el exceso de peso y grasa corporal (9).
El objetivo de este estudio fue evaluar las propiedades saciantes del consumo habitual de un caldo ibérico funcional enriquecido con FOS a través de la capacidad de modular la concentración plasmática de diferentes hormonas gastrointestinales involucradas en el apetito y la evaluación de la composición corporal.
MATERIAL Y MÉTODOS
SUJETOS DEL ESTUDIO
Se contó con un total de 18 participantes, hombres y mujeres sanos, reclutados por la Unidad de Nutrición y Dietética del Hospital Universitario La Paz (HULP). Los criterios de inclusión incluyeron sujetos en edades comprendidas entre 18 y 50 años, con un IMC entre ≥ 22 y < 33 kg/m2 y que contasen con un adecuado nivel cultural para comprender el estudio. Todos ellos firmaron el consentimiento informado. Los criterios de exclusión fueron: personas con IMC < 22 a ≥ 30 kg/m2, que siguiesen un patrón de dieta vegetariana o tuvieran un consumo de fibra ≥ 30 g/día. Estuvieron excluidos aquellos individuos con diabetes mellitus, dislipemia o hipertensión arterial bajo tratamiento farmacológico. No podían incluirse sujetos fumadores o con consumo de alcohol > 2-3 raciones/día en el caso de los varones y > 1 ración/día en el de las mujeres, que hubiesen sufrido grandes fluctuaciones de peso o que se hubieran sometido a dietas de adelgazamiento en los tres últimos meses. También fueron excluidos aquellos sujetos con enfermedades gastrointestinales que afectasen a la digestión o absorción de nutrientes y las mujeres embarazadas, en periodo de lactancia o con irregularidades menstruales. Por último, no se incluyeron sujetos con actividad física intensa o que rechazasen los alimentos incluidos en el desayuno estándar del estudio.
El protocolo de investigación fue aprobado por el Comité Ético de Investigación Clínica del HULP (código 3451) bajo la normativa descrita en la Declaración de Helsinki.
DISEÑO DEL ESTUDIO
Se llevó a cabo un ensayo clínico nutricional de diseño agudo cruzado, aleatorizado, doble ciego y controlado. Los sujetos fueron asignados aleatoriamente (manteniendo la proporción de género de la muestra) a una de las dos secuencias de tratamiento (caldo funcional [CF] o caldo de control [CC]) durante 2 días diferentes, separados por un lavado de 14 días. Tras este periodo, los participantes que tomaron el CF en el primer periodo tomaron el CC en el segundo y viceversa. Durante la intervención, los sujetos consumieron una barqueta de caldo con el desayuno. Ni los investigadores ni los sujetos conocían la secuencia de tratamiento asignada.
PRODUCTO DEL ENSAYO CLÍNICO Y ENMASCARAMIENTO
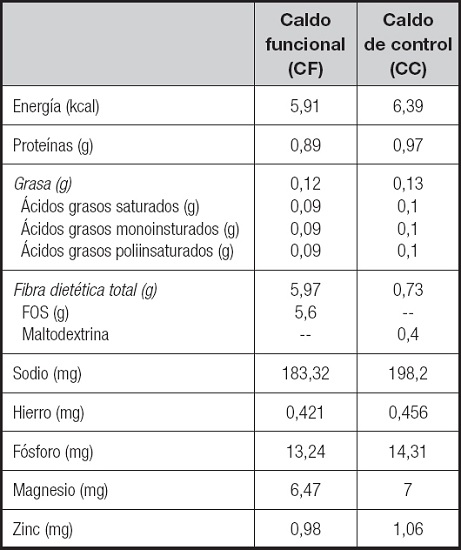
Cada barqueta de 150 g de CF contenía 8,4 g de FOS procedente de la hidrólisis enzimática parcial de la inulina de la achicoria, mientras que el CC contenía maltodextrina (Tabla I).
La empresa Sociedad Cooperativa Andaluza Ganadera de Valle de los Pedroches, COVAP (Córdoba, España), elaboró, empaquetó, etiquetó y suministró los productos de ambos grupos de tratamiento. Las barquetas tenían una apariencia externa idéntica y se diferenciaban únicamente por un número de lote, garantizando el ciego de los tratamientos. El desenmascaramiento se llevó a cabo una vez finalizado el estudio, verificada la ausencia de incumplimiento del protocolo y revisados y analizados los datos.
ALEATORIZACIÓN Y TAMAÑO MUESTRAL
El procedimiento de aleatorización de los participantes a las diferentes secuencias de intervención fue realizado por la Unidad de Bioestadística del HULP. Al tratarse de un estudio piloto, el tamaño muestral se eligió teniendo en cuenta el estudio de Hess y cols. 2011 (11). Los voluntarios fueron aleatorizados en uno de los dos grupos del estudio según el sexo.
METODOLOGÍA DEL TRABAJO
Este estudio se llevó a cabo según la normativa europea, cumpliendo con los Requisitos de la Autoridad de Seguridad Alimentaria (12). Todos los participantes entregaron firmado el consentimiento informado. El día de la prueba por la mañana, los participantes acudieron a la Unidad Clínica de Investigación y Ensayos Clínicos del HULP. Los días de estudio se obtuvieron medidas antropométricas (peso, talla y perímetro de la cintura), se recogieron el estudio dietético del registro de alimentos de 3 días y la frecuencia de consumo de alimentos, y se analizó la actividad física a través del cuestionario IPAQ. Los días del estudio se tomaron las muestras de sangre y se evaluó el apetito mediante escalas analógicas visuales (EAV), como se describe a continuación (12).
En el minuto -30, tras la primera extracción sanguínea y después de rellenar la primera EAV, se indicó a los participantes que consumieran el caldo adjudicado junto a una comida estándar tipo brunch (bocadillo con 60 g de pan blanco, 40 g de jamón de York y 40 g de queso). Su consumo debía realizarse en un máximo de 10 minutos. Los participantes completaron inmediatamente una EAV sobre las calificaciones del apetito, repitiéndola en el minuto 30, 60, 90, 120, 180, 240 y 260. Las extracciones sanguíneas coincidieron con los minutos -30, 0, 30, 60 y 120. Durante el estudio no se permitió comer ni beber durante las 4 horas de la curva; se permitió leer, estudiar, hablar o escuchar música, pero no dormir.
Tras la realización de la EAV en el minuto 240, los participantes consumieron una comida ad libitum que consistió en tortilla de patata estandarizada (proteínas, 10,7 %; grasas, 72,8 %; hidratos de carbono, 16,6 %), pan blanco y 500 ml de agua. Se indicó a los participantes que podían consumir la cantidad elegida hasta sentirse saciados. Para conocer el consumo que realizó cada uno de los participantes, se pesó la cantidad de alimento servida al inicio y el sobrante al final de su consumo. Tras la comida ad libitum, los participantes completaron la última EAV.
DETERMINACIÓN DEL PERFIL DE APETITO
El perfil de apetito se evaluó utilizando las calificaciones de hambre, saciedad, plenitud, deseo de ingerir algún alimento y deseo de ingerir algo graso, salado, dulce o sabroso según la EAV. Estas medidas se obtuvieron utilizando una escala de 100 mm que iba desde 0 nada a 100 mucho (13). Este cuestionario se completó antes del consumo del caldo (-30 minutos) y cada 30 minutos durante los primeros 120 minutos, cada 60 minutos hasta los 240 minutos y a los 20 minutos hasta los 260 posteriores a la ingesta del producto. Se calculó una puntuación compuesta del apetito (CAS) con la ecuación: CAS = [saciedad + plenitud + (100 − consumo prospectivo de alimentos) + (100 − hambre)] / 4 (13).
MUESTRA DE SANGRE
Se extrajo sangre antes de la ingesta de los productos (tiempo, −30) e inmediatamente después de la ingesta de los caldos en intervalos regulares a los 0, 30, 60 y 120 minutos.
DETERMINACIÓN ANTROPOMÉTRICA Y DE LA COMPOSICIÓN CORPORAL
El peso se midió en una báscula digital de uso clínico (capacidad, 0-150 kg) y la altura a través de un tallímetro de precisión milimétrica. Por último, la circunferencia de la cintura se determinó a cabo en el punto más estrecho entre la última costilla y la cresta ilíaca, con la cinta pegada a la piel, sin comprimir.
Para determinar la masa ósea, la masa grasa y la masa magra se utilizó la técnica de la absorciometría dual de rayos X (DXA) (GE Healthcare, Madison, WI, EE. UU) el mismo día de la intervención en agudo.
MÉTODOS ANALÍTICOS
Se midieron las concentraciones del metabolismo glucémico (glucosa, insulina, HOMA) y lipídico (colesterol total, LDL, HDL, TG), además de las enzimas hepáticas (GPT-ALAT, GOT-ASAT, transaminasas), la creatinina y el urato, mediante un método enzimático-espectrofotométrico utilizando el analizador automático Olympus Diagnostics AU 5400 (Beckman Coulter, Nyon, Suiza). Para la medición de hormonas relacionadas con la saciedad y la plenitud (leptina, ghrelina, GLP-1, PYY) se empleó el analizador de perfiles multianalítico Luminex® 200™ y el kit de inmunoensayo HMHEMAG-34K Milliplex Map Kit (MiLLIPLEX MAP Human Metabolic Hormone Magnetic Bead Panel - Metabolism Multiplex Assay, EMD Millipore Corp, Billerica, MA, EE. UU). Los datos fueron analizados utilizando el software 3.1 xPONENT (Millipore). La técnica tiene un coeficiente de variación intra e interensayo del 10 y 15 %, respectivamente. La mínima concentración detectable de ghrelina es de 13 pg/ml; la de leptina, de 41 pg/ml; la de GLP-1, de 2,5 pg/ml; la de péptido YY, de 28 pg/ml e insulina 87 pg/mL.
ANÁLISIS ESTADÍSTICO
Los resultados cualitativos se han expresado en forma de frecuencias absolutas y porcentajes y los datos cuantitativos mediante media y desviación típica o mediana y cuartiles. Previamente se hizo un contraste de normalidad con la prueba de Shapiro-Wilk. Para analizar la respuesta de la variable a lo largo del tiempo, se calculó el área incremental de la curva de respuesta.
Para el estudio de áreas y de la evolución temporal y descartar un efecto cruzado o efecto del periodo de tratamiento, se ajustó un modelo mixto de la varianza que incluyó secuencia, tratamiento y periodo. Se realizaron comparaciones múltiples a posteriori para detectar cambios debidos al tratamiento en cada uno de los tiempos y se aplicó la corrección de Bonferroni. Para el análisis de las áreas se aplicó un análisis de la varianza unifactorial de medidas repetidas en caso de no detectar ningún efecto cruzado o del periodo. En el caso de los análisis no paramétricos para el estudio de la influencia del tiempo en cada uno de los tratamientos se llevó a cabo el análisis de la varianza no paramétrico de Friedman, de medidas repetidas en el tiempo, seguido de comparaciones múltiples “a posteriori” entre pares de tiempos. Para el estudio de la influencia del tratamiento, en cada tiempo se evaluaron los rangos signados de Wilcoxon. En ambos casos se aplicó la corrección de Bonferroni.
Todas las pruebas estadísticas se consideraron bilaterales y, como valores significativos, aquellos p inferiores a 0.05. Los datos se analizaron con el programa estadístico SAS 9.4 (SAS Institute Inc., Cary, NC, EE. UU.) y SPSS 25.
RESULTADOS
Un total de 34 personas estuvieron interesadas en participar; 21 cumplieron los criterios de selección y se aleatorizaron para llevar a cabo el estudio. A lo largo del ensayo clínico, tres individuos abandonaron el estudio por motivos laborales o personales. Finalmente, un total de 18 participantes sanos (8 hombres, 10 mujeres) con edades comprendidas entre 22 y 56 años terminaron el estudio (Fig. 1). Con esta muestra se realizó el análisis estadístico.
Todos los participantes completaron las pruebas de acuerdo con el protocolo. En términos generales, todos los participantes del estudio partieron de una situación similar (Tabla II). Los sujetos tenían una edad media de 37,3 ± 9,72 años y un IMC de 25,26 ± 3,28 kg/m2 (sobrepeso). El 11,1 % de los participantes tenían sobrepeso de tipo I y el 33,3 % de tipo II. La media de la población tenía un perímetro de la cintura elevado (tanto en hombres (92,44 ± 8,15 cm) como en mujeres (85,85 ± 9,10 cm). La masa grasa era similar en ambos grupos y la media, tanto en hombres (27,62 %) como en mujeres (36,15 %), mostró un porcentaje de grasa corporal elevado. Al inicio del estudio, el colesterol total y el LDL fueron superiores a lo aconsejado, mientras que los valores medios de glucosa se encontraron dentro de la normalidad. La masa grasa al inicio del estudio fue similar y, aunque el porcentaje de grasa corporal que presentaron los sujetos del estudio se encontraba en rangos de obesidad, se pudo observar que existían diferencias significativas entre los tratamientos (p < 0,05), disminuyendo la grasa en los sujetos que tomaron el CF (-0,15 ± 0,32 vs. 0,09 ± 0,52).
Tabla II. Características demográficas, antropométricas y bioquímicas basales de los participantes
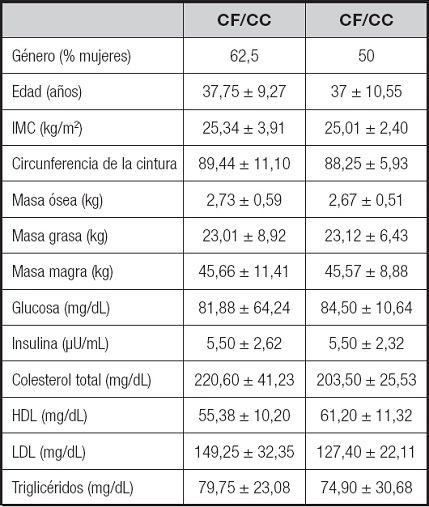
No se encontraron diferencias signifi cativas para ninguna de las variables entre ambos grupos de tratamiento.
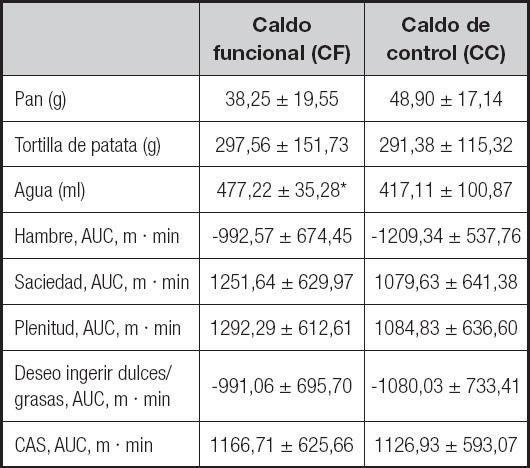
Las áreas bajo la curva (AUC) de todas las variables evaluadas mediante las EAV, para determinar las calificaciones del apetito y la ingesta energética ad libitum 4 horas después de la ingesta del caldo, se muestran en la tabla III. No hubo diferencias significativas en cuanto a la cantidad de alimentos consumidos después de la ingesta del CF. Sin embargo, aquellos individuos que consumieron el CF tuvieron un consumo significativamente mayor de agua en la comida ad libitum (p = 0,032) (Tabla III).
Tabla III. Concentración de glucosa, insulina, HOMA y hormonas gastrointestinales en adultos sanos tras la ingesta de CF y CC expresado en AUC
*Diferencias signifi cativas con respecto al grupo de control (p < 0,05).
No existieron cambios en las AUC de las EAV. Solo la variable hambre mostró cambios entre ambos grupos de tratamiento en el minuto 60, sintiendo menor sensación de hambre el grupo que consumió el CC (p = 0,05) (Fig. 2A). Una vez finalizado el estudio, la sensación de hambre fue similar en ambos grupos de tratamiento (Tabla III).
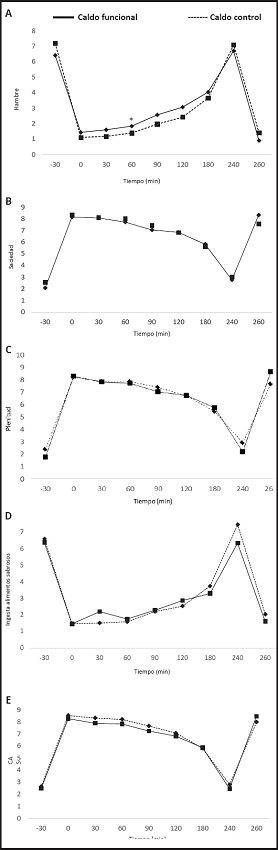
Figura 2. Puntuación EAV de hambre (A), saciedad (B), plenitud (C), deseo de ingerir algo sabroso (D) y CAS (E) tras la ingesta de CF y CC en voluntarios sanos
La sensación de saciedad no presentó cambios significativos entre los tratamientos (Fig. 2B); sin embargo, sí pudo observarse una tendencia en la sensación de plenitud, y los participantes que consumieron el CF, en el minuto 260 sintieron mayor plenitud (p = 0,059) (Fig. 2C). Además, se observó cómo, a pesar de no ser significativa, la tendencia del deseo de ingerir algo sabroso fue más elevada en el minuto 240 en el grupo que consumió el CC (p = 0,063) (Fig. 2D). Con respecto al valor CAS no se observaron diferencias significativas (Fig. 2E).
Las AUC y las concentraciones de hormonas se muestran en la Tabla IV y la figura 3, respectivamente. Los niveles de glucosa, insulina y HOMA tuvieron una respuesta similar en ambos grupos de tratamiento; sin embargo, se observó un aumento significativo de los niveles de glucosa en el minuto 30 en los participantes pertenecientes al CC (p = 0,001) (Tabla IV, Fig. 3A, Fig. 3B y C).
Tabla IV. Concentración de glucosa, insulina, HOMA y hormonas gastrointestinales en adultos sanos tras la ingesta de CF y CC expresado en AUC

*Diferencias signifi cativas con respecto al CC (p < 0,05).
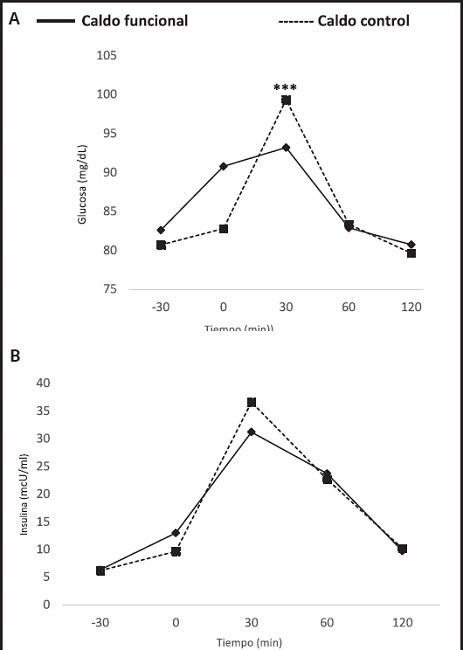
Figura 3. Concentraciones plasmáticas de glucosa (A), insulina (B), HOMA (C), leptina (D), ghrelina (E), GLP-1 (F) y PYY (G) tras la ingesta de CF y CC en voluntrios sanos
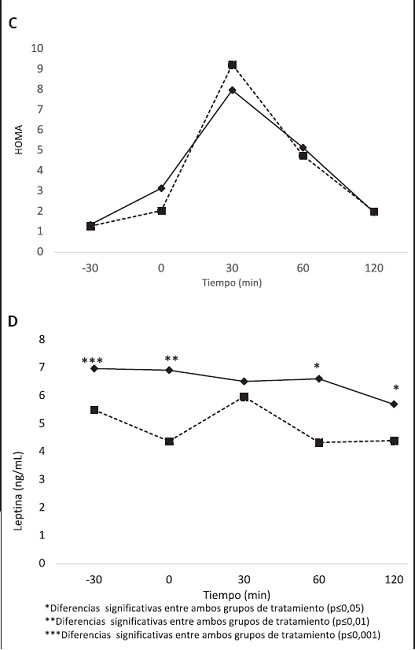
Figura 3 (cont.). Concentraciones plasmáticas de glucosa (A), insulina (B), HOMA (C), leptina (D), ghrelina (E), GLP-1 (F) y PYY (G) tras la ingesta de CF y CC en voluntrios sanos
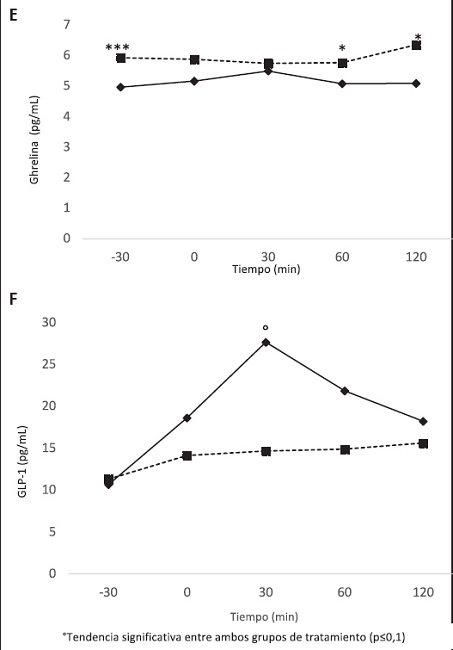
Figura 3 (cont.). Concentraciones plasmáticas de glucosa (A), insulina (B), HOMA (C), leptina (D), ghrelina (E), GLP-1 (F) y PYY (G) tras la ingesta de CF y CC en voluntrios sanos
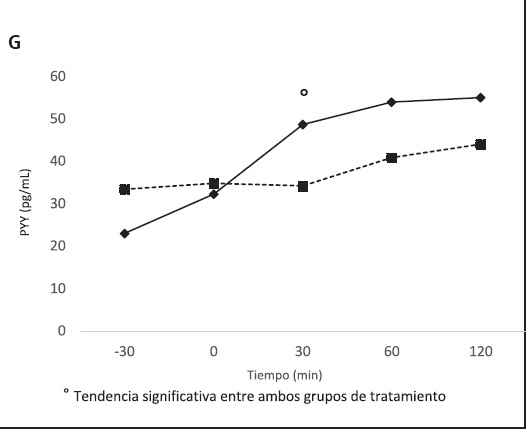
Figura 3 (cont.). Concentraciones plasmáticas de glucosa (A), insulina (B), HOMA (C), leptina (D), ghrelina (E), GLP-1 (F) y PYY (G) tras la ingesta de CF y CC en voluntrios sanos.
Si bien la AUC no mostró diferencias en cuanto a los niveles de leptina entre los tratamientos, se pudo observar un aumento de la concentración en aquellos individuos que consumieron el CF (p < 0,001), observándose diferencias significativas a los -30 (p < 0,001), 0 (p < 0,001), 30 (p = 0,026) y 120 minutos (p = 0,049) (Fig. 3D). Caso contrario ocurrió con los niveles de ghrelina, cuya AUC fue menor en los individuos que consumieron el CF (p = 0,0181) (Tabla IV), observándose un aumento significativo de la concentración plasmática a los −30 (p = 0,030), 60 (p = 0,034) y 120 (p = 0,034) minutos (Fig. 3E). Los niveles de GLP1 tuvieron una AUC superior en aquellos sujetos que consumieron el CF (p = 0,033), observándose una tendencia superior de las concentraciones desde el tiempo 0 hasta el tiempo 120 (Fig. 3F), sin llegar a ser significativa la diferencia entre ambos grupos de tratamiento.
Por último, en cuanto a las concentraciones de PYY, la AUC de dicha hormona fue estadísticamente superior en los individuos que consumieron el CF (p = 0,022), observándose una tendencia al aumento de esta hormona a lo largo del tiempo de intervención, pero no de forma significativa (Fig. 3G).
DISCUSIÓN
Los hallazgos más relevantes del presente estudio muestran que la ingesta de un CF enriquecido con FOS mejora los niveles de las hormonas relacionadas con la saciedad y reduce la cantidad de grasa corporal. El consumo del CF tuvo un efecto sobre las concentraciones plasmáticas de las hormonas leptina, GLP-1 y PYY, hormonas que participan en la regulación de la saciedad modulando el apetito y el gasto de energía.
Dichos resultados podrían atribuirse al contenido de fibra del CF. En este sentido, existen diversos mecanismos por los cuales la fibra de la dieta puede aumentar la sensación de saciedad. Estos incluyen el retraso del vaciamiento gástrico y el aumento del volumen del contenido gastrointestinal (14,15). Los FOS, estructurados por fructanos de cadena corta, son rápidamente fermentados por la microbiota intestinal, ejerciendo una acción prebiótica (16). Su fermentación aumenta la producción de ácidos grasos de cadena corta (AGCC) en el colon y, en las personas con exceso de peso, se ha observado que generan un aumento de la oxidación de la grasa (17) y un aumento de PYY en el plasma (18), inhibiendo las hormonas estimulantes del apetito (19). Los FOS, por lo tanto, aumentan la sensación temprana de saciedad (11).
A pesar de que se observó una mayor tendencia a la plenitud al final del estudio en los individuos que consumieron el CF, este efecto no fue acompañado por una reducción significativa de la ingesta de alimentos en la comida ad libitum. Estos resultados se suman a los de otros estudios que demuestran que, a pesar de que la fibra puede aumentar la sensación de plenitud, no siempre se acompaña de una disminución posterior de la ingesta de alimentos (20). Estudios como el de Kristensen y cols. (21) observó que una mayor cantidad de fibra en diferentes matrices no regulaba el balance energético a corto plazo (20,21). Aunado a ello, también debe contemplarse que el balance de energía está influido por otros factores psicológicos y fisiológicos (12).
Los pacientes que consumieron el CF tuvieron una curva de glucosa estable mientras que los que ingirieron el CC mostraron un pico acusado al minuto 30. Esto podría deberse a que los FOS tienen un efecto hipoglucemiante (22). De hecho, los FOS incrementan el número de bifidobacterias en el organismo, dando lugar a una mayor producción de butirato que actúa positivamente sobre el metabolismo de la glucosa (23).
Por otro lado, se ha observado que los FOS actúan alterando la secreción de hormonas gastrointestinales que regulan el apetito (13). Gracias a la liberación de hormonas como la leptina, la ghrelina, el GLP-1 y el PYY se controla la ingesta de alimentos y, como consecuencia, el peso corporal. En ello influyen factores como la cantidad o el tipo de fibra (12). En este sentido, es sabido que la leptina es una hormona que actúa de manera positiva, provocando la disminución de la ingesta de alimentos a largo plazo (24), y que su concentración puede verse influida por la ingesta de FOS. También se ha observado que la secreción de leptina es más acusada en las personas con importante exceso de peso (25), ya que se ve influenciada por la cantidad de tejido adiposo del individuo (8,9). En el presente estudio, los niveles de leptina fueron significativamente más elevados en el grupo del CF, relacionándose más con el consumo de FOS que con el contenido de grasa corporal.
Por otro lado, la ghrelina, que es una hormona estimuladora del apetito (26), guarda una relación directa con la regulación del peso corporal a corto y largo plazo (27). En este sentido habría cabido esperar que la ghrelina se redujera significativamente en los participantes que consumieron el CF, dado su contenido de fibra. De hecho, Costabile y cols. (2018) han demostrado que el consumo de fibra da lugar a una disminución de la concentración de esta hormona. Sin embargo, dicho mecanismo no parece haber influido de manera importante en los consumidores del CF enriquecido con FOS, ya que esta tendencia se observó en la totalidad de la población. Este resultado podría estar relacionado con la cantidad de tejido adiposo, pues Cui y cols. (2012) determinaron que el contenido de grasa corporal está inversamente relacionado con la concentración de ghrelina. En este sentido, se ha podido observar que los participantes que consumieron el CF redujeron significativamente el contenido de masa grasa. Ello podría haber tenido como consecuencia una disminución menos acusada de la ghrelina en los consumidores del CF. En este sentido, se ha observado que las personas con mayor cantidad de grasa presentan una menor concentración de ghrelina. Otros factores, como la privación del sueño, pueden provocar alteraciones en la hormona (28).
El GLP-1 es una hormona capaz de provocar retrasos del vaciamiento gástrico, dando lugar a un aumento de la sensación de saciedad (29). El consumo de FOS y la producción de AGCC estimulan la secreción de GLP-1, proporcionando señales que suprimen la secreción de glucagón (30) y provocando que la ingesta de alimentos sea menor. Este mecanismo podría explicar que, en el presente estudio, se observaran valores de AUC del GLP-1 superiores en el grupo que consumió el CF. El PYY es un péptido anorexígeno que interviene en la inhibición del apetito (31). En este sentido, y como en el presente estudio, se ha observado que los alimentos enriquecidos con FOS provocan un aumento de la sensación de saciedad, existiendo una relación directa entre ambos (32). Esta relación se ha asociado a la producción de bacterias en el colon que ayudan a la oxidación de las grasas (17), si bien también se ha observado un efecto directo provocado por los FOS (33). En este sentido, también hay que señalar que un periodo de intervención más prolongado con FOS podría haber podido mejorar las concentraciones de PYY (34).
En el presente estudio no se recogieron factores que afectasen a la concentración de las hormonas como serían la calidad del sueño, el gusto o aversión de los sujetos al producto de forma previa o el cálculo del aporte de FOS según el peso de los participantes (35), lo cual puede representar una limitación del estudio.
En conclusión, el consumo de caldo ibérico enriquecido con FOS mejora la concentración plasmática de las hormonas involucradas en el control de la saciedad y reduce la cantidad de grasa corporal. Dichos efectos podrían ser beneficiosos en la prevención y el tratamiento del exceso de peso.