INTRODUCCIÓN
La enfermedad inflamatoria intestinal (EII), en especial la colitis ulcerosa (CU) y la enfermedad de Crohn (EC), es actualmente frecuente en todos los países desarrollados. La desnutrición puede ocurrir tanto en la CU como en la EC, pero es un problema considerablemente mayor en la EC dada su capacidad para afectar cualquier parte del tracto gastrointestinal a diferencia de la CU, que está restringida al colon y tiene pocos efectos directos de malabsorción. Al igual que en los adultos, la desnutrición es prevalente en la EII pediátrica, principalmente en la enfermedad activa y más en la EC que en la CU. Dado que los pacientes con EII constituyen una población de alto riesgo de desnutrición, necesitan un cribado para detectarla, así como su posterior evaluación y tratamiento. La atención nutricional es claramente importante en el tratamiento de los pacientes con EII e incluye la prevención de la desnutrición y los déficits de micronutrientes, la prevención de la osteoporosis y, en los niños, la promoción de un crecimiento y desarrollo óptimos.
METODOLOGÍA
La presente guía consta de 40 recomendaciones y se basa en la Guía ESPEN: nutrición clínica en la enfermedad inflamatoria intestinal, versión práctica (1) y versión científica (2). La guía original se ha resumido acortando los comentarios recogidos de la evidencia y la literatura en que se basan las recomendaciones. Las recomendaciones no se han modificado (excepto “nutrición artificial”, que se ha reemplazado por “nutrición médica”, y el lenguaje, que se ha adaptado al inglés americano), y la presentación del contenido se ha transformado en una presentación gráfica que consiste en diagramas de flujo de toma de decisiones siempre que ha sido posible. La guía original se desarrolló de acuerdo con el procedimiento operativo estándar (SOP) para las guías ESPEN (3). Este SOP está orientado hacia la metodología de la Scottish Intercollegiate Guidelines Network (SIGN). La búsqueda de la literatura se calificó de 1 a 4 según la evidencia, y las recomendaciones se redactaron y clasificaron en cuatro clases (A/B/0/GPP). Las recomendaciones no solo se han basado en la evidencia sino que también se han sometido a un proceso de consenso, que se refleja en un porcentaje de acuerdo (%). Siempre que ha sido posible, han participado representantes de diferentes profesiones (médicos, dietistas, enfermeras, otros), así como representantes de pacientes. El proceso de la guía ha sido financiado exclusivamente por la ESPEN. El resumen y la difusión de la guía han sido financiados en parte por la UEG y también por la ESPEN. Para obtener más detalles sobre la metodología, consulte la versión completa de la Guía ESPEN (1) y el ESPEN SOP (3).
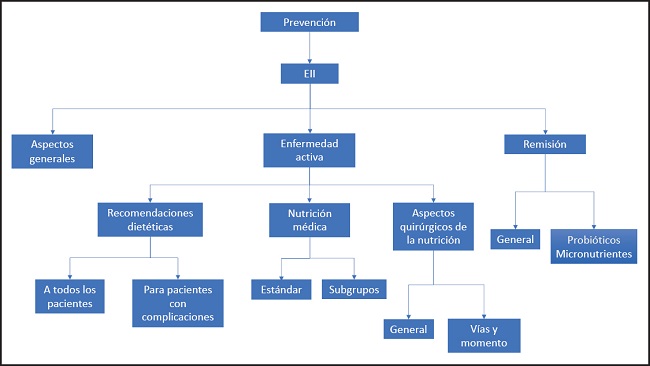
La Guía de Práctica Clínica ESPEN “Nutrición clínica en la enfermedad inflamatoria intestinal” se ha estructurado de acuerdo con un diagrama de flujo que cubre todos los aspectos nutricionales de la EII (Fig. 1).
RESULTADOS
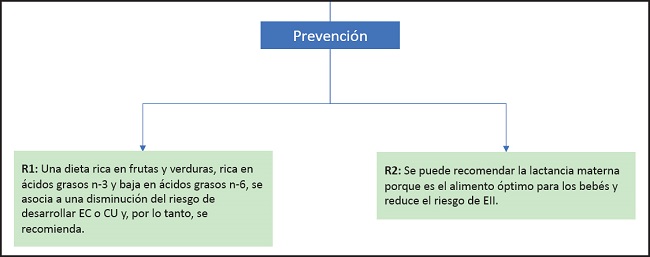
I. PREVENCIÓN DE LA EII (FIG. 2)
Recomendación 1
Una dieta rica en frutas y verduras, rica en ácidos grasos n-3 y baja en ácidos grasos n-6, se asocia a una disminución del riesgo de desarrollar EC o CU y, por lo tanto, se recomienda.
Grado de recomendación 0, consenso fuerte (90 % de acuerdo).
Comentario
El tabaquismo, el uso de antibióticos y la dieta son factores de riesgo potencialmente reversibles para la EII. Numerosos estudios han evaluado el efecto de la dieta sobre el riesgo de desarrollar EII. Sin embargo, la mayoría de ellos son estudios retrospectivos de casos y controles. En 2011, Hou y cols. publicaron la primera revisión sistemática, titulada “Ingesta alimentaria y riesgo de desarrollar EII” (4). Utilizaron una metodología recomendada por la guía para evaluar la asociación entre la ingesta de nutrientes (grasas, carbohidratos, proteínas) y grupos de alimentos (frutas, verduras, carnes) antes de la enfermedad, y el riesgo de un recibir diagnóstico posterior de EII. Se incluyeron diecinueve estudios que agruparon a 2609 pacientes con EII (1269 con EC y 1340 con CU) y más de 4000 controles. Los resultados principales son: (i) mayor riesgo de desarrollar CU y EC con una ingesta elevada de PUFA, ácidos grasos n-6 y carnes; (ii) menor riesgo de EC, pero no de CU, con una ingesta elevada de fibra dietética (> 22 g/día) y frutas.
Fibra, frutas y verduras (5): cuando se compararon, en mujeres, los efectos de una menor ingesta de fibra ajustada por energía con los de la ingesta de fibra en el quintil más alto (mediana 24 g/d), se observó en el último caso una asociación con una reducción significativa del riesgo de EC (HR: 0,59; IC 95 %: 0,39-0,90) pero no del riesgo de CU.
En un metanálisis que incluyó un total de 14 estudios de casos y controles (6), el consumo de vegetales se asoció negativamente con el riesgo de CU (OR = 0,71) pero no con el riesgo de EC (OR = 0,66). Un mayor consumo de fruta se asoció negativamente con un menor riesgo de CU (OR = 0,69) y de EC (OR = 0,57).
Grasa dietética (7): la ingesta acumulada de grasa total ajustada por energía, grasas saturadas, grasas no saturadas y AGPI n-6 y n-3 no se asoció con el riesgo de EC o CU. Sin embargo, una mayor ingesta de AGPI n-3 de cadena larga se asoció a una tendencia hacia un menor riesgo de CU (HR: 0,72). En contraste, la ingesta elevada a largo plazo de ácidos grasos trans insaturados se asoció con una tendencia hacia una mayor incidencia de la CU (HR: 1.34).
En el estudio EPIC se reclutaron 229.702 participantes de nueve centros europeos entre 1991 y 1998 (8). En el momento del reclutamiento, la ingesta dietética de DHA y ácidos grasos se midió mediante cuestionarios validados de frecuencia alimentaria. En un análisis anidado de casos y controles, cada participante que desarrolló CU (n = 126) se comparó con cuatro controles. El cuartil más alto de ingesta de ácido linoleico se asoció con un mayor riesgo de CU (OR: 2.49), con una tendencia significativa entre los cuartiles (OR: 1.32 por aumento de cuartil).
Recomendación 2
Se puede recomendar la lactancia materna porque es el alimento óptimo para los niños y reduce el riesgo de EII.
Grado de recomendación B, consenso fuerte (93 % de acuerdo).
Comentario
Dos revisiones sistemáticas de 2004 y 2009 concluyeron firmemente a favor de la lactancia materna (9,10) y los estudios posteriores han reforzado esta interpretación. Un estudio de casos y controles de Nueva Zelanda reportó que la lactancia materna era protectora frente a la EII (EC: OR, 0,55; IC 95 %: 0,41-0,74; CU: OR, 0,71; IC 95 %: 0,52-0,96) con un efecto de duración-respuesta (11). Se reportaron datos comparables en un estudio de cohortes danés en el que la lactancia materna durante más de seis meses disminuyó las probabilidades de EII (OR, 0,50; IC 9 5%: 0,23-1,11) (12). Otras dos publicaciones confirmaron esta relación, una de los EE. UU. y otra de Asia-Pacífico (13,14). La lactancia materna durante seis meses o más es deseable en todos los lactantes (15).
II. ASPECTOS GENERALES (FIG. 3)
Recomendación 3A
Los pacientes con EII están en riesgo nutricional y, por lo tanto, deben someterse a un cribado de la desnutrición en el momento del diagnóstico y, posteriormente, de forma regular.
Grado de recomendación GPP, consenso fuerte (96 % de acuerdo).
Recomendación 3B
La desnutrición documentada en pacientes con EII debe tratarse adecuadamente, ya que empeora el pronóstico, la tasa de complicaciones, la mortalidad y la calidad de vida.
Grado de recomendación GPP, consenso fuerte (96 % de acuerdo).
Comentario para A/B
Los adultos con EII tienen un mayor riesgo de desnutrición, siendo los déficits nutricionales más comunes en los pacientes con EC que en aquellos otros con CU (16). Los pacientes obesos pueden tener déficits encubiertos de masa magra que pueden desenmascararse con herramientas tales como la medición del grosor de los pliegues cutáneos. Los pacientes con EII activa, particularmente aquellos cuya enfermedad no responde bien al tratamiento médico, corren el mayor riesgo de desnutrición. En los adultos, el riesgo de desnutrición se puede evaluar con herramientas de detección validadas (17).
Los pacientes desnutridos con EII tienen más probabilidades de ser hospitalizados después de una visita a Urgencias (18) y tienen también más probabilidades de ser ingresados en el hospital debido a alguna infección (19). En los pacientes hospitalizados, la desnutrición es un factor de riesgo independiente de sufrir un tromboembolismo venoso (20), una cirugía no electiva (21), un ingreso más prolongado (16,21) y un aumento de la mortalidad (16).
Desnutrición en niños: la desnutrición en la EC infantil es frecuente en el momento del diagnóstico y puede persistir a pesar del tratamiento de la enfermedad (22). Los niños con CU también corren el riesgo de una nutrición deficiente, pero los déficits nutricionales pueden no ser obvios en la evaluación de la altura y el peso (23). Aunque existe una variedad de herramientas de cribado, dichas herramientas tienen poca capacidad para distinguir diferentes niveles de riesgo nutricional para los niños con EII (24). La desnutrición en la EII infantil contribuye a una interrupción del desarrollo puberal y a una alteración de la velocidad de crecimiento que puede conducir a baja estatura en la edad adulta. El fallo del crecimiento es de particular importancia en la EII pediátrica y es el resultado de una combinación de inflamación y desnutrición crónica (25).
Recomendación 4
En general, los requerimientos de energía de los pacientes con EII son similares a los de la población sana; el aporte debería estar en línea con los requerimientos.
Grado de recomendación GPP, consenso fuerte (93 % de acuerdo).
Comentario
Para una mayor claridad, esta pregunta puede formularse de dos maneras. En primer lugar, ¿tienen los pacientes con EII unos requerimientos de energía alterados en comparación con los individuos sanos?; en segundo lugar, ¿los requerimientos de energía varían con la actividad de la enfermedad?
Hay relativamente pocos estudios que hayan evaluado el gasto energético en pacientes con CU, y todos los estudios incluyen un pequeño número de pacientes. Puede haber un aumento de la actividad metabólica en los casos de CU aguda grave en comparación con los de adultos en remisión (26,27), lo cual es comprensible considerando que es frecuente la alteración sistémica (fiebre y taquicardia). Sin embargo, es probable que el aumento del gasto energético en reposo se compense con la reducción de la actividad física. La reducción significativa de la ingesta alimentaria es frecuente en la CU aguda y puede resultar en un balance energético negativo (28).
Un único estudio ha medido el gasto energético total en adultos con EC y detectó valores normales (29). Se ha comunicado que el gasto energético, medido en reposo por kilogramo, de los pacientes adultos es superior (30) o igual (31) al medido en controles sanos. Sin embargo, esto podría deberse a una consideración inadecuada del tamaño corporal y las proporciones relativas de los tejidos de diferente actividad metabólica. No se ha demostrado una asociación consistente entre la actividad de la EC y el gasto energético en reposo en adultos. En los niños con EC no se ha demostrado que el gasto energético medido en reposo sea significativamente diferente. La medición del gasto energético en reposo por calorimetría indirecta podría utilizarse en los casos difíciles.
Recomendación 5A
Los requerimientos de proteínas aumentan en la EII activa y la ingesta debe aumentarse (a 1,2-1,5 g/kg/día en los adultos) en relación con la ingesta recomendada para la población general.
Grado de recomendación GPP, consenso fuerte (96 % de acuerdo).
Recomendación 5B
Los requerimientos de proteínas de los pacientes en remisión generalmente no son elevados y el aporte debe ser similar (aproximadamente 1 g/kg/día en los adultos) al recomendado para la población general.
Grado de recomendación GPP, consenso fuerte (96 % de acuerdo).
Comentario para A/B
Los pacientes con EII desarrollan una reducción relativa de la masa magra y un aumento de la obesidad a lo largo del tiempo. Esto puede ocurrir debido a una ingesta dietética crónicamente deficiente, a unas mayores tasas de recambio de proteínas y a la pérdida intestinal de nutrientes durante las fases de la enfermedad activa o por efecto de los tratamientos de la enfermedad. Los corticoides aumentan la pérdida neta de proteínas en los niños (32) y los adultos (33) con EC. En contraste, la administración de una dieta elemental o polimérica como tratamiento de la EC, o como soporte nutricional complementario, da como resultado la reducción de la proteólisis y la adquisición de tejido magro en los niños y los adultos (34-36).
La monitorización de la antropometría proporciona información sobre qué pacientes desarrollan déficits relativos de la masa magra y, por lo tanto, se beneficiarían de la suplementación nutricional. No hay evidencias de que las necesidades diarias de proteínas de los pacientes con EII difieran de las de los controles sanos pero, como se refirió previamente, la disminución del apetito y la reducción de la ingesta dietética son frecuentes. En los pacientes que reciben esteroides y están en reposo intestinal, la nutrición enteral (NE) puede proporcionar efectos beneficiosos sobre el recambio proteico sin consecuencias perjudiciales para la actividad de la enfermedad.
No hay evidencia de que las necesidades diarias de proteínas de los pacientes con EII en remisión difieran de las de los controles sanos. Por lo tanto, es razonable proporcionar 1 g de proteína por cada kilogramo de peso corporal. Sin embargo, en la inflamación activa, la respuesta catabólica proteolítica justifica un aumento del aporte de 1,2 hasta 1,5 g/kg de peso corporal (37,38).
Recomendación 6
Los pacientes con EII deben ser evaluados de forma regular para detectar las posibles deficiencias de micronutrientes y los déficits específicos deben corregirse adecuadamente.
Grado de recomendación GPP, consenso fuerte (100 % de acuerdo).
Comentario
Los pacientes con EII son vulnerables a los déficits de micronutrientes debido a las pérdidas intestinales por diarrea y a la ingesta alimentaria inadecuada a causa de la anorexia que acompaña a la actividad de la enfermedad. En el momento en que se ofrece soporte nutricional también se deben aportar suplementos multivitamínicos y de micronutrientes para garantizar una ingesta nutricional adecuada y equilibrada.
Al interpretar los resultados sanguíneos de micronutrientes y oligoelementos, es importante tener en cuenta que muchos valores séricos, o marcadores de estado, son reactantes de fase aguda tanto positivos como negativos. Los niveles séricos aumentan o disminuyen como parte de la respuesta inflamatoria: por ejemplo, la ferritina y el cobre aumentan pero el folato, el selenio y el zinc disminuyen con la inflamación (39). A la luz de todo ello, algunos autores han examinado el estado de micronutrientes en pacientes con remisión de la enfermedad clínica y han encontrado déficits de diversos micronutrientes (40,41). Además, los déficits pueden estar presentes incluso en individuos aparentemente bien nutridos (42). Estas observaciones resaltan la necesidad de un cribado de rutina (quizás anualmente) para detectar deficiencias. Un suplemento multivitamínico diario puede corregir la mayoría de las déficits pero no es garantía de suficiencia, incluso a largo plazo; es probable que el hierro, el zinc y la vitamina D requieran regímenes de reposición específicos (43). El cumplimiento deficiente, particularmente en los adolescentes, es frecuente con los suplementos multivitamínicos, y es importante explicarle al paciente los motivos de su utilización (44).
Las consecuencias del estado alterado de micronutrientes incluyen anemia, alteración del crecimiento lineal y mala salud ósea. Investigaciones recientes se han centrado en la vitamina D; esta, así como su receptor, pueden tener algunas propiedades inmunomoduladoras, lo que subraya aun más la necesidad de una atención específica al estado de los micronutrientes en los pacientes con EII (Recomendación 11).
Recomendación 7A
Se recomienda la reposición de hierro en todos los pacientes con EII cuando presentan anemia por déficit de hierro. El objetivo de la suplementación es normalizar los niveles de hemoglobina y las reservas de hierro.
Grado de recomendación A, consenso fuerte (100 % de acuerdo).
Recomendación 7B
El hierro oral debe considerarse como un tratamiento de primera línea para los pacientes con anemia leve, cuya enfermedad está clínicamente inactiva y que no han tenido previamente intolerancia al hierro oral.
Grado de recomendación A, consenso fuerte (100 % de acuerdo).
Recomendación 7C
El hierro intravenoso debe considerarse como tratamiento de primera línea en los pacientes con EII clínicamente activa, en aquellos con intolerancia previa al hierro oral, en quienes tienen la hemoglobina por debajo de 100 g/L y en los pacientes que necesitan agentes estimulantes de la eritropoyesis.
Grado de recomendación A, consenso fuerte (93 % de acuerdo).
Comentario para A/B/C
La anemia se considera la manifestación extraintestinal más frecuente de la EII, que generalmente complica el curso tanto de la CU como de la EC. Se debe evaluar la presencia de anemia en todos los pacientes con EII, independientemente de su edad (45). Las principales formas de anemia en la EII son la anemia por deficiencia de hierro, la anemia por enfermedad crónica y la anemia de origen mixto (posicionamiento de la ECCO sobre la anemia 1A) (45). Los criterios diagnósticos para la deficiencia de hierro dependen del nivel de inflamación. Para el cribado de laboratorio se deben utilizar el hemograma completo, la ferritina sérica y la proteína C-reactiva (posicionamiento de la ECCO sobre la anemia 1B). Para los pacientes en remisión o con enfermedad leve, las mediciones deben realizarse cada seis a doce meses. En los pacientes ambulatorios con enfermedad activa, tales mediciones deben realizarse al menos cada tres meses (posicionamiento de la ECCO sobre la anemia 1B). En los pacientes sin evidencia clínica, endoscópica o bioquímica de enfermedad activa, la ferritina sérica < 30 µg/L es un criterio apropiado para el diagnóstico de anemia por deficiencia de hierro. En presencia de inflamación, una ferritina sérica de hasta 100 µg/L aún puede ser compatible con la deficiencia de hierro (posicionamiento de la ECCO sobre la anemia 1D). En presencia de evidencia bioquímica o clínica de inflamación, los criterios diagnósticos para la anemia por enfermedad crónica son una ferritina sérica > 100 µg/L y una saturación de transferrina < 20 %. Si el nivel de ferritina sérica está entre 30 y 100 µg/L, es probable que se produzca una combinación de deficiencia de hierro real y anemia por enfermedad crónica (posicionamiento de la ECCO sobre la anemia 1E).
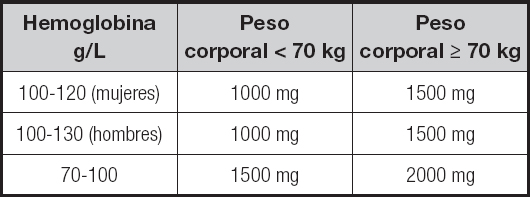
Se recomienda la administración de suplementos de hierro a todos los pacientes con EII, independientemente de su edad, cuando haya anemia por déficit de hierro (posicionamiento de la ECCO sobre la anemia 2A). La calidad de vida mejora con la corrección de la anemia y esta mejora es independiente de la actividad clínica (46). La guía de práctica clínica de la Organización Europea de Crohn y Colitis (ECCO) (45) concluye que “el hierro IV es más efectivo, muestra una respuesta más rápida y se tolera mejor que el hierro oral” y establece que “el hierro IV debe considerarse como primera línea de tratamiento en los pacientes con EII clínicamente activa, con intolerancia previa al hierro oral, con hemoglobina por debajo de 100 g/L y que necesiten agentes estimulantes de la eritropoyesis, mientras que el hierro oral puede usarse en los pacientes con anemia leve, con enfermedad clínicamente inactiva y que no han tenido intolerancia al hierro oral (45). La estimación de la necesidad de hierro generalmente se basa en la hemoglobina basal y el peso corporal (47) (Tabla I).
Después de un tratamiento eficaz de la anemia por deficiencia de hierro con hierro intravenoso, se debe iniciar un nuevo tratamiento con hierro intravenoso tan pronto como la ferritina sérica caiga por debajo de 100 µg/L o la hemoglobina por debajo de 12 o 13 g/dL, según el género (posicionamiento de la ECCO sobre la anemia 3E).
III. RECOMENDACIONES DIETÉTICAS EN LA ENFERMEDAD ACTIVA (FIGS. 4 Y 5)
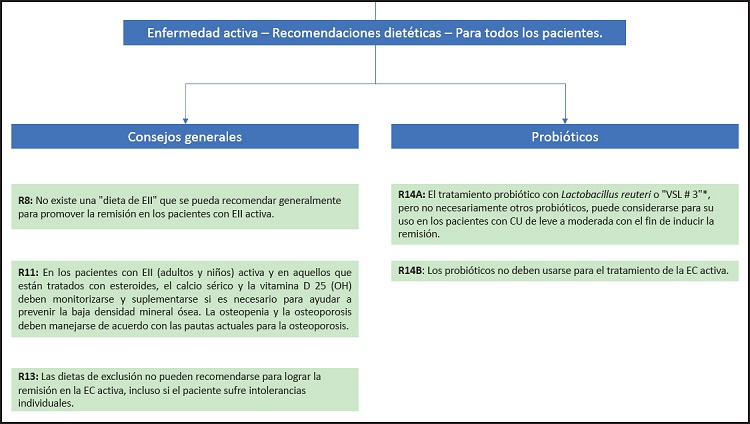
Recomendación 8
No existe ninguna “dieta de la EII” que se pueda recomendar de manera global para promover la remisión en los pacientes con EII activa.
Grado de recomendación GPP, consenso fuerte (96 % de acuerdo).
Comentario
No se dispone aún de datos de ensayos clínicos aleatorizados y controlados sobre los efectos de las dietas experimentales: carbohidratos específicos, dieta paleolítica, dieta sin gluten, con oligo-, di- y monosacáridos y polioles de baja fermentación (FODMAP), o dietas enriquecidas con PUFA ω-3 sobre la inflamación intestinal o la inducción de la remisión. Un ensayo aleatorizado y controlado, con potencia adecuada, de fructo-oligosacáridos no mostró beneficio clínico en los pacientes con EC activa (48) (véase también la “Recomendación 31”). Por lo tanto, no se puede recomendar generalmente una “dieta oral de la EII” para promover la remisión en los pacientes con EII activa. Esta recomendación no excluye las necesidades de todos los pacientes con EII de recibir un enfoque individual (nutricional) basado en su situación personal específica, preferiblemente con la participación activa de un dietista o nutricionista como parte del enfoque multidisciplinario.
Recomendación 9A
Los pacientes con EII y diarrea intensa o con yeyunostomía o ileostomía de alto débito deben controlar las pérdidas de líquidos y el sodio en orina, y las entradas de líquidos deben adaptarse en consecuencia (disminuir los líquidos hipotónicos y aumentar las soluciones salinas) teniendo en cuenta que las intolerancias alimentarias pueden, a su vez, aumentar las pérdidas de líquidos.
Grado de recomendación 0, consenso fuerte (93 % de acuerdo).
Recomendación 9B
La reposición parenteral (líquidos y electrolitos) puede ser necesaria en el caso de los estomas de alto débito.
Grado de recomendación 0, consenso fuerte (96 % de acuerdo).
Comentario para A/B
La diarrea continua e intensa y el estoma de alto débito pueden provocar insuficiencia intestinal (49) con malabsorción, pérdida de peso involuntaria, desnutrición, deficiencias nutricionales y/o deshidratación. La malabsorción es un factor importante que contribuye a la desnutrición en la EII (50). El estudio retrospectivo de Baker en 687 pacientes con estoma (51) mostró que el alto débito precoz (dentro de las primeras tres semanas) de una ileostomía es frecuente y que, aunque el 49 % de los casos se resolvieron espontáneamente, el 51 % necesitaron tratamiento médico continuo, generalmente debido a un intestino delgado corto remanente. El 71 % de los pacientes fueron tratados con restricción oral de líquidos hipotónicos, solución salina y de glucosa, y medicación antidiarreica para poder retirar las infusiones parenterales. El 8 % tuvieron que continuar con solución salina parenteral o subcutánea en el domicilio. Hace más de 35 años se demostró el manejo domiciliario satisfactorio con restricción de líquidos orales y monitorización del contenido de sodio en la orina (52). En un estudio de 13 pacientes adultos con estoma (ileal) de alto débito, las soluciones de rehidratación oral que contienen suplementos de maltodextrinas de arroz mejoraron el equilibrio de sodio y potasio. La asociación del aumento del peso corporal con la disminución de las concentraciones séricas de renina sugiere que también se produjo un balance hídrico positivo (53). En otro estudio se probaron tres soluciones salinas y/o de glucosa diferentes en seis pacientes con yeyunostomías. Basado en este pequeño grupo, una solución bebida de electrolitos y glucosa parecía ser el modo óptimo de reposición del sodio en los pacientes con estoma de alto débito (54). No hay ensayos aleatorizados y controlados disponibles sobre el tratamiento nutricional de la diarrea relacionada con la EII o el estoma de alto débito. Solo se han publicado estudios de casos sobre el tratamiento de la EC con estoma de alto débito, que muestran un tratamiento exitoso con restricción de líquidos hipotónicos, dietas enriquecidas con sodio, nutrición enteral exclusiva y/o infusiones parenterales que contienen sodio.
Recomendación 10
En los pacientes con EC que presentan estenosis intestinal y síntomas obstructivos, se puede recomendar una dieta de textura adaptada o la NE distal (postestenosis).
Grado de recomendación GPP, consenso fuerte (acuerdo del 95 %).
Comentario
Dependiendo de la gravedad (grado de obstrucción) y la localización de las estenosis intestinales, el soporte nutricional puede ser necesario mientras se esperan los efectos del tratamiento. Tal tratamiento puede ser médico (con medicamentos) si el estrechamiento es principalmente el resultado de la inflamación, o mecánico (dilatación con balón o cirugía) cuando hay cicatrices fibróticas. En los pacientes con estenosis del intestino radiológicamente identificada pero asintomática, es habitual recomendar una dieta modificada que sea baja en fibra insoluble, pero no hay datos sólidos que respalden este enfoque aparentemente lógico. Cuando los síntomas están presentes, puede ser necesario adaptar la dieta a una de consistencia blanda, quizás predominantemente con fluidos nutritivos.
La fibrosis intestinal es una característica frecuente de la EC y puede aparecer como una estenosis u obstrucción intestinal. La EC estenosante conduce a una calidad de vida significativamente deteriorada en los pacientes afectados y constituye un desafío para el tratamiento. Un reciente estudio chino observacional y prospectivo de 59 pacientes adultos con EC y estenosis inflamatorias intestinales mostró que la NE exclusiva de doce semanas puede disminuir eficazmente las estenosis inflamatorias del intestino; el 81,4 % lograron la remisión sintomática, 35 pacientes (53,8 %) lograron la remisión radiológica y 42 pacientes (64,6 %) lograron la remisión clínica (55). Aunque es una práctica común recomendar una dieta modificada con una consistencia adaptada y predominio de fluidos nutritivos, al menos en los pacientes con estenosis radiológicamente identificada del intestino (proximal) y síntomas obstructivos, o alimentar distalmente mediante NE siempre que sea posible, no existen datos sólidos para apoyar estos enfoques aparentemente lógicos.
Recomendación 11
En los pacientes con EII (adultos y niños) y enfermedad activa, y en aquellos que están tratados con esteroides, deben monitorizarse los niveles de calcio sérico y la vitamina D 25 (OH), y suplementarse si es necesario, para ayudar a prevenir la baja densidad mineral ósea. La osteopenia y la osteoporosis deben manejarse de acuerdo con las pautas actuales para la osteoporosis.
Grado de recomendación B, consenso fuerte (96 % de acuerdo).
Comentario
La vitamina D sérica baja, el género masculino, la etnia asiática, la EC, el IMC bajo y el uso de corticosteroides son factores de riesgo significativos de baja densidad mineral ósea que se han estudiado en poblaciones adultas con EII (n = 116 y n = 205), mientras que no hay consenso sobre el papel de la edad actual o en el momento del diagnóstico (56,57). En los niños y adolescentes con EII, los factores de riesgo asociados a la baja densidad mineral ósea son la dosis acumulada de corticosteroides, la puntuación Z de la estatura para la edad y la puntuación Z del IMC (58).
No existe consenso general sobre el estado de la vitamina D y las acciones necesarias en niños y adolescentes con EII. Un ensayo clínico aleatorizado y controlado de 132 pacientes adultos osteopénicos con EC mostró una mejoría de la densidad mineral ósea en la columna lumbar después de dos años de tratamiento semanal con risedronato en dosis de 35 mg, concomitantemente con suplementos de calcio y vitamina D (59). Un ensayo clínico aleatorizado y controlado anterior no mostró ningún beneficio significativo de la suplementación con calcio solo (1 g/día) sobre la densidad mineral ósea al año en pacientes con EII que precisaban corticosteroides y tenían osteoporosis (60). Se recomienda la evaluación de la deficiencia de vitamina D en la EII y asegurar siempre un suministro adecuado de calcio y vitamina D, especialmente en los pacientes con EII tratados con esteroides. La limitación del uso de corticosteroides ayuda a prevenir la disminución de la densidad mineral ósea.
Recomendación 12A
Los pacientes con EC tratados con quelantes como la colestiramina tienen un riesgo adicional mínimo de malabsorción de grasas y, por lo tanto, no necesitan una terapia nutricional diferente de la de otros pacientes con EC.
Grado de recomendación GPP, consenso (86 % de acuerdo).
Recomendación 12B
Los pacientes con EII e hiperoxaluria a menudo también tienen malabsorción de grasa, por lo que deben recibir asesoramiento sobre la malabsorción de grasa.
Grado de recomendación GPP, consenso (acuerdo del 88 %).
Comentario para A/B
Las causas frecuentes de la malabsorción de ácidos biliares en la EC son la resección ileal y la inflamación del íleon terminal. La disminución de la reabsorción de los ácidos biliares conjugados conduce a un paso excesivo de estos a la luz del colon, donde son desconjugados por las bacterias. La diarrea osmótica y (en la malabsorción intensa de ácidos biliares) la malabsorción de grasa podrían ser una consecuencia (61). Si es leve, la diarrea por ácidos biliares puede controlarse mediante un quelante como la colestiramina (62,63). En un estudio cruzado doble ciego de 14 pacientes con EC que se habían sometido a resección ileal, no se informó de ningún efecto negativo del tratamiento con colestiramina sobre la absorción de grasa yeyunal. Sin embargo, en los casos graves de malabsorción de ácidos biliares, la esteatorrea puede empeorar como resultado del tratamiento con colestiramina (64).
La hiperoxaluria entérica (secundaria) (con mayor riesgo de cálculos renales) se produce en casos de EC de intestino delgado grave asociada a malabsorción de grasa y el incremento subsiguiente de la absorción de oxalato intestinal. La hiperoxaluria entérica puede ocurrir después de la resección ileal. La presencia del colon es un factor importante, ya que el oxalato permanece disponible (libre) para su absorción en el colon debido a la malabsorción de grasa concomitante y su unión con el calcio (65). La excreción urinaria de oxalato se correlaciona con la excreción de grasa, como se mostró en un estudio de pacientes con EC sometidos a resección intestinal. El aumento de la ingesta de grasas en la dieta en estos pacientes aumentó aun más la excreción urinaria de oxalato (66). Se encontraron valores medios significativamente más bajos de excreción urinaria de oxalato en los pacientes pediátricos con EC que en los adultos (67). Una razón para ello puede ser la historia más corta de la EC, que generalmente también implica menos resecciones intestinales. Esto implica que en los pacientes con hiperoxaluria se debe recomendar una dieta baja en grasas y oxalato y alta en calcio. La restricción del oxalato en la dieta (tés y frutas, principalmente) parece justificada solo en aquellos con cálculos recurrentes del tracto urinario.
Recomendación 13
Las dietas de exclusión no pueden recomendarse para conseguir la remisión en la EC activa, incluso si el paciente presenta intolerancias a nivel individual.
Grado de recomendación GPP, consenso fuerte (96 % de acuerdo).
Comentario
La investigación sistemática ha mostrado evidencia insuficiente para hacer recomendaciones firmes acerca de las dietas de exclusión como terapia de inducción. Se han descrito dietas de exclusión para aliviar los síntomas (68), pero solo escasos estudios no controlados han proporcionado información acerca de la inducción de la remisión (69,70).
En un ensayo clínico aleatorizado y controlado se observó una remisión más prolongada (después de la inducción con éxito de la remisión utilizando una fórmula elemental) en pacientes que utilizaron un programa de introducción dietética gradual, excluyendo los alimentos que empeoraron los síntomas, en comparación con los pacientes que recibieron corticosteroides en un programa de dosis decrecientes mientras seguían una dieta normal (71). Resultados similares sobre el mantenimiento de la remisión fueron reportados por el mismo grupo en un estudio abierto, utilizando una dieta personal de exclusión de alimentos (72). Otro estudio informó del mantenimiento de la remisión clínica utilizando una dieta de exclusión guiada por IgG4 en pacientes adultos con EC (73).
Las dietas de exclusión son muy laboriosas para el personal y son complejas, exigentes y a menudo desagradables para los pacientes. La investigación sistemática no reveló evidencia de que las dietas de exclusión sean peligrosas cuando se aplican con la supervisión médica adecuada. No se obtuvieron pruebas que indicaran que contribuyen a crear deficiencias nutricionales. No obstante, es una buena práctica monitorizar cuidadosamente las deficiencias que pudieran predecirse a partir de un conjunto particular de exclusiones.
Recomendación 14A
El tratamiento probiótico con Lactobacillus reuteri o “VSL # 3”, pero no necesariamente con otros probióticos, puede plantearse para inducir la remisión en un pacientes con CU de leve a moderada.
Grado de recomendación 0, consenso fuerte (92 % de acuerdo).
Recomendación 14B
Los probióticos no deben usarse para el tratamiento de la EC activa.
Grado de recomendación B, consenso fuerte (acuerdo del 95 %).
Comentario para A/B
Dos ensayos clínicos de pacientes pediátricos con CU muestran un efecto moderado de los enemas rectales que contienen Lactobacillus reuteri sobre la CU distal leve (74) y de una preparación oral de “VSL # 3” sobre la CU activa (75). La investigación sistemática indicó que los probióticos eran, en general, ineficaces en la EC activa.
Al hablar del “VSL # 3” nos referimos solamente al producto probiótico utilizado en la literatura citada y a productos equivalentes independientes del etiquetado actual del producto.
IV. NUTRICIÓN MÉDICA EN LA EII ACTIVA (FIGS. 6 Y 7)
Recomendación 15A
Los suplementos nutricionales orales (SNO) son el primer paso cuando la nutrición médica está indicada en la EII, pero generalmente son una terapia de soporte menor que complementa a la comida normal.
Grado de recomendación 0, consenso fuerte (92 % de acuerdo).
Recomendación 15B
Si la alimentación oral no es suficiente, entonces debe plantearse la NE como terapia de apoyo. Las fórmulas de NE o líquidos siempre deben tener preferencia sobre la NP, a menos que estén completamente contraindicadas.
Grado de recomendación A, consenso fuerte (100 % de acuerdo).
Recomendación 15C
La NP está indicada en la EII (i) cuando la nutrición oral o la NE no es suficiente (por ejemplo, cuando el tracto gastrointestinal es disfuncional o en los pacientes con EC que tienen intestino corto); (ii) cuando hay un intestino obstruido y no hay posibilidad de colocar una sonda de alimentación más allá de la obstrucción o esta medida ha fallado; (iii) cuando ocurren otras complicaciones, como una fuga anastomótica o una fístula intestinal de alto débito.
Grado de recomendación B, consenso fuerte (96 % de acuerdo).
Comentario para A/B/C
La decisión sobre la ruta óptima de la nutrición médica en la EII puede ser compleja e involucrar varios aspectos, incluida la capacidad del paciente para comer, la capacidad de absorción del tracto gastrointestinal, el estado nutricional del paciente y los objetivos terapéuticos. Los suplementos de nutrición oral (SNO) son el primer paso, pero generalmente son una terapia de apoyo menor que se usa además de la comida normal. Al usar SNO, se puede lograr una ingesta suplementaria de hasta 600 kcal/día sin comprometer la ingesta normal de alimentos en los adultos. Si no es posible la alimentación oral, se debe considerar alimentar al paciente a través de una sonda nasogástrica o nasoentérica. La NE debe considerarse en los pacientes con tracto gastrointestinal funcional pero que no pueden tragar con seguridad (76,77). En las situaciones en que el intestino no puede absorber todas las necesidades nutricionales, la NE debe complementarse con la NP (42-78,79). La NP está indicada cuando hay un intestino obstruido y no hay posibilidad de colocar una sonda de alimentación más allá de la obstrucción o esta medida ha fallado. Se requiere en los pacientes con intestino corto causante de estados de malabsorción grave de nutrientes y/o pérdida de líquidos y electrolitos que no se pueden manejar enteralmente. La NP también está indicada en los casos quirúrgicos, como se indicó anteriormente, y en cualquier paciente intolerante a la NE o en quien la nutrición no pueda mantenerse por la vía enteral (80). Sin embargo, debe reconocerse que estos pacientes que necesitan NP son los que presentan los cuadros más complicados (81).
Recomendación 16
La NE exclusiva es efectiva y se recomienda como primera línea de tratamiento para inducir la remisión en los niños y adolescentes con EC activa aguda.
Grado de recomendación B, consenso fuerte (92 % de acuerdo).
Comentario
La terapia nutricional primaria en forma de NE exclusiva debe considerarse en todos los pacientes con EC activa aguda. Esta es una primera opción para los pacientes con alto riesgo de terapia alternativa, como los esteroides. Antiguos metaanálisis demostraron que los corticosteroides son mejores que la NE exclusiva para la inducción de la remisión en los adultos. El argumento a favor de la NE exclusiva es más fuerte en la práctica pediátrica y, normalmente, será la primera opción en muchos centros. En primer lugar, esto se debe a los efectos nocivos de la desnutrición sobre el crecimiento. En segundo lugar, dado que el crecimiento es tan esencial en los niños, la NE aumenta la posibilidad de evitar el uso de esteroides o de retrasar su introducción, lo cual es de suma importancia. Tercero, y quizá más importante, es (i) la capacidad de la NE para inducir la remisión, tal y como se demuestra en los estudios pediátricos, que muestran una eficacia similar de los esteroides y la NE exclusiva (82); y (ii) en algunos entornos (por ejemplo, el tratamiento inmunomodulador concomitante), la NE exclusiva podría incluso ser superior a los corticosteroides en los niños (83). Sin embargo, estos estudios adolecen de limitaciones metodológicas. Las recomendaciones en niños se hacen solo para la NE exclusiva y algunos datos limitados sugieren que la NE parcial podría ser menos efectiva (61), aunque un ensayo clínico aleatorizado y controlado mostró una eficacia similar (84). Los datos son más débiles para la práctica en adultos y la mayoría de los centros continuarán usando esteroides (o productos biológicos) como terapia de primera línea, a menos que estos agentes estén activamente contraindicados. Sin embargo, las características del paciente y la enfermedad también contribuyen a las decisiones de manejo terapéutico, lo que puede hacer que el tratamiento con NE sea una opción de primera línea también en determinados casos de adultos con EC aguda (85). Se prefiere la NE porque no se ha demostrado que la NP ofrezca ninguna ventaja en el ámbito de la EC y debe usarse solo para mejorar el estado nutricional después de la cirugía y cuando no son posibles otros modos de nutrición (86).
Recomendación 17A
Para la NE en la EII se pueden usar sondas nasales o el acceso percutáneo.
Grado de recomendación B, consenso fuerte (96 % de acuerdo).
Recomendación 17B
La NE en la EC debe administrarse a través de una bomba de alimentación enteral.
Grado de recomendación B, consenso fuerte (92 % de acuerdo).
Comentario para A/B
La NE puede administrarse de manera segura mediante sonda nasogástrica o gastrostomía endoscópica percutánea (87-89). La NE continua, administrada a través de una bomba de alimentación enteral con volúmenes gradualmente crecientes hasta alcanzar las dosis prescritas, parece tener tasas de complicaciones más bajas que la administración en bolos (87-90). Las complicaciones más frecuentes de la NE son las mecánicas (relacionadas con la sonda) y, luego, las metabólicas e infecciosas, pero estas no son notablemente diferentes de las observadas en otras enfermedades crónicas (89,90). Pocos pacientes con CU necesitarán NE o NP excepto durante las exacerbaciones más graves y en la fase perioperatoria. La NE es más apropiada y está asociada de forma significativa a menos complicaciones que la NP en la CU aguda. El reposo intestinal obtenido mediante nutrición exclusivamente intravenosa no altera el pronóstico; no obstante, no existen contraindicaciones específicas al uso de la NP en la CU.
En la EC, el soporte nutricional se necesita con mayor frecuencia. No existe una contraindicación específica para el uso de la NP en los pacientes con EC, en comparación con otras enfermedades, y se puede seleccionar una vía central o periférica de acuerdo con la duración esperada. No hay suficientes datos para aconsejar el uso de sustratos específicos en la composición de la NP en la EC. Sin embargo, la NP debe ajustarse para satisfacer las necesidades individuales del paciente. La NP, especialmente en el domicilio, debe verse como una nutrición complementaria, no exclusiva, que pueda reducirse a un nivel mínimo cuando la composición corporal se haya recuperado lo suficiente.
Recomendación 18A
La NE estándar (fórmula polimérica, con moderado contenido en grasa, sin suplementos particulares) puede emplearse como tratamiento nutricional primario o como tratamiento de soporte en la EII activa.
Grado de recomendación 0, consenso fuerte (96 % de acuerdo).
Recomendación 18B
Las formulaciones o sustratos específicos (por ejemplo, glutamina, ácidos grasos n-3) no se recomiendan en el uso de la NE o la NP para pacientes con EII.
Grado de recomendación B, consenso fuerte (96 % de acuerdo).
Comentario para A/B
Varios estudios han comparado la eficacia de diferentes tipos de fórmulas enterales (dietas elementales, semielementales, oligoméricas o poliméricas) en el manejo de la EC activa. Un metaanálisis Cochrane de diez ensayos no mostró diferencias estadísticamente significativas entre los pacientes tratados con dieta elemental (n =188) y los sometidos a dieta no elemental (dieta semielemental o polimérica; n =146) (91). La composición proteica no pareció influir en el potencial terapéutico de la NE. La actual investigación sistemática revela evidencia insuficiente para hacer recomendaciones firmes (91,92). Por lo tanto, se recomienda que se empleen fórmulas estándar si la NE se utiliza como terapia nutricional primaria.
El uso de fórmulas suplementadas con factores de crecimiento, fórmulas con niveles más bajos de emulsionantes o fórmulas oligoméricas como alternativa a las dietas estándar no está respaldado por datos fiables. Igualmente, no hay evidencia de que ninguna de estas alternativas sea inferior al uso de las fórmulas poliméricas estándar (93).
No hay suficientes datos para recomendar el uso de sustratos específicos en la composición de la NP en la EC. No obstante, la NP debe ajustarse para satisfacer las necesidades individuales del paciente.
Recomendación 19
En los pacientes con EC se debe hacer todo lo posible para evitar la deshidratación y minimizar el riesgo de tromboembolismo.
Grado de recomendación GPP, consenso fuerte (100 % de acuerdo).
Comentario
Aunque no hay datos suficientes para prescribir la anticoagulación de rutina, esta debe considerarse en todos los pacientes con EII y, especialmente, en aquellos con NP, subrayando la importancia de evitar la deshidratación (94-98).
Recomendación 20A
Los pacientes con EC que presentan una fístula distal (ileal baja o colónica) de bajo débito generalmente pueden recibir todo el soporte nutricional a través de la vía enteral (generalmente como alimento).
Grado de recomendación 0, consenso fuerte (100 % de acuerdo).
Recomendación 20B
Los pacientes con EC que presentan una fístula proximal y/o un débito muy alto deben recibir soporte nutricional con NP parcial o exclusiva.
Grado de recomendación B, consenso fuerte (96 % de acuerdo).
Comentario para A/B
Los pacientes con EC son propensos a la formación de fístulas entre dos localizaciones intestinales o desde el intestino a otro órgano (especialmente, la piel, la vejiga y la vagina). La mayoría se producen después de la operación. Está demostrado que, en los pacientes quirúrgicos, el soporte nutricional temprano, independientemente de la vía de administración, disminuye la aparición y la gravedad de las fístulas (85-99,100). La desnutrición con IMC < 20 aparece como un factor de riesgo independiente (101).
El tratamiento de las fístulas intestinales suele ser complejo, dependiendo de la ubicación, la escala y la naturaleza de los síntomas, y justifica el tratamiento por un equipo multidisciplinario que incluya un gastroenterólogo, un cirujano y un dietista (100). En los pacientes con fístula distal (ileal o colónica baja) puede ser posible proporcionar todo el soporte nutricional necesario a través de la vía enteral (102-104). En el paciente con fístula proximal y/o débito muy alto, puede ser preferible manejar la situación con reposo intestinal y una NP completa (105,106); sin embargo, aun así, el beneficio psicológico de comer puede justificar su inclusión en el régimen nutricional a pesar de las expectativas mínimas de que haya una absorción útil de nutrientes (103). La corrección quirúrgica es más probable que tenga éxito si el estado nutricional se ha optimizado antes de la operación (107).
Recomendación 21
En los pacientes con enfermedad de Crohn (EC) que han permanecido privados de nutrición durante muchos días deben tomarse las medidas y precauciones estándar para prevenir el síndrome de realimentación, especialmente con respecto al fosfato y la tiamina.
Grado de recomendación B, consenso fuerte (100 % de acuerdo).
Comentario
El síndrome de realimentación no debería ser un problema en el paciente con enfermedad inflamatoria intestinal (EII) bien controlada, aunque no es raro encontrar pacientes en quienes la falta de nutrición se haya prolongado muchos días. Este es un tema de gran interés y que requiere la debida atención ya que, en ellos, se requiere adoptar todas las medidas y precauciones estandarizadas para evitar el síndrome de realimentación, especialmente con respecto al fosfato y la tiamina (108-110).
Recomendación 22A
La nutrición enteral (NE) parece segura y puede recomendarse como terapia de apoyo de acuerdo con la práctica nutricional estándar para los pacientes con colitis ulcerosa (CU) grave.
Grado de recomendación: PCP, consenso fuerte (100 % de acuerdo).
Recomendación 22B
La nutrición parenteral (NP) no debe usarse en el caso de la CU excepto si se produce insuficiencia intestinal.
Grado de recomendación 0, consenso fuerte (88 % de acuerdo).
Comentario para A/B
La NE no se ha evaluado suficientemente en la CU activa. Sin embargo, parece segura y puede ser nutricionalmente aceptable en los pacientes con enfermedad grave (111). Su eficacia debería evaluarse en nuevos estudios con cohortes más grandes de pacientes.
La NP se recomienda a los pacientes desnutridos con CU y a aquellos con enfermedad grave solo cuando no son capaces de tolerar la NE o no pueden ser alimentados eficazmente por la boca o por sonda enteral (111-113).
V. ASPECTOS QUIRÚRGICOS DE LA NUTRICIÓN EN LA EII (FIGS. 8 Y 9)
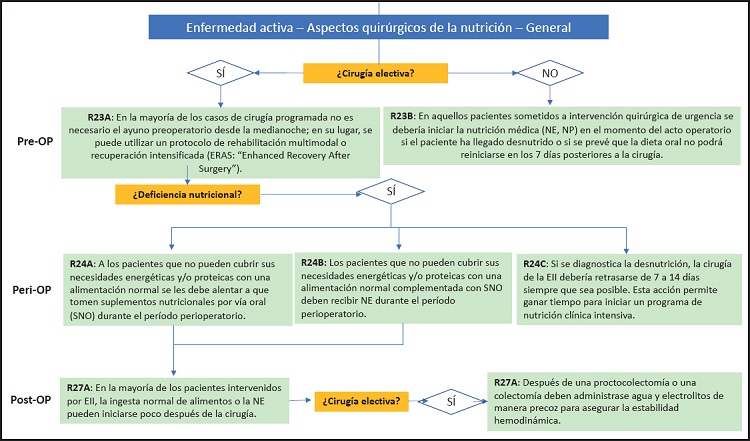
Recomendación 23A
En el preoperatorio de la mayoría de los casos de cirugía programada no es necesario mantener al paciente en ayunas a partir de la medianoche; en su lugar, se puede utilizar un protocolo de rehabilitación multimodal o de recuperación intensificada (PRI), conocidos también como protocolos ERAS (del inglés “Enhanced Recovery After Surgery”).
Grado de recomendación B (consulte la guía quirúrgica de la Sociedad Europea de Nutrición Clínica y Metabolismo (ESPEN) (114), consenso fuerte (100 % de acuerdo).
Comentario
La ESPEN ha elaborado una guía sobre la nutrición del paciente quirúrgico (114) y la mayoría de los principios establecidos son igualmente aplicables al paciente con EII sometido a una intervención quirúrgica. Durante el período perioperatorio deben seguirse las recomendaciones que se enumeran más abajo. Desde un punto de vista metabólico y nutricional, los aspectos fundamentales del cuidado perioperatorio son:
− Evitar los largos períodos de ayuno preoperatorio.
− Restablecer la alimentación oral lo antes posible después de la cirugía.
− Integrar la nutrición en el plan de cuidados general del paciente.
− Realizar un control metabólico, por ejemplo, de la glucosa en sangre.
− Reducir todos aquellos factores que exacerban el catabolismo relacionado con el estrés o alteran la función digestiva.
− Llevar a cabo una movilización precoz para facilitar la síntesis de proteínas y la función muscular.
Recomendación 23B
En aquellos pacientes sometidos a una intervención quirúrgica de urgencia se debería iniciar la nutrición clínica (NE, NP) en el momento del acto operatorio si el paciente ha llegado desnutrido o si se prevé que la dieta oral no podrá reiniciarse en los 7 días posteriores a la cirugía.
Grado de recomendación B (consulte la guía de cirugía de la ESPEN (114), consenso (88 % de acuerdo).
Comentario
El soporte nutricional está indicado en los pacientes con desnutrición e incluso en el paciente sin desnutrición importante si se prevé que no será capaz de comer durante más de siete días durante el período perioperatorio. También está indicado para los pacientes que no puedan mantener la ingesta por vía oral por encima del 60-75 % de la ingesta recomendada durante más de diez días. En estas situaciones se recomienda iniciar lo antes posible el soporte nutricional (preferiblemente, por vía enteral).
Recomendación 24A
Se debe alentar a los pacientes que no puedan cubrir sus necesidades energéticas y/o proteicas con una alimentación normal a que tomen suplementos nutricionales por vía oral (SNO) durante el período perioperatorio.
Grado de recomendación B, consenso fuerte (100 % de acuerdo).
Comentario
Una ingesta preoperatoria insuficiente constituye una indicación de interconsulta de asesoramiento o consejo dietético, o para la administración de SNO. Kuppinger y cols. (115) demostraron, en pacientes sometidos a cirugía abdominal, que una menor ingesta de alimentos antes del ingreso hospitalario constituye un factor de riesgo independiente de complicaciones posoperatorias. Veinticuatro ensayos sobre el uso de los SNO y la NE han analizado las ventajas significativas de la NE, especialmente con respecto a la reducción de las complicaciones infecciosas, la duración de la estancia hospitalaria y los costes. En seis ensayos clínicos aleatorizados (ECA) se ha investigado la administración posoperatoria y post-hospitalaria de los SNO (116-120). Los datos disponibles no muestran con certeza que la administración sistemática mejore el resultado, pero sí muestran beneficios en términos de mejora del estado nutricional, menor tasa de complicaciones, bienestar y calidad de vida en aquellos pacientes que no pueden cubrir sus necesidades nutricionales en el domicilio con la alimentación habitual.
Recomendación 24B
Los pacientes que no puedan cubrir sus necesidades energéticas y/o proteicas con una alimentación normal complementada con SNO deben recibir NE durante el período perioperatorio.
Grado de recomendación B, consenso fuerte (100 % de acuerdo).
Comentario
Como se indicó anteriormente, una ingesta preoperatoria insuficiente afecta a la tasa de complicaciones. Por tanto, si la ingesta oral es insuficiente, independientemente de la intervención (alimentación oral o SNO), se debe iniciar la NE (114). Después de la cirugía, la NE debe continuarse o iniciarse ya que muchos estudios han demostrado los beneficios y la viabilidad de la alimentación a través de una sonda colocada distalmente a la anastomosis, bien sea mediante un catéter a través de una yeyunostomía o bien mediante una sonda nasoyeyunal, situando el extremo de la sonda más allá de la anastomosis en el propio acto operatorio (121-126).
Recomendación 24C
Si se diagnostica la presencia de desnutrición, la cirugía para la EII debería retrasarse de 7 a 14 días siempre que sea posible. Esto permite ganar tiempo para iniciar un programa de nutrición clínica intensiva.
Grado de recomendación A (consulte la guía de cirugía de la ESPEN (114), consenso fuerte (96 % de acuerdo).
Comentario
La desnutrición tiene un impacto negativo sobre la evolución clínica, la tasa de complicaciones posoperatorias y la mortalidad (127-132). Por lo tanto, los pacientes con riesgo nutricional grave (ver más abajo) podrían beneficiarse de una terapia nutricional antes de someterse a una cirugía mayor, incluso si la cirugía tiene que retrasarse. Un grupo de trabajo de la ESPEN (2006) ha definido el riesgo nutricional «grave» como la presencia de, al menos, uno de los siguientes criterios:
Recomendación 25A
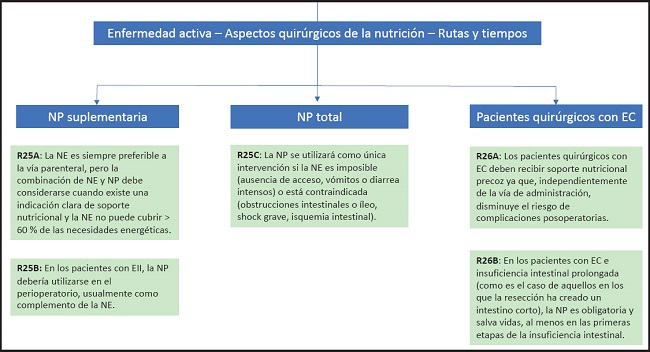
La NE es siempre preferible a la vía parenteral, pero la combinación de NE y NP debe considerarse cuando existe una indicación clara de soporte nutricional y la NE no puede cubrir > 60 % de las necesidades energéticas.
Grado de recomendación A (consulte la guía de cirugía de la ESPEN (114), consenso fuerte (100 % de acuerdo).
Recomendación 25B
En los pacientes con EII, la NP debería utilizarse en el perioperatorio, usualmente como complemento de la NE.
Grado de recomendación B, consenso fuerte (96 % de acuerdo).
Recomendación 25C
La NP se utilizará como única intervención si la NE es imposible (ausencia de acceso, vómitos o diarrea intensos) o está contraindicada (obstrucciones intestinales o íleo, shock grave, isquemia intestinal).
Grado de recomendación A, consenso fuerte (96 % de acuerdo).
Comentario para A/B/C
Siempre se debe preferir la vía enteral, excepto cuando se presenten una o más de las siguientes contraindicaciones:
− Obstrucciones intestinales o íleo.
− Shock grave.
− Isquemia intestinal.
− Fístula de alto débito.
− Hemorragia intestinal grave.
En esos casos, la NP puede ser necesaria durante un período de días o semanas, hasta que se recupere la función digestiva. Para obtener más detalles, consulte la Guía de la ESPEN sobre nutrición clínica en cirugía (114).
Recomendación 26A
Los pacientes quirúrgicos con EC deben recibir soporte nutricional precoz ya que, independientemente de la vía de administración, disminuye el riesgo de complicaciones posoperatorias.
Grado de recomendación B: consenso fuerte (100 % de acuerdo).
Comentario
En dos metaanálisis (una revisión sistemática Cochrane) se han demostrado las ventajas de la NE inicial en las 24 horas posteriores a la cirugía en comparación con el inicio tardío (133,134).
Recomendación 26B
En los pacientes con EC e insuficiencia intestinal prolongada (como aquellos en los que la resección ha creado un intestino corto), la NP es obligatoria y salva vidas, al menos en las primeras etapas de la insuficiencia intestinal.
Grado de recomendación B (consulte la guía de cirugía de la ESPEN), consenso fuerte (92 % de acuerdo).
Comentario para A/B
Aunque la NE ha demostrado ser la más beneficiosa en casi todas las poblaciones de pacientes, es relativamente raro que sea suficiente en los individuos con insuficiencia intestinal aguda o fístulas enterocutáneas, debido a que la integridad del intestino se halla comprometida. Por este motivo, la NP a menudo representa la opción principal, sola o en asociación con la NE (NP suplementaria) (73).
Recomendación 27A
En la mayoría de los pacientes intervenidos por EII, la ingesta normal de alimentos o la NE pueden iniciarse poco después de la cirugía.
Grado de recomendación 0 (consulte la guía de cirugía de la ESPEN), consenso fuerte (100 % de acuerdo).
Recomendación 27B
Después de una proctocolectomía o una colectomía deben administrase agua y electrolitos de manera precoz para asegurar la estabilidad hemodinámica.
Grado de recomendación A (consulte la guía de cirugía de la ESPEN), consenso fuerte (96 % de acuerdo).
Comentario para A/B
Como se indica en las guías quirúrgicas (114), el comienzo temprano de la alimentación normal o la NE, incluidos los líquidos claros, en el primer o segundo día del posoperatorio no afecta la cicatrización de las anastomosis en el colon o el recto y reduce significativamente la duración de la estancia hospitalaria. La importancia de este aspecto se ha resaltado en una revisión sistemática Cochrane (130). En los metaanálisis recientes (134-136) se observaron beneficios significativos con respecto a la recuperación posoperatoria y la tasa de infección. La nutrición posoperatoria inicial se asocia con reducciones significativas de la tasa global de complicaciones, en comparación con las políticas tradicionales de alimentación posoperatoria, y no afecta negativamente a los resultados, incluida la mortalidad: la frecuencia de la dehiscencia anastomótica, la reanudación de la función intestinal o la duración de la estancia hospitalaria (136).
VI. RECOMENDACIONES DIETÉTICAS DURANTE LA REMISIÓN (FIGS. 10 Y 11)
Recomendación 28
Todos los pacientes con EII en remisión deben recibir el asesoramiento de un dietista como parte del enfoque multidisciplinario, con el fin de mejorar la terapia nutricional y evitar la desnutrición y cualquier otro trastorno relacionado con la misma.
Grado de recomendación PCP, consenso fuerte (100 % de acuerdo).
Comentario
Hay muy pocos datos originales a este respecto pero al menos nueve artículos incluyen declaraciones que indican que es probable que el asesoramiento por parte de un dietista pueda ser útil para el control de la EII en adultos y niños; el fundamento de estos datos es limitado. Es probable que las carencias nutricionales sean más evidentes en los pacientes con EC que afecte al intestino delgado que en aquellos otros con enfermedad colónica aislada o CU, pero estos últimos grupos también pueden verse afectados (103).
En muchos países europeos se ha adoptado el cribado nutricional como parte fundamental del manejo clínico de estos pacientes, y también se recomienda que todos los pacientes con EII tengan acceso a un dietista con experiencia en este campo.
Recomendación 29
No es necesario seguir una dieta específica durante las fases de remisión de la EII.
Grado de recomendación 0, consenso fuerte (96 % de acuerdo).
Comentario
En general, no es necesario seguir una dieta específica durante las fases de remisión. Ninguna de las dietas alternativas o dietas semiexclusivas parece eficaz para obtener la remisión. Sin embargo, a menudo se observan intolerancias alimentarias individuales en los pacientes con EII y es habitual que haya mala tolerancia a la lactosa y los productos lácteos, las especias, las hierbas, los fritos, los alimentos flatulentos y los ricos en fibra (137-140).
Los pacientes con EC se inclinan habitualmente por una dieta baja en fibra y vegetales que a menudo es hipocalórica y se asocia a múltiples deficiencias de micronutrientes (41). La intolerancia adquirida a la lactosa es especialmente frecuente en los pacientes con EC proximal y justificará una dieta con restricción de lactosa. Las dietas de exclusión específicas son consideradas de utilidad por los propios pacientes aunque, realmente, si se pretende mejorar sus resultados, deben indicarse de un modo personalizado para evitar la aparición de intolerancias alimentarias a título individual. Esta estrategia es difícil de generalizar y realmente no hay ensayos recientes acerca del potencial beneficio de las dietas de exclusión. Se dispone de pocos datos procedentes de ensayos controlados que avalen la eliminación de la lactosa, los productos lácteos en general, las especias, las hierbas, los alimentos fritos y los alimentos que aumentan la producción de gas o que son ricos en fibra, y solo se aconseja su restricción cuando se toleren mal, siendo útiles en este contexto para mantener la remisión sintomática (141). Otros estudios de calidad razonable también han incluido manipulaciones dietéticas. Estos estudios, junto con el uso de suplementos nutricionales, se tratan en apartados posteriores. El uso de un régimen de NE exclusiva es claramente una forma extrema de exclusión dietética.
Se cree que la NE interviene en la prevención de las recaídas en los niños con EC inactiva (78,91,142,143) y este efecto también se ha observado en un estudio japonés realizado en pacientes adultos con EC (144-146). Esaki y cols. (147) realizaron un ensayo en 145 pacientes con EC (en su mayoría con remisión inducida con NP total) y consideraron que el empleo de la nutrición elemental/polimérica de mantenimiento disminuía el riesgo de recurrencia si la afectación se producía en el intestino delgado, en comparacion con los efectos sobre el intestino grueso. Sin embargo, la presente investigación sistemática indica que, en general, el uso de la NE elemental es ineficaz para mantener la remisión en la EC, declarando que esta práctica no puede recomendarse. El grupo de expertos considera que se trata de una conclusión controvertida, especialmente teniendo en cuenta una evaluación Cochrane anterior que consideraba que la NE prolongada podía ayudar a mantener la remisión y reducir el uso de corticosteroides en la EC (87,147). Por tanto, no se hace ninguna recomendación.
Recomendación 30
No se recomienda la suplementación con ácidos grasos n-3 para el mantenimiento de la remisión en los pacientes con EII.
Grado de recomendación B, consenso fuerte (100 % de acuerdo).
Comentario
En las revisiones sistemáticas se ha llegado a la conclusión de que complementar la dieta con ácidos grasos n-3 es ineficaz para el mantenimiento de la remisión en los pacientes con CU (148,149). Por lo tanto, no se recomienda. Los datos anteriores se obtuvieron a partir de adultos. Parece razonable extrapolar las conclusiones a la práctica pediátrica. En la última revisión Cochrane (150) se ha concluido que los ácidos grasos n-3 probablemente no sean efectivos para el mantenimiento de la remisión en la EC.
Recomendación 31
Como norma, no se deben recomendar dietas inespecíficas con elevado contenido en fibra para mantener la remisión en la EII.
Grado de recomendación 0, consenso fuerte (96 % de acuerdo).
Comentario
Gran parte de la literatura reciente analiza los efectos de agentes específicos, como los prebióticos, que no se analizan aquí, pero se presupone que muchas formas de fibra tendrán un efecto notable sobre la microbiota intestinal y, en consecuencia, posiblemente sobre el mantenimiento de la remisión en la EII. En general, se acepta que la fibra vegetal no es aconsejable en los pacientes con estenosis intestinal (PCP), pero cada vez se publican más datos que indican que las fibras prebióticas pueden ser útiles para el mantenimiento de la remisión en algunos pacientes con CU. En varios pequeños estudios controlados se ha observado un beneficio claro de la adición de fibra a la dieta de los pacientes con CU (151-153). Dado que los efectos para mantener la remisión fueron similares para la cebada germinada, la cáscara de ispágula y las semillas de Plantago ovata, puede ser razonable concluir que se trata de un efecto genérico del aumento de la fibra vegetal.
A menudo, la fibra está relativamente contraindicada en la EC debido a la presencia de estenosis y, según parece, la fibra en forma de prebiótico fructooligosacárido es ineficaz en la EC (48). Sin embargo, en un estudio pobremente controlado que evaluó los efectos de la suplementación con fibra de trigo, los pacientes que recibieron los suplementos mostraron una mejor calidad de vida y no presentaron efectos adversos evidentes (154). Hay otro estudio reciente sobre la suplementación con fibra en el que también se han comunicado beneficios. Se estudió el uso no controlado de una dieta ovovegetariana con más de 30 g de fibra por cada 2000 kcal. El mantenimiento de la remisión a un año fue notable (92 %) (155). Véase también la recomendación 8.
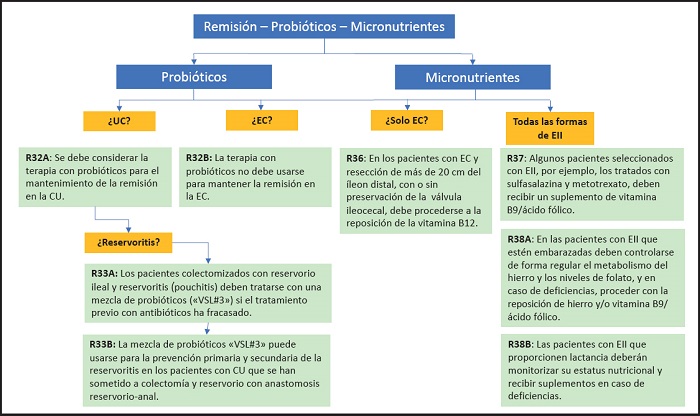
Recomendación 32A
Se debe considerar la terapia con probióticos para el mantenimiento de la remisión en la CU.
Grado de recomendación B, consenso fuerte (96 % de acuerdo).
Recomendación 32B
La terapia con probióticos no debe usarse para mantener la remisión en la EC.
Grado de recomendación 0, consenso fuerte (100 % de acuerdo).
Comentario para A/B
La cepa de E. coli Nissle 1917 y la formulación multiespecie «VSL#3» tienen beneficios, avalados por un metaanálisis (156), sobre el mantenimiento de la remisión en los pacientes, incluidos los niños, con CU de leve a moderada, en comparación con los compuestos de 5-aminosalicilato (75-157,158). Se han estudiado otros preparados probióticos que, por regla general, se han tolerado bien y con tendencia a mostrar beneficios, pero no se ha observado una eficacia significativa (159,160). Existe una nota de advertencia con respecto a Lactobacillus rhamnosus GG; así, en casos aislados de niños y adultos se han descrito bacteriemias tras la administración de este probiótico a pacientes con CU aguda grave (161,162).
Es probable que los probióticos no sean efectivos para prevenir la recurrencia de la enfermedad en los pacientes con EC (158). Aunque se hacen algunas afirmaciones positivas, no se puede concluir ningún beneficio inequívoco (163-68). Actualmente no se recomiendan los probióticos.
El término “VSL # 3” se refiere solo al producto probiótico utilizado en la literatura citada y a productos equivalentes independientes del etiquetado actual del producto.
Recomendación 33A
Los pacientes colectomizados con reservorio ileal y reservoritis (pouchitis) deben tratarse con una mezcla de probióticos («VSL#3») si el tratamiento previo con antibióticos fracasa.
Grado de recomendación B, consenso fuerte (96 % de acuerdo).
Recomendación 33B
La mezcla de probióticos «VSL#3» puede usarse para la prevención primaria y secundaria de la reservoritis en los pacientes con CU que se han sometido a colectomía y tienen un reservorio con anastomosis reservorio-anal.
Grado de recomendación B, consenso fuerte (100 % de acuerdo).
Comentario para A/B
Los antibióticos (ciprofloxacino, metronidazol) son el tratamiento de referencia de la reservoritis aguda (169). Dos ensayos doble ciego controlados con placebo y realizados en adultos mostraron la efectividad de una mezcla probiótica particular («VSL#3» que contiene 450 mil millones de unidades formadoras de colonias de ocho bacterias del ácido láctico: B. breve, B. longum, B. infantis, L. acidophilus, L. casei, L. delbrueckii, L. plantarum y Streptococcus salivarius subespecie thermophilus) para mantener la remisión en pacientes con reservoritis crónica (170,171). Un análisis agrupado de estos dos estudios (76 participantes) sugiere que esta bacterioterapia puede ser más eficaz que el placebo para el mantenimiento de la remisión. El 85 % (34/40) de los pacientes tratados con el principio activo mantuvieron la remisión de nueve a doce meses, en comparación con el 3 % (1/36) de los pacientes tratados con placebo (RR: 20,24). Un análisis GRADE indicó que la calidad de los datos que avalan este resultado es baja debido a la escasez de datos (35 acontecimientos) (172). En otro estudio (169) se evaluaron los efectos de esta bacterioterapia como complemento de un tratamiento de referencia. La disminución de las puntuaciones obtenidas en el índice de actividad de la enfermedad en el caso de la CU (IACU) (≥ 50 %) fue mayor en el grupo tratado con el principio activo que en el grupo tratado con un placebo (63,1 frente a 40,8, según el protocolo; p = 0,010). La remisión fue mayor en el grupo tratado con el principio activo que en el grupo tratado con el placebo (47,7 % frente a 32,4 %; p = 0,069).
Prevención de la reservoritis: los resultados de un pequeño estudio (40 participantes) indican que la bacterioterapia puede ser más eficaz que el placebo en la prevención de la reservoritis (173). El 90 % (18/20) de los pacientes tratados con principio activo no presentaron ningún episodio de reservoritis aguda durante el estudio de doce meses, en comparación con el 60 % (12/20) de los pacientes tratados con placebo (RR: 1,50). Un análisis GRADE indicó que la calidad de los datos que avalan este resultado fue baja debido a la escasez de datos (30 acontecimientos). Por el contrario, la cepa GG de Lactobacillus rhamnosus no fue eficaz para prevenir las recaídas (174). Las pautas de la ECCO proponen el uso de «VSL#3» tanto para el mantenimiento de la remisión inducida por antibióticos como para la prevención de la reservoritis en los adultos (175) y en la CU pediátrica (176).
El término “VSL # 3” se refiere solo al producto probiótico utilizado en la literatura citada. A partir de enero de 2016, esta formulación dejó de estar disponible con la misma marca VSL # 3.
Recomendación 34A
Ni la NE ni la NP se recomiendan como terapia primaria para mantener la remisión en la EII.
Grado de recomendación PCP, consenso fuerte (100 % de acuerdo).
Recomendación 34B
En los pacientes con EC en que la desnutrición no ha podido corregirse suficientemente mediante el asesoramiento dietético, se puede recomendar el uso de SNO o NE.
Grado de recomendación de PCP, consenso fuerte (100 % de acuerdo).
Comentario para A/B
El soporte nutricional no se ha evaluado como terapia de mantenimiento en la CU, ni en la NP, ni en la EC. Una revisión sistemática reciente de doce ECA y estudios de cohortes no aleatorizados (177) (1169 pacientes, incluidos 95 niños), la mayoría de buena calidad, mostró que la NE de mantenimiento había sido igual o más eficaz que el comparador (dieta estándar, 5-AAS o azatioprina) para prevenir las recaídas de la EC durante períodos de seis meses a cuatro años. El estudio con el menor riesgo de sesgo comparó la NE suplementaria (50 %) con una dieta regular en 51 pacientes adultos con EC (178). Los pacientes de cada grupo del estudio estaban tomando medicamentos similares (5-AAS o azatioprina). En el estudio se observó que, en el grupo de la NE, nueve de 26 pacientes (34 %) tuvieron una recaída durante un seguimiento medio de 11,9 meses, en comparación con 16 de 25 pacientes (64 %) en el grupo sin NE (HR = 0,40; IC del 95 %: 0,16-0,98; p < 0,01). El estudio de laNE de mantenimiento como adyuvante de la terapia con infliximab ha arrojado resultados contradictorios, con un estudio negativo (145) y dos estudios positivos (179,180) entre los publicados hasta la fecha.
Las fórmulas elementales han sido las más estudiadas. En una revisión sistemática no se pudo observar ninguna diferencia significativa entre las tasas de remisión obtenidas, comparando las fórmulas elementales con las poliméricas (181). Sin embargo, se observó una tasa de adherencia al tratamiento más baja para la NE elemental, comparada con una dieta sin restricciones. Las organizaciones europeas de EII y de gastroenterología y nutrición pediátrica, ECCO y ESPGHAN, sugieren un posible papel para la NE parcial como terapia de mantenimiento en los pacientes con enfermedad muy leve o riesgo bajo de recaída, en cuyo caso se prefiere la alimentación polimérica, reservando la alimentación elemental para los casos de alergia a las proteínas de la leche de vaca (182).
Recomendación 35
En los pacientes con EII en remisión se debe seguir una dieta estándar (o SON), prestando atención al cribado nutricional y recurriendo al apoyo nutricional genérico cuando sea necesario.
Grado de recomendación PCP, consenso fuerte (95 % de acuerdo).
Comentario
Se han probado pocos suplementos dietéticos para el mantenimiento de la remisión en los pacientes con EII utilizando criterios de valoración clínicos. Un ensayo clínico aleatorizado, multicéntrico, de grupos paralelos y abierto demostró en 105 pacientes con CU en remisión que las semillas de Plantago ovata (10 g dos veces al día) eran tan eficaces como la mesalamina (500 mg tres veces al día) para mantener la remisión hasta un año (152). Una revisión sistemática Cochrane ha analizado seis estudios (1039 pacientes) de suplementación con ácidos grasos n-3 (150): hubo un beneficio marginal significativo para la terapia con n-3 en el mantenimiento de la remisión.
Recomendación 36
En los pacientes con EC y resección de más de 20 cm del íleon distal, con o sin preservación de la la válvula ileocecal, debe procederse a la reposición de vitamina B12.
Grado de recomendación A, consenso fuerte (100 % de acuerdo).
Comentario
Una revisión sistemática reciente ha evaluado la literatura en busca de la prevalencia, los factores de riesgo, la evaluación y el manejo de la deficiencia de vitamina B12 en la EII (183). La CU no resecada no predispone a niveles bajos de B12 o deficiencia de B12. La prevalencia de la deficiencia de B12 en la EC varía del 5,6 % al 38 %. La resección de más de 30 cm del íleon distal, con independencia de que se haya resecado o no la válvula ileocecal, pondrá al paciente en riesgo de deficiencia de B12. La resección de menos de 20 cm normalmente no causa deficiencia (184). La EC ileal no se asocia inevitablemente con la deficiencia de vitamina B12 (185,186), pero es difícil descartar su responsabilidad cuando se trata de más de 30-60 cm (183). Los pacientes con EC y afectación ileal y/o resección y/o características clínicas que sugieran una deficiencia deberán evaluarse anualmente para detectar cualquier posible deficiencia de cobalamina (183).
Los pacientes con deficiencia clínica deben recibir 1000 µg de vitamina B12 por inyección intramuscular en días alternos durante una semana, y luego cada mes de por vida (187). Los pacientes con resección de más de 20 cm de íleon deben recibir 1000 μg de vitamina B12 de forma profiláctica también cada mes y de forma indefinida (187). La terapia oral puede ser igual de eficaz, pero está poco explorada en la EC. Un estudio retrospectivo, abierto y no aleatorizado de 36 pacientes con EC ha demostrado que la vía oral (1200 µg al día durante en 33 pacientes, 2400 µg al día en tres pacientes) es eficaz en el tratamiento de la deficiencia de vitamina B12 (188). Por ahora, la suplementación parenteral sigue siendo la referencia, pero la reposición oral puede convertirse en referencia en los próximos años.
Recomendación 37
Algunos pacientes seleccionados con EII —por ejemplo, los tratados con sulfasalazina y metotrexato— deben recibir un suplemento de vitamina B9/ácido fólico.
Grado de recomendación B, consenso fuerte (100 % de acuerdo).
Comentario
La deficiencia de folato en la EII puede tener varias causas: ingesta escasa, malabsorción y exceso de utilización del folato debido a la inflamación de las mucosas y al efecto de los medicamentos. Una combinación de estos factores podría ser responsable de la deficiencia de esta vitamina. Los fármacos son los principales responsables de la deficiencia de folato por inhibición de la dihidrofolato-reductasa, una enzima que cataliza la reducción del ácido dihidrofólico en ácido tetrahidrofólico (metotrexato) (189), o por inducir la malabsorción de folato (sulfasalazina) (190). La azatioprina y la 6-mercaptopurina también inducen macrocitosis, pero a través de una actividad mielosupresora.
Una revisión sistemática y un metaanálisis de 10 estudios realizados en 4517 pacientes encontraron un efecto protector general de la suplementación de ácido fólico sobre el desarrollo del cáncer colorrectal (HR combinado = 0,58; IC del 95 %: 0,37 a 0,80) (191). Un estudio italiano comparó un mes de suplementación con 15 mg de ácido fólico o folínico en 30 pacientes con EII tratados con sulfasalazina (192). Ambos pudieron restaurar las reservas corporales de folato pero el ácido folínico fue más eficiente. Las directrices ECCO-ESPGHAN sobre el tratamiento médico de la EC pediátrica recomiendan la administración oral de ácido fólico a los pacientes tratados con metotrexato, 5 mg una vez a la semana, 24-72 horas después del metotrexato, o 1 mg al día durante cinco días a la semana (182). Este grupo de expertos recomienda la misma práctica en los adultos.
Recomendación 38A
En las pacientes con EII que están embarazadas deben controlarse de forma regular el metabolismo del hierro y los niveles de folato y, en caso de deficiencias, proceder con la reposición de hierro y/o vitamina B9/ácido fólico.
Grado de recomendación de PCP, consenso fuerte (95 % de acuerdo).
Recomendación 38B
En las pacientes con EII en período de lactancia, el estado nutricional debe controlarse regularmente y, en caso de deficiencias, proceder a la terapia de reposición correspondiente.
Grado de recomendación PCP, consenso fuerte (100 % de acuerdo).
Comentario para A/B
Las consecuencias de la anemia y aquellas derivadas de los defectos del tubo neural (193), junto con las frecuentes deficiencias observadas en los pacientes con EII, justifican la detección periódica de las posibles deficiencias de hierro y folato, respectivamente, durante el embarazo, junto con un seguimiento nutricional.
Hay poca información disponible que sea específica con respecto a la situación de la mujer con EII que está considerando amamantar. Sin embargo, no hay datos que indiquen la aparición de daño alguno por el uso de cualquier intervención nutricional que se considere apropiada como parte del tratamiento para la madre.
Recomendación 39
En todos los pacientes con EII debería fomentarse el ejercicio aeróbico (ejercicios de media o baja intensidad y de larga duración). En los pacientes con EII y disminución de la masa muscular y/o del rendimiento muscular se debe recomendar una actividad física adecuada.
Grado de recomendación PCP, consenso fuerte (95 % de acuerdo).
Comentario
Una revisión sistemática de 19 estudios sobre la composición corporal realizados en 926 pacientes con EII reveló poca masa magra en el 28 % de los pacientes con EC y en el 13 % de los pacientes con CU (194). Se ha notificado la presencia de masa muscular, fuerza de prensión y rendimiento escasos en cohortes de adultos con EII (195,196), y también se han observado hallazgos similares en niños (197). Se comunicó la existencia de sarcopenia en el 12 % de los pacientes con EII, con una edad media de 31 años, asociada a osteopenia (195).
En un estudio alemán, 30 pacientes de 41 ± 14 años con EII de leve a moderada se aleatorizaron para realizar una carrera supervisada de intensidad moderada tres veces por semana durante diez semanas frente a un grupo de control sin ejercicio. La calidad de vida relacionada con la salud, notificada como puntuación total del cuestionario para la enfermedad inflamatoria intestinal (IBDQ, por sus siglas en inglés) mejoró un 19 % en el grupo de intervención y un 8 % en el grupo de control, con diferencias significativas con respecto a la subescala social del IBDQ, que mejoró significativamente en el grupo de intervención en comparación con los controles (p = 0,023) (198).
El tratamiento de referencia para la sarcopenia, junto con el mantenimiento de una ingesta proteica adecuada, es el entrenamiento de resistencia. Se recomienda en la sarcopenia relacionada con la edad (199). Sin embargo, no se ha evaluado en pacientes con EII. Aun así, el grupo de expertos recomienda prescribir el entrenamiento de resistencia (ejercicios con pesas) en los pacientes con EII que tengan sarcopenia o características de sarcopenia (masa muscular, fuerza y/o rendimiento reducidos).
Recomendación 40
Se debe recomendar a los pacientes obesos con EII que reduzcan el peso solo en los periodos de remisión estable y seguir entonces las directrices actuales en materia de tratamiento de la obesidad.
Grado de recomendación PCP, consenso fuerte (100 % de acuerdo).
Comentario
Hoy en día, el sobrepeso y la obesidad son el trastorno nutricional más frecuente en los pacientes con EII. Su prevalencia varía entre países, afectando al 32,7 % de 581 pacientes adultos con EII en EE. UU. (30,3 % de los pacientes con EC y 35,2 % de los pacientes con CU) (200) y al 17 % de 100 pacientes irlandeses con EC (201). En un estudio estadounidense de 1494 pacientes con EII (31,5 % de obesos) se observó una asociación entre la obesidad y sus comorbilidades habituales, la mala calidad de vida y los niveles elevados de proteína C-reactiva (202). Sin embargo, la obesidad no se asoció con una mayor utilización de la atención médica o un mayor número de cirugías relacionadas con la EII. Ningún estudio intervencionista ha abordado el tratamiento de la obesidad en pacientes con EII. Sin embargo, la elevada prevalencia tanto de las deficiencias de micronutrientes como de la sarcopenia (nombrada en este caso como obesidad sarcopénica) indica que el paciente con una dieta restrictiva tiene riesgo de sufrir más deficiencias y pérdida de masa muscular, especialmente en los estados catabólicos como los que ocurren durante los brotes de EII. Por lo tanto, el grupo de expertos se declara en contra de las dietas bajas en calorías para los pacientes con enfermedad activa y antes recomienda el ejercicio aeróbico como primer paso para obtener una pérdida peso.
Autores de la versión en castellano: Rosa Burgos (Unidad de Soporte Nutricional. Vall d´Hebron Barcelona Hospital Campus. Profesor Universitat Autónoma de Barcelona -UAB-) y Miguel Montoro (Unidad de Gastroenterología, Hepatología y Nutrición. Hospital Universitario San Jorge. Huesca. Instituto Aragonés de Ciencias de la Salud. Tutor Practicum del Grado de Nutrición Humana y Dietética. Facultad de Ciencias de la Salud y del Deporte. Universidad de Zaragoza).