INTRODUCCIÓN
La vitamina D es una prohormona compleja (1) cuya principal función es mantener la concentración de calcio y fósforo dentro del rango fisiológico que permita el metabolismo normal, la transmisión neuromuscular y la mineralización ósea.
En los últimos años se han encontrado receptores de vitamina D o de sus metabolitos en diferentes células del organismo, lo cual sugiere que, además de estar implicada en el metabolismo fosfocálcico, puede estar implicada en numerosos procesos fisiológicos (2). Por ello, recientemente no solo se relaciona su déficit con el raquitismo y la osteomalacia, como clásicamente se pensaba. Por sus propiedades no calciotrópicas (3,4), no tan conocidas hasta ahora, se está asociando también con mayor riesgo de padecer diabetes mellitus (5), obesidad (6), enfermedades cardiovasculares (7), oncológicas (8) e infecciosas, enfermedades autoinmunes (3) e incluso enfermedades psiquiátricas (9).
Las interacciones con el sistema inmune son los más conocidos de sus efectos no clásicos (10-12). La vitamina D actúa en la mayoría de las células del sistema inmune a través de su receptor VDR, haciendo que aumente su efectividad de acción ante las infecciones e inhibiendo el desarrollo de la autoinmunidad, así como el rechazo de los trasplantes.
Asimismo, la vitamina D juega un papel primordial en la regulación de la secreción de insulina, pudiendo aumentar su secreción y la sensibilidad a la misma, por lo que su déficit confiere un mayor riesgo de sufrir diabetes mellitus de tipo 1 y 2 (13,14), habiéndose comprobado también que los niños, en su debut, tienen menores concentraciones de vitamina D, en comparación con los controles sanos (15).
Además, la vitamina D parece afectar a la homeostasis de la glucosa, mediante un efecto directo sobre las células β y, de forma indirecta, mediante la regulación del calcio, puesto que la secreción de insulina depende del calcio intracelular (16). Sin embargo, la relación entre la concentración de vitamina D y el control metabólico de la DM de tipo 1, así como el efecto de la suplementación con vitamina D, son dos aspectos que permanecen todavía sin aclarar (17,18).
El objetivo del presente estudio fue analizar la prevalencia de déficit de vitamina D en nuestra población de niños diabéticos de tipo 1 y estudiar si existe relación entre el déficit de vitamina D y un peor control de la enfermedad, así como con el metabolismo óseo y lipídico, dado que la DM1 puede inducir osteopenia y/o alteraciones en la homeostasis mineral, principalmente durante el crecimiento, y que la presencia de dislipidemia incrementa la frecuencia y la severidad de las complicaciones asociadas a la diabetes.
MATERIAL Y MÉTODOS
Se trata de un estudio retrospectivo en el cual se determinó la concentración de 25-hidroxivitamina D, aprovechando la analítica anual de control, en la revisión rutinaria trimestral de los niños afectos de DM1, que se controlan en la Unidad de Diabetes Pediátrica de nuestro hospital. En dicha Unidad se controlan 290 niños y, en el periodo analizado, se disponía de los datos de 124 niños con DM1, ya que se excluyeron los debuts que se produjeron en dicho periodo, por considerarse más adecuado que la muestra fuera homogénea y que todos los pacientes estuvieran ya en tratamiento con insulina. También se excluyeron los niños que tuvieran en ese momento una enfermedad aguda o estuvieran tomando alguna medicación que pudiera interferir con el metabolismo de la vitamina D o con el metabolismo óseo.
Las analíticas se realizaron tras la obtención del consentimiento informado de los pacientes, padres o tutores. El estudio fue aprobado por el Comité de Ética de nuestra comunidad autónoma y se han seguido los protocolos de nuestro hospital para poder acceder a los datos de las historias clínicas.
Debido a que la concentración de vitamina D se asocia con la exposición solar, variable que cambia con la estación del año, se anotó la estación del año en que se extrajo la muestra de la analítica, de acuerdo con las siguientes categorías: invierno (22 de diciembre a 21 de marzo), primavera (22 de marzo a 21 de junio), verano (22 de junio a 21 de septiembre) y otoño (22 de septiembre a 21 de diciembre).
Ninguno de los niños con DM1 estaba tomando suplementos de vitamina D y se analizaron también, en el suero, otros parámetros del metabolismo fosfocálcico, como calcio, fósforo, parathormona intacta (PTHi), osteocalcina y fosfatasa alcalina ósea, así como el perfil lipídico completo: colesterol total (CT), colesterol LDL (C-LDL), colesterol HDL (C-HDL) y triglicéridos (TG). La clasificación en cuanto a suficiencia o deficiencia de vitamina D se ha llevado a cabo basándonos en las recomendaciones de la OMS y de las guías de práctica clínica publicadas en el año 2011, considerándose como deficientes aquellas concentraciones de vitamina D < 20 ng/ml y como suficientes aquellas ≥ 20 ng/ml (19).
Para determinar la concentración de 25-hidroxivitamina D en el suero, el laboratorio utiliza el analizador IDS-iSYS. El ensayo emplea una técnica de quimioluminiscencia, totalmente automatizada. Dicha técnica se encuentra estandarizada como garantía de calidad de los resultados.
La isoenzima ósea de la fosfatasa alcalina (FAO) en suero se midió mediante un enzimoinmunoensayo manual (Microvue BAP EIA, Quidel Corporation, San Diego, CA, EE. UU.), así como la osteocalcina (N-MID Osteocalcin ELISA, Inmunodiagnostic Systems Ltd, Boldon, Reino Unido). El rango de referencia de la FAO es de 12-43 U/L y el de osteocalcina de 5,8-39,8 ng/ml. Tanto la PTHi como los parámetros lipídicos se determinaron mediante técnicas totalmente automatizadas en un AU 5420 Analyzer, (Beckman Coulter Inc, Brea, EE. UU.). Para el análisis estadístico se utilizó el programa IBM SPSS® Statistics 21.0 (IBM Corporation, Armonk, NY). En primer lugar se empleó el test de Kolmogorov-Smirnov (K-S) para estudiar la distribución de las variables cuantitativas. En el caso de que siguieran una distribución normal (K-S, p > 0,05) se emplearon para su descripción la media (M) y la desviación estándar (DS) y para el análisis, respecto a una variable cualitativa de 2 categorías, el test de la t de Student (t-test).
En el caso de que las variables cuantitativas no siguieran una distribución normal (K-S, p ≤ 0,05), se emplearon para su descripción la mediana (Me) y el rango intercuartílico (RQ) y, para el análisis respecto a una variable cualitativa de 2 categorías, el test de la U de Mann Whitney (W). Respecto a una variable cualitativa de más de 2 categorías, se usó el test de Kruskal-Wallis (H) con la corrección de Bonferroni. El test del chi cuadrado (χ²) se empleó para el análisis entre variables cualitativas.
Además, se analizaron las correlaciones entre las variables cuantitativas, empleando el test de Pearson (r) y el test de Spearman (rs), según siguieran o no una distribución normal, respectivamente.
Los resultados más relevantes y significativos se describen en el apartado de resultados. El nivel de significación estadística, para todos los test estadísticos empleados, se estableció a partir de un valor p ≤ 0,05.
RESULTADOS
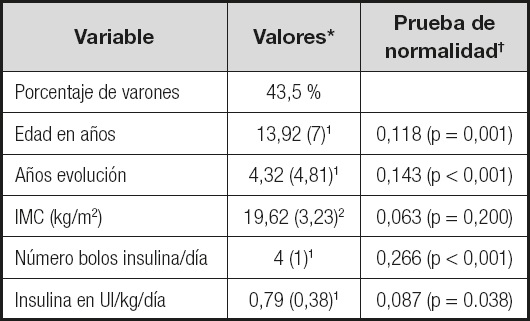
La muestra estaba formada por 124 niños con DM1, existiendo una distribución homogénea entre niños (43,5 %) y niñas (56,5 %). La edad mediana de los niños fue de 13,92 (RQ: 7) y la edad media de debut de 7,50 (DS: 3,90 años). El porcentaje de prepúberes fue del 33,1 %.
La enfermedad autoinmune más frecuente de los niños incluidos en la serie fue la enfermedad tiroidea autoinmune (11,3 %), seguida de la celiaquía (7,3 %). Como tratamiento, al 78,2 % de los niños se les aplicaba terapia convencional con múltiples dosis de insulina (MDI) y, al resto, infusión continua de insulina subcutánea (ICIS).
Alrededor de la mitad (43,55 %) de los niños con DM1 presentaban un buen control metabólico (HbA1c < 7,5 %). La mediana de tiempo de evolución de la enfermedad de la población de estudio fue de 4,32 años (RQ: 4,81).
Las características del grupo con respecto a edad, años de evolución, índice de masa corporal (IMC), necesidad de insulina total y bolos de insulina rápida al día se muestran en la tabla I y los resultados bioquímicos en las tablas II y III.
Tabla I. Características antropométricas y tratamiento recibido por los niños con diabetes mellitus de tipo 1.
*En las variables cuantitativas se muestran las medidas de tendencia central y desviación típica en relación a los resultados de las pruebas de normalidad.
†Test de prueba de normalidad realizado: Kolmogorov-Smirnov.
1Mediana y rango intercuartílico.
2Media y desviación típica.
Tabla II. Parámetros del metabolismo glucídico y óseo.

*Test de prueba de normalidad realizado: Kolmogorov-Smirnov.
1Mediana y rango intercuartílico.
2Media y desviación típica.
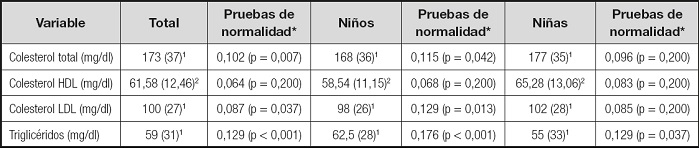
Tabla III. Parámetros del metabolismo lipídico.
*Test de prueba de normalidad realizado: Kolmogorov-Smirnov.
1Mediana y rango intercuartílico.
2Media y desviación típica.
La concentración media de vitamina D del total de la muestra fue de 25,41 (DS: 7,43). El presente estudio mostró que la prevalencia del déficit de vitamina D en estos niños, entendida como aquellas concentraciones por debajo de 20 ng/mL, era del 24,79 %. Un 54,55 % del total presentaban concentraciones de vitamina D entre 20 y 29 ng/mL, y el 20,66 % las tenían iguales o superiores a 30 ng/ml. La mayoría de los sujetos presentaban, por tanto, concentraciones iguales o superiores a 20 ng/ mL (79,84 0%).
La concentración de vitamina D, tanto en el grupo de niños como en el de niñas sigue una distribución normal (niñas: vit. D: K-S, 0,08, p = 0,20; niños: vit. D: K-S, 0,092, p = 0,20) y se observó una media de concentración de vitamina D significativamente más elevada (t-test: -2,8, p = 0,006) en los niños (IC 95 %: 25,48-29,11) frente a las niñas (IC 95 %: 21,05-25,18). La HbA1c media de la muestra total, expresada en porcentaje (%), fue de 7,84 (DS: 1,010).
La vitamina D, la glucosa y la HbA1c de la muestra total siguieron una distribución normal (K-S, 0,069, p = 0,020; K-S, 0,083, p = 0,060 y K-S, 0,080, p = 0,074, respectivamente) y tanto la asociación entre vitamina D y glucosa como la asociación entre vitamina D y HbA1c no fueron estadísticamente significativas (r: 0,099, p = 0,281 y r: 0,020, p = 0,829, respectivamente).
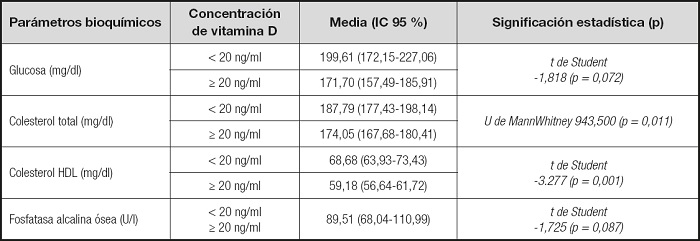
Sin embargo, cuando se establecieron dos grupos de niños, en función de su concentración de vitamina D (≥ 20 ng/ml y < 20 ng/ml), se pudo observar que la concentración de glucosa en sangre de los niños con concentración < 20 ng/ml (K-S, 0,097, p = 0,20) era inferior, pero no de forma significativa (t-test: -1,818, p = 0,072) a la concentración de glucosa de los niños con concentración ≥ 20 ng/ml de vitamina D (K-S, 0,077, p = 0,20).
Al estudiar el colesterol total respecto a la concentración de vitamina D (< 20 ng/ml CT, K-S: 0,12, p = 0,20; ≥ 20 ng/ml CT, K-S: 0,11, p = 0,014) y el colesterol HDL (< 20 ng/ml HDL-C, K-S: 0,068, p = 0,20; ≥ 20 ng/ml HDL-C, K-S: 0,069, p = 0,20) se encontraron en ambos casos diferencias estadísticamente significativas (W: 9,435, p = 0,011 y t-test: -3,277, p = 0,001 respectivamente). En el caso de la FAO respecto a la concentración de vitamina D (< 20 ng/ml CT, K-S: 0,121, p = 0,20; ≥ 20 ng/ml CT, K-S: 0,083, p = 0,020), las diferencias no llegaron a ser estadísticamente significativas (t-test: 1,725, p = 0,087) (Tabla IV).
Es decir, los niños con una concentración adecuada de vitamina D (≥ 20 ng/ml) tenían a su vez menores concentraciones de colesterol total (≥ 20 ng/ml, Me: 170; < 20 ng/ml, Me: 186,5). Sin embargo, los niños con insuficiencia de vitamina D (< 20 ng/ml) tenían concentraciones más elevadas de colesterol HDL (< 20 ng/ml, C-HDL: 63,93-73,43; ≥ 20 ng/ml, C-HDL: 56,64-61,72).
Tampoco se encontraron diferencias significativas al analizar la relación de la concentración de vitamina D con el control metabólico de los niños con DM1 (χ²: 1,13, p = 0,286), pues la concentración de vitamina D era muy similar entre los pacientes con buen y mal control metabólico.
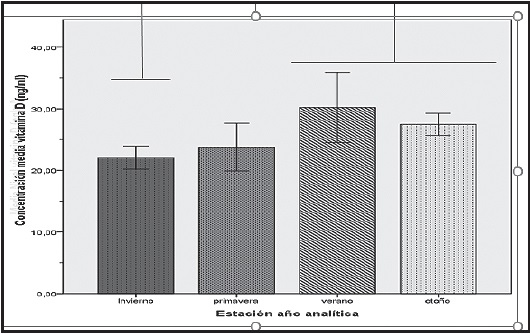
Cuando se analizó la concentración de vitamina D según la estación del año en la que se realizó la analítica (invierno, vit. D, K-S: 0,107, p = 0,20; primavera, vit. D, K-S: 0,128, p = 0,20; verano, vit. D, K-S: 0,136, p = 0,20; otoño, vit. D, K-S: 0,143; p = 0,048) se encontraron diferencias significativas (H: 15,07, p = 0,02). En invierno y primavera se obtuvieron concentraciones más bajas (20,65-24,40 y 19,91-27,66, respectivamente) mientras que en verano y otoño (23,15-35,80 y 25,89-29,78, respectivamente) se encontraron concentraciones más elevadas. Las diferencias intergrupos encontradas entre invierno y otoño e invierno y verano fueron estadísticamente significativas (corrección de Bonferroni, 0,003 y 0,025, respectivamente (Fig. 1).
Al analizar la concentración de vitamina D según la comorbilidad (no comorbilidad, vit. D, K-S: 0,075, p = 0,20; sí comorbilidad, vit. D, K-S: 0,118, p = 0,20) no se observaron diferencias estadísticamente significativas (t-test: 1,431, p = 0,155).
Por otra parte, al estudiar la correlación entre la concentración de vitamina D y la concentración de los marcadores óseos (fósforo, K-S: 0,064, p = 0,20; FAO, K-S: 0,072, p = 0,20; PTH, K-S: 0,148, p < 0,001; calcio, K-S: 0,119, p = 0,001; osteocalcina, K-S: 0,142, p < 0,001) no se encontró correlación estadísticamente significativa con ninguno de ellos (vitamina D y fósforo: r = 0,026, p = 0,779; vitamina D y FAO: r = -0,004, p = 0,967; vitamina D y PTHi: rs = -0,173, p = 0,062; vitamina D y calcio: rs = 0,031, p = 0,734; vitamina D y osteocalcina: rs = 0,005, p = 0,961).
Por otra parte, los niños que tenían buen control metabólico (HbA1c < 7,5) presentaban mayor concentración de colesterol HDL y de FAO de forma estadísticamente significativa (p = 0,015 y p = 0,005, respectivamente), al aplicar el test de la t de Student, por tratarse de muestras que siguen una distribución normal. Asimismo, se obtuvieron diferencias estadísticamente significativas al comparar los niveles de triglicéridos, colesterol LDL y osteocalcina (U de Mann Whitney, distribuciones no paramétricas) según el control metabólico. Tanto la concentración de triglicéridos como la de colesterol LDL fueron superiores en los niños con mal control metabólico (p = 0,006 y p = 0,010, respectivamente). Sin embargo, la concentración de osteocalcina fue inferior en los niños que presentaban mal control metabólico (p = 0,044).
DISCUSIÓN
Los resultados del presente estudio muestran que no hay una relación entre la concentración adecuada o inadecuada de vitamina D y el control metabólico de la DM1. La concentración media de vitamina D obtenida en nuestra población está por encima del límite de 20 ng/ml, al igual que lo descrito en otro estudio realizado en una cohorte de 107 niños sanos (20). Sin embargo, el porcentaje de niños con concentraciones de vitamina D por debajo de 20 ng/ml es bastante más bajo que el que presentan otros estudios, también realizados en poblaciones de niños con DM1.
Aunque varios estudios muestran mayor prevalencia de déficit de vitamina D en los niños con DM1, en comparación con los controles sanos (21), nuestros resultados muestran concentraciones plasmáticas de vitamina D muy similares entre los niños con DM1 y los niños sanos, al igual que otros estudios (22-24).
El establecimiento como punto de corte de la concentración de 25(OH)D por debajo de 20 ng/mL para considerar que existe déficit de vitamina D se fundamenta en los estudios de Chapuy y cols. (25), que ya en 1997 observaron un claro aumento de la PTHi en sangre cuando la concentración de vitamina D era < 20 ng/ml y que la densidad mineral ósea no disminuye hasta alcanzar concentraciones de 25(OH)D < 20 ng/mL. No obstante, para maximizar el efecto de la vitamina D en otros tejidos, deberían conseguirse concentraciones por encima de 30 ng/mL, ya que la concentración de 25(OH)D, que precisa la 1-alfa-hidroxilasa para sintetizar 1,25(OH)D, varía según si la acción es endocrina o autocrina/paracrina (26,27). En nuestro estudio el porcentaje encontrado de niños con concentración de vitamina D igual o superior a 30 ng/ml solo fue del 20,16 %, por lo que sigue siendo necesario controlar y mejorar la concentración de vitamina D en estos niños.
Cuando analizamos la concentración de vitamina D según la estación del año en que se realizó la extracción, encontramos concentraciones más elevadas en verano y otoño (tras pasar el verano) y más bajas en invierno y primavera, resultados similares a los obtenidos por Hansen y cols. en una población formada por niños y adultos (28), y por Shen y cols. en un estudio llevado a cabo en población adulta (29).
Es importante destacar que, en condiciones normales, existe una variación importante en los niveles de vitamina D según la estación del año, debido a la diferente exposición solar. Sin embargo, Pozzilli y cols. (30) no encontraron esta variación estacional de la concentración de vitamina D en los niños con DM1.
Por otra parte, mientras que existe evidencia respecto a la asociación entre el déficit de vitamina D y el riesgo de padecer diabetes mellitus, hay mayor controversia en cuanto a la relación entre la concentración de vitamina D y el control metabólico de la enfermedad. En este estudio no hemos encontrado correlación estadísticamente significativas entre la concentración de vitamina D y el porcentaje de HbA1c, al igual que en los estudios de Carakushansky y cols. (24), Mutlu y cols. (31) y Brody y cols. (32), todos ellos realizados en niños diabéticos de tipo 1, lo cual, sin embargo, contrasta con los resultados aportados por otros autores como ALkharashi y cols. (33) y Savastio y cols. (34), los cuales encontraron una asociación inversa estadísticamente significativa.
Existe también bastante controversia en cuanto a la relación existente entre la presencia de dislipemia y los niveles bajos de vitamina D. Así, por ejemplo, en la National Health and Nutrition Examination Survey encontraron, al igual que nosotros, concentraciones de CT más elevadas en los niños que presentaban déficit de vitamina D (35), a diferencia de otros autores (36,37). En nuestro estudio, los niños con déficit de vitamina D también presentaban concentraciones más altas de C-HDL, al igual que en el estudio de Szternel y cols. (38). En la misma línea, Wang y cols. (39), en un metaanálisis acerca del efecto de la suplementación de vitamina D sobre los lípidos, encontraron que se producía una disminución del C-HDL y los TG al suplementar a los niños con vitamina D, aunque las diferencias no llegaron a ser estadísticamente significativas.
Cabe destacar también que en nuestro estudio no se ha encontrado ninguna asociación inversa (p = 0,062) entre la concentración de PTHi y vitamina D, lo cual difiere de la asociación inversa estadísticamente significativa que se encuentra habitualmente en los niños no diabéticos (21). En este sentido, algunos estudios, como el de Schwarz y cols. (40), llevado a cabo en una población adulta, sugieren que en los pacientes diabéticos existe una respuesta entorpecida de PTHi ante valores bajos de vitamina D, debido a la desregulación de la homeostasis del calcio.
Además, los niños incluidos en el presente estudio también presentaron una tendencia a una mayor concentración de fosfatasa alcalina ósea (marcador de formación ósea) cuando la concentración de vitamina D era ≥ 20 ng/ml. Es decir, cuando la concentración de vitamina D es suficiente, existe una mayor formación ósea, lo cual puede apoyar la idea de que una concentración adecuada de vitamina D en estos niños ayudará a prevenir la osteoporosis futura, comorbilidad bien conocida de los pacientes adultos con DM1.
Una de las limitaciones del estudio es el escaso número de niños incluidos en el mismo, aunque es bastante representativo de la totalidad de niños que se controlan en la Unidad de Diabetes Pediátrica de nuestro hospital. Además, el menor déficit de vitamina D encontrado en nuestra población de niños con DM1 en relación con otros estudios podría deberse en parte a que a los niños se les hace mucho hincapié para que mejoren los hábitos de vida saludable, tanto en lo que respecta a la alimentación como en lo referente a la práctica de ejercicio físico al aire libre, lo que puede contribuir a aumentar la concentración de vitamina D en la sangre.
La vida saludable al aire libre y el ejercicio son fundamentales en la consecución de unos niveles adecuados de vitamina D y, en consecuencia, en la obtención de un pico de masa ósea adecuado que permita contrarrestar otros efectos de la propia enfermedad.
CONCLUSIONES Y RECOMENDACIONES
Se trata de un estudio descriptivo transversal de los niveles de vitamina D en pacientes con DM de tipo 1 y de su asociación con el metabolismo óseo y lipídico en el que no hemos encontrado diferencias estadísticamente significativas de control metabólico entre los niños con concentración suficiente e insuficiente de vitamina D.
Los niños con DM1 del presente estudio presentan un buen control metabólico de su diabetes y su concentración de vitamina D es bastante parecida a la encontrada en un estudio similar en niños sanos. Aunque no hemos encontrado relación entre las concentraciones plasmáticas de vitamina D y la mayoría de los marcadores del metabolismo óseo analizados, sí hemos observado una tendencia a una mayor concentración de fosfatasa alcalina ósea (marcador formación ósea) cuando la concentración de vitamina D era ≥ 20 ng/ml, por lo que sigue siendo muy importante controlar y, a ser posible, mejorar la concentración de vitamina D de estos niños para prevenir una osteoporosis futura y garantizar una salud adecuada en todos los aspectos. El perfil óseo y lipídico de estos niños era más favorable cuando presentaban buen control metabólico.
Por otra parte, debido a la capacidad de la vitamina D para modular el sistema inmunológico, varios estudios han demostrado que concentraciones bajas de la misma se asocian de forma estadísticamente significativa a riesgo de contraer infección por coronavirus; a su vez, sabemos que la severidad de los debuts diabéticos de los niños ha aumentado durante la pandemia de COVID, por lo que es de vital importancia el mantenimiento de una concentración adecuada de vitamina D en estos niños, aportando suplementos de la misma si fuera necesario.