INTRODUCCIÓN
En marzo de 2020 el brote de la enfermedad de COVID-19 fue declarado pandemia, al haber causado una elevada mortalidad en el mundo. Hasta la fecha de hoy, se han descrito siete olas que conllevaron el contagio de 12,3 millones de personas en España entre las cuales ha habido 160.000 fallecidos (1). La gravedad de la enfermedad se ha relacionado con la presencia de factores de riesgo como la edad, diabetes, hipertensión, enfermedades cardiovasculares o cáncer (2). Los casos más severos se han caracterizado por la presencia de neumonía, síndrome de dificultad respiratoria del adulto (SDRA), miocarditis, daño renal agudo y sobreinfecciones bacterianas (3). La causa más frecuente de mortalidad de esta enfermedad es la microtrombosis, debida a la llamada “tormenta de citoquinas”, una hiperreactividad del sistema inmune que se produce en respuesta a la infección (3). Desde que se declaró la pandemia hasta la fecha, el número de publicaciones sobre SARS-CoV-2/COVID-19 ha crecido exponencialmente. Sin embargo, algunos aspectos relacionados con la patología y su tratamiento han sido poco estudiados, existiendo un número relativamente limitado de publicaciones.
La evidencia actual indica un papel importante de la vitamina D en la regulación de la respuesta inmune, que ha permitido hipotetizar que su deficiencia puede tener consecuencias en el curso de la enfermedad de COVID-19. La deficiencia de vitamina D también se ha definido por muchos como una “pandemia”, dada su relación con la severidad de diferentes patologías; sin embargo, su importancia clínica no se ha concretado hasta el límite de establecer medidas de salud pública que ayuden a evitar dicha deficiencia.
Según Szeto y cols. (4) existen diversos factores de riesgo que tienen que ver con la incidencia y gravedad de la COVID-19, como la latitud norte, la edad avanzada, las razas no caucásicas y la hipertensión arterial y la diabetes. Estos factores tienen mucha relación con los niveles plasmáticos de la vitamina D, lo que sugiere la relación entre infección por COVID-19 y la deficiencia de esta vitamina. Sin embargo, los resultados de ese trabajo (4), considerado preliminar, no demuestran relación significativa entre los niveles plasmáticos de vitamina D y la severidad de COVID-19 (4).
Liu y cols. (5) reportaron resultados contradictorios respecto a la posible asociación significativa entre el déficit de vitamina D y la severidad de la COVID-19. La existencia de interacción entre déficit de vitamina D con la edad de los pacientes y con la gravedad de la infección por COVID-19, sugiere que la deficiencia de esta vitamina puede tener mayor relevancia en pacientes más jóvenes (6).
Los niveles plasmáticos de vitamina D dependen de la ingesta de dicha vitamina y de la producción endógena tras la exposición solar. Dado los riesgos de la exposición solar, y en particular el daño que pueden causar los rayos uV, se prefiere recurrir a la suplementación de la vitamina D para elevar los niveles plasmáticos como prevención en el desarrollo de enfermedades. A este respecto, existen estudios epidemiológicos que aportan información puntual sobre la posible eficacia de este tratamiento en diferentes patologías (7). Por ello, durante la pandemia de COVID-19, ha ido creciendo el interés sobre la suplementación de vitamina D como parte del tratamiento de la enfermedad (8,9).
un aspecto relevante es que el significado clínico de la deficiencia de vitamina D, así como las causas de esta, están condicionados por la genética de cada individuo, lo que puede provocar que niveles plasmáticos similares de vitamina D tengan acciones y efectos diferentes. Por ello, el estudio de los polimorfismos de un solo nucleótido (SNP) más relevantes de los genes que participan en el metabolismo y en la acción de la vitamina D, parece de gran importancia. Los SNP más estudiados son los del gen del receptor de la vitamina D (VDR, de sus siglas en inglés vitamin D receptor) y del gen GC que codifica la globulina de unión a la vitamina D (DBP, vitamin D binding protein). A este respecto se encuentran numerosos estudios que describen una asociación positiva entre ciertos polimorfismos del VDR y el desarrollo de enfermedades como la enfermedad de Crohn (10), diferentes tipos de cáncer (11) y, enfermedad de Alzheimer (12).
En lo que concierne al VDR, su rol es fundamental para la acción de la vitamina D como regulador de la expresión génica. Por eso, los polimorfismos del VDR pueden afectar a la acción de la vitamina D, modificando tanto la estructura misma del receptor como sus niveles de expresión en las regiones reguladoras. Por otro lado, el gen GC codifica para DBP, que es la principal proteína de transporte para todos los metabolitos de la vitamina D (13). La DBP es altamente polimórfica y sus diferentes variantes tienen un significado clínico (14) y por ello se considerará en esta revisión.
El sistema inmunitario genera citoquinas tanto proinflamatorias como antiinflamatorias en respuesta a infecciones virales y bacterianas, como se observa en pacientes con COVID-19. La aparición y la gravedad de SDRA en pacientes infectados por SARS-CoV-2 es una afección potencialmente mortal y un factor determinante del pronóstico. Los pacientes con SDRA padecen de inflamación pulmonar, secreción mucosal espesa en las vías respiratorias y liberación de grandes cantidades de citoquinas proinflamatorias por células efectoras inmunitarias (15). Este último, es uno de los mecanismos fisiopatológicos principales que contribuyen a la severidad o aumento en la gravedad de la infección por SARS-CoV-2 (16,17) (Fig. 1).

Figura 1. Mecanismos fisiopatológicos por los que aumenta la severidad por SARS-CoV-2. La infección está caracterizada por una “tormenta de citoquinas” debida a una hiperreactividad del sistema inmune. Además, la inflamación altera el sistema renina-angiotensina con la consiguiente disminución de ECA2, que induce daño pulmonar e incrementa la severidad de la infección (CCL o CXCL: ligando de quimiocina; ECA2: enzima convertidora de angiotensina 2; IFN: interferón; IL: interleucina; TNF: factor necrótico tisular) (Figura original diseñada por los autores de la revisión).
El segundo mecanismo fisiopatológico involucrado en el SDRA es la activación del sistema renina-angiotensina por una disminución de la enzima convertidora de angiotensina 2 (ECA2). La inflamación local o sistémica puede activar el sistema renina-angiotensina de manera negativa, alterando la producción endógena de enzimas transformadoras de angiotensina II, ECA/ECA2 (18). La disminución de la disponibilidad de ECA2 durante SARS-CoV-2 induce daños pulmonares y la infección se vuelve más letal, conduciendo a acumulación excesiva de neutrófilos, una mayor permeabilidad vascular y edema pulmonar (19).
La activación de la respuesta inmune frente a la infección de SARS-CoV-2 está en parte relacionada a la activación del VDR, que a su vez se encuentra en gran medida en las células inmunitarias que se localizan en el tracto respiratorio (linfocitos T, linfocitos B, macrófagos, monocitos, células dendríticas y células epiteliales). En diferentes estudios se ha estudiado el rol de la expresión génica inducida por el VDR y la vitamina D en la disminución de algunas complicaciones respiratorias como la lesión pulmonar aguda y el SDRA (20,21).
Aunque existen muchos factores que regulan o disparan la producción de citocinas por las células inmunitarias (p. ej., activación de los receptores de tipo Toll, que detectan la presencia de bacterias, virus y hongos, y desencadenan vías de señalización que estimulan la producción de diferentes mediadores (22); la presencia de obesidad central (23); cambios en la permeabilidad intestinal (24,25), se ha señalado recientemente como función no clásica de la vitamina D u hormona D su papel sobre el sistema inmune y la respuesta inflamatoria (26-28). El 25(OH)D (calcidiol), es la principal forma circulante de vitamina D y debe transformarse en su forma activa 1,25(OH)2D3 (calcitriol) en el epitelio bronquial y en las células inmunitarias, con la ayuda de la enzima D-1α-hidroxilasa (CYP27B1), que a su vez es activada por citoquinas y ligandos de receptores tipo Toll (29). La hormona D sintetizada en los macrófagos se une al VDR que a su vez forma el heterodímero VDR-RXR (VDR, receptor de la vitamina D; RXR, receptor X retinoide). Este se une a los elementos de respuesta a vitamina D (VDRE) ubicados en la región promotora del gen y promueve la síntesis de péptidos antivirales en el epitelio respiratorio como las β2-defensinas y la catelicidina, reforzando la capacidad de defensa a nivel de la mucosa (30). Con respecto al sistema renina-angiotensina implicado en la ARDS, la 1,25(OH)2D/VDR es un regulador negativo importante. Inhibe la producción de ECA e induce la actividad de ECA2 con efecto protector sobre los pulmones debido a la mayor degradación de la angiotensina II (21) (Fig. 2). A través de estos mecanismos la vitamina D reduce la producción de citoquinas proinflamatorias y contrarresta la hiperactivación del sistema inmunitario adaptativo posterior a la infección viral (19).

Figura 2. Efecto protector de la vitamina D debido a la activación del VDR y a la expresión de proteínas antinflamatorias. La vitamina D (25(OH)D) circula unida a una globulina (DBP). La vitamina D se libera en el citoplasma y transforma en 1,25-(OH)2D3 por acción del citocromo CYP27B1. La presencia de 1,25-(OH)2D3 permite la activación del VDR, formación del heterodímero VDR-RXR, unión del 1,25-(OH)2D3 al heterodímero VDR-RXR y translocación al núcleo para unirse al elemento de respuesta VDRE. Esto resulta en la expresión de citoquinas antinflamatorias, disminución de la síntesis de citoquinas proinflamatorias, aumento de la expresión de ECA2 e inhibición simultánea de ECA. Por consiguiente, el estado inflamatorio mejora teniendo lugar un efecto protector contra el empeoramiento de la enfermedad (VDR: receptor de la vitamina D; RXR: receptor X retinoide; VDRE: elemento de respuesta a la vitamina D; ECA: enzima convertidora de la angiotensina; ECA2: enzima convertidora de la angiotensina 2; 25(OH)D: calcidiol; CYP27B1: citocromo responsable de la conversión de 25(OH)D a 1,25(OH)2D3; 1,25(OH)2D3: calcitriol. DBP: glicoproteína de unión a la vitamina D) (Figura original diseñada por los autores de la revisión).
Por tanto, dado que se ha encontrado niveles deficitarios de vitamina D en pacientes afectados de SARS-CoV-2, se especula que una deficiencia de vitamina D podría agravar las complicaciones por SARS-CoV-2 (4,5,19,20,27,31).
OBJETIVO E HIPÓTESIS
El objetivo de esta revisión es conocer la evidencia científica de algunos factores genéticos que pueden determinar la actividad de la vitamina D y determinar si los polimorfismos de los genes VDR y GC están relacionados con las formas más graves de la patología. La hipótesis de esta revisión es que tales polimorfismos se asocian con la severidad de la enfermedad de COVID-19, y que, por ello, su estudio es fundamental para el tratamiento personalizado de los pacientes. En consecuencia, la revisión se realizará considerando la posible relación entre los polimorfismos de los genes VDR y GC y la severidad de la infección por SARS-CoV-2.
MÉTODOS
Se realizó una búsqueda bibliográfica en el periodo marzo a agosto de 2022 en las bases de datos PubMed, Google Scholar y Scielo. Se incluyeron ensayos controlados aleatorizados y estudios observacionales (cohortes y casos-controles) tanto en inglés como en español, que cumplieron con los siguientes criterios: pacientes diagnosticados con COVID-19 por pruebas de PCR o antígeno e inclusión de valores de vitamina D sérica previo y posterior al tratamiento eventual. En la selección de artículos no se tuvo en cuenta el género, edad, etnia, nacionalidad, ni la gravedad de la enfermedad. Se excluyeron los estudios donde se analizaron los efectos de otros tipos de coronavirus como SARS y MERS.
En la figura 3 se detallan los motivos de búsqueda, inclusión y exclusión de estudios. Se seleccionaron las siguientes palabras claves: “vitamin D” AND “COVID 19” AND “polymorphism”, “VDR” AND “COVID 19” AND “polymorphism” y “DBP” AND “COVID 19” AND “polymorphism”.
RESULTADOS
IMPLICACIÓN DE LOS POLIMORFISMOS DE LOS GENES VDR Y GC EN LAS INFECCIONES VIRALES
Los diferentes polimorfismos de los genes VDR y GC que codifican para estas proteínas (Fig. 4) pueden modificar la eficiencia de la señalización de la vitamina D, determinando respuestas diferentes frente a niveles similares plasmáticos de dicha vitamina. Como hemos comentado, la vitamina D participa en los mecanismos de inmunidad induciendo la expresión de genes “diana” a través de la activación del VDR. La diferente respuesta a los niveles de vitamina D depende, entre otros mecanismos, del propio VDR, y de los polimorfismos del gen VDR.

Figura 4. A. Polimorfismos del gen VDR en el brazo largo del cromosoma 12, 12q14, relacionados con la severidad de la enfermedad COVID-19 (Cdx: alelo de riesgo “A”; A1012F/GATA: alelo de riesgo “C”; rs11574018: alelo de riesgo “T”; rs11574024: alelo de riesgo “G”; FokI: alelo de riesgo “T”; BmsI: alelo de riesgo “G”; ApaI: alelo de riesgo “C” (47) y “A” (48); TaqI: alelo de riesgo “A”). B. Polimorfismos del gen GC localizado en el brazo largo del cromosoma 4 4q12-13 relacionados con la severidad de la enfermedad COVID-19 (rs7041: alelo de riesgo “T”; rs4588: alelo de riesgo “G”) (Figura original diseñada por los autores de la revisión).
La mayoría de los estudios sobre las variantes de VDR se han centrado en la asociación entre polimorfismos y la severidad de diferentes enfermedades.
En lo que concierne a las infecciones virales, se han descrito asociaciones con la severidad de las enfermedades con seis polimorfismos comunes (32).
El gen VDR se sitúa en el brazo largo del cromosoma 12, en la posición 12q12-q14. En la región 3'uTR se han identificado los polimorfismos rs1544410 (Bms I) (33), rs7975232 (Apa I) (34) y rs731236 (Taq I) (33). Ninguno de estos polimorfismos afecta a la estructura del receptor, pero influencian la estabilidad del mRNA producido (35,36). Por ejemplo, el polimorfismo rs7975232 (Apa I) afecta la traducción del mRNA de VDR a través de modificaciones en los sitios de “splicing” (37).
En la región 5'uTR se encuentran dos polimorfismos: a) en posición rs11568820 el Cdx; y b) en posición rs4516035, el A1012G. El polimorfismo Cdx se localiza en el promotor del gen VDR en el lugar de unión del factor de transcripción Cdx-2. Se asocia a la alteración del control mediado por la vitamina D en linfocitos T (38) y se encuentra relacionado con los niveles de metilación del gen VDR (39). El polimorfismo A1012G se localiza en una modificación del factor de transcripción GATA-3 implicado en la polarización de linfocitos T hacia Th2 (40) y los diferentes alelos se han relacionado con una mayor susceptibilidad a HIV (41).
Otro polimorfismo, el rs2228570 asociado a FokI, se ha encontrado en el exón II y afecta a la estructura del receptor, determinando que el genotipo FF, respecto al genotipo ff, codifique una proteína VDR a la que le faltan tres aminoácidos (42). Se ha encontrado una relación positiva significativa entre el polimorfismo ff y un mayor riesgo de padecer infecciones respiratorias del tracto inferior en niños pequeños (43). Esta asociación puede ser explicada por una modificación en la interacción TFIIB-VDR (factor de transcripción II B-receptor de la vitamina D) con la consiguiente alteración en la eficacia de transcripción en las células inmunes (44).
En lo que concierne a la DBP, una globulina Gc responsable del transporte de la vitamina D en el plasma y codificada por el gen GC, se han estudiado diferentes polimorfismos que pueden tener relevancia a nivel clínico. El gen GC se ubica en el brazo largo del cromosoma 4, en la posición 4q12-q13. Se han encontrado más de 120 polimorfismos, pero los más frecuentes son rs7041 y rs4588. Estos polimorfismos determinan las tres principales variantes del gen GC: Gc1F, Gc1S (indicados en otros trabajos como DBP1F [rs7041-T (ASP), rs4588-C (Thr)] y DBP1S [rs7041-G (ASP), rs4588-C (Thr)]) y Gc2 (indicada en otros trabajos como DBP2 [rs7041-T (ASP), rs4588-A (Lys)]) (13). La afinidad por la vitamina D es cuatro veces mayor en el polimorfismo Gc1F que en Gc2 y dos veces más alta que en Gc1S (45), lo que determina diferentes niveles de vitamina D en plasma dependiendo del alelo. Leuridsen y cols. encontraron niveles plasmáticos más elevados de vitamina D en portadores del genotipo Gc1-1, intermedios en Gc1-2 y más bajos en Gc2-2 (46).
RELACIÓN DE LOS POLIMORFISMOS DE LOS GENES VDR Y GC CON LA SEVERIDAD DE LA INFECCIÓN POR SARS-COV-2
Teniendo en cuenta las relaciones comentadas en el epígrafe anterior, y la sintomatología de los pacientes infectados por SARS-CoV-2, en los últimos años se ha estudiado la posible relación de estos polimorfismos y la severidad de la enfermedad de COVID-19. Las tablas I y II resumen los resultados más relevantes de los estudios donde se sugiere relación entre los polimorfismos en los genes VDR y GC y la severidad de la enfermedad.
Tabla I. Estudios en que se evalúa la presencia de polimorfismos de del gen que codifica la proteína del receptor de la vitamina D (VDR) en pacientes con diagnóstico positivo a SARS-CoV-2 y la relación con la severidad de la enfermedad.
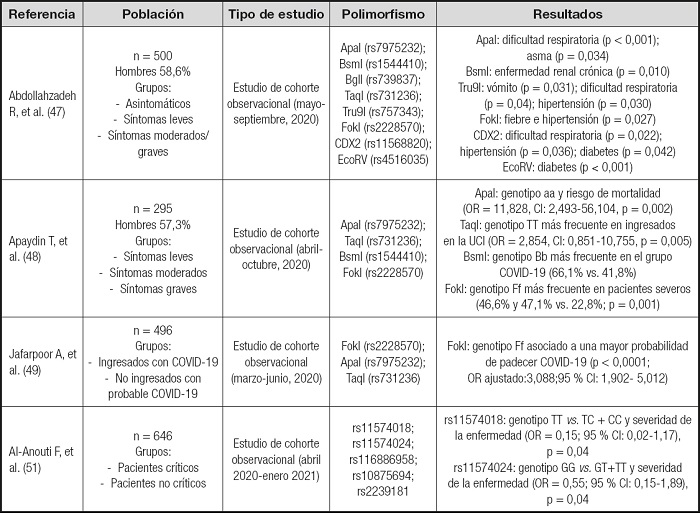
OR: odds ratio; CI: intervalo de confianza; p: probabilidad, siendo significativo para p < 0,05.
Tabla II. Estudios en que se evalúa la presencia de polimorfismos del gen GC que codifica la proteína de unión a la vitamina D (DBP) en pacientes con diagnóstico positivo a SARS-CoV-2 y la relación con la severidad de la enfermedad.
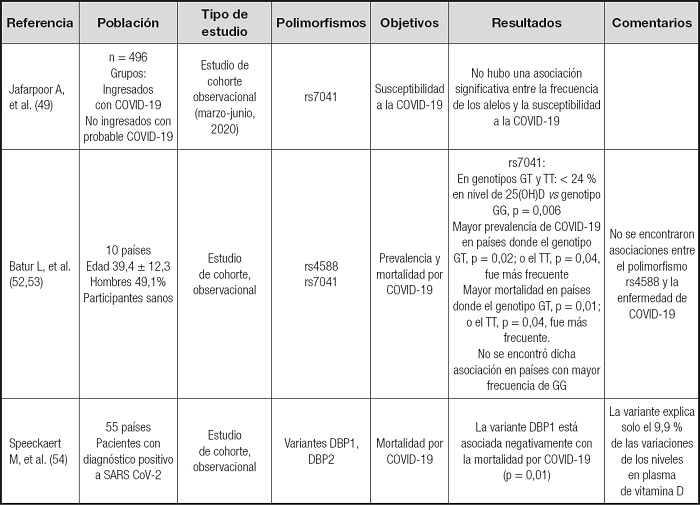
*Variante DBP1 (DBP1F + DBP1S): DBP1F [rs7041-T (ASP), rs4588-C (Thr)], DBP1S [rs7041-G (ASP), rs4588-C (Thr)]); variante DBP2 [rs7041-T (ASP), rs4588-A (Lys)]); p = probabilidad, siendo significativo para p < 0,05.
Abdollahzadeh y cols. (47), en una investigación realizada en una muestra de 500 iraníes con diagnóstico positivo de COVID-19 confirmado a través de RT-PCR, estudiaron diferentes polimorfismos de VDR. La muestra se dividió en tres grupos: asintomáticos, con síntomas leves y con síntomas graves. Para algunos polimorfismos (ApaI, BsmI, Tru9I, FokI, CDX2, EcoRV) (Tabla I y Fig. 4), estos autores encontraron una asociación significativa entre la prevalencia de un alelo y la pertenencia al grupo de asintomáticos o de síntomas leves o graves (47). En otro estudio, Apaydin y cols. (48) clasificaron a 295 pacientes, con diagnóstico positivo de COVID-19 confirmado a través de RT-PCR e ingresados en el hospital, en dos grupos, uno que presentaban síntomas leves y otro con síntomas más severos. Como grupo control se consideraron los datos de individuos registrados en el banco de datos del mismo hospital. Recientemente Jafarpoor y cols. (49) estudiaron una muestra de 188 pacientes hospitalizados con diagnóstico positivo de COVID-19 y un grupo control de 218 individuos no hospitalizados con síntomas que indicaban una probabilidad de padecer de la COVID-19.
El objetivo del estudio fue encontrar una relación entre los polimorfismos estudiados (FokI, ApaI, TaqI) y la susceptibilidad a la enfermedad.
Abdollahzadeh y cols. (47) encontraron una frecuencia más alta del alelo “f” que del alelo “F en la variante rs2228570 (FokI; alelo menor “f”, alelo mayor “F”) en individuos sintomáticos respecto a los asintomáticos, lo que sugiere una posible relación entre ser portador del alelo “f” y los síntomas de COVID-19. La vulnerabilidad (p. ej. fiebre, hipertensión) en individuos “FF” fue menor que en los portadores del alelo “f”. No obstante, no se observaron diferencias entre los genotipos “FF” y “Ff”. Apaydin y cols. (48) describieron que el genotipo “FF” fue más prevalente en los pacientes con síntomas leves, mientras que el genotipo “Ff” lo fue en el grupo con síntomas severos. También, según Jafarpoor y cols. (49) el genotipo “Ff” de la variante rs2228570 se encuentra significativamente asociado a la severidad de la enfermedad (Tabla I). De forma similar a otros estudios donde se encontró asociación entre el polimorfismo rs11568820 (Cdx-2; alelo menor “c”, alelo mayor “C”) y enfermedades como tuberculosis y rubeola (39,50). Abdollahzadeh y cosl. (47) encontraron una frecuencia significativamente más alta del alelo “c” en individuos sintomáticos respecto a los asintomáticos. Además, señalaron un efecto protector frente a muchos síntomas y comorbilidades del genotipo “CC” frente a los portadores “c” (“Cc” + ”cc”).
Por lo que concierne al polimorfismo rs4516035 (EcoRV-A1012G; alelo menor “e”, alelo mayor “E”), Abdollahzadeh y cols. (47) señalaron que el alelo menor “e” fue más prevalente en pacientes sintomáticos respecto al alelo mayor “E”. Inesperadamente, no se encontraron diferencias en las frecuencias de los genotipos “ee” y “EE” entre los pacientes con o sin síntomas, y, además, los individuos “Ee” fueron los que mostraron mayor severidad de COVID-19. Además, el alelo “e” respecto al alelo “E” fue más frecuente en pacientes que padecían de algún tipo de diabetes. Cuando se relacionó el polimorfismo rs7975232 (ApaI; alelo menor “a”, alelo mayor “A”) con la gravedad de la patología se encontraron resultados contradictorios. Así el genotipo “AA” hace más probable la aparición de síntomas respecto a los genotipos “Aa + aa” y “Aa”. Sin embargo, se observó un efecto protector del genotipo “Aa” respecto a “AA + aa”. Por otro lado, según Apaydin y cols. (48) el genotipo AA es más común en el grupo de control, respecto a los pacientes COVID-19, mientras que el genotipo “aa” fue más común en los pacientes fallecidos, respecto a los no fallecidos por la enfermedad. Jafarpoor y cols. (49) no encontraron relación significativa entre la frecuencia de los alelos de ApaI y TaqI y la susceptibilidad a la enfermedad. Abdollahzadeh y cols. (47) no encontraron asociaciones significativas entre las frecuencias de los diferentes alelos de los polimorfismos BsmI, Tru9I, TaqI y BglI y la severidad de la enfermedad por COVID-19. Sin embargo, en otros trabajos se indica que el alelo mayor de TaqI, “T”, está relacionado con niveles más bajos de vitamina D3 en el plasma (36). Además, Apaydin y cols. (48) señalan una frecuencia mayor del genotipo “TT” en pacientes ingresados en la uCI, respecto a lo no ingresados. Además, el grupo de pacientes infectados por COVID-19 presentó una frecuencia mayor del genotipo “Tt” de TaqI, respecto al grupo control, donde prevalece el genotipo “tt”. En el mismo estudio se encuentra una relación también para el polimorfismo BsmI, siendo más frecuente el genotipo “bb” en el grupo control, y “Bb” en el grupo COVID-19. Esta misma relación no fue reportada en el estudio de Apaydin y cosl. (48), aunque Abdollahzadeh y cols. (47) no hallaron asociaciones entre estos polimorfismos y la severidad de la enfermedad, pero en el mismo estudio se destaca que algunos alelos están relacionados con la presencia o ausencia de algunos síntomas, como la dificultad de respirar en los portadores “a” vs. “A” del polimorfismo Apal. Según Apaydin y cols. (48) el genotipo “aa” se ha asociado con una mayor probabilidad de mortalidad.
Por su parte, Al-Anouti y cols. (51) estudiaron otros SNP menos conocidos del gen VDR. Los 646 participantes con diagnóstico positivo por SARS-CoV-2, a través de RT-PCR, fueron clasificados en dos grupos: pacientes críticos y no críticos. Los polimorfismos estudiados fueron rs11574018, rs11574024, rs116886958, rs10875694, rs2239181. Se encontraron diferencias significativas entre ambos grupos de pacientes para los polimorfismos rs11574018 y rs11574024.
Respecto a los polimorfismos del gen GC, codificante de la DBP, se han estudiado principalmente los polimorfismos rs7041 y rs 4588. Hasta la fecha existe poca evidencia sobre la relación de estos polimorfismos y la severidad de la enfermedad por el SARS-CoV-2. Batur y cols. (52) en 51 individuos con diagnóstico positivo a SARS-CoV-2 observaron un menor nivel de la vitamina (como 25(OH)D) en portadores GT y TT del polimorfismo rs7041 respecto a los GG, pero no encontraron diferencias significativas para los niveles de DBP entre los tres grupos. Posteriormente el mismo grupo, analizó las frecuencias genotípicas para los mismos polimorfismos en pacientes de 10 países y su relación con la mortalidad por COVID-19 (53). Para el polimorfismo rs7041 se encontraron diferencias significativas en la tasa de mortalidad frente a la enfermedad entre los países donde el genotipo TT fue más prevalente respecto a aquellos donde lo era el genotipo GT. Destaca la relación positiva y significativa entre la prevalencia de COVID-19, tasa de mortalidad y el genotipo GT, mientras que se observó una relación negativa y significativa entre estos parámetros y el genotipo TT, lo que sugiriere que ser homocigoto TT puede proteger frente a la mortalidad por COVID-19. Por lo que concierne al polimorfismo rs4588 no se han encontrado asociaciones significativas entre el polimorfismo y la prevalencia de COVID-19 o la tasa de mortalidad. Speeckaert y cols. (54) analizaron la tasa de positividad a SARS-CoV-2 en 55 países y la relación entre la prevalencia de las variantes del gen GC en los mismos. Se reveló una asociación negativa entre la prevalencia de la variante DBP1 (DBP1F [rs7041-T, rs4588-C], DBP1S [rs7041-G, rs4588-C) y la mortalidad de COVID-19.
DISCUSIÓN
Además de sus funciones clásicas relacionadas con la absorción de calcio y el fisiologismo óseo, la vitamina D u hormona D presenta otras muchas funciones entre las que destacan modificación de actividades en las células y tejidos involucrados en la progresión y/o gravedad de COVID-19, específicamente con mejora del síndrome de dificultad respiratoria aguda (SDRA) a través de la mejora de la inmunidad innata y adaptativa. Los síntomas más comunes en la infección por SARS-CoV-2 son fiebre (80,4 %), fatiga (46 %) y tos (63,1 %). Otros síntomas comunes son dolor muscular, opresión en el pecho y disnea (55). La severidad de la infección dependerá en la respuesta inmunitaria individual, donde las comorbilidades presentes jugarán un papel significativo. A este respecto, la respuesta individual a aportes muy similares de vitamina D es diferente en unos individuos de otros, lo que sugiere un papel relevante de la dotación genética de cada individuo y en particular de la existencia de polimorfismos en algunos genes candidatos, en particular aquellos de la VDR y DBP, que pueden hacer ineficaz o modificar significativamente el transporte y captación por las células y tejidos de dicha vitamina liposoluble.
En esta revisión se resume la implicación de los diferentes polimorfismos para VDR y DBP en el transcurso y evolución de la enfermedad de COVID-19. Además, se destaca el rol de la vitamina D y la importancia de evaluar los niveles plasmáticos para ayudar a prevenir las formas más severas de la enfermedad. En la actualidad se dispone de una gran cantidad de publicaciones que apoyan la correlación entre la gravedad y la tasa de muerte de las infecciones por SARS-CoV-2 y el nivel sanguíneo de 25(OH)D (5,6). Sin embargo, existen discrepancias en los resultados que conducen a un debate abierto sobre si esta relación es causal, debido a que la mayoría de los estudios determinaron los niveles de esta vitamina después del inicio de la infección. Los estudios están caracterizados por poblaciones de diferentes edades, donde a menudo el único criterio de inclusión es el diagnóstico positivo a SARS-CoV-2, lo que justifica la disparidad de resultados entre estudios en cuanto a la posible relación entre la deficiencia de vitamina D y la enfermedad de COVID-19. Tampoco los estudios señalan si la respuesta diferente a los niveles plasmáticos de vitamina D es modificada (potenciada o disminuida) dependiendo de la interacción entre alelos de riesgo de los genes VDR y DBP y la presencia de comorbilidades (p. ej. diabetes, obesidad).
Debe destacarse la importancia de conseguir un nivel plasmático óptimo de vitamina D a largo plazo, dado que la recuperación de la deficiencia vitamínica cuando los síntomas ya se manifiestan pueda que no sea suficiente para tener un efecto clínicamente relevante. Aunque los estudios sobre SARS-CoV-2 son todavía escasos, los conocimientos adquiridos sugieren la posible relación entre genes candidatos, sus polimorfismos y la severidad de la enfermedad de COVID-19. En particular, los genes VDR y GC presentan diferentes polimorfismos que se han relacionado con la severidad de la enfermedad de COVID-19 (47,48,51,53,54).
Deben resaltarse la interacción de la vitamina D con los polimorfismos ApaI (aa vs. AA) y TaqI (tt vs. TT), que atendiendo al Odd ratio encontrado por Apaydin y cols. (48) (OR = 11,828, p = 0,002 y OR = 2,854, p = 0,005 respectivamente) parecen los más discriminativos y por tanto los que se deberían determinar preferentemente en el contexto de la pandemia COVID-19. Por otro lado, son necesarios estudios futuros que consideren un mayor número de participantes para poder estudiar de manera significativa el papel de otros alelos minoritarios o aparentemente no relacionados. El estudio de estos polimorfismos y las evidencias encontradas sugieren la necesidad de incluir el estudio de genes candidatos especialmente en la prevención de la enfermedad COVID-19.
El estudio detallado de los polimorfismos considerados en esta revisión ayudaría a entender las razones de estados carenciales eventuales de vitamina D, lo que sugiere evaluar de forma individualizada a los pacientes con el objetivo de pautar dietas personalizadas o prescribir suplementos de vitamina D o en caso de que fuera necesario tratamiento farmacológico para así poder alcanzar un nivel óptimo (56).
Por otro lado, debe señalarse que la suplementación a dosis altas de vitamina D puede conllevar efectos secundarios negativos a la salud como la hipercalcemia, hiperfosfatemia, entre otros, los cuales pueden ser contraproducentes en la respuesta a la enfermedad (57). Por lo tanto, la suplementación de vitamina D en pacientes que cursen con la enfermedad por COVID-19 debe realizarse con precaución, y estudiando los efectos de forma individual en cada paciente, ya que la respuesta a la suplementación de 25(OH) D va a depender de las variedades polimórficas de genes implicados en la síntesis, transporte y degradación de la 25(OH) D. Por ejemplo, los polimorfismos de rs4588 y rs7041 del gen DBP se relacionan con variaciones en la respuesta a la suplementación con vitamina D, siendo esta respuesta menor dependiendo del alelo (58), pero no existe evidencia en los pacientes afectados con COVID-19. También, en cuanto al polimorfismo Bsml en el gen VDR, se ha observado que las personas con el genotipo BB/Bb responden mejor que aquellos con genotipo bb a una dosis elevada de vitamina D (59).
Por ello, se debería de evaluar cuidadosamente la necesidad de la suplementación de vitamina D dependiendo de los polimorfismos de los genes VDR y GC. A este respecto, hay que señalar que la fuente nutricional más importante de vitamina D son los pescados grasos los cuales, a su vez, aportan cantidades relevantes de ácidos grasos polinsaturados omega-3 de reconocido papel en la inflamación y en la resolución de la inflamación a través de la producción de resolvinas, protectinas y maresinas (60). No debe olvidarse el papel importante de los AGP omega 3 (ácidos grasos polinsaturados) en la diabetes, dislipemia y obesidad, factores que se han relacionado a su vez como factores predisponentes de las formas más graves de la enfermedad de COVID-19 (61).
También es necesario destacar la necesidad de estudios doble ciego aleatorizado para determinar si esta relación entre la vitamina D y el COVID-19 es de causalidad o casualidad, dado que tanto los niveles plasmáticos de vitamina D como su acción están relacionados con otros numerosos factores ambientales y genéticos. Por ello, la evidencia científica actual no parece suficiente para determinar con certeza si los niveles plasmáticos de vitamina D juegan un papel clave y clínicamente importante en el desarrollo de complicaciones de la enfermedad de la COVID-19 y si los polimorfismos de los genes VDR y GC están claramente implicados.
PAUTAS FUTURAS
Es evidente la necesidad de estudios con un número mayor de participantes y un diseño que tenga en cuenta las variables que puedan influenciar la severidad de esta enfermedad, incluyendo los polimorfismos comentados. De la misma manera, se deberán considerar estudio de asociación de genoma completo (GWAS, whole genoma association study) para buscar nuevos polimorfismos de los genes que estén relacionados con el metabolismo de la vitamina D en particular, así como generar de puntaciones genéticas de riesgo (GRS, genetic risk score) tanto ponderadas como no ponderadas, que se basen en la confluencia de alelos de riesgo para los genes implicados de mayor penetrancia (62) y en sus efectos sobre los niveles circulantes de vitamina D. Además, será necesario profundizar la influencia del epigenoma sobre la concentración y acciones de la vitamina D, incluyendo los diferentes niveles de silenciamiento de genes, mediante metilaciones y/o desacetilaciones (63). En términos de regulación de la expresión génica se deberán también estudiar los polimorfismos que afectan a la acción de los microRNA, fundamentales a la hora de favorecer o inhibir la traducción de los mRNA (64). Asimismo, la inclusión de análisis del metagenoma (conjunto de genes microbianos presentes en un entorno o ecosistema determinado; p. ej. intestinal, oral y de otras localizaciones) (65) puede aportar información útil a la hora de evaluar las diferencias en pacientes sanos o enfermos, dada su importancia en la modulación del sistema inmune.
En lo que concierne a los factores predisponentes no deben olvidarse las diferencias claras en la morbimortalidad por COVID-19 entre ambos géneros, siendo mayor en los varones (61), por lo que será esencial conocer la influencia de la interacción del género con los polimorfismos ya citados sobre los niveles de vitamina D y la gravedad de la patología inducida por SARS-CoV-2. Por último, señalar que la inmunidad adquirida por la vacunación o por una infección anterior puede ya no ser eficaz frente a las mutaciones futuras del virus SARS-CoV-2 (1) lo que justifica que al menos desde un punto de vista preventivo, toda la población debería elevar sus niveles séricos de 25-OH vitamina D mediante ingesta y suplementación a un nivel óptimo. Dado que no se han encontrado publicaciones que relacionen la efectividad de la vacunación en individuos con diferentes niveles de vitamina D en plasma y polimorfismos de genes tanto del receptor como del transportador de vitamina D, sería importante considerar la necesidad de plantear estudios futuros donde se evalúen estos aspectos.















