INTRODUCCIÓN
El fallo intestinal en un paciente con Intestino corto secundario a resección quirúrgica y con una o varias fístulas entero-cutáneas es una condición médica de manejo complejo cuya atención requiere un equipo multidisciplinario debido a todos los retos médicos y metabólicos que la situación presenta (1,2).
El objetivo final en este contexto clínico es la reconstrucción del tracto intestinal pero, debido al escenario que acompaña a este tipo de pacientes, la espera para una reconexión intestinal segura puede llevar aproximadamente 6 meses o más, período durante el cual el paciente requerirá apoyo nutricional y metabólico (2). De forma inicial esto se consigue a través de la nutrición parenteral total, pero también, al existir la oportunidad de lograr colocar una sonda para el acceso enteral (lo que se conoce como fistuloclisis), esta puede utilizarse para proporcionar un soporte nutricional mixto y obtener mayores beneficios en el período de espera quirúrgica. Al utilizar la vía enteral, la cual es más fisiológica, hay estimulo de la perfusión del lecho esplácnico, se favorece la integridad estructural y funcional de la mucosa del tracto gastrointestinal, se previene la adhesión bacteriana a las células epiteliales intestinales y se aporta una mayor estimulación del sistema GALT (Gut Associated Lymphoid Tissue), generando una mayor producción de IgA y una menor respuesta inflamatoria local; estos factores potencian el trofismo de la mucosa local y, a largo plazo, brindarán mejores resultados en la cirugía definitiva para la reconstrucción del tránsito intestinal. Así mismo, diversos estudios han demostrado que, gracias a estos beneficios, se reduce la tasa de infección intrahospitalaria en los pacientes críticos, además de lograrse también una ventaja sobre la nutrición parenteral en términos de costo-beneficio (3-5).
En México, el Instituto Nacional de Ciencias Médicas y Nutrición Salvador Zubirán es uno de los principales centros de atención del Sistema de Salud. Dada la complejidad de los cuadros clínicos de los pacientes ingresados, no es infrecuente encontrar casos en donde se puedan utilizar los beneficios de la fistuloclisis. En el presente artículo presentamos brevemente dos casos clínicos, atendidos en el período 2020-2021, en los que la fistuloclisis pudo utilizarse de forma exitosa.
CASO CLÍNICO 1
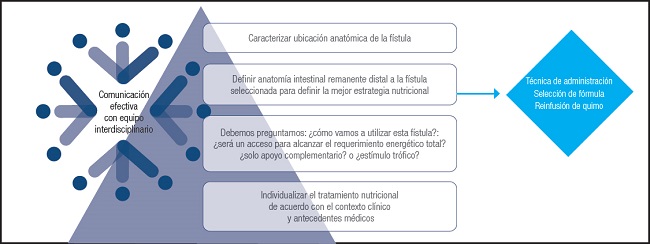
Un hombre de 58 años ingresó a nuestro instituto con puntaje NRS-2002 de 5, peso de 45 kg, IMC de 15,6 kg/m2, dinamometría basal de 6 kg y diagnóstico de síndrome de Lynch desde hace doce años. Requirió hemicolectomía derecha y anastomosis ileotransversa, además de quimioterapia. Hace dos años presenta un cuadro de oclusión intestinal por recidiva oncológica que ameritó varios procedimientos quirúrgicos junto con diversas resecciones de intestino delgado. Desarrolló sepsis abdominal, que fue manejada con técnica de abdomen abierto y cierre en segunda intención; la anatomía gastrointestinal al final de la resolución de la sepsis fue de exclusión duodenal con gastrostomía descompresiva, fistulas entero-atmosféricas en yeyuno proximal y una anastomosis ileotransversa, además de terapia VAC para el manejo de la herida abierta. Se localiza una fístula que tiene continuidad con el trayecto intestinal distal (libre de fístulas) y se procede a colocar una sonda de alimentación de calibre 12 French (Fig. 1).
Figura 1. Paciente con síndrome de Lynch. Colocación de sonda de alimentación con calibre 12 French.
INTERVENCIÓN NUTRICIA
Se realizó una calorimetría indirecta que reportó un gasto energético basal de 2500 kcal. Inicialmente se manejó con apoyo parenteral y luego, al efectuarse la fistuloclisis, se inicia un apoyo enteral con fórmula elemental, alcanzando velocidades máximas de infusión de hasta 125 ml/hora a través de la fistuloclisis. Sin embargo, dadas las características anatómicas remanentes (intestino corto) y al ver que no se consiguen las metas de ganancia ponderal exclusivamente con la fistuloclisis, se decide un apoyo parenteral complementario. Durante la hospitalización se manejó con nutrición parenteral total con aporte inicial de 2200 kcal totales (1,6 g/kg de proteína según el peso al ingreso); se reanuda la alimentación enteral alcanzando las velocidades previamente mencionadas; una vez se obtuvo este aporte energético total, se realizó una nueva calorimetría de seguimiento, encontrando un RQ de 1,2, ajustándose así los aportes energéticos.
Los aportes calóricos se mantuvieron durante ocho meses de la siguiente forma: NPT: 1410 kcal (40 gramos de AA) más 2200 kcal de NET a través de la fistuloclisis (202,3 gramos de proteína), con lo que se obtuvieron un balance nitrogenado positivo de 4 y una recuperación ponderal hasta de 61 kg, con dinamometría final de 21 kg. Un año después de su última intervención pasa a quirófano para restablecer el tránsito intestinal, donde se realizó una resección del trayecto intestinal fistulizado (yeyuno) junto con una anastomosis yeyuno-yeyunal. Cursa con un postoperatorio satisfactorio.
CASO CLÍNICO 2
Una mujer de 27 años fue trasladada a nuestro centro hospitalario y a su ingreso presentó NRS-2002 de 5 puntos, peso de 35 kg, IMC de 12 kg/m2 y dinamometría basal de 3 kg. Tenía antecedentes médicos previos de enfermedad de von Willebrand, dislipidemia en estudio y perforación intestinal, por lo que fue intervenida en dos ocasiones en otro centro hospitalario; el informe quirúrgico reportaba resección intestinal a nivel yeyunal de 10 cm más yeyunostomía en asa a un metro del ángulo de Treitz (Fig. 2).
Figura 2. Paciente con enfermedad de von Willebrand y resección intestinal a nivel yeyunal más yeyunostomía.
INTERVENCIÓN NUTRICIA
Ingresa con muy alto riesgo de desarrollar síndrome de realimentación; se prescribe un protocolo de administración de tiamina. Se inicia la nutrición parenteral a razón de 10 kcal/kg de peso actual; 2 semanas después de su inicio y con un aporte de 1200 kcal, se evidencian en los exámenes de laboratorio un patrón colestásico e hipertrigliceridemia (800 mg/dL). Realizamos una calorimetría indirecta, reportando un RQ de 0,7 y un GEB de 1900 kcal; descartados los datos de sobrealimentación, continuamos con la progresión del aporte energético y realizamos el cambio de la emulsión lipídica, que en principio estuvo basada en aceite de oliva, para prescribir una emulsión lípidica basada en aceite de soya, oliva, omega-3 y MCT. Después de esta estrategia mejora el patrón colestásico pero persiste la hipertrigliceridemia (668 mg/dL), por lo que se decide agregar 1 g de L-carnitina a la nutrición parenteral. Se instala una sonda de calibre 12 French en el estoma distal e iniciamos el estímulo enteral con una fórmula polimérica estándar. Durante el aumento de la velocidad de infusión de la fórmula, la paciente presenta dolor abdominal y distensión. Se realiza un abordaje clínico con tomografía contrastada de abdomen/pelvis que muestra en el anexo derecho una imagen hipodensa en rangos hemáticos de 43 x 32 mm con nivel líquido-líquido en su interior. Se valora por Ginecología, que decide un manejo conservador. A pesar de múltiples intentos de aumentar la velocidad de infusión a través de la fistuloclisis, el dolor abdominal a nivel pélvico se agudizaba cada vez que se incrementaba el volumen de NET, por lo que la velocidad máxima tolerada fue de 50 ml/hora con una fórmula basada en péptidos. Los aportes calóricos finales fueron: NPT de 1600 kcal (1,2 g de proteína por kg de peso actual) y NET de 1200 kcal de fórmula basada en péptidos. Una vez se llega a su peso habitual (49 kg) se disminuye el aporte de NPT a 1100 kcal y se mantiene el aporte calórico por NET de 1200 kcal, obteniéndose con todo esto un balance nitrogenado positivo de 3 g, un peso de 49 kg y una dinamometría final de 16 kg. Tras seis meses de apoyo nutricio se realiza la reconexión intestinal, que evolucionó sin complicaciones posquirúrgicas, reanudándose la vía oral de forma exitosa.
DISCUSIÓN
El fallo intestinal por sí mismo es una condición médica compleja que requiere un manejo multidisciplinario. Uno de los principales factores que serán determinantes para el éxito de la reconexión intestinal es el estado nutricional del paciente que la padece. El abordaje nutricional dependerá de diferentes factores: el cuadro clínico que originó el fallo intestinal, la edad de aparición, la longitud intestinal y la anatomía del intestino remanente (enterostomía, preservación del íleon, válvula ileocecal y/o del colon), así como la función motora del intestino residual. En esta presentación de casos vemos a dos pacientes en diferentes contextos clínicos a quienes se les brindó con éxito apoyo nutricional mixto para favorecer su recuperación. En ambos casos se inició la NPT y, tan pronto se tuvo un acceso enteral a través de una fístula, iniciamos la administración de la nutrición enteral. Si bien es cierto que no se pudo retirar por completo la nutrición parenteral, el promover el uso del tubo digestivo cumplió una función crucial para promover la salud y adaptación del tracto gastrointestinal. Está ampliamente comprobado que al exponer la mucosa, sin importar la cantidad energética (pudiendo ser esta tan mínima como un 4 % del aporte calórico total) (6,7), ello estimula el flujo sanguíneo entérico, mantiene la función de barrera al preservar la integridad de las uniones intercelulares herméticas, induce la producción y liberación de inmunoglobulinas y factores de crecimiento endógenos, mantiene la salud hepática y pancreática, y presenta al cirujano un tejido de mejor calidad para una anastomosis exitosa (5). En virtud de todo lo anterior, la NE ha demostrado una disminución de la mortalidad en los pacientes críticos, una reducción de las infecciones asociadas al entorno hospitalario y una disminución de los días de estancia intrahospitalaria (8). No nos cabe la menor duda de que ambos casos experimentaron los beneficios de la NE.
En ambos pacientes, una vez se controló la sepsis abdominal, ninguno desarrolló infecciones asociadas al catéter, neumonía intrahospitalaria u otra complicación, a pesar de su estancia intrahospitalaria prolongada.
Mantener un estado nutricional óptimo en este tipo de pacientes es un reto clínico. Existen diversas controversias sobre el tratamiento nutricional ya que, en diferentes centros de todo el mundo, muchas de las practicas están “basadas en la experiencia” en lugar de “la evidencia”, y esto debido a la gran heterogeneidad del fallo intestinal (9). Así mismo, sabemos que la literatura actual recomienda reinfundir el quimo en este tipo de pacientes, pero en nuestro caso esto no fue posible debido al calibre de las sondas de fistuloclisis, las normas epidemiológicas temporales derivadas de la pandemia y la falta de equipo automatizado de reinfusión de quimo.
CONCLUSIÓN
Lo que consideramos sumamente valioso es la búsqueda intencionada de un acceso enteral y, aunque existan situaciones que no permitan alcanzar el requerimiento energético total, como puede ser el caso de las fístulas distales, donde dicha situación es menos probable, esto no debe desanimarnos: al contrario, si logramos al menos mantener un estímulo trófico se obtendrán todos los beneficios del uso del tracto gastrointestinal.
Debido a la complejidad de este tipo de pacientes, en nuestro centro han sido de suma utilidad los pasos ilustrados en la figura 3.