INTRODUCCIÓN
El tejido adiposo realiza, además de su bien conocido papel como deposito de energía, la producción de una serie de moléculas con múltiples acciones llamadas adipoquinas. Estas moléculas bioactivas tienen funciones importantes en el metabolismo, la sensibilidad a la insulina y los sistemas de control de la saciedad y el apetito (1). Estas adipoquinas podemos categorizarlas en dos subgrupos, antiinflamatorias y proinflamatorias, y ambos sistemas se encuentran en estado de equilibrio e involucrados en el metabolismo de la glucosa. Dentro del grupo de las adipoquinas proinflamatorias tenemos a la resistina. Esta molécula es secretada por los macrófagos infiltrados en el tejido adiposo y también a nivel del tejido hepático (2). En algunos trabajos de investigación, las concentraciones circulantes de resistina sérica se asocian con un aumento de la masa grasa total, la masa grasa visceral (3) y la presencia de diabetes mellitus de tipo 2 (4). Existe una relación entre los niveles elevados de resistina y la inhibición de la vía de señalización de la insulina. Esta inhibición está provocada por la acción del supresor de la señalización de citoquinas 3 (SOCS-3), que conduce a la inducción del sustrato del receptor de insulina 1/2 (IRS1/2) y a la degradación de la resistencia a la insulina (5).
Además, las concentraciones circulantes de resistina tienen un alto grado de heredabilidad (6), que puede alcanzar hasta el 80 %. El gen que codifica la resistina (RETN) se encuentra en el cromosoma 19p13.2, y en él se han descrito varios polimorfismos de un único nucleótido (SNP) con resultados contradictorios. Se ha demostrado que los polimorfismos de un solo nucleótido (SNP) de RETN aumentan la susceptibilidad a la diabetes mellitus al elevar las concentraciones de resistina (7-9). Sin embargo, otros SNP de este gen, como el rs7139228, apenas se han evaluado. Esta variante C/T del intrón 5´UTR (SNP rs7139228) es un polimorfismo asociado con concentraciones elevadas de resistina independientemente de la edad, el índice de masa corporal y el sexo (10). A pesar de estos datos, no existen estudios en la literatura que evalúen su relación con el riesgo de síndrome metabólico (SM) en pacientes obesos. Si tenemos en cuenta que la presencia de SM en el paciente obeso aumenta su riesgo cardiovascular (11), investigar el efecto de los polimorfismos de nucleótido único (SNP) del gen RETN es de alto interés para poder detectar a los pacientes predispuestos. Por tanto, el objetivo de nuestro estudio es evaluar la influencia del SNP rs7139228 del gen RETN sobre las concentraciones séricas de resistina, así como sobre la presencia de síndrome metabólico en pacientes obesos.
MATERIAL Y MÉTODOS
SUJETOS
Se reclutaron un total de 1003 sujetos obesos que acudieron a las consultas externas de nutrición en un muestreo no probabilístico consecutivo. El estudio se llevó a cabo en el Hospital Clinico Universitario de Valladolid de acuerdo con los principios de la Declaración de Helsinki, y fue aprobado por el Comité Ético Institucional para la Investigación en seres humanos (HCUVa 6/2018). Todos los participantes firmaron un consentimiento informado, con un anexo referente al estudio genético realizado, y se les explicó la importancia del estudio. Estos pacientes obesos fueron reclutados por el Servicio de Endocrinología y Nutrición tras ser derivados por los médicos de atención primaria del Área para evaluación de su obesidad. Los criterios de inclusión en el estudio fueron los siguientes: edad mayor de 18 años, índice de masa corporal (IMC) mayor de 30 kg/m2 y ausencia de dieta durante los 6 meses previos al estudio. Los criterios de exclusión fueron los siguientes: antecedentes de enfermedad cardiovascular o accidente cerebrovascular durante los 12 meses anteriores, cáncer o cirugía mayor por cualquier causa en los 6 meses anteriores y uso actual de tratamientos farmacológicos para la diabetes, antiinflamatorios no esteroideos, fibratos o glucocorticoides.
PROCEDIMIENTOS
Se obtuvieron muestras de sangre venosa tras 12 h en ayunas de todos los sujetos mediante punción venosa. En estas muestras se determinaron los niveles de glucosa basal, el perfil lipídico (colesterol total, colesterol-LDL, colesterol-HDL, concentración de triglicéridos plasmáticos), la proteína C-reactiva (PCR), la insulina, la resistencia a la insulina determinada por HOMA-IR y las concentraciones de resistina.
En todos los pacientes obesos se determinaron los siguientes parámetros antropométricos: masa grasa por bioimpedancia, peso, talla, índice de masa corporal (IMC) y circunferencia de la cintura, y finalmente se midió la presión arterial. Todas estas determinaciones antropométricas y la medida de la presión arterial se realizaron a la misma hora del día (por la mañana). También se registraron la ingesta dietética y el ejercicio físico que realizaba cada paciente.
Se utilizaron los criterios del Adult Treatment Panel III (ATPIII) para diagnosticar en los sujetos la presencia de síndrome metabólico (11). El diagnóstico de SM requirió al menos 3 de los siguientes datos: glucosa en ayunas elevada o tratamiento para la diabetes mellitus, triglicéridos elevados (> 150 mg/dl) o tratamiento para la hiperlipidemia, colesterol-HDL bajo < 40 mg/dl (hombres) o < 50 mg/dl (mujeres), presión arterial sistólica o diastólica elevadas (> 130/85 mmHg o tratamiento antihipertensivo) y perímetro de cintura aumentado (> 94 cm [hombres] o > 80 cm [mujeres]).
GENOTIPADO DEL POLIMORFISMO DEL GEN RETN RS7139228
El ADN genómico se extrajo de leucocitos de sangre periférica con el kit comercial Vineo Extract DNA (Biorad CA, LA, EE. UU.). La cantidad de ADN extraído se analizó con un espectrofotómetro (Fischer, Madrid, España). La reacción en cadena de la polimerasa (RCP) en tiempo real se realizó con un termociclador (Biorad CA, LA, EE. UU.). En primer lugar se marcó el ADN amplificado (fluorescente; 5'6-carboxiffluoresceína (FAM) y 6-hexaclorofluoresceína [HEX]), y posteriormente se midió la cantidad de fluorescencia liberada durante la amplificación, la cual es directamente proporcional a la cantidad de ADN amplificado. Los cebadores y sondas de oligonucleótidos se diseñaron con el programa informático Beacon Designer 5.0 (Premier Biosoft International®, LA, CA, EE. UU.). Se realizó una PCR con 50 ng de ADN genómico y 0,5 μL de cada oligonucleótido cebador (cebador directo: 5'- ACGTTGGATGGCAAAGATTCTGATCTCGGG -3' y reverso 5'- ACGTTGGATGCCATCATTTTCAGCATGTATG -3'). El ADN se desnaturalizó a 95 °C durante 3 minutos; se realizaron 45 ciclos de desnaturalización a 95 °C durante 15 segundos y, posteriormente, a 59,3 °C durante 45 segundos. La PCR se realizó en un volumen final de 25 μl que contenía 12,5 μl de IQTM Supermix (Bio-Rad®, Hercules, CA, EE. UU.) con ADN-polimerasa TAq. Si ambas cadenas crecían en una muestra de paciente, este paciente se clasificó como heterocigoto. Si solo crecía una hebra en una muestra de paciente, este paciente se clasificó como homocigoto. El software del termociclador clasifica a cada paciente como homocigoto de tipo salvaje (GG), heterocigoto (GA) y homocigoto mutante (AA). Además, en cada reacción se incluyeron un control negativo y muestras de control que representaban todos los genotipos. El equilibrio de Hardy-Weinberg se determinó con una prueba estadística (chi cuadrado). La variante del gen RETN estaba en equilibrio de Hardy-Weinberg (p = 0,26).
DETERMINACIONES DE LABORATORIO
El análisis bioquímico sérico de glucosa, insulina, proteína C-reactiva (PCR), colesterol total, colesterol-HDL y triglicéridos se llevó a cabo utilizando el analizador COBAS INTEGRA 400 (Roche Diagnostic, Basilea, Suiza). El colesterol-LDL se calculó mediante la fórmula de Friedewald (colesterol-LDL = colesterol total - colesterol-HDL - triglicéridos / 5) (12). La resistencia a la insulina se calculó mediante el método modelo de homeostasis para la resistencia a la insulina (HOMA-IR) con la siguiente fórmula: glucosa x insulina / 22,5 (13). Las concentraciones de resistina se determinaron por ELISA (Biovendor Laboratory, Inc., Brno, República Checa) con una sensibilidad de 0,2 ng/ml y con un rango de normalidad de 4-12 ng/ml (14).
TENSIÓN ARTERIAL, MEDIDAS ANTROPOMÉTRICAS Y ENCUESTA NUTRICIONAL
La tensión arterial se midió en tres ocasiones después de un tiempo de reposo de 10 minutos con un esfigmomanómetro de mercurio (Omrom, LA, CA, EE. UU.), y se promediaron los resultados. El peso corporal se midió con una balanza con precisión de 100 g (Omrom, LA, CA, EE. UU.) y el índice de masa corporal se calculó como peso (kg) / talla (m2), clasificando como obesos a los pacientes con un índice de masa corporal superior a 30 kg/m2 (15). También se determinó la circunferencia de la cintura con una cinta métrica (tipo SECA, SECA. Birmingham, UK) (diámetro más estrecho entre la xifoides y la cresta ilíaca). La masa grasa total se calculó mediante impedanciometría con una precisión de 5 g (16) (EFG BIA 101 Aniversario, Akern, It). Se utilizó la siguiente fórmula (0,756 x Altura2 / Resistencia) + (0,110 x Masa corporal) + (0,107 x Reactancia) - 5,463. Todos los sujetos recibieron instrucciones para registrar su ingesta dietética diaria durante tres días no consecutivos, incluido un día de fin de semana. Los registros fueron analizados con un sistema de evaluación de datos basado en el software (Dietosource®, Ge, Swi) (17). Todos los sujetos registraron el ejercicio físico diario en minutos por semana con un cuestionario autoadministrado, que consistía en la recogida diaria de la actividad en una agenda.
ANÁLISIS ESTADÍSTICO
El tamaño de la muestra del estudio se calculó para detectar diferencias en la prevalencia del síndrome metabólico del 5 % con una potencia del 90 % y una significación del 5 % (n = 1000). Se utilizó la prueba de Kolmogorov-Smirnov para determinar la distribución de las variables. Los resultados se expresaron como media +/- desviación estándar. Las variables numéricas cuantitativas con distribución normal se analizaron con una prueba t de Student. Las variables no paramétricas se analizaron con la prueba U de Mann-Whitney. Las variables categóricas se analizaron con la prueba del chi cuadrado, con la corrección de Yates y la prueba de Fisher. Se determinó la odds ratio (OR) con un intervalo de confianza del 95 % para evaluar la influencia de este SNP en la presencia de síndrome metabólico y sus criterios; posteriormente se realizó un análisis de regresión logística (método forward) con la variable dependiente dicotómica. El análisis estadístico se realizó para los genotipos GA y AA combinados como un grupo (grupo mutante, alelo menor) y GG como un genotipo de tipo salvaje, con un modelo dominante. Se consideró estadísticamente significativo un valor de p < 0,05 (SPSS 23.0, IL, EE. UU.).
RESULTADOS
Un total de 733 (73,1 %) eran mujeres y 270 (26,9 %) eran hombres (n = 1003). La edad media del grupo era de 48,3 ± 6,2 años, sin diferencias significativas de edad entre varones y mujeres (48,1 ± 5,2 años vs. 48,9 ± 6,1 años: ns).
Tras el genotipado de los 1003 sujetos obesos en función del polimorfismo rs7139228, la distribución del genotipo fue la siguiente: 852 sujetos con GG (84,9 %), 147 sujetos con GA (14,7 %) y 4 sujetos con AA (0,4 %). La frecuencia alélica fue G (0,92) y A (0,08). Al agrupar a los sujetos para realizar un análisis dominante, se obtuvieron las siguientes frecuencias: 852 sujetos con genotipo salvaje GG (84,9 %), con un total de 614 mujeres (72,1 %) y 238 hombres (27,9 %), y un to- tal de 151 (15,1 %) sujetos con genotipo mutante (GA+AA), siendo 119 (78,9 %) mujeres y 32 (21,1 %) hombres.
En la tabla I se muestran los valores medios de los diferentes parámetros antropométricos y la presión arterial en relación con el polimorfismo rs7139228, sin diferencias significativas entre ambos grupos de genotipos (análisis dominante).
Tabla I. Parámetros antropométricos y presión arterial.
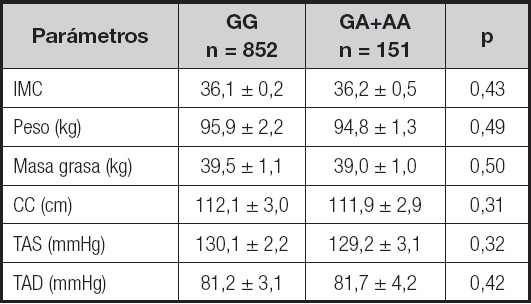
IMC: índice de masa corporal; TAD: tensión arterial diastólica; TAS: tensión arterial sistólica; CC: circunferencia de la cintura. Sin diferencias estadísticamente significativas entre los genotipos, análisis dominante (GG vs. GA+AA).
En la tabla II se muestran los valores bioquímicos en relación al polimorfismo rs7139228, sin diferencias significativas entre ambos grupos de genotipos en el perfil lipídico, la glucosa basal y los niveles de proteína C-reactiva. Sin embargo, las concentraciones séricas de resistina (delta: 1,7 ± 0,2 ng/ml; p = 0,01), insulina (delta: 4,2 ± 0,4 UI/L; p = 0,01) y HOMA-IR (delta: 1,9 ± 0,2 unidades; p = 0,03) fueron mayores en los pacientes portadores del alelo A que en los no portadores.
Tabla II. Parámetros bioquímicos y niveles circulantes de resistina (media ± DE).
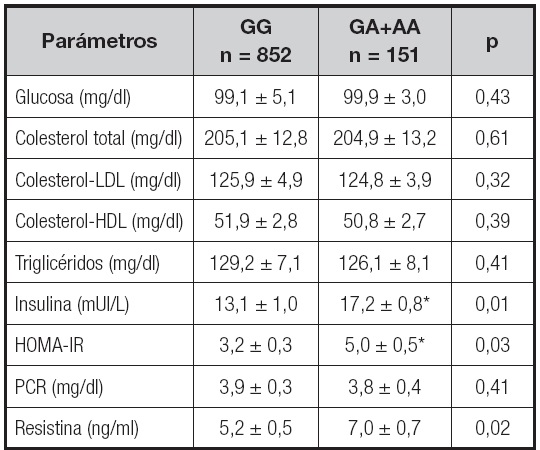
HOMA-IR: homeostasis model assessment of insulin resistance; PCR: proteína C-reactiva.
Diferencias estadísticamente significativas entre los genotipos (insulina-HOMA-IR), análisis dominante (GG vs. GA+AA).
Para evaluar la relación de la ingesta dietética y de la actividad física, se compararon estos parámetros en ambos grupos de sujetos obesos, sin encontrar diferencias estadísticamente significativas ni en la ingesta calórica, ni en la distribución de macronutrientes (análisis dominante) (Tabla III).
Tabla III. Ingesta dietética y actividad física (media ± DE).
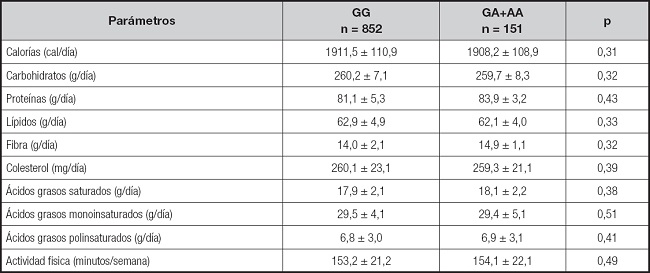
Sin diferencias estadísticamente significativas entre los genotipos; análisis dominante (GG vs. GA+AA).
Para analizar la relación entre las concentraciones de resistina, los genotipos SNP rs7139228 y la presencia de síndrome metabólico (SM), se compararon los valores de resistina en ambos genotipos. Las concentraciones séricas de resistina fueron mayores en los portadores del alelo A con síndrome metabólico (SM 7,9 ± 0,4 ng/ml vs. sin SM 4,7 ± 0,3 ng/ml; p = 0,03); sin embargo, no existieron diferencias en las concentraciones séricas de resistina en los pacientes no portadores del alelo A (SM 5,3 ± 0,5 ng/ml vs. sin MS 5,1 ± 0,8 ng/ml; p = 0,43).
La prevalencia global de síndrome metabólico en la muestra fue del 48,1 %. El porcentaje de pacientes con síndrome metabólico y sus diferentes componentes (obesidad central, niveles bajos de colesterol HDL, hipertrigliceridemia, hipertensión o hiperglucemia) se muestran en la tabla IV. El porcentaje de sujetos con obesidad que presentaban hiperglucemia (OR = 1,63, IC 95 % = 1,12-2,37; p = 0,02) y síndrome metabólico (OR = 1,44, IC 95 % = 1,02-2,04; p = 0,02) fueron mayores en los portadores del alelo A que en los no portadores de este alelo de riesgo.
Tabla IV. Síndrome metabólico y componentes del síndrome metabólico.
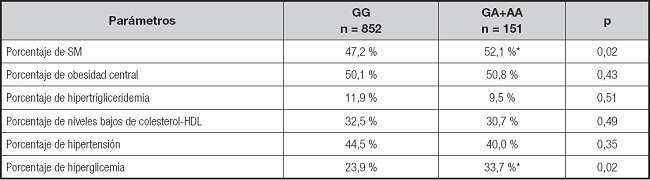
Los puntos de corte para los criterios son: obesidad central (perímetro de cintura > 88 cm en mujeres y > 102 en hombres), hipertensión (TA sistólica > 130 mmHg o TA diastólica > 85 mmHg o tratamiento específico), hipertrigliceridemia (triglicéridos > 150 mg/dl o tratamiento específico) o hiperglucemia (glucosa plasmática en ayunas > 110 mg/dl o tratamiento farmacológico para la glucemia elevada).
*p < 0,05 entre genotipos en un modelo dominante (GG vs. GA+AA).
Por último, el análisis de regresión logística mostró un mayor porcentaje de hiperglucemia (OR = 1,60, IC 95 % = 1,08-2,96; p = 0,02) y de síndrome metabólico (OR = 1,33, IC 95 % = 1,07-3,39; p = 0,02) en los portadores del alelo A después de ajustar los niveles de resistina, el sexo, el IMC y la edad.
DISCUSIÓN
La relación entre la variante rs7139228 del gen RETN y la presencia de síndrome metabólico aún no se ha evaluado a pesar de la consistente relación detectada en la literatura entre las concentraciones sanguíneas de resistina y las alteraciones metabólicas (18,19). En nuestro estudio transversal que analiza esta variante del gen RETN en pacientes adultos caucásicos obesos, mostramos una asociación significativa entre el alelo A del SNP rs7139228, con la variante C/T del intrón 5´UTR, y las concentraciones de resistina, insulina y resistencia a la insulina (HOMA-IR). Además, de manera independiente, se detectó una relación con una mayor prevalencia de hiperglucemia y síndrome metabólico y con la presencia del alelo A.
Estas asociaciones metabólicas encontradas tienen una base fisiopatológica y se ha demostrado que la resistina incrementa la síntesis de citocinas inflamatorias en los macrófagos del tejido adiposo y que este estado inflamatorio induce a su vez la expresión del gen de la resistina (20). A su vez, esta situación proinflamatoria mantenida en el tiempo se involucra en la patogenia de la resistencia a la insulina y, por tanto, la resistina podría ser el nexo de unión entre la situación inflamatoria del obeso y la resistencia a la insulina que este presenta. Además, se ha demostrado que la resistina incrementa las concentraciones plasmáticas de TNF-alfa (21), estando las concentraciones elevadas en los pacientes obesos junto con los ácidos grasos libres circulantes. Además, la resistina disminuye la secreción y expresión de otras adipocinas antiinflamatorias como la adiponectina (22). Todas estas alteraciones metabólicas previamente comentadas producen un aumento de la resistencia a la insulina. Aunque nuestro trabajo es el primero en la literatura que evalúa el papel del polimorfismo rs7139228 sobre todas estas alteraciones metabólicas, otros trabajos con diferentes polimorfismos de este gen (23) han demostrado que la variante 3745367 está directamente relacionada con la HOMA-IR en sujetos diabéticos, y esta asociación se ha observado en diferentes etnias (24-26).
Por otra parte, la resistina suprime la diferenciación de los adipocitos, lo que conduce a una sobrecarga de ácidos grasos y una alta lipotoxicidad al aumentar la producción de colesterol-LDL y la degradación de los receptores de LDL en los músculos y el tejido hepático, lo que conlleva un aumento de la presencia de síndrome metabólico (27). Y, en segundo lugar, la resistina circulante induce la resistencia a la insulina al disminuir la supresión de la gluconeogénesis hepática inducida por la insulina, así como los niveles altos de glucosa, al disminuir el transporte de glucosa en los músculos (28).
El aumento de las concentraciones de resistina en nuestro estudio debido al polimorfismo rs7139228 de RETN puede explicarse mediante varias hipótesis. La primera hipótesis es relacionar estas concentraciones elevadas de resistina circulante con la unión específica de los factores de transcripción Sp1 y Sp3 a un elemento promotor que genera un incremento de la actividad promotora, como se muestra con otros SNP (8). En segundo lugar, la metilación del ADN, una modificación por tanto epigenética, también puede desempeñar un papel importante en la regulación de la expresión génica (29), mostrando una relación inversa de los niveles de resistina circulantes con el nivel de metilación. En tercer lugar, este SNP puede estar en desequilibrio de ligamiento con otro SNP desconocido que module a su vez el nivel de expresión génica de la resistina (8). Otra teoría podría ser que esta variante genética formara parte de una secuencia del elemento regulador que media la unión de proteína correguladora implicada en la regulación de la expresión del gen RETN (30). Finalmente, este SNP podría formar parte de una transcripción de micro-ARN que regularía la estabilidad de la transcripción de un gen involucrado en la fisiopatología del síndrome metabólico (31).
Hasta la fecha, en la literatura no existen estudios de intervención con este SNP y solo hemos encontrado un estudio de diseño transversal (10). Sin embargo, podríamos suponer que, al igual que ha ocurrido con otros SNP del gen RETN, este SNP rs7139228 también podría modificar la respuesta a las intervenciones dietéticas (32) y las intervenciones de cirugía bariátrica (33). También es necesario tener en cuenta que la actividad física genera una regulación del eje de la resistina (34) y, por tanto, es otro elemento a tener en cuenta en los estudios de intervención. Por tanto, nuestro estudio puede generar las bases para futuros estudios de intervención y nutrición personalizada del paciente obeso.
Nuestro trabajo presenta algunas limitaciones. En primer lugar, solo hemos evaluado un SNP del gen RETN y otros SNP de este gen podrían estar involucrados en los parámetros metabólicos e interactuar con otros haplotipos. En segundo lugar, un diseño transversal no genera causalidad y son necesarios estudios prospectivos para demostrar esta causalidad. En tercer lugar, son necesarios nuevos estudios para validar estos hallazgos en pacientes con sobrepeso, así como en pacientes obesos diabéticos. Finalmente, nuestros datos solo pueden generalizarse en pacientes obesos, no siendo extrapolables a la población general ni a la población con normopeso. Como fortalezas del trabajo, tenemos un estudio con un tamaño muestral importante y la muestra representa a los pacientes obesos que acuden en la práctica clínica real a nuestras consultas.
En conclusión, el alelo A de la variante genética rs7139228 se asocia con mayores concentraciones de resistina, insulina basal, resistencia a la insulina y prevalencia de síndrome metabólico en sujetos obesos.














