INTRODUCCIÓN
Los trastornos gastrointestinales crónicos (TGIC) son patologías de difícil manejo que se manifiestan con síntomas heterogéneos. Pueden ser de origen funcional y/u orgánico y presentan un curso crónico de remisión-recaída, por lo que tienen un impacto significativo en la calidad de vida del paciente y representan una importante carga económica para los sistemas de salud (1-3). En los últimos años, debido a cambios en el estilo de vida, la alimentación y los intereses de la industria, se ha producido un incremento muy importante en las consultas por sospecha de intolerancias alimentarias (4,5). El manejo nutricional es fundamental en el ámbito de los TGIC, pues puede ser un factor para mejorar la sintomatología y calidad de vida de los pacientes; no obstante, es importante evitar la prescripción de dietas restrictivas de manera innecesaria e identificar otras causas primarias cuando las restricciones no conducen a un mejor estado del paciente (6).
Los TGIC son patologías notablemente comunes y representan el mayor porcentaje de consultas gastrointestinales realizadas en Atención Primaria y secundaria de salud (2). En población adulta a nivel mundial, el 40,3 % presenta al menos un TGIC, y en España la prevalencia es del 43,7 % (1). La presentación clínica de los TGIC es heterogénea; los pacientes pueden cursar con estreñimiento, diarrea, flatulencia, distensión abdominal y meteorismo, entre otra amplia variedad de síntomas con distinta intensidad y frecuencia (7). De acuerdo con el modelo biopsicosocial, los TGIC son producto de la interacción entre factores psicosociales, fisiológicos, genéticos, culturales y ambientales, los cuales influyen en la presentación clínica de estos trastornos, es decir, la aparición y persistencia de los síntomas, la severidad y el resultado clínico en cuanto a calidad de vida, el ausentismo laboral, los costes y la utilización de los servicios sanitarios (7,8). Entre los factores de riesgo para el desarrollo de TGIC se encuentra la inflamación (9), pues cualquier afección intercurrente que curse con inflamación de la mucosa intestinal, como infecciones, alergias alimentarias, enfermedades inflamatorias o alteraciones en la microbiota intestinal, puede producir una sensibilización de los nervios aferentes y predisponer al desarrollo de hipersensibilidad visceral (8,9), así como llevar asociado un aumento de la permeabilidad intestinal con pérdida de función barrera (4). Esta alteración puede manifestarse como trastornos funcionales de dolor abdominal y, en algunos casos, puede ir acompañada de otros síntomas gastrointestinales como alteración del ritmo deposicional e intolerancias alimentarias transitorias, entre otros (8,9).
Dentro de los TGIC podemos tratar con trastornos funcionales gastrointestinales (TFGI), presentes por sí solos o en combinación con patologías orgánicas (10). Se ha visto que ciertos trastornos funcionales de dolor abdominal pueden estar combinados con entidades como la enfermedad celiaca (EC) y la enfermedad inflamatoria intestinal (EII) y que pueden acompañarse de otros trastornos digestivos como la intolerancia a la lactosa (IL) (9,10). En algunos trastornos, como el dolor abdominal crónico (DAC), las causas son no orgánicas en el 85-95 % de los casos, pero el 5-15% de los casos tiene un origen orgánico identificable (8), es decir, al menos para un porcentaje de estos pacientes podríamos encontrar una posible respuesta que guíe el tratamiento y que potencialmente podría mejorar su calidad de vida.
En el origen de las posibles causas de los TGIC pueden identificarse causas primarias y secundarias. Dentro de las posibles causas primarias, encontramos enfermedades con base genética como la EC y la hipolactasia primaria, cuyos síntomas fácilmente se confunden con otros problemas de tubo digestivo (10).
La EC es una enteropatía inflamatoria de origen autoinmune resultado de la interacción entre el gluten y factores inmunológicos, genéticos y ambientales (11,12). Se produce daño en el intestino delgado, caracterizado por infiltración de células inflamatorias crónicas en la lámina propia y el epitelio, y atrofia vellositaria, lo que puede tener un impacto a nivel intestinal que, dentro de las consecuencias, se manifieste como intolerancia a los carbohidratos (11). Cada vez es más frecuente su diagnóstico en la edad adulta, con formas menos sintomáticas, con síntomas digestivos inespecíficos y manifestaciones extraintestinales que podrían confundirse con otro tipo de alteraciones gastrointestinales (12). De hecho, el 20-50 % de los pacientes con EC cumple con los criterios Roma para síndrome de intestino irritable (SII), pues algunos síntomas pueden parecerse a los de la EC, como el dolor abdominal y la diarrea, que están presentes frecuentemente en pacientes con ambas condiciones (9,11).
De manera similar, la IL también presenta manifestaciones clínicas heterogéneas similares a las de otras entidades como la EC, el síndrome de sobrecrecimiento bacteriano (SIBO) o el SII (10,13). Una persona presenta digestión deficiente de lactosa solo cuando existe evidencia de incapacidad funcional de la enzima lactasa para hidrolizar lactosa y convertirla en glucosa y galactosa (10). En los humanos, la producción de la enzima lactasa se reduce al 10 % de los niveles neonatales y solo el 25-30 % de la población es capaz de digerir la lactosa en la edad adulta (13). La hipolactasia o malabsorción de lactosa es primaria cuando existe una alteración genética a nivel del gen MCM6 encargado de codificación y síntesis de la enzima lactasa que provoca una pérdida temprana de su actividad. Sin embargo, el mecanismo fisiopatológico de la absorción deficiente de lactosa en el intestino puede también ser secundario a otras enteropatías o coexistir con otras enfermedades intestinales, lo cual en algunos casos puede complicar el diagnóstico y tratamiento (10).
Respecto a las posibles causas secundarias para el desarrollo de TGIC, identificamos algunos factores ambientales, como pueden ser la alimentación y las infecciones por microorganismos, dentro de las cuales se incluyen las parasitosis. Se registra que más del 10 % de los adultos y aproximadamente el 36 % de los niños con enteritis infecciosa aguda desarrollan trastornos funcionales con dolor abdominal que pueden durar varios años (9). Los parásitos intestinales podrían estar relacionados con los TGIC debido a una reactividad intestinal alterada en respuesta a estímulos psicológicos o luminales como agentes infecciosos o alimentos (6,14). Las enteroparasitosis afectan a la estructura y el ambiente intestinal generando sintomatología en pacientes susceptibles, y podrían llegar a desencadenar, agravar o confundirse con TGIC (15). Adicionalmente, las enteritis infecciosas, tanto bacterianas (Shigella sonnei) como virales (norovirus) o protozoarias (Giardia intestinalis [G. intestinalis], Cryptosporididum spp.), son un factor de riesgo para el desarrollo de SII postinfeccioso (9,16). Además, otros autores afirman una correlación positiva entre dispepsia, malabsorción/intolerancia a carbohidratos entre otras patologías y las parasitosis intestinales, de las cuales destaca G. intestinalis (6).
Por otro lado, cada vez es mayor la evidencia de que la dieta contribuye a los síntomas funcionales digestivos, siendo los nutrientes con mayor efecto sobre el tracto digestivo grasas, carbohidratos y fibras. En las últimas décadas, el consumo de alimentos ultraprocesados (UPF) ha aumentado sustancialmente, sobre todo en países occidentales, donde representan un alto porcentaje de la dieta. Los UPF se caracterizan por tener una alta densidad de ácidos grasos saturados, azúcar y sodio y un bajo contenido de otros nutrientes como las fibras y las proteínas. Una dieta basada en este tipo de productos podría contribuir a la inducción o exacerbación de los síntomas digestivos y, además, privar a los individuos de gozar de los beneficios de otros nutrientes favorables para el intestino como son algunos tipos de fibra (4). Tanto es así que la combinación de una parasitosis no diagnosticada que podría alterar la absorción de carbohidratos, acompañada de una dieta alta en UPF ricos en carbohidratos simples, podría generar síntomas gastrointestinales.
Esta revisión y propuesta tiene por objetivo establecer los beneficios de utilizar un algoritmo de pruebas recomendadas para el manejo dietético-nutricional (DN) del paciente con TGIC. El beneficio de utilizar un enfoque algorítmico para guiar el manejo DN del enfermo/a con TGIC es que nos permitirá optimizar el proceso diagnóstico y pautar un tratamiento nutricional considerando el origen del trastorno y sus efectos secundarios para paliar la intensidad y frecuencia de los síntomas con la menor cantidad de restricciones alimentarias posibles y mejorar la calidad de vida de los pacientes.
MATERIAL Y MÉTODOS
Para definir el algoritmo propuesto, se realizó una revisión bibliográfica con el objetivo de valorar e identificar información respecto al origen y manejo de los TGIC. Se efectuó la búsqueda de documentos en diversas bases de datos científicas (Scopus, Medline, SciencieDirect, WoS), utilizando palabras clave adaptadas según la información requerida. La búsqueda priorizó, pero no se limitó, a documentos a partir de 2018, entre ellos, revisiones sistemáticas, metaanálisis, guías de práctica clínica y tesis doctorales, tanto en español como en inglés.
Se realizó una búsqueda cruzada de los siguientes términos en español y su traducción en inglés: “trastorno crónico gastrointestinal”, “trastorno funcional gastrointestinal”, “dolor abdominal crónico”, “parásitos”, “intolerancia”, “malabsorción”, “fructosa, lactosa”, “enfermedad celiaca y dieta”, “síntomas”, “pruebas diagnósticas”, “manejo”, “tratamiento”, “origen”, “orgánico”, “genética”.
Se seleccionaron los artículos con mayor relevancia y, para organizar y almacenar la información, se utilizó la herramienta Mendeley, que permitió agrupar los artículos en las siguientes categorías: TFGI, IL, intolerancia fructosa, EC y parásitos.
RESULTADOS
El algoritmo propuesto (Fig. 1) se aplica a personas que presentan síntomas gastrointestinales crónicos cuya etiología no ha sido identificada. En primer lugar, se realizan las pruebas que podrían estar relacionadas con causas secundarias del TGIC, el SIBO y la intolerancia/malabsorción de carbohidratos. Las pruebas de aire espirado se acompañan de un análisis con PCR a tiempo real para determinar la presencia de parásitos en heces y una analítica complementaria que incluya marcadores de malabsorción intestinal, inflamación e infección y marcadores de EC.
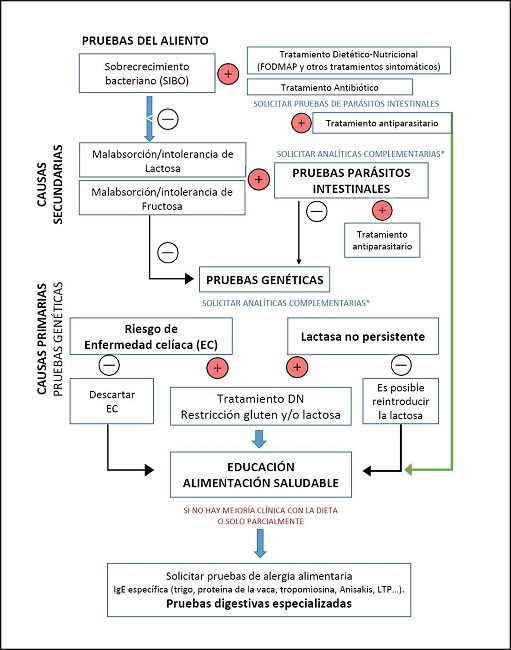
Figura 1. Algoritmo de pruebas recomendadas para el manejo dietético-nutricional del paciente con trastornos gastrointestinales crónicos.
La primera prueba es la de SIBO. Cuando esta prueba de aire espirado, realizada con glucosa, es positiva, se administra antibiótico junto con el tratamiento antiparasitario en caso de que estos hayan sido identificados. El tratamiento farmacológico se acompaña de terapia DN, prescribiendo una guía de alimentación basada en la dieta FODMAP (del inglés Fermentable, Oligosaccharides, Disaccharides, Monnosacharides and Polyols) durante 6-8 semanas. Una vez terminado el tratamiento farmacológico, se verifica la erradicación de la parasitosis y/o SIBO repitiendo las pruebas y, de acuerdo con el umbral de tolerancia y la evolución de los pacientes, se reintroducen alimentos progresivamente por medio de educación alimentaria.
Cuando la prueba de SIBO es negativa, el siguiente paso es realizar pruebas de aire espirado para intolerancia a lactosa y fructosa. Si el resultado de las pruebas de intolerancia es positivo, se requieren tratamiento DN específico para tratar la sintomatología y tratamiento farmacológico en caso de que se identifiquen parásitos.
En caso de que no exista presencia de parásitos asociados con las intolerancias o si directamente son descartadas las posibles causas secundarias por medio de pruebas negativas de intolerancia/malabsorción a lactosa y fructosa y pruebas de parásitos, el siguiente paso es explorar las posibles causas primarias por medio de un estudio genético para determinar el riesgo de desarrollar EC y lactasa no persistente (LNP).
En caso de que las pruebas genéticas sean positivas, se prescribe un tratamiento DN basado en la restricción de gluten y/o lactosa según lo requiera cada paciente, acompañado de educación alimentaria.
Finalmente, en caso de que los resultados de las pruebas de aire espirado y de parásitos y el estudio genético sean negativos y los síntomas del paciente persistan, se procede a solicitar otro tipo de pruebas y análisis a fin de buscar una explicación del cuadro sintomático del paciente. Entre ellas, podemos considerar: inmunoglobulina E (IgE) total, IgE específica (trigo, proteína de la vaca, tropomiosina, Anisakis, proteína LTP, etc.) y sensibilidad no celiaca al gluten, siempre acompañadas de la respectiva educación alimentaria y del tratamiento DN específico cuando se requiera.
DISCUSIÓN
El algoritmo propuesto abarca el uso de pruebas recomendadas para el manejo DN del enfermo/a con TGIC con el fin de optimizar el proceso diagnóstico y pautar un tratamiento nutricional considerando el posible origen del trastorno, que puede ser primario o secundario. El objetivo es mejorar la intensidad y frecuencia de los síntomas con la menor cantidad de restricciones alimentarias posibles y, así, mejorar la calidad de vida de los pacientes.
En pacientes con síntomas gastrointestinales crónicos de acuerdo con el algoritmo propuesto, primero se realiza la prueba de SIBO y se acompaña de un análisis con PCR a tiempo real para determinar la presencia de parásitos en heces. Fedewa y Rao (17) recomiendan descartar la presencia de SIBO o tratarlo primero con antibióticos antes de poder identificar intolerancia a fructosa en un paciente. Así pues, en el presente estudio, cuando la prueba de aire espirado con glucosa para SIBO es positiva, se provee tratamiento antibiótico junto con el de parásitos, si han sido identificados. Este tratamiento se acompaña de terapia DN prescribiendo una guía de alimentación basada en la dieta FODMAP durante 6-8 semanas. Una vez terminado el tratamiento farmacológico, se verifica la erradicación de la parasitosis y/o SIBO repitiendo las pruebas y, de acuerdo con el umbral de tolerancia y evolución de los pacientes, se reintroducen alimentos progresivamente.
Grez y cols. (18) y Fedewa y Rao (17) afirman que la dieta occidental que se consume actualmente es alta en FODMAP de origen natural, pero también de alimentos procesados, y que afecta cada vez a mayor porcentaje de la población. Baranguán Castro y cols. (19) coinciden en que el cambio ocurrido en los hábitos alimentarios ha aumentado el consumo de alimentos ricos en FODMAP, entre ellos, la fructosa y los fructanos provenientes del trigo, y alimentos procesados derivados, así como un aumento en el consumo de polioles (edulcorantes) provenientes de productos denominados dietéticos, bajos o sin azúcar. Por lo antes mencionado, un eje transversal para todos los tratamientos dietéticos-nutricionales de este estudio es la educación alimentaria para mejorar la calidad de los alimentos consumidos por los pacientes y los síntomas que presentan.
Cuando la prueba de SIBO es negativa, el siguiente paso es realizar pruebas de aire espirado para intolerancia a lactosa y fructosa, las cuales utilizan el aire expirado de productos producidos por la fermentación intestinal alterada de carbohidratos que no han sido absorbidos (para el presente estudio, la lactosa y la fructosa) (5). Se utilizan los valores tanto de hidrógeno como de metano porque el resultado es más preciso (14). De acuerdo con estudios previos, estas pruebas son la mejor herramienta disponible para diagnosticar intolerancia y malabsorción de carbohidratos, dado que se obtiene un diagnóstico objetivo y claro que evita la prescripción de dietas restrictivas de manera innecesaria (17). Cuando el resultado de las pruebas es positivo, se requiere tratamiento DN específico para tratar la sintomatología.
En caso de intolerancia a la fructosa, se recomienda que los pacientes pasen por una fase inicial en la cual se reduce o elimina de la dieta el nutriente que se presume es responsable de la intolerancia, seguida de una fase que consiste en reintroducir gradualmente distintos alimentos de acuerdo con la tolerancia de los pacientes (17). No obstante, para el tratamiento de intolerancia a la lactosa, Szilagyi e Ishayek (14) indican que la mayor parte de personas puede tolerar hasta 12-15 g/lactosa/día y que ya no se recomienda la eliminación total de lactosa de la dieta, sino un aporte restringido.
Aguilar menciona que el uso de pruebas de aire espirado permite detectar intolerancias (lactosa y fructosa) y diferenciar de SIBO (5). No obstante, este autor considera que el “gold standard” para diagnosticar una intolerancia alimentaria se establece cuando se elimina o reduce el aporte de estos carbohidratos en la dieta, seguido de la reaparición de síntomas cuando se reintroducen los mismos. Putkonen y cols. (20) mencionan, además, que utilizar fructosa pura durante estas pruebas no se asemeja al consumo real de este nutriente, pues usualmente se encuentra junto a otros carbohidratos en los alimentos. Otros autores, entre ellos Hidalgo (8), también mencionan que para tratar un TGIC como el DAC, una estrategia puede ser disminuir la cantidad ingerida de alimentos ricos en fructosa. No obstante, sin negar que la restricción de fructosa puede aliviar los síntomas, indica que esta restricción podría tener un impacto negativo a nivel de la microbiota colónica (20). Adicionalmente, Trelis y cols. (6) explican que este tipo de dietas restrictivas, especialmente a largo plazo, limitan la variedad de alimentos ingeridos y repercuten en el estado de salud y la calidad de vida de los pacientes.
La intolerancia y la malabsorción de fructosa no son identificadas en algunos casos y los síntomas del paciente, por su similitud, se atribuyen al SII (17). Varios autores afirman que, en muchos casos, la sintomatología heterogénea de diferentes TGIC puede ser similar entre varias patologías, y es así como la IL, que además está sobrediagnosticada, puede confundirse con EC, mientras que los síntomas del SII pueden parecerse a los de la EC (9-11,14). Además, en muchos casos la etiología de los síntomas es una combinación de varios factores y los TGIC pueden estar presentes por sí solos, pero también en conjunto con patologías orgánicas (9). Martínez y Nogueira (10) explican en su estudio que el mecanismo fisiopatológico de la absorción deficiente de lactosa en el intestino puede ser secundario a otras patologías del tracto digestivo que también pueden coexistir entre ellas, lo cual puede complicar el diagnóstico y el tratamiento.
Forsgård menciona en su estudio ensayos clínicos en los cuales los sujetos que afirman ser intolerantes a la lactosa no son capaces de distinguir cuando reciben placebos, lo que sugiere que algunos sujetos atribuyen sus síntomas de manera equivocada al consumo de lactosa y la eliminan de su dieta sin ser la responsable de los síntomas (13). Adicionalmente, Van Lanen y cols. indican que muchos pacientes realizan dietas de eliminación, sobre todo de lactosa y gluten, sin mostrar una mejora notable de los síntomas, y estas no son recomendables cuando no están presentes la EC o una intolerancia a la lactosa o gluten confirmadas (21).
En la presente revisión y propuesta, se recalca la importancia de indagar si el origen de dichas intolerancias es primario (genético) o secundario (parásitos, alergias, EII, SII, SIBO, fármacos, etc.) para poder brindar un tratamiento eficaz y evitar el riesgo de prescribir dietas restrictivas de manera innecesaria. En el artículo de Trelis y cols. se sugiere indagar otras causas, entre ellas, parasitosis no diagnosticadas, cuando el manejo dietético mediante restricción de azúcares no ha dado resultado para pacientes diagnosticados con malabsorción (6). El presente algoritmo recomienda acompañar las pruebas de aire espirado con pruebas de parásitos intestinales y una analítica complementaria que nos permita identificar marcadores de malabsorción intestinal, inflamación e infección y marcadores de EC. La determinación de anticuerpos anti-transglutaminasa de clase IgA (ATGt-IgA) es usualmente el método serológico de elección para el diagnóstico y seguimiento de estos pacientes, puesto que tiene un elevado valor predictivo, alta sensibilidad y alta especificidad (8).
Por otro lado, los parásitos intestinales, dentro de los cuales destaca G. intestinalis, podrían estar relacionados con los TGIC debido a una reactividad intestinal alterada en respuesta a estímulos psicológicos o luminales, entre ellos, agentes infecciosos como los parásitos o alimentos. La infección por parásitos como G. intestinalis puede producir dolor recidivante e ir acompañada de diarrea e intolerancia secundaria y transitoria a la lactosa (8) y también a la fructosa (6). Como mencionan Ozaki y cols. (22), la malabsorción de fructosa es una causa de dolor abdominal en adultos y puede también ser el detonante de episodios de dolor abdominal en pacientes con TFGI. Hidalgo y Molina (8) mencionan que TGIC como el DAC tienen un mayor riesgo de desarrollarse por SIBO después de una infección gastrointestinal de origen bacteriano, por la toma de antibióticos o por llevar dietas muy ricas en hidratos de carbono no digeridos, entre ellos, fructosa y sorbitol. El contenido elevado de este tipo de carbohidratos fermentables coincide también con lo descrito por Baranguán y cols. (19) respecto a su alto contenido en la dieta occidental actual. Por lo tanto, varios autores coinciden en que existen numerosos factores que podrían interactuar entre sí y empeorar la condición de los pacientes, por lo que se considera importante descartar las posibles causas que se pueda identificar y profundizar en otras.
Respecto a la intolerancia a carbohidratos por causas secundarias, Trelis y cols. (6) explican que en algunos casos la malabsorción de carbohidratos puede pasar de ser considerada una condición crónica a una patología con tratamiento específico, con lo cual, al curar la infección parasitaria que puede no estar diagnosticada se revierte la malabsorción secundaria provocada por el parásito. Por otro lado, Martínez y Nogueira (10) explican que un paciente puede presentar hipolactasia secundaria debido a enfermedades gastrointestinales, sin embargo, cuando existe predisposición genética de intolerancia a la lactosa, un daño en la mucosa podría causar hipolactasia de manera permanente. Frente a ello, los autores (10) mencionan que las pruebas genéticas para LNP permiten distinguir la intolerancia a la lactosa primaria de una alteración en la mucosa intestinal que provoca déficit temporal de la enzima lactasa.
Por otro lado, eliminar la lactosa de manera innecesaria podría empeorar los síntomas de intolerancia a este carbohidrato al alterar la microbiota intestinal de pacientes con deficiencia de lactosa. Forsgård (13) recomienda mantener el consumo de lactosa de acuerdo con la tolerancia de los pacientes a pesar de su predisposición genética. Su teoría explica que el consumo de lactosa promueve una adaptación colónica de las bacterias intestinales, que al aumentar y mejorar la metabolización de este carbohidrato reducen los síntomas intestinales propios de la intolerancia. Por lo tanto, es posible mantener la lactosa como parte de la dieta de los pacientes de acuerdo con su umbral de tolerancia y respetando su deseo de introducirla o no. Esto es así especialmente en pacientes con predisposición genética de lactasa persistente (LP) en los cuales se ha identificado y resuelto la causa primaria de inflamación y alteración de la mucosa intestinal.
Una vez descartadas las posibles causas secundarias (o de manera paralela, si es posible, para optimizar el tiempo de atención y tratamiento al paciente), el siguiente paso de acuerdo con el algoritmo es explorar las causas primarias y realizar un estudio genético que permita pautar un tratamiento DN adecuado a largo plazo a fin de descartar otras posibles causas del TGIC y, sobre todo, evitar dietas altamente restrictivas de manera permanente cuando no son necesarias, entre ellas, la dieta libre de gluten y/o lactosa.
Prácticamente todas las personas que presentan EC poseen en su genoma al menos uno de los genes asociados con esta patología, HLA DQ2 y HLA DQ8. Por ello, las pruebas genéticas cumplen con la función de descartar la posibilidad de desarrollar EC en caso negativo, pero en caso positivo solo indican predisposición genética de EC sin arrojar un diagnóstico definitivo. Las pruebas genéticas tienen la ventaja de ser efectivas independientemente de factores externos como la ingesta de gluten, parasitosis o patologías concomitantes como el SII (11). Sierra et al. (12) indican que la ausencia de predisposición genética para desarrollar EC excluye con una alta probabilidad el diagnóstico de esta patología, lo cual permite centrarse en buscar otras alteraciones gastrointestinales que pueden presentarse con síntomas similares. Además, la EC se presenta cada vez más con síntomas digestivos inespecíficos y formas menos sintomáticas, e incluso a través de manifestaciones extraintestinales, por lo que poder descartarla ya es un paso hacia adelante. En el caso de pacientes no diagnosticados con EC, encontrar el origen de una intolerancia secundaria no solo solucionaría la sintomatología del paciente, sino que permitiría identificar una patología de base no diagnosticada y descartar situaciones inmunomediadas potencialmente graves, como la EC o algunos casos de alergias alimentarias (5). Por lo antes mencionado, es importante entender el origen para pautar un tratamiento DN adecuado. En casos como el de la EC, la dieta libre de gluten tendrá que ser de por vida, pues actualmente el único tratamiento efectivo para EC es la eliminación total del gluten en la dieta (8,11,12, 23), para lo cual es conveniente tener mayor certeza antes de pautar dietas restrictivas que puedan alterar el estilo de alimentación de los pacientes.
Finalmente, en caso de que los resultados de las pruebas de aire espirado y parásitos y el estudio genético sean negativos, se procede a solicitar otro tipo de pruebas y análisis a fin de identificar causas menos frecuentes del cuadro sintomático del paciente. Entre ellas, podemos considerar IgE total, IgE específica (trigo, proteína de la vaca, tropomiosina, Anisakis, proteína LTP, etc.) y sensibilidad no celiaca al gluten, siempre acompañadas de la respectiva educación alimentaria y del tratamiento DN específico cuando se requiera.
Como se mencionó al inicio de la discusión, la educación alimentaria para mejorar la calidad de la dieta de todos los pacientes es un eje transversal en este algoritmo. Los nutrientes más comúnmente asociados con los TGIC y sus síntomas son fibras, grasas y carbohidratos. Los resultados del trabajo de Schnabel y cols. (4), consistentes con otros estudios, muestran que en la dieta actual ha aumentado el consumo de alimentos ultraprocesados junto con la ingesta total de energía, consumo de grasas saturadas, carbohidratos y sodio, mientras que a su vez ha disminuido el contenido de fibra en la dieta. Por su parte, Grez y cols. (18) mencionan que el alto contenido de FODMAP en la dieta occidental actual en forma de jarabes y edulcorantes, junto con el bajo aporte de fibra, son factores que contribuyen a desarrollar y/o agravar los síntomas GI que afectan cada vez a mayor población.
CONCLUSIONES
Utilizar pruebas genéticas, analizar la presencia de parásitos y SIBO, así como evaluar la tolerancia de ciertos carbohidratos como la lactosa o la fructosa permiten no solo paliar los síntomas, sino tratar también el origen y ser más específicos en cuanto a las recomendaciones, de manera que el DN pueda tener una guía para valorar en qué casos se debería considerar o no la reintroducción de ciertos grupos de alimentos y evitar posibles restricciones permanentes.
Para el manejo de cualquier patología, primaria o secundaria, es indispensable analizar la calidad de la dieta del paciente y sus hábitos alimentarios y proveer educación alimentaria para fortalecer y/o establecer las bases de una alimentación saludable.
Respecto a las dietas restrictivas, tanto la dieta FODMAP como la dieta baja en fructosa deben seguirse durante un periodo de tiempo limitado y ser supervisadas por una nutricionista o personal sanitario especializado que facilite la reintroducción gradual de alimentos variados en la dieta del paciente.
Por otro lado, en dietas como la libre de gluten o lactosa se debe recalcar la importancia de seguirlas de manera estricta y ofrecer alternativas a los pacientes para que puedan llevar dietas igualmente variadas, equilibradas y que se adapten a su estilo de vida y alimentación.
Teniendo en cuenta el deterioro de la calidad en la alimentación de nuestra sociedad actual, enseñar a los pacientes a mantener una alimentación saludable y variada es fundamental, tanto para el control de síntomas como para la prevención de patologías a mediano y largo plazo.
Una de las limitaciones de esta investigación es la escasez de estudios prospectivos de casos control que evalúen la utilidad de las distintas estrategias diagnósticas-terapéuticas. Es necesario realizar este tipo de trabajo para mejorar la eficacia y calidad del tratamiento que requieren los pacientes.














