INTRODUCCIÓN
La anorexia nerviosa (AN) es un trastorno mental complejo y grave, caracterizado por una imagen corporal distorsionada, miedo a aumentar el peso y una extrema restricción de la ingesta de alimentos, acompañada de una severa pérdida de peso y comorbilidades psiquiátricas. Puede clasificarse en dos subtipos, restrictivo o purgativo. Mientras que el subtipo restrictivo se caracteriza por inanición e hiperactividad física frecuente, el subtipo purgativo se define por vómitos autoinducidos y abuso de laxantes y/o diuréticos (1).
Esta enfermedad se presenta principalmente en niñas adolescentes o mujeres jóvenes. Se ha estimado que la AN tiene una prevalencia del 1,4 % para las mujeres y del 0,2 % para los hombres (2). Algunos autores sugieren un incremento importante de la prevalencia en la mayoría de los países en los últimos años. Sin embargo, otros atribuyen este aumento al cambio en los criterios aplicados según el Manual Diagnóstico y Estadístico de los Trastornos Mentales (DSM-IV a DSM-V). Es una enfermedad con un importante subdiagnóstico debido a la negación, el estigma y la vergüenza que acompaña a muchos pacientes que la padecen. La AN tiene la tasa de mortalidad más alta de todas las enfermedades psiquiátricas, la cual es 10-12 veces superior a la de la población general (3). La eficacia actual del tratamiento es limitada, y el 40 % de las personas afectadas siguen mostrando sintomatología relevante después de diez años de iniciado el trastorno de la conducta alimentaria (TCA) (4).
Se considera una enfermedad multifactorial en la que participan factores individuales, familiares y culturales (sexo, edad, baja autoestima, insatisfacción con la imagen corporal, características familiares, presión social y cultural por la delgadez); factores biológicos (genéticos, de regulación de la conducta alimentaria); y otros como la práctica de actividad física, padecer determinadas enfermedades crónicas metabólicas y digestivas o la realización de dietas para la pérdida de peso sin control. Asimismo, en los últimos años se ha puesto el foco en la disbiosis intestinal y su posible relación con diferentes alteraciones con las que nos encontramos en estos pacientes, que podrían tener un papel como factor causal o bien, ser una alternativa de tratamiento (Fig. 1).
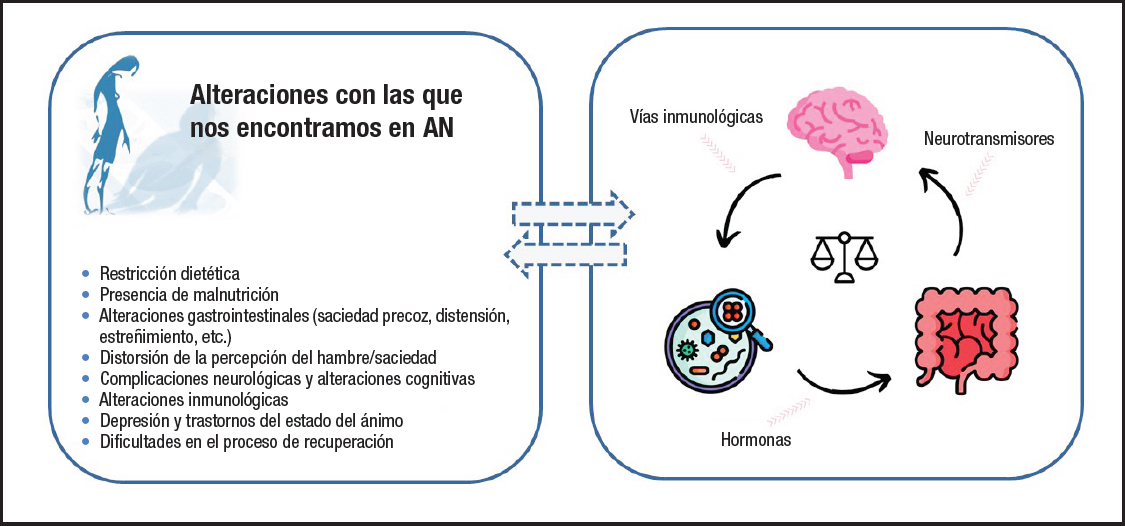
Figura 1. Disbiosis intestinal y su relación con las alteraciones observadas en pacientes con anorexia nerviosa.
El objetivo de este trabajo ha sido revisar el estado actual del conocimiento de las alteraciones en la microbiota intestinal identificadas en pacientes con AN y la posibilidad del uso de probióticos como alternativa terapéutica en el abordaje de esta enfermedad.
MICROBIOTA Y DISBIOSIS
La microbiota intestinal es un ecosistema compuesto por bacterias, arqueas, microeucariotas (incluidos hongos y protozoos) y virus, que viven en relaciones simbióticas dentro del huésped (5).
Cada persona tiene un ecosistema intestinal único y muy dinámico que depende de diferentes relaciones entre genética y medio ambiente. Las similitudes en la composición microbiana y las funciones entre individuos sanos sugieren una microbiota central que se necesita para la salud del huésped (6).
Muchas enfermedades están relacionadas con el desequilibrio de la microbiota normal, que se conoce como disbiosis (5). Así, la disbiosis se define como la pérdida o desequilibrio del estado de simbiosis fisiológica entre microbiota y hospedador por alteración de la estructura y las funciones de las congregaciones microbianas (7). Esta alteración se caracteriza por la proliferación de microbios endógenos benignos, la pérdida de comensales y la pérdida de diversidad microbiana o sus combinaciones. La composición de la microbiota y sus metabolitos asociados pueden verse influenciados por muchos factores, como la dieta, la higiene, la ubicación geográfica, el genotipo del huésped, la edad, los medicamentos, etc. (5).
La restricción calórica, el desequilibrio entre los macronutrientes consumidos, así como la ansiedad y el estrés que a menudo acompañan a la AN, pueden alterar la microbiota normal del hospedador (8).
ALTERACIONES DE LA MICROBIOTA INTESTINAL EN PACIENTES DIAGNOSTICADOS DE ANOREXIA NERVIOSA
La microbiota intestinal desempeña una tarea fundamental en el mantenimiento de un peso adecuado, así como en el adecuado aprovechamiento de la energía de la dieta. La alteración en la composición de la dieta también puede provocar cambios significativos en la microbiota (9). Así, por ejemplo, se ha descrito que la restricción de alimentos en pacientes con trastornos alimentarios cambia la disponibilidad de sustratos energéticos (tipo, cantidad y duración) para los microbios intestinales y conduce a distintos perfiles microbianos. Durante el ayuno prolongado, comparable a la restricción alimentaria a la que se someten los pacientes con AN, los microorganismos que utilizan las mucinas intestinales del huésped pueden desarrollarse en ausencia o escasez de nutrientes (10).
Lam y cols. (2017) observaron que la abundancia de los taxones degradadores de mucina aumentaba significativamente en los pacientes con AN al inicio del tratamiento y volvía a niveles similares a los de los controles sanos después del aumento de peso. La consecuencia del recorte energético crónico en personas con AN parece producir una simplificación en la diversidad de congregaciones de microbios intestinales que frecuentemente se relaciona con los malos resultados clínicos obtenidos en estos pacientes (10). Se ha visto también que la microbiota intestinal actúa en el control del apetito. Uno de los efectos es el impacto de las bacterias intestinales en la elaboración y desempeño de las hormonas moduladoras del hambre. Las células endocrinas expresan receptores tipo Toll que, al unirse a elementos bacterianos, se activan (por ejemplo, lipopolisacáridos [LPS]) y, además, transforman la secreción de hormonas (como la colecistoquinina) que regulan el apetito y la saciedad. De la misma forma, existe evidencia de que las bacterias intestinales, especialmente mediante la producción de LPS, modulan efectos del sistema nervioso central (SNC) sobre la ingesta de alimentos, la función gastrointestinal y la homeostasis energética (10).
Los primeros estudios de casos en personas con AN mostraron once nuevas especies bacterianas clasificadas en Firmicutes, Bacteroidetes y cuatro nuevas especies de microeucariotas, en una sola muestra fecal, lo que demuestra el estado de disbiosis que pueden presentar estos pacientes. Se ha observado un incremento del género Methanobrevibacter en pacientes con AN que podría estar asociado con un mecanismo adaptativo para una dieta hipocalórica y que podría explicar una obtención de energía y calorías más eficiente y aumentada en AN. El resultado sería un incremento de la eficiencia energética y metabólica generada por una dieta hipocalórica, lo que permite subsistir con aportes de energía muy bajos. Asimismo, el ambiente deficiente en nutrientes, junto con un tránsito del colon retrasado en pacientes con AN, favorece el aumento de microorganismos degradadores de mucina (por ejemplo, Akkermansia muciniphila y Methanobrevilacter smithii), que contribuirán a una barrera intestinal debilitada y a una inflamación crónica de bajo grado, que puede provocar mayor gravedad de la enfermedad. Es por ello que el perfil de la microbiota en la AN se ha relacionado con la presencia de inflamación intestinal y el deterioro de la estructura de la capa epitelial, que se pone de manifiesto por los valores aumentados de interleucina-6 (IL-6) encontrados en pacientes con AN (11).
También se ha observado que los microorganismos productores de butirato (como Roseburia spp.) disminuyen y se ha sugerido que la cantidad de este junto a otros ácidos grasos de cadena corta podrían ser un marcador clave por su función mediante el mantenimiento de la barrera intestinal y por producir una mejora en la regulación del apetito y en la presencia de los síntomas psicológicos (12). La fermentación de estos microorganismos favorece un aumento en la producción de péptido gástrico (PYY), el cual está caracterizado por disminuir el apetito y aumentar los síntomas de depresión (13).
EJE INTESTINO-CEREBRO Y SU IMPLICACIÓN EN LA ANOREXIA NERVIOSA
El eje intestino-cerebro, conectado a través de vías neuronales, hormonales e inmunológicas, es un sistema de comunicación bidireccional entre la microbiota y el SNC que, si sufre un desequilibrio, puede favorecer la aparición de disbiosis intestinal (10). Diferentes estudios han identificado la importante relación que existe entre la microbiota intestinal y la regulación del peso corporal, por un lado, y los estados psicológicos, como la depresión y la ansiedad, por otro. Esto podría tener especial interés en el desarrollo de intervenciones innovadoras para pacientes con enfermedades psiquiátricas, y en particular, para AN (14).
Las bacterias intestinales interactúan con el SNC mediante la síntesis de neurotransmisores como, por ejemplo, la dopamina, la serotonina, el ácido gamma aminobutírico (GABA), la acetilcolina y el glutamato, y responden a hormonas. Además, como se explicó anteriormente, la diversidad microbiana intestinal también se asocia con la desregulación del apetito debido a la capacidad de influir en las vías de saciedad intestinal (11).
Los efectos de las bacterias del intestino en el comportamiento están regulados mayoritariamente por sus acciones en el eje hipotalámico-pituitario-suprarrenal (HPA), que es un importante sistema neuroendocrino que regula la respuesta a los factores de estrés tanto psicológicos como físicos y es clave en la etiología y el desarrollo de los trastornos alimentarios (10).
PROBIÓTICOS Y SUS FUNCIONES EN LA MICROBIOTA INTESTINAL
La Asociación Científica Internacional de Probióticos y Prebióticos (ISAPP) define los probióticos como microorganismos vivos que, cuando se administran en cantidades adecuadas, confieren beneficios para la salud del huésped (15-16). Se relacionan con el bienestar del hospedador, ya que afectan a la microbiota en la que se encuentran, a las células del epitelio intestinal y, a nivel general, al sistema inmune. Ejercen sus efectos beneficiosos a través de varios mecanismos, que incluyen la reducción del pH intestinal, la disminución de la colonización y la invasión de organismos patógenos y la modificación de la respuesta inmunitaria del huésped (17).
Los probióticos son una terapia poco invasiva para manipular la microbiota intestinal, y la evidencia clínica preliminar sugiere que la administración oral de determinadas cepas bacterianas podría tener efectos beneficiosos sobre el estado de ánimo y la función gastrointestinal. Dichos resultados han generado interés en el uso potencial de la suplementación con probióticos como coadyuvante de la terapia estándar de AN, ya que podrían ayudar a abordar las comorbilidades que a menudo complican la recuperación (18).
Estudios relevantes se centran en varias cepas, desde los probióticos comunes, como las bacterias Lactobacillus y Bifidobacterium o la levadura Saccharomyces boulardii, hasta modelos más recientes, como Akkermansia muciniphila y Faecalibacterium prausnitzii. Todos estos candidatos han reforzado la barrera intestinal, reducido la inflamación y, finalmente, mejorado la homeostasis de la glucosa (17).
Bifidobacterium spp. y Lactobacillus spp. producen GABA, que se relaciona con el control de la ansiedad; y Enterococcus spp., Streptococcus spp., Escherichia spp. y Candida spp. producen serotonina, un neurotransmisor involucrado en la regulación del estado de ánimo, y también Bacillus spp., productor de dopamina. En general, las bacterias Gram-negativas producen lipopolisacáridos bacterianos que, como se mencionó anteriormente, intervienen en la regulación de la ingesta de alimentos, pudiendo afectar los comportamientos alimentarios y la pérdida de peso (11).
INFLUENCIA DE LA DISBIOSIS EN LA FUNCIÓN COGNITIVA DE LOS PACIENTES CON ANOREXIA NERVIOSA
Las enfermedades psiquiátricas y del neurodesarrollo se asocian sistemáticamente con un estado de disbiosis. Los microbios intestinales se necesitan para que el cerebro funcione de manera normal (10).
En varios estudios se ha evaluado el funcionamiento neuropsicológico en individuos con trastornos de la alimentación y un elevado número de ellos apoya la hipótesis de que los adolescentes que presentan trastornos de la alimentación pueden padecer también, de forma subyacente, un déficit en el desarrollo de la función cognitiva. No obstante, muchos de los autores que encontraron resultados positivos explican sus hallazgos sugiriendo que los deterioros cognitivos observados resultan como consecuencia de la inanición y que pueden revertir mediante una nutrición adecuada (19).
En un estudio se demostró que los pacientes con AN sufren una pérdida significativa del volumen cerebral, tanto de materia gris como de la blanca, lo que se asocia a deficiencias neuropsicológicas y malos pronósticos clínicos (13).
Los déficits en la función cognitiva de la AN pueden ser de causa multifactorial y estar asociados a la malnutrición. En un estudio realizado por Loria-Kohen y cols. (2012), en el que se evaluaba el estado cognitivo a través de la prueba de Stroop en un grupo de pacientes con trastorno de la conducta alimentaria (TCA), se observó que un tercio de ellos estaban por debajo de las puntuaciones medias de sujetos sanos de la misma edad (20). Estas alteraciones cognitivas pueden dificultar la eficacia del tratamiento y contribuir a la cronicidad de la enfermedad.
Por lo tanto, se puede suponer que los adolescentes que presentan déficits neuropsicológicos en áreas del desarrollo cognitivo, incluidos el funcionamiento ejecutivo y la atención, son incapaces de desarrollar estrategias de resolución de problemas a las interacciones sociales y, por lo tanto, desarrollan conductas alimentarias desadaptativas como un medio para lidiar con el conflicto del desarrollo personal (19).
Existe evidencia en estudios en animales que sugiere que las variaciones en la composición de la microbiota intestinal del huésped pueden modular el estrés oxidativo y la producción de factores neutrófilos derivados del cerebro, ambos implicados en la función cognitiva (21).
USO DE PROBIÓTICOS COMO ALTERNATIVA TERAPÉUTICA EN ANOREXIA NERVIOSA
Estudios muestran que los probióticos pueden alterar los procesos cognitivos y emocionales que modulan los comportamientos y los procesos cerebrales mediante el eje intestino-cerebro en modelos animales (14).
La suplementación probiótica con Lactobacilos y Bifidobacterias, al estimular un mecanismo de alimentación cruzada y aumentar la abundancia de Roseburia y la producción de butirato, mejoraría el desequilibrio en la estructura intestinal de pacientes con AN (11).
Además, la administración de Lactobacillus y Bifidobacteria, en un estudio, disminuyó los niveles de hormona corticoide circulante tanto en humanos como en ratas, lo que acentuó más el papel que la microbiota tiene en la regulación del estrés (13). Como se ha mencionado previamente, el estrés oxidativo puede inducir la muerte de las células neuronales y causar disfunción cognitiva (21), por lo que la administración de estos probióticos podría ser una opción de tratamiento útil en la AN (13).
En este momento, existe un gran número de estudios observacionales desarrollados en los últimos años que muestran un patrón de microbiota alterada en personas con TCA (13). Sin embargo, según nuestro conocimiento, a fecha actual, no se han desarrollado aún estudios controlados y aleatorizados que permitan valorar la efectividad del uso de probióticos sobre el estado nutricional, la función cognitiva o la disbiosis intestinal. Se ha desarrollado solamente un estudio en el que se evalúa la administración de probiótico sobre el estreñimiento (22).
En este estudio, de Žaja y cols., no se encontró evidencia significativa de alivio del estreñimiento en los tres primeros meses de evaluación entre los grupos administrados con probiótico Lactobacillus reuteri y los que recibieron placebo. Sin embargo, después de seis meses de estudio, sí que hubo diferencia estadística suficiente en la frecuencia de deposiciones, cuyo número había aumentado en los pacientes con probiótico, pero no en la consistencia de estas (22).
También se ha publicado recientemente el inicio de un proyecto que pretende comparar la eficacia clínica de la administración de probióticos multicepa junto con el tratamiento habitual de la AN, en comparación a pacientes con AN que recibirán placebo. Dicho estudio incluye evaluaciones periódicas, cada seis meses, además de evaluaciones sobre el aumento del peso, las molestias gastrointestinales y la psicología. Si este método sirviese de mejora, supondría un tratamiento fácilmente aplicable a estos pacientes y podría ayudar en la estabilización de muchos de los síntomas que presentan (14).
CONCLUSIONES
Si bien quedan muchas respuestas por descubrir, la disbiosis intestinal parece jugar un rol importante, ya sea como causa o como consecuencia de muchas de las alteraciones que se observan en los pacientes con AN. La microbiota intestinal representa un verdadero “órgano” con funciones específicas y fundamentales para la protección, prevención y tratamiento de muchos trastornos, entre los que también se incluyen los TCA. La modulación de la microbiota intestinal podría tener un papel crucial en las nuevas terapias para el tratamiento nutricional, por supuesto, de la mano de los tratamientos convencionales.














