INTRODUCCIÓN
Bajo el término trastornos de la conducta alimentaria (TCA) se engloba un conjunto de enfermedades mentales que comparten entre sí la presencia persistente de una alteración del comportamiento alimentario que afecta al estado nutricional y de salud, así como al funcionamiento psicosocial de las personas que lo padecen (1). La comida, la percepción de la propia imagen y el peso corporal se transforman en los elementos centrales de la vida de las personas con TCA, relegando el resto de los aspectos a un segundo plano.
En la actualidad, con base en la última versión del Manual diagnóstico y estadístico de los trastornos mentales (DSM-5), se distinguen tres entidades diferenciales, como son la anorexia nerviosa (AN), la bulimia nerviosa (BN) y el trastorno por atracón (TA). Además, se identifican las denominadas formas atípicas de los TCA, como especificados y no especificados.
La AN constituye un trastorno psiquiátrico grave caracterizado por la restricción alimentaria y la desnutrición, la elevada incidencia de comorbilidades psiquiátricas, resistencia al tratamiento y un riesgo elevado de mortalidad como consecuencia de las complicaciones médicas y del suicidio (2). Aspectos relevantes, como su prevalencia creciente, el infradiagnóstico, el elevado número de factores que intervienen en su desarrollo, la alta prevalencia de comorbilidades psiquiátricas y no psiquiátricas, las complicaciones médicas derivadas de la desnutrición/restricción/conductas compensatorias inadecuadas, etc., hacen necesario un enfoque multidisciplinar y experto, así como el compromiso por parte de las instituciones sanitarias y de las sociedades científicas en la formación específica de los distintos profesionales implicados.
JUSTIFICACIÓN PARA LA ACTUALIZACIÓN DEL DOCUMENTO
En el año 2018 se publicó el consenso sobre la evaluación y el tratamiento nutricional de los TCA con el aval de la Sociedad Española de Nutrición Clínica y Metabolismo (SENPE) en forma de suplemento específico en la revista órgano de la sociedad (1).
El Grupo de Trabajo de los Trastornos de la Conducta Alimentaria ha seguido trabajando desde su formación hasta la fecha con el objetivo de profundizar en el manejo multidisciplinar de los TCA mediante publicaciones en revistas, documentos de consenso, representación en los congresos nacionales, etc. En este sentido, destaca el protocolo de educación nutricional (EN) en el tratamiento de los TCA en el ámbito clínico y asistencial (3), así como el documento de consenso para la prevención de los TCA de SENPE- SENC (Sociedad Española de Nutrición Comunitaria)-SEPEAP (Sociedad Española de Pediatría Extrahospitalaria y Atención Primaria)-SEMERGEN (Sociedad Española de Médicos de Atención Primaria) (4).
A tenor de las observaciones y de las consideraciones por parte de los miembros actuales de este grupo de trabajo en torno a las muchas novedades acontecidas en los últimos años en el abordaje de estos trastornos, se consideró pertinente de forma unánime la actualización del consenso que, pese a contener información con plena vigencia, requería de la actualización de algunos aspectos importantes para la prevención, el diagnóstico, el tratamiento o el abordaje de las complicaciones, entre otros. También de forma consensuada y, dado que en el consenso anterior ya se separaron las distintas entidades en varias publicaciones, esta actualización se centrará de forma específica en la AN. En la elaboración del actual documento se ha considerado oportuno que la lectura de los apartados por separado ofrezca la información necesaria para la comprensión del texto. Esto conduce inevitablemente a la reiteración de determinados conceptos, lo que redunda en la extensión final del documento.
MAGNITUD DEL PROBLEMA
Los estudios epidemiológicos centrados en la prevalencia de los TCA son escasos y, por lo general, costosos y altamente ineficaces por el infradiagnóstico. Ello responde a distintos factores, como la negación de la enfermedad, la falta de búsqueda de ayuda, el estigma social asociado (especialmente en la AN), la edad de presentación o la respuesta social positiva a la delgadez o a la pérdida de peso. Una revisión reciente sobre la prevalencia de AN y BN señala una tendencia estable de la AN en los últimos años, con un incremento de la incidencia en sujetos menores de 15 años (5), aunque no parece factible identificar si esto responde a un mayor diagnóstico precoz o se trata de un “adelantamiento” de la edad de inicio.
Una revisión sistemática de la literatura centrada en el periodo 2000-2018 sobre la prevalencia de los TCA, que incluye un total de 94 estudios, señala datos de prevalencia por diagnóstico de AN (datos puntuales) del 2,8 % en mujeres y del 0,3 % en varones (6).
La pandemia por COVID-19 tuvo un impacto no desdeñable en los sujetos con TCA. Se ha constatado a nivel clínico un recrudecimiento de los síntomas, así como de su gravedad. Una revisión sistemática y un metaanálisis de 16 estudios pone de manifiesto el deterioro clínico de los pacientes con TCA durante la pandemia, especialmente con AN, con mayor gravedad, mayor repercusión nutricional, más complicaciones y mayor necesidad de hospitalización (7).
Otro aspecto relevante es la prevalencia de riesgo de TCA, es decir, la valoración de la presencia de conductas consideradas de riesgo y que podrían evolucionar hacia un TCA establecido. Para ello se utilizan cuestionarios autoevaluados administrados a los propios pacientes. Las publicaciones en relación con el riesgo de TCA son escasas. Recientemente se ha publicado una revisión sistemática centrada en estudiantes de medicina que establece una prevalencia del riesgo de TCA, basada en el cuestionario Eating Attitude Test-26 (EAT 26), del 10,5 % (8).
La incidencia de AN en mujeres ha sido objeto de análisis en una revisión sistemática y en un metaanálisis de 31 estudios (9). El rango de incidencia observado fue de 0,5-318 casos por cada 100 000 mujeres/año, con diferencias en función de los datos consultados (una incidencia mayor en los estudios basados en registros de sistemas sanitarios sobre mujeres atendidas en el medio ambulatorio que en los referidos a ingresos hospitalarios).
CRITERIOS DIAGNÓSTICOS PARA LA ANOREXIA NERVIOSA
Los criterios diagnósticos de los TCA han venido actualizándose de la mano de la Asociación Americana de Psiquiatría (American Psychiatric Association - APA) a través del DSM y de la Organización Mundial de la Salud (OMS) mediante la Clasificación Internacional de Enfermedades (CIE). Se dispone de una última versión, publicada en 2013, en el caso del DSM-5, y en 2019 para el CIE-11. En la práctica clínica habitual, los criterios diagnósticos más empleados son los propuestos por el DSM-5 (10) (Tabla I).
Tabla I. Criterios diagnósticos de la anorexia nerviosa según DSM-5
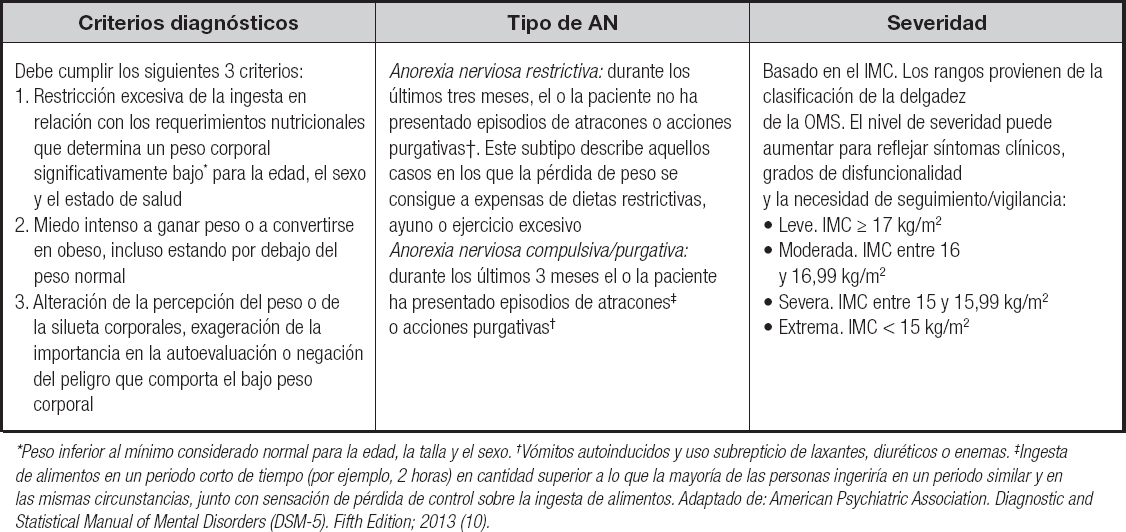
*Peso inferior al mínimo considerado normal para la edad, la talla y el sexo. †Vómitos autoinducidos y uso subrepticio de laxantes, diuréticos o enemas. ‡Ingesta de alimentos en un periodo corto de tiempo (por ejemplo, 2 horas) en cantidad superior a lo que la mayoría de las personas ingeriría en un periodo similar y en las mismas circunstancias, junto con sensación de pérdida de control sobre la ingesta de alimentos. Adaptado de: American Psychiatric Association. Diagnostic and Statistical Manual of Mental Disorders (DSM-5). Fifth Edition; 2013 (10).
La CIE-11 es la actualización más reciente. En ella se define la AN como (11):
− Peso corporal significativamente bajo para la altura, la edad y la etapa de desarrollo del sujeto, que no se debe a otra afección de salud o a la falta de disponibilidad de alimentos. Se propone un umbral de índice de masa corporal (IMC) inferior a 18,5 kg/m2 en adultos y un IMC para la edad por debajo del percentil 5 en niños y adolescentes. La pérdida rápida de peso (por ejemplo, más del 20 % del peso corporal total en 6 meses) puede reemplazar al bajo peso corporal siempre que se cumplan otros requisitos. En los niños y en los adolescentes, en lugar de la pérdida de peso puede observarse una incapacidad para ganar el peso al ritmo esperable para su edad y su sexo.
− Patrón persistente de comportamiento dirigido a evitar la restauración del peso normal mediante la restricción alimentaria, comportamientos purgativos o comportamientos destinados a incrementar el gasto energético, típicamente asociados a un miedo intenso a la ganancia ponderal.
− El bajo peso o la figura corporal son elementos centrales para la autoevaluación de la persona o se perciben inadecuadamente como normales o incluso excesivos.
A efectos de la codificación se diferencian aquellos casos de AN con peso normal, significativamente bajo (IMC de entre 14 y 18,5 kg/m2 en adultos y entre el percentil 3 y 25 para la edad en niños) y peligrosamente bajo (IMC < 14 kg/m2 adultos y < percentil 3 para la edad en niños) y los subtipos restrictivos y de atracón y purga (11).
El concepto de AN atípica es un término que se encuentra frecuentemente en la literatura, pero cuyos criterios no están estandarizados, lo que resulta en un concepto impreciso (12,13). Este término se encuentra codificado como F50.1 en la CIE-10 y hace referencia a aquellos pacientes en los que una o más características de la AN (según criterios CIE-10: F50.0) están ausentes (por ejemplo, la amenorrea o la pérdida significativa de peso) (14). Con los nuevos criterios diagnósticos de AN de la CIE-11, hay pacientes que, según CIE-10, eran diagnosticados de AN atípica, pero que cumplen criterios de AN con los nuevos requisitos. En el DSM-5 el término se encuentra recogido dentro del apartado de “otros trastornos de la conducta o de la ingesta de alimentos especificados”, en el que la AN atípica se establece cuando se cumplen todos los criterios para la AN, excepto que, a pesar de la pérdida significativa de peso, el peso está dentro o por encima del intervalo normal.
DIAGNÓSTICO DIFERENCIAL CON OTRAS ENFERMEDADES Y TRASTORNOS DEL COMPORTAMIENTO ALIMENTARIO
Con frecuencia, los sujetos con TCA presentan ciertas características clínicas que permiten llegar al diagnóstico de sospecha de un trastorno alimentario. En el caso de la AN, el bajo peso, la restricción alimentaria a pesar de este, la exclusión predominante de ciertos alimentos y la edad de aparición, así como ciertos rasgos de personalidad o conducta, suelen ser de utilidad para establecer la sospecha diagnóstica. Sin embargo, en ocasiones puede ser necesario contemplar otras entidades. Este diagnóstico diferencial suele venir orientado por dos grandes grupos de síntomas: de un lado, los de índole mental, y de otro, los relacionados con las variaciones drásticas de peso o alteraciones conductuales en lo referente a la dieta.
La comorbilidad psiquiátrica entre los pacientes con AN es relativamente elevada, circunstancia que, además del tratamiento, puede dificultar el diagnóstico, en tanto que puede resultar complejo establecer si la sintomatología psiquiátrica refleja la presencia de diagnósticos psiquiátricos previos o, por el contrario, es el resultado del propio TCA. A nivel psiquiátrico debe establecerse el diagnóstico diferencial con el trastorno depresivo mayor, fobias sociales, trastornos de conversión, abuso de sustancias, trastorno obsesivo compulsivo (TOC), etc.
Los cambios bruscos de peso podrían explicarse por la presencia de enfermedades como la diabetes no controlada, la insuficiencia suprarrenal, el hipertiroidismo, procesos neoplásicos, enfermedades infecciosas graves o cuadros de malabsorción grave. Por otro lado, los sujetos con TCA, con frecuencia, presentan sintomatología digestiva secundaria a las irregularidades propias de la conducta alimentaria, que constituyen, de hecho, un motivo inicial frecuente de consulta médica. Por ello, es importante mantener un elevado nivel de sospecha en pacientes con sintomatología digestiva florida, que limita de forma significativa la ingesta, pero sin organicidad que lo justifique (15). También es importante recordar que patologías digestivas, como la celiaquía o la enfermedad inflamatoria intestinal, pueden dar lugar a modificaciones de la dieta que actúen como factores de riesgo o precipitantes de un TCA.
HERRAMIENTAS DE CRIBADO EN TCA
La sospecha clínica en este grupo de trastornos es altamente valiosa, con base en la complejidad inherente al manejo una vez están establecidos. Es muy importante conocer los signos de alerta para realizar una detección y un tratamiento precoces. Estos signos de alerta son (16,17):
− Alteración de las curvas de crecimiento y del desarrollo puberal.
− Pérdida no justificada de peso.
− Disminución de las ingestas o realización de ayunos, cambios en la alimentación con restricción de alimentos de modo progresivo, ingestas cada vez más lentas, con troceado pequeño y esparcido por el plato, esconder o tirar alimentos, rechazo a comer los mismos alimentos que el resto de la familia y querer prepararse sus propias comidas.
− Mostrar excesivo interés por la actividad física y la alimentación saludable, frecuentación habitual de páginas web o de redes sociales de dietas, control de las calorías, de grasas y de azúcares de los alimentos, leer minuciosamente las etiquetas de cada alimento que ingieren y consumir alimentos light.
− Aumento significativo de la actividad física (camina mucho, sube y baja escaleras, le cuesta permanecer sentado, etc.).
− Es frecuente la negación de problemas alimentarios. Sin embargo, muestran gran preocupación por los síntomas somáticos asociados (estreñimiento, sensación de plenitud, pirosis y mareo).
− Cambios del estado de ánimo, alteraciones del sueño y tendencia al aislamiento.
− Dedicación de mayor tiempo al estudio y a actividades supuestamente útiles; rituales relacionados con el orden y la limpieza. Aparición de ansiedad si se alteran sus rituales.
− Consumo de laxantes, uso de diuréticos, medicación no pautada o productos herbolario. Presencia de vómitos autoinducidos.
− Cambio en la forma de vestir a ropas muy anchas o, por el contrario, prendas que marcan la silueta.
Los atracones suelen ocurrir cuando están solos, por lo que los padres pueden detectar que desaparece comida, que el paciente va al baño después de comer, presencia de restos de alimentos o vómitos en habitación o señales físicas de purga.
En la actualidad se dispone de distintos cuestionarios dirigidos a evaluar el riesgo de padecer un TCA, como el cuestionario SCOFF (de las siglas en inglés Sick Control on Fat Food), el EAT-26 (por sus siglas en inglés, Eating Attitude Test-26) y el ChEAT-26 (por sus siglas en inglés Children Eating Attitude Test-26; adaptación del anterior para niños de entre 8 y 12 años).
La APA, en la cuarta edición de su guía de práctica clínica para el tratamiento de los TCA, recomienda la realización de un cribado como parte inicial de la entrevista psiquiátrica (18). Otros organismos, como el Grupo de Trabajo de Servicios Preventivos de los Estados Unidos (United States Preventive Services Task Force - USPSTF), ha publicado recientemente su posicionamiento sobre la utilización de las herramientas de cribado en el que concluye que, en la actualidad, la evidencia es insuficiente para establecer los riesgos o los beneficios de su realización en adolescentes y en adultos (19).
La detección precoz de los TCA es fundamental, dado que mejora el pronóstico. Para ello, es importante que profesionales sanitarios, como los médicos de Atención Primaria, pediatras, ginecólogos y gastroenterólogos, entre otros, conozcan los factores de riesgo (por ejemplo, mujeres adolescentes, deportistas, pacientes con diabetes mellitus de tipo 1 [DM1], etc.) y los síntomas o signos de alarma con el fin de poder identificar de forma temprana estos trastornos. Es recomendable tener protocolizada la actitud a seguir ante dicha sospecha.
Recientemente se ha publicado el consenso para la prevención de los TCA (4), en el que se revisa en profundidad la evidencia disponible en torno a los programas de prevención en distintos niveles asistenciales y no asistenciales.
ETIOPATOGENIA
La evidencia sugiere que existe una amplia gama de factores involucrados en la etiopatogenia de la AN, por lo que se trata de una patología de origen multifactorial en la que participan factores sociales, culturales, psicológicos, genéticos, psiquiátricos, biológicos y ambientales (20,21).
Los adolescentes y los adultos jóvenes son la población de mayor riesgo por grupo de edad. Su inicio puede estar relacionado con un acontecimiento vital estresante que actúa como detonante, por ejemplo, un problema familiar, una pérdida importante o un cambio de residencia (22,23).
Dentro de los factores que predisponen a su aparición se encuentran la presencia de un IMC bajo, la realización de dietas restrictivas (especialmente en la adolescencia), la internalización de los ideales de belleza y la negación de los costes de perseguirla, así como las expectativas positivas y la presión por la delgadez, que promueven la insatisfacción corporal y contribuyen a conductas de control de peso poco saludables (20,21). El uso de aplicaciones móviles que contabilizan calorías o de tipo fitness se ha asociado a mayores síntomas alimentarios alterados en adolescentes (24).
También se han descrito estados emocionales, patrones cognitivos y aspectos de la personalidad que pudieran adquirir relevancia en la etiopatogenia. Entre ellos se encuentran el miedo al abandono y a no ser amado, sentimientos de fracaso, de culpa o de vergüenza, impulsividad, perfeccionismo, rigidez, temor a la pérdida de control, tendencias obsesivas compulsivas y conductas narcisistas, así como la presencia de trastorno de ansiedad, personalidad límite, depresión o abuso (23). También se han descrito como factores de riesgo vivir en entornos familiares o sociales disfuncionales (20).
El impacto de la exposición, especialmente de los más jóvenes, a las redes sociales (RR. SS.) y su implicación en la conducta alimentaria debe tenerse en cuenta en los pacientes con AN. El empleo de RR. SS. se ha vinculado a una mayor insatisfacción corporal, a la restricción dietética, la impulsividad, el exceso alimentario y a elecciones de comida no saludables (25).
Además de los factores ambientales involucrados en la aparición de la AN, también pueden intervenir factores genéticos. Las investigaciones de asociación de todo el genoma han identificado loci específicos que demuestran su naturaleza familiar, con un rango de heredabilidad del 28-84 % (26). Dichas correlaciones genéticas implican factores tanto psiquiátricos como metabólicos en su origen (26-28).
En los últimos años, los estudios de los mecanismos fisiopatológicos implicados en la AN han incorporado como novedad la disbiosis intestinal y su potencial papel en la regulación del eje intestino-cerebro. Numerosos estudios han encontrado profundas diferencias en la composición microbiana intestinal de las personas con AN y bajo peso y sujetos sanos, aunque con una gran variabilidad y poca especificidad en los resultados. Por ejemplo, se ha identificado que el género Archaeon Methanobrevibacter smithii, que desempeña un papel importante en la digestión eficiente de los polisacáridos al consumir los productos finales de la fermentación bacteriana, se encuentra elevado en estos pacientes. Sin embargo, se desconoce en qué medida las alteraciones identificadas participan como causa o consecuencia de la enfermedad (29-31).
VALORACION MÉDICO-NUTRICIONAL EN LA ANOREXIA NERVIOSA
En los pacientes con AN, de forma paralela a la valoración psiquiátrica, debe realizarse una evaluación clínica y nutricional que incluya una historia clínica completa, con aspectos médicos y nutricionales, exploración física con datos antropométricos y pruebas complementarias (laboratorio, composición corporal, imagen, etc., según proceda). Esta valoración clínica y nutricional debe entenderse como un proceso continuo en el seguimiento evolutivo de estos pacientes y adaptarse, según se trate de una primera evaluación, de evaluaciones sucesivas o del entorno intra- o extrahospitalario.
HISTORIA CLÍNICA
Como en cualquier historia clínica debe preguntarse sobre los antecedentes personales de interés, tanto médicos (diabetes, hipotiroidismo, patología digestiva, etc.) como psiquiátricos o por el consumo perjudicial de sustancias. Es importante recoger información sobre antecedentes familiares de TCA o de otras enfermedades psiquiátricas (depresión, ansiedad, TOC, antecedentes de suicidio, etc.) y de patologías médicas, como obesidad grave o diabetes.
La anamnesis irá dirigida a recabar una serie de datos que, en buena medida, debe proporcionar el paciente, pero, siempre que sea posible, ha de intentarse obtener información adicional de otras fuentes, como el entorno familiar o los datos médicos recogidos en su historia clínica previa. Es muy frecuente que, aunque sea evidente la situación de desnutrición o de gravedad, el paciente no tenga conciencia de enfermedad, no entienda la necesidad de asistencia médica, minimice los posibles síntomas y no muestre una actitud colaboradora. Es fundamental tener una actitud empática y trabajar la confianza en la relación desde el contacto inicial.
Debe preguntarse sobre el inicio del cuadro que, aunque muchas veces es insidioso y sin un claro factor precipitante, otras sí está relacionado con algún acontecimiento vital, ya sea físico o de índole afectiva (ruptura sentimental, duelo, divorcio de los padres, etc.). En niños y adolescentes, el acoso escolar, el ciberacoso y la influencia de la información recibida a través de las RR. SS. adquiere una especial relevancia (32). Otro aspecto a tener en cuenta son los cuadros de incongruencia de género, particularmente en varones transexuales, en los que, a través de la pérdida ponderal mediante la restricción alimentaria u otras conductas compensatorias, se busca difuminar las formas femeninas o evitar la menstruación o la progresión de los cambios físicos en la etapa puberal (33).
Es importante conocer la evolución ponderal durante el proceso, incluyendo el peso mínimo y máximo, los cambios ponderales recientes, el peso habitual previo y el peso deseado por el paciente o aquel que le crea menor malestar. Documentar posibles pérdidas de talla en sujetos adultos hará sospechar aplastamientos vertebrales en relación con osteoporosis, sobre todo en pacientes de larga evolución. En el caso de niños y adolescentes, las curvas de peso y de talla darán información importante sobre eventuales retrasos de crecimiento asociados al TCA (34).
Otro aspecto importante es la presencia de conductas de control del peso, ya sean de tipo purgativo (vómitos, laxantes, enemas, diuréticos, preparados de herboristería, etc.), toma de fármacos (análogos del GLP1 [glucagon-like peptide 1] u hormonas tiroideas) o ejercicio físico excesivo. En pacientes con diabetes, la manipulación del tratamiento con la reducción de las dosis de insulina o la omisión de algunas de ellas, es una maniobra compensatoria frecuentemente observada y no siempre reconocida por el paciente.
Debe registrarse el tipo de actividad física y su duración e intensidad, así como la motivación del paciente para realizarla y sus sentimientos tanto tras su realización como cuando se les limita.
La AN repercute en la esfera sexual y reproductiva. Como frecuentemente el paciente con AN es una mujer joven, debe preguntarse por su historia menstrual, edad de la menarquia, si mantiene menstruaciones y sus características, y en caso de amenorrea, el tiempo de duración y si se ha prescrito tratamiento hormonal para tratarla. Asimismo, tanto en mujeres como en varones, puede haber disminución de la libido y clínica de disfunción sexual.
En la historia deben recogerse también las manifestaciones clínicas relacionadas con las comorbilidades y las complicaciones tanto médicas como nutricionales a nivel de los diferentes órganos y sistemas, en buena medida relacionadas con el grado de desnutrición, la posible presencia de cuadros carenciales y las maniobras purgativas (se detallarán más adelante, en el apartado de complicaciones).
HISTORIA NUTRICIONAL
Es fundamental preguntar sobre cambios en los patrones de ingesta y en la selección de alimentos. Ha de conocerse la cantidad y la calidad de los alimentos ingeridos, restringidos y evitados. Los pacientes suelen prescindir de aquellos de alta densidad calórica, grasa visible o ricos en carbohidratos, y tienden a preservar la ingesta de al menos una cantidad mínima de proteínas. La confección culinaria suele ser “sencilla”, evitando fritos y guisos. Es común, en los casos restrictivos, que el paciente esté ingiriendo menos de 1000 kcal al día durante meses. Algunos pacientes asumen tipos específicos de dieta: vegana/vegetariana, sin gluten, macrobiótica, paleolítica, etc., o incluyen alimentos poco habituales en nuestra alimentación tradicional. Pueden referir supuestas intolerancias alimentarias y no son raras las fobias o aversiones. En la tabla II se resume la caracterización del patrón alimentario en los pacientes con AN.
Tabla II. Caracterización del patrón alimentario de los pacientes con anorexia nerviosa
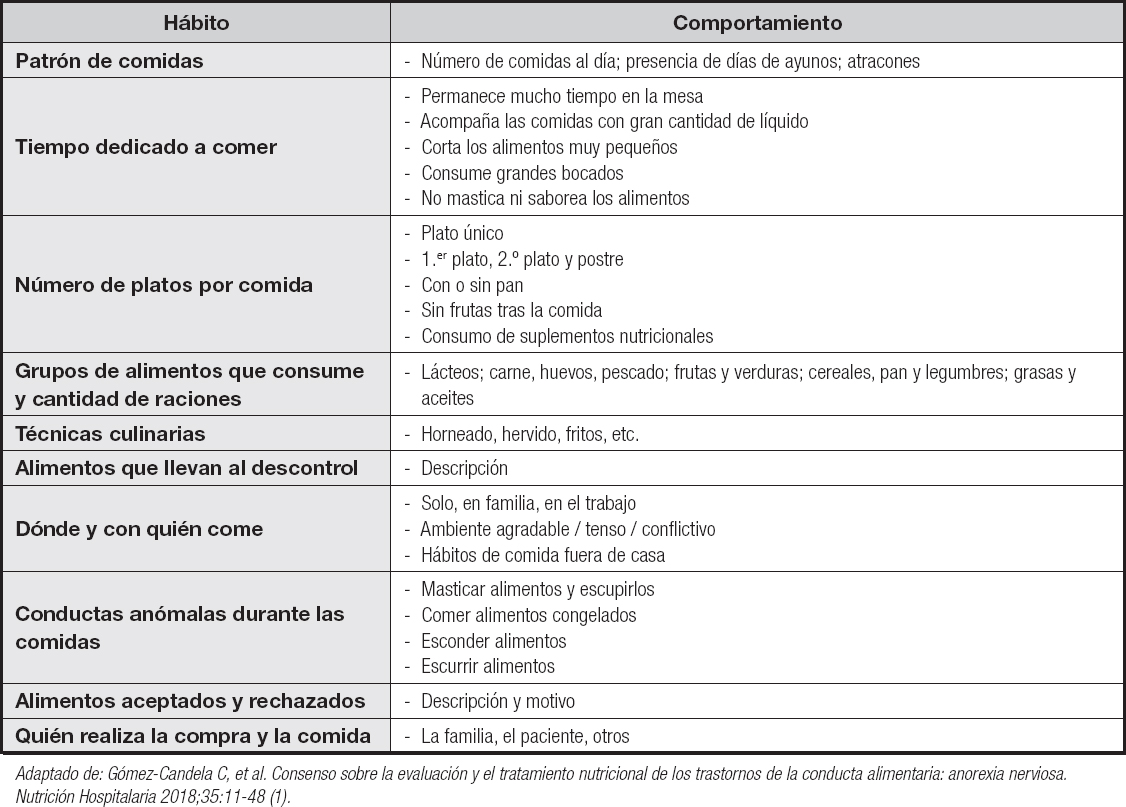
Adaptado de: Gómez-Candela C, et al. Consenso sobre la evaluación y el tratamiento nutricional de los trastornos de la conducta alimentaria: anorexia nerviosa. Nutrición Hospitalaria 2018;35:11-48 (1).
Existen distintas herramientas para la cuantificación de la ingesta (Tabla III). Es muy útil contar con un registro de ingesta (3-7 días) para poder cuantificar las calorías, el porcentaje de macronutrientes y detectar posibles déficits de micronutrientes. Existen aplicaciones móviles que pueden facilitar el registro de ingesta y que permiten compartir con los profesionales fotografías sobre los platos consumidos.
Tabla III. Herramientas recomendadas para cuantificar la ingesta

Nota: los pacientes suelen sobreestimar su ingesta. Si es posible, debe cotejarse la información con un familiar / cuidador.Modificado de: Gómez-Candela C, et al. Consenso sobre la evaluación y el tratamiento nutricional de los trastornos de la conducta alimentaria: anorexia nerviosa. Nutrición Hospitalaria 2018;35:11-48 (1).
También es necesario conocer el comportamiento ante la comida y el desarrollo de rituales y de estereotipias (35): trocear en pequeñas porciones, desmenuzar los alimentos, separar la posible grasa visible o utilizar papel para absorber aceite o salsas, etc. Otros datos, como si comen sentados o de pie, en compañía o solos o si evitan las comidas sociales, si cocina el paciente u otro miembro de la familia, el tiempo de duración del acto de comer, la cantidad de comidas al día o la estimación subjetiva del tamaño de las raciones que ingieren aportan información importante sobre la actitud del paciente hacia la alimentación. Cabe recordar que la historia nutricional ha de realizarse con el paciente y la familia o convivientes siempre que sea posible.
EXPLORACIÓN FÍSICA
Los signos exploratorios dependerán del grado de desnutrición y de la presencia o no de maniobras purgativas. El dato más llamativo suele ser la pérdida de grasa subcutánea y de masa muscular proximal o global.
Como fenómeno adaptativo puede encontrarse reducción de la temperatura corporal, bradicardia e hipotensión arterial. Frecuencias cardíacas (FC) inferiores a 50 latidos por minuto (lpm), cifras de presión arterial (PA) sistólica inferiores a 90 o una temperatura corporal inferior a 36 °C son signos vitales que pueden indicar una situación de inestabilidad física y precisar un seguimiento más estrecho (36).
La piel suele estar seca, pálida, con queratosis folicular y acrocianosis periférica, y ocasionalmente carotinémica en las palmas y en las plantas. Pueden presentar cabello fino y quebradizo, con tendencia a caer, junto con la aparición de un vello fino y lacio (lanugo) en las extremidades y en el dorso. Puede haber edemas en extremidades inferiores y signos secundarios a estados carenciales, como estomatitis angular, glositis o sangrado gingival (37).
En los cuadros de AN purgativos por vómitos los pacientes pueden presentar, además, hipertrofia parotídea, erosión del esmalte dental en la cara lingual de los incisivos y de los caninos superiores y el signo de Russell (erosiones y callosidades en los nudillos y en el dorso de la mano por las maniobras de provocación del vómito).
Ha de buscarse la presencia de signos de autolesión, como incisiones o cortes, relativamente frecuentes en pacientes con AN (38).
En niños y adolescentes hay que evaluar el grado de desarrollo puberal y constatar el estadio según la escala de Tanner.
Con todo, lo más relevante en la exploración es evaluar el estado nutricional y realizar comparaciones futuras según la evolución.
ANTROPOMETRÍA
La talla y el peso son los parámetros iniciales a evaluar. El peso debe determinarse en cada visita y la frecuencia con que se talle al paciente va a depender de si es un adulto, un niño o un adolescente. Es preciso asegurarse de que el peso es válido, evitando en lo posible manipulaciones por ingesta previa abusiva de agua o por la presencia de materiales pesados escondidos entre la ropa o sujetos con cintas o adhesivos en diferentes partes del cuerpo. Para ello, ha de instarse al paciente a que orine antes de subirse a la báscula y pesarle desvestido, solo cubierto con una bata hospitalaria. La decisión de que el paciente vea o no lo que pesa va a depender del programa terapéutico que esté aplicándose.
Con la talla y el peso se calculará el IMC (kg/m2), que, con sus limitaciones al no distinguir entre grasa, masa muscular y agua, proporciona una primera información del estado nutricional del individuo según los puntos de corte definidos por consensos. En niños y adolescentes el IMC se valorará por percentiles, z-score y por el porcentaje en relación con el percentil 50 del IMC (en adelante: m%BMI, por sus siglas en inglés, median percentage body mass index), que se calcula: IMC actual del paciente / valor IMC del percentil 50 para sexo y edad x 100 (39). Tan esencial como conocer la cuantía de la pérdida ponderal es considerar el tiempo en que ha ocurrido. Pérdidas rápidas de peso generan un riesgo nutricional elevado. En niños y adolescentes es importante hacer un seguimiento evolutivo de la talla según percentiles y comparar con su curva previa de crecimiento para detectar desviaciones de su patrón habitual de crecimiento, dada la presencia frecuente de retrasos en el crecimiento y en el desarrollo secundarios a la AN (34).
PARÁMETROS DE LABORATORIO
Los datos biológicos estarán casi siempre, salvo complicaciones, dentro de la normalidad y muchos pacientes con AN invocan lo anterior para justificar que en realidad “no se encuentran enfermos”. En la primera visita se solicitará una analítica completa con el fin de completar la evaluación nutricional y detectar posibles complicaciones médicas. La periodicidad de los controles analíticos posteriores dependerá de cada paciente (es recomendable al menos una analítica al año).
En el hemograma puede observarse la presencia de anemia leve, en general normocítica, salvo en situaciones de carencias de vitamina B12, fólico o hierro. Puede detectarse linfopenia y ocasionalmente neutropenia y trombopenia. La bioquímica puede mostrar niveles bajos de creatinina (relacionados con una baja masa muscular), glucemia en rangos bajos e hipercolesterolemia. Puede haber disfunción hepática con hipertransaminasemia. Los niveles séricos de calcio, fósforo y magnesio suelen estar en rango de normalidad; sin embargo, puede existir un estatus mineral reducido en el organismo. En el caso de abuso en la ingesta de líquidos puede detectarse hiponatremia, junto con una osmolaridad urinaria baja. En cuadros purgativos, en relación a la presencia de vómitos, consumo abusivo de laxantes o diuréticos, puede detectarse hipopotasemia con alcalosis metabólica hipoclorémica y niveles elevados de amilasa de origen salivar. La lipasa suele estar normal, pero también puede elevarse tanto en relación con la desnutrición como con la renutrición. Las concentraciones plasmáticas de albúmina, transferrina, prealbúmina o proteína unida a retinol generalmente estarán en rango de normalidad. Deben descartarse cuadros carenciales a través de la determinación de ácido fólico, vitaminas B12 y 25 OH vitamina D y perfil ferrocinético. Se valorará también la inclusión de otros parámetros como vitaminas A, D y E, cobre, y zinc.
El estudio hormonal inicial puede reflejar niveles de TSH (de sus siglas en inglés, thyroid-stimulating hormone) y T4 libre normales con T3 libre reducida y un incremento en T3 reversa, hallazgos similares a los del síndrome del eutiroideo enfermo. La determinación de hormonas tiroideas también sirve para descartar la toma subrepticia por parte del paciente de levotiroxina o de extractos tiroideos con el objetivo de perder peso. Los niveles de cortisol sérico y de cortisol libre en orina suelen estar elevados, así como los de GH (growth hormone), pero con IGF-1 (insulin-like growth factor) reducida en relación con la desnutrición.
En los varones y en las mujeres con irregularidades menstruales o amenorrea deben medirse niveles de esteroides sexuales y de gonadotrofinas y prolactina (PRL). Los niveles de esteroides sexuales, de testosterona y de estradiol estarán descendidos, con gonadotrofinas no elevadas, con un patrón prepuberal, lo que indica una situación de hipogonadismo hipogonadotropo funcional. En mujeres con amenorrea, incluso en las más jóvenes, se recomienda hacer siempre un test de embarazo.
OTRAS EXPLORACIONES COMPLEMENTARIAS
− Electrocardiograma (ECG). Debe realizarse un ECG inicial en todos los pacientes con AN restrictiva, con conductas purgativas graves o con fármacos que prolonguen el intervalo QT. Deberá repetirse ante la presencia de alteraciones hidroelectrolíticas, bradicardia (FC < 50 lpm), hipotensión, pérdida de peso muy rápida, abuso de laxantes o diuréticos, consumo excesivo de cafeína, debilidad muscular y uso de fármacos que puedan prolongar el intervalo QT (18,40).
− Ecocardiograma. No se precisa de rutina en todos los pacientes. En aquellos con desnutrición grave, alteraciones en el ECG, exploración física patológica (ingurgitación yugular, edemas en miembros inferiores, pulso paradójico, auscultación patológica, etc.) o síntomas cardiológicos de alarma (disnea, ortopnea, síncopes, etc.) debe plantearse la realización de un ecocardiograma para descartar alteraciones estructurales y conocer la fracción de eyección del ventrículo izquierdo (41).
− Radiografía simple. Se pedirá una radiografía simple de tórax si existe otra patología asociada o para comprobar la colocación de una eventual sonda nasogástrica (SNG) de alimentación.
− Densitometría ósea. La evaluación de la densidad mineral ósea (DMO) se realiza mediante absorciometría dual de rayos X (DXA), pero no hay acuerdo sobre cuándo solicitarla en pacientes con AN. Algunos grupos la solicitan a partir de 6 meses de amenorrea, otros la incluyen siempre en la evaluación inicial, aunque no haya alteraciones menstruales, y otros la piden en amenorreas prolongadas o desnutrición grave. En el caso de pacientes prepuberales o con amenorrea primaria tampoco hay acuerdo sobre su realización (18,42). Teniendo en cuenta la evidencia disponible, parece razonable la realización de DXA cuando exista amenorrea de 6 o más meses de evolución o desnutrición grave. La reevaluación debe individualizarse, considerando un intervalo de 1-2 años.
COMPOSICIÓN CORPORAL
En la AN se producen una serie de cambios en la composición corporal, con una pérdida no solo de grasa, sino de masa magra y cambios en su distribución regional que afectan más a las extremidades que al tronco (43,44). Los parámetros antropométricos clásicos, como el IMC, los pliegues cutáneos (información sobre grasa corporal total), la circunferencia muscular del brazo, el perímetro de la pantorrilla (indicadores de la masa muscular) y el índice cintura-cadera (indicadores de la distribución de grasa regional) dan una idea de la composición corporal, pero hoy en día se dispone, cada vez de forma más generalizada, de otras exploraciones que proporcionan una información más precisa.
DXA / DEXA
La DXA de cuerpo entero evalúa los tres compartimentos corporales (tejido óseo, grasa y tejidos blandos). Es una técnica cara, no siempre disponible en la práctica clínica habitual y que emite radiación, aunque sea a bajos niveles (45).
Impedanciometría bioeléctrica (BIA)
La BIA permite el estudio de la composición corporal y resulta útil para el seguimiento evolutivo a la hora de valorar los cambios corporales en un mismo sujeto. Aunque es una técnica más accesible y barata que la DXA y exenta de radiación, tiene sus limitaciones cuando se altera el estado de hidratación, algo que no es infrecuente en los TCA, y cuando los pacientes presentan un peso muy bajo y una reducción importante de la masa grasa (45). Es necesario el desarrollo de ecuaciones más específicas para pacientes con AN que mejoren su validez y su precisión. El análisis vectorial de BIA (BIVA), disponiendo de controles de referencia ajustados a la población de AN, puede dar una información más precisa de la composición corporal y de su evolución durante el proceso de recuperación (46). También puede ser de utilidad la determinación del ángulo de fase, que se ha observado que está disminuido en pacientes con AN de forma similar a otros pacientes desnutridos y que aumenta a medida que mejora el estado nutricional, por lo que puede ser de utilidad en el seguimiento de estas pacientes (46,47). En aquellas con amenorrea hipotalámica funcional secundaria a la AN, se sabe que para reanudar los ciclos menstruales se precisa que alcancen un mínimo de grasa corporal. En este sentido, un trabajo reciente evaluó la mejor herramienta para determinar el porcentaje de masa grasa a partir del cual las pacientes con AN recuperaban los ciclos menstruales, y la BIA fue el método de mejor sensibilidad y especificidad (comparado con el peso y el IMC), con un punto del corte de 21,2% (48).
Ecografía nutricional
La ecografía nutricional es una herramienta que utiliza la determinación mediante ultrasonidos de una serie de medidas que permite evaluar la masa magra y la masa grasa. Además de poder medir la grasa y su distribución corporal, resulta muy útil para evaluar la cantidad (el grosor y el área muscular) y la calidad (ecogenicidad) del músculo, utilizando fundamentalmente el recto anterior del cuádriceps para su valoración. Aporta ventajas como la accesibilidad, la portabilidad, el bajo coste y que se trata de una técnica no invasiva y que no radia al paciente. Ahora bien, presenta la limitación de la falta de estudios poblacionales en diferentes patologías que permitan obtener valores de referencia y puntos de corte para interpretar los resultados individuales (49).
VALORACIÓN FUNCIONAL
En la AN se produce pérdida de masa muscular, cambios en la contractilidad y atrofia de las fibras musculares, fundamentalmente de las de tipo II. La capacidad funcional se puede ver comprometida hasta en un 50 % o más, aunque es frecuente que el paciente no lo refiera (50). En la práctica clínica, aunque determinados cuestionarios de riesgo nutricional incluyen ítems funcionales, la valoración de la capacidad funcional de los pacientes se realiza fundamentalmente mediante la evaluación de su función muscular. La prueba más difundida es la dinamometría de la mano con medición (en kg) de la fuerza de prensión, que se relaciona con la masa corporal libre de grasa. Existen puntos de corte que delimitan el diagnóstico de sarcopenia. Otros test funcionales, como el test de la silla o sentadillas (Sit Up Squat Stand Test [SUSS]) ha demostrado su validez a la hora de evaluar la potencia muscular en pacientes con AN (51). Otras pruebas funcionales pueden ser la medición del flujo espiratorio máximo y la espirometría incentivada.
CLASIFICACIÓN DE LA GRAVEDAD DE LA DESNUTRICIÓN
La clasificación de la gravedad de la desnutrición en pacientes con AN depende de los criterios empleados. El IMC, a pesar de sus limitaciones, sigue siendo un parámetro frecuentemente empleado por su sencillez.
En adultos, según los criterios GLIM (que no son específicos para TCA), se considera desnutrición grave atendiendo a los criterios fenotípicos: pérdida de > 10 % de peso en los últimos 6 meses o > 20 % más allá de 6 meses; IMC < 18,5 kg/m2 en menores de 70 años; masa muscular gravemente reducida (52). Por su parte, los criterios de gravedad del DSM-5 ofrecen la siguiente clasificación: leve, cuando el IMC ≥ 17 kg/m2; moderada, entre 16 y 16,99 kg/m2; severa, entre 15 y 15,99 kg/m2, y extrema, cuando el IMC se sitúa por debajo de 15 kg/m2 (10) (Tabla I). El CIE-11 diferencia a los pacientes con un IMC significativamente bajo (IMC de entre 14 y 18,5 kg/m2) y peligrosamente bajo (IMC < 14 kg/m2) (11). No obstante, en general, los criterios mencionados no discriminan entre la variabilidad del riesgo orgánico y la mortalidad de los pacientes con un IMC extremadamente bajo. En trabajos retrospectivos sobre mortalidad hospitalaria en función del IMC se han reportado cifras de IMC menores a 13,5 kg/m2 para el 100 % de fallecimientos no atribuibles a suicidio (53), así como incrementos significativos de riesgo para un IMC por debajo de 11 (54) o 11,5 kg/m2 (53). Considerando estos datos, podría ser más útil la clasificación del Royal College of Psychiatrists, que establece como grave un IMC inferior a 13 kg/m2 en adultos (55).
En cuanto al paciente pediátrico, por un lado,la CIE-11 distingue, al igual que en adultos, entre pacientes con un IMC significativamente bajo (entre el percentil 3 y 25 para la edad) y peligrosamente bajo (< percentil 3 para la edad) (11). Por otro lado, los expertos del Royal College of Psychiatrists establecen como grave en menores de 18 años un m%BMI inferior al 70 % (55). Por su parte, la Society for Adolescent Health and Medicine (39) defiende el empleo de forma combinada del m%BMI, el IMC z-score, el porcentaje de pérdida de peso y la velocidad de dicha pérdida. En la tabla IV se muestran los criterios recomendados para la clasificación del grado de desnutrición en niños, adolescentes y adultos jóvenes con TCA restrictivos que propone dicha sociedad (39).
Tabla IV. Clasificación del grado de desnutrición en niños, adolescentes y adultos jóvenes con trastorno restrictivo de la conducta alimentaria según The Society for Adolescent Health and Medicine
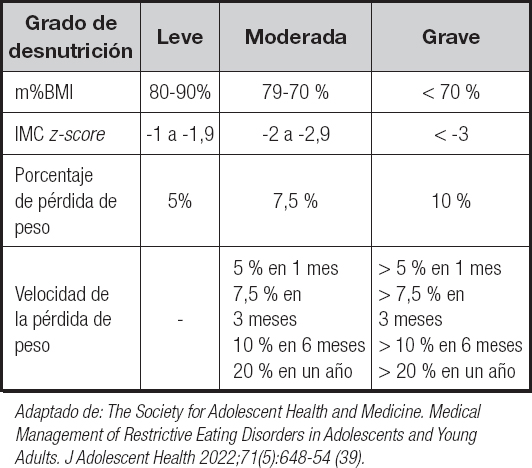
Adaptado de: The Society for Adolescent Health and Medicine. Medical Management of Restrictive Eating Disorders in Adolescents and Young Adults. J Adolescent Health 2022;71(5):648-54 (39).
REQUERIMIENTOS
El gold estándar para la determinación del gasto energético en reposo (GER) en la AN es la calorimetría indirecta. Las ecuaciones predictivas no estiman adecuadamente el GER de los pacientes desnutridos con AN. La ecuación de Harris Benedict tiende a sobreestimarlo; la de Schebendach (una adaptación de la de Harris Benedict para pacientes con AN) lo infraestima en algunos casos, y la de Müller (una adaptación de la de Harris Benedict para pacientes con IMC < 18,5 kg/m2), aunque es la que mejor correlaciona con el GER medido por calorimetría indirecta, tiene la limitación de precisar la determinación previa de la masa grasa y la masa magra, bien por DXA o por BIA. Una serie de factores, además de la gravedad de la desnutrición, como la duración de la enfermedad o su subtipo restrictivo o purgativo, las comorbilidades psiquiátricas o médicas, las posibles adicciones o la presencia o no de hiperactividad, pueden influir en el GER y condicionar la discordancia entre el GER estimado y el medido (56).
COMPLICACIONES MÉDICAS DE LA ANOREXIA NERVIOSA Y SU ABORDAJE
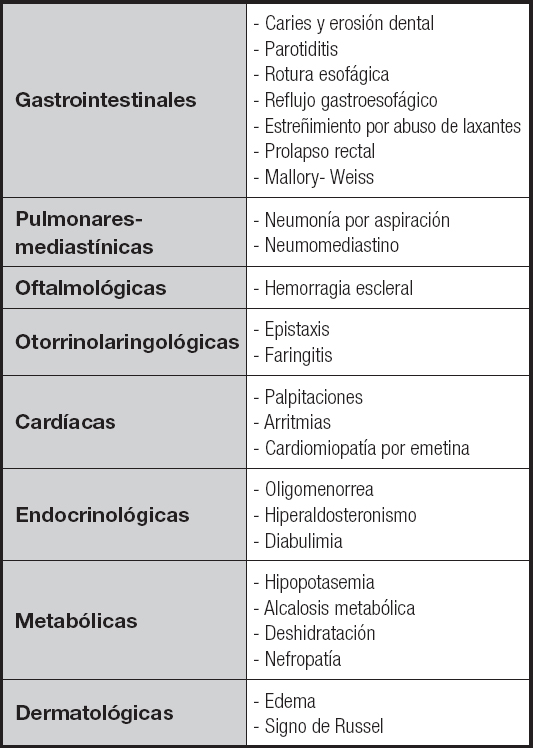
La AN se asocia con múltiples complicaciones médicas que condicionan el estado de salud, la calidad de vida y la supervivencia (1). La prevalencia disponible de las principales complicaciones se refleja en la tabla V (57). Las complicaciones médicas son las responsables de más de la mitad de las muertes en la AN (58) y se derivan de la pérdida de peso, de la desnutrición y de las maniobras purgativas en los casos en los que se realizan (1,59) (Tabla VI). No ha podido asociarse el valor del IMC con una determinada complicación (60), aunque sí se dispone de datos de complicaciones médicas en pacientes con AN extrema (61), al igual que se han descrito complicaciones en la AN atípica (62).
Tabla V. Prevalencia de las principales complicaciones médicas en la anorexia nerviosa
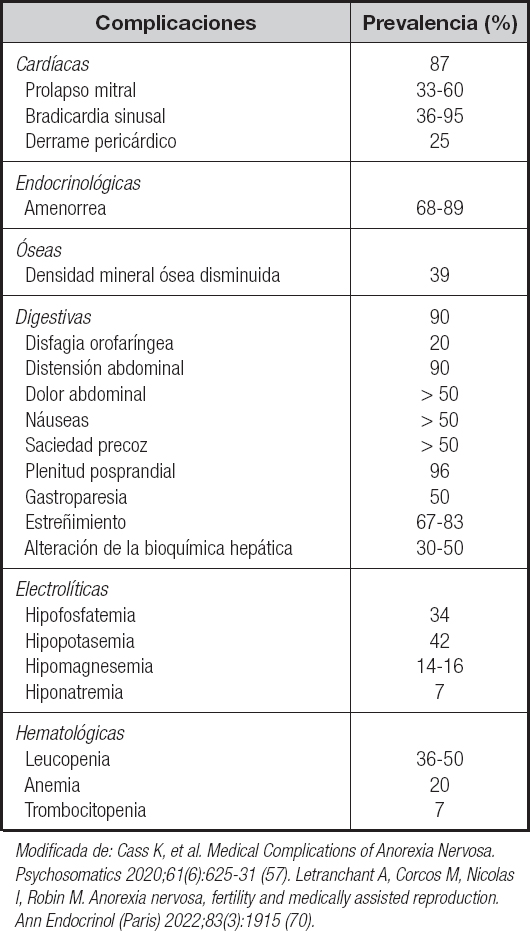
Modificada de: Cass K, et al. Medical Complications of Anorexia Nervosa. Psychosomatics 2020;61(6):625-31 (57). Letranchant A, Corcos M, Nicolas I, Robin M. Anorexia nervosa, fertility and medically assisted reproduction. Ann Endocrinol (Paris) 2022;83(3):1915 (70).
La inanición potencia el catabolismo de proteínas y grasas para obtener glucosa, lo que conduce a la pérdida de masa celular y a la atrofia de los distintos órganos. El número de órganos afectados y las complicaciones aumenta con la gravedad de la pérdida ponderal (63). Los principales factores de riesgo implicados en la incidencia de complicaciones asociadas a AN son el grado de pérdida de peso y la cronicidad de la enfermedad (1).
En general, el tratamiento de las complicaciones médicas consiste en el cese de conductas compensatorias, la recuperación ponderal y la reversión del estado de desnutrición, que se acompaña del tratamiento sintomático apropiado, ya que, por el momento, no se dispone de evidencia científica sólida que apoye otro abordaje (1).
Dado que se han revisado de un modo exhaustivo las complicaciones médicas en la AN en el consenso previo (1), se destacan a continuación aquellos aspectos que merecen actualizarse.
COMPLICACIONES CARDIOVASCULARES
Las alteraciones cardiovasculares son frecuentes en la AN. Aparecen hasta en un 87 % en alguna fase de la enfermedad. La mayoría de las complicaciones son leves, asintomáticas y reversibles con la recuperación ponderal (41), por lo que la terapia generalmente se limita al control de síntomas y al tratamiento nutricional apropiado (64). Las alteraciones más frecuentes son la bradicardia sinusal (FC inferior a 60 lpm) y la hipotensión arterial (PA inferior a 90/50 mmHg), que están mediadas por un aumento del tono vagal y suelen ser asintomáticas y bien toleradas, sin que sea necesaria la colocación de un marcapasos permanente (65). Se ha detectado una disminución de la variabilidad de la FC en la AN, pero se necesitan más estudios para entender la implicación clínica de este fenómeno, ya que no se ha encontrado una relación clara con la muerte súbita (66). Tampoco hay una clara causalidad entre la propia AN y el alargamiento del QT, sino que más bien parece causado por alteraciones electrolíticas (hipopotasemia) o efectos adversos de fármacos como la metoclopramida, la olanzapina y algunos antidepresivos (67).
El derrame pericárdico se detecta hasta en un 25 % de los casos con AN, si bien es un hallazgo ecográfico sin manifestación clínica y que se resuelve generalmente con el tratamiento nutricional (41), realizándose pericardiocentesis solo en caso de taponamiento cardíaco (64).
Los cambios estructurales, como la disfunción diastólica y la reducción de masa del ventrículo izquierdo, también se resuelven con el tratamiento nutricional. La fibrosis miocárdica, descrita en el 23 % de una serie, explicaría las alteraciones de la contractilidad y el riesgo de arritmias malignas con muerte súbita (41). Se han descrito casos de insuficiencia cardíaca por síndrome de realimentación (SR), por miocardiopatía tóxica por jarabe de ipecacuana y cardiomiopatía de tako-tsubo (68). El prolapso valvular mitral es la valvulopatía más frecuente en la AN, y en algunos casos persiste pese a la restauración ponderal (41).
COMPLICACIONES ENDOCRINO-METABÓLICAS
Las complicaciones endocrino-metabólicas más destacadas se han descrito en el documento de consenso (1). En resumen, pueden detectarse: hipogonadismo hipogonadotropo, activación del eje hipotálamo-hipófisis-adrenal, adaptación del eje tiroideo a la enfermedad, resistencia a la hormona de crecimiento, disminución de oxitocina y leptina y elevación de grelina y péptido YY (69). La mayoría de estas alteraciones revierte con la recuperación ponderal.
Aunque la amenorrea ya no es un criterio diagnóstico para la AN (10), está presente en el 68-89 % de las pacientes con AN (70). Se recomienda descartar embarazo, disfunción tiroidea e insuficiencia ovárica precoz antes de interpretar que la amenorrea se debe al hipogonadismo hipogonadotropo funcional (69). El tratamiento del hipogonadismo hipogonadotropo de la AN es la recuperación ponderal, aunque la amenorrea puede persistir en un 20 % de las pacientes (1,69). No se recomienda en general el tratamiento sustitutivo hormonal ni en hombres ni mujeres, pero sí puede individualizarse cada caso (1,64,69).
COMPLICACIONES ÓSEAS
En las pacientes con AN, la formación ósea es menor y la resorción ósea es mayor que en los controles, con una pérdida de DMO anual aproximada del 2,4 % en la cadera y del 2,6 % en la columna vertebral (69). La baja DMO (definida como DMO z-score inferior a -2 en la columna vertebral, la cadera o el radio) está presente en el 39 % de las mujeres con AN y en un 24 % de AN atípica (71), teniendo mayor riesgo en la columna vertebral y en la cadera (72).
Los factores de riesgo para una baja DMO en pacientes con AN son: inicio de la enfermedad durante la adolescencia, IMC bajo, duración de la enfermedad, hipogonadismo hipogonadotropo, baja masa muscular, ingesta de calcio inferior a 600 mg al día, niveles bajos de 25-hidroxi vitamina D y baja masa grasa (69,72). Un diagnóstico de baja DMO puede motivar a pacientes con AN activa a intentar una recuperación ponderal, ya que es el principal tratamiento actual, y aun así el efecto de la recuperación ponderal no siempre es capaz de revertir la baja DMO (69).
En el tratamiento de la baja DMO es necesario valorar otras causas nutricionales o endocrinológicas que puedan estar influyendo. Los objetivos principales son la recuperación ponderal y la restauración de ciclos menstruales para mejorar la DMO, ya que los suplementos de calcio y de vitamina D no bastan para mejorarla (69). No se recomienda la anticoncepción oral como tratamiento de la baja DMO, ya que no corrige las alteraciones del metabolismo óseo e incluso puede empeorar la DMO por supresión de la secreción hepática de IGF-1 (69). Sin embargo, el tratamiento con estradiol transdérmico puede mejorar la DMO. Se recomienda asociar un progestágeno cíclico, sobre todo si ha superado el periodo de 6-12 meses de amenorrea, aunque haya recuperado peso (42,73). En el momento actual, no está aprobado ningún otro tratamiento para la baja DMO en la AN (69).
COMPLICACIONES DIGESTIVAS
La clínica digestiva se presenta en el 90 % de la AN. Existe un gran componente funcional. Los síntomas más frecuentes son el estreñimiento, náuseas, dolor abdominal, distensión abdominal, plenitud posprandial, vómitos, pirosis, dolor epigástrico, disminución del apetito, diarrea y disfagia. La gravedad de los síntomas no se correlaciona con el IMC ni tampoco hay mayor incidencia de enfermedad celíaca ni de otras patologías inmunológicas, aunque los síntomas aparezcan con la ingesta de determinados alimentos (74-76).
Pese a que la mayoría de los síntomas son funcionales, se ha descrito disfagia orofaríngea sarcopénica, dilatación duodenal y el síndrome de la arteria mesentérica superior (sobre todo en AN restrictiva) y dilatación gástrica aguda con isquemia, necrosis y perforación (sobre todo en AN purgativa) (59,60,74,77). Respecto al síndrome de la arteria mesentérica superior, se ha descrito en asociación a pérdidas ponderales significativas y cursa con cuadros de dolor abdominal intenso y vómitos (no autoinducidos) tras la ingesta. El origen es la obstrucción intestinal alta por compresión duodenal entre la aorta y la arteria mesentérica superior por la pérdida de grasa a ese nivel. La confirmación diagnóstica se obtiene mediante tomografía computarizada (TC) abdominal y el manejo implica la recuperación nutricional para restaurar el panículo adiposo y la anatomía vascular. La nutrición enteral mediante sonda pospilórica suele ser una medida eficaz y bien tolerada en estos casos (59).
El abordaje de las complicaciones se basa en la recuperación ponderal y en el tratamiento sintomático (60,64,74,76).
A nivel hepático puede producirse, por autofagia y apoptosis, una disfunción hepática con elevación de transaminasas, además de hipoglucemia e hipofosfatemia, que se correlacionan con el IMC y son reversibles con la recuperación ponderal. La elevación de transaminasas también puede verse en el caso de que el aporte calórico durante el tratamiento sea excesivo (1,60,74).
Se han descrito cambios en la microbiota intestinal de pacientes con AN, con una reducción de las especies Roseburia y un aumento de Enterobacteriacee y Methanobrevibacter smithii. Aunque la recuperación ponderal aumenta la diversidad de la microbiota, inicialmente no se producen cambios en los síntomas digestivos, la disbiosis y el perfil de ácidos grasos de cadena corta, por lo que aún queda por investigar la relación entre AN y disbiosis, así como en su papel de causa y efecto (74,75).
COMPLICACIONES RENALES Y ALTERACIONES HIDROELECTROLÍTICAS
El tipo de AN condiciona la afectación renal e hidroelectrolítica: en los casos de AN restrictiva sin purgas ni hipopotasemia, la bradicardia y la hipovolemia parecen ser los mecanismos del daño renal por baja perfusión y glomeruloesclerosis; en los casos de AN purgativa, la hipopotasemia sostenida condiciona una tubulopatía que se asocia tanto a daño agudo renal como a enfermedad renal crónica (78).
En la AN restrictiva los electrolitos suelen estar en el rango de la normalidad, si bien se describe hiponatremia por la dificultad en la eliminación de agua libre más que por una secreción inapropiada de vasopresina, lo que lleva a una hiponatremia crítica si se ingieren con rapidez unos litros de agua (59). El patrón de alteración hidroelectrolítica más típico de la AN purgativa es la hipopotasemia (42 %) con alcalosis metabólica (33 %). Se requiere más cantidad de potasio para la normalización en los casos de empleo de laxantes por el intercambio de iones y la salida de potasio intracelular de la acidosis metabólica hiperclorémica (59). Una muestra de orina con sodio elevado orienta hacia una purga con diurético; en el caso del cloro aumentado, orienta hacia el abuso de laxantes, mientras que disminuido orienta hacia vómitos o diuréticos (78).
Otras alteraciones que también pueden detectarse son la hipomagnesemia y la hipofosfatemia, que deben alertar de un posible SR (1,78). En los casos de AN purgativa, la activación crónica del sistema renina-angiotensina-aldosterona aumenta la secreción de aldosterona en el túbulo distal (síndrome pseudo-Bartter), por lo que una interrupción brusca de las purgas condiciona la formación de edema y ganancia ponderal, más acusada con una rápida administración de suero fisiológico parenteral. El tratamiento consiste en la reposición lenta y supervisada de volumen, así como en el empleo de espironolactona durante 3 semanas (78).
Se ha descrito la aparición de una hiperfosfatemia tardía transitoria en pacientes con AN gravemente desnutridas en relación a la repleción nutricional y que probablemente resulta de una inapropiada reabsorción tubular de fósforo (79). Se desconocen los mecanismos de este fenómeno, pero se postulan los sistemas GH/IGF-1 y FGF-23 (fibroblast growth factor 23)/Klotho. Asimismo, se ignora si tiene un significado patológico o si se trata de un fenómeno adaptativo (79).
COMPLICACIONES PULMONARES
La AN puede llevar a debilidad muscular respiratoria, disnea, reducción de la capacidad pulmonar y aeróbica y alteraciones parenquimatosas como bullas, bronquiectasias y cambios similares al enfisema (74).
Se han descrito casos de neumotórax espontáneo y neumomediastino. Los mecanismos implicados serían el trauma esofágico por vómitos o la ruptura alveolar por el efecto Macklin debido al aumento de la presión intraalveolar y a la baja presión perivascular, con la migración de aire alveolar al mediastino, al pericardio y a los tejidos subcutáneos (74,80). El abordaje de elección es conservador, sin intervención, si se descarta una rotura esofágica u otra causa secundaria. El neumotórax puede ser traumático (tras una maniobra de reanimación en una parada cardíaca), espontáneo (por alteraciones parenquimatosas descritas en la AN) o yatrogénico, en el contexto de una prueba o de una técnica como un sondaje nasogástrico, una broncoscopia, una toracocentesis, la colocación de una vía central o similares. Por esto, debe valorarse el riesgo-beneficio para la realización de una técnica potencialmente yatrogénica, así como realizar una radiografía de tórax ante la presencia de síntomas respiratorios (80).
La neumonía bacteriana es la infección más frecuente en pacientes hospitalizados con AN y desnutrición grave. La aspiración es el mecanismo principal, incluso con la ausencia de vómitos, en el contexto de disfagia orofaríngea sarcopénica. Dado que las infecciones en pacientes con AN no suelen acompañarse de fiebre, una normalización o un aumento de los leucocitos debería hacer sospechar un proceso infeccioso (80).
COMPLICACIONES HEMATOLÓGICAS
La desnutrición en la AN condiciona la degeneración gelatinosa de la médula ósea, con una atrofia de la grasa y la sustitución por un mucopolisacárido que produce una hipoplasia de las tres líneas celulares: leucopenia, anemia y trombocitopenia por frecuencia de presentación (60,74). La leucopenia es más frecuente en la AN de tipo restrictivo (50,5 %) que en la AN de tipo purgativo (36,8 %). La anemia (en torno al 20 %) y la trombocitopenia (7 %) son similares en ambos tipos (81). A pesar de la neutropenia, no parece haber un mayor riesgo de infección. No obstante, esta prevalencia puede variar en función de la gravedad de la situación clínica, ya que en un estudio en pacientes con AN con desnutrición muy grave (IMC de 12 kg/m2 o menor al ingreso) la complicación más frecuente fue la anemia (79 %) (82). El tratamiento es la recuperación ponderal con el tratamiento nutricional, sin precisar factores de crecimiento. La anemia suele ser normocítica o macrocítica, por lo que debería realizarse una evaluación más completa en los casos de anemia microcítica (74). Sin embargo, los niveles de ácido fólico y de vitamina B12 suelen estar elevados por disfunción del hepatocito (60,83).
COMPLICACIONES NEUROLÓGICAS
Además de las consecuencias de los déficits vitamínicos, la desnutrición en la AN condiciona cambios atróficos cerebrales tanto en la sustancia blanca como en la gris; incluso puede persistir deterioro de la función neurocognitiva tras la mejoría de la atrofia con la recuperación ponderal (1,60).
COMPLICACIONES DERMATOLÓGICAS
Los múltiples cambios cutáneos que pueden presentarse en la AN se relacionan con la reducción del tejido celular subcutáneo o el intento de mantener la temperatura corporal evitando la pérdida de calor, más que signos de virilización. Puede haber xerosis, lanugo, hipercarotenemia, acné, acrocianosis, efluvio telógeno y otras manifestaciones que mejoran con la recuperación ponderal (1,60,77,84).
TRATAMIENTO MULTIDISCIPLINAR Y EQUIPO TERAPÉUTICO
El tratamiento de la AN requiere de una intervención individualizada que incluya aspectos psicológicos, físicos y nutricionales. La posible afectación orgánica y nutricional da lugar a un espectro clínico variable en cuanto a forma de presentación y gravedad que exige un abordaje centrado en el paciente y de carácter multidisciplinar con alto nivel de especialización por parte del equipo terapéutico y con una adecuada coordinación por parte de todos los integrantes (1,18). Existe evidencia que apunta a una menor mortalidad de este colectivo gracias a la instauración de verdaderos equipos multidisciplinares para el manejo de los TCA (85,86).
En España, según los datos del registro RECALSEEN, el 40 % de los hospitales de más de 500 camas y el 16 % con menos de 500 presentaban en su cartera de servicios una consulta monográfica multidisciplinar de TCA (87). En la Encuesta Sobre Unidades Asistenciales y Atención a Trastornos de la Conducta Alimentaria en España, a pesar de que los resultados pueden no ser extrapolables a la realidad nacional por la baja tasa de respuesta a la encuesta, se objetivó que el 87 % de los centros presta atención a los pacientes con TCA (88). Un 50 % de los hospitales de más de 500 camas dispone de consulta monográfica de TCA en comparación con el 14 % de menos de 500 (88). La colaboración con psiquiatría también fue diferente según la complejidad hospitalaria: está presente en el 91,3 % de los centros de más de 500 camas y en ninguno de los de menor tamaño (88). La satisfacción del profesional con respecto al tratamiento de los TCA fue superior en los centros de mayor tamaño y se relacionó con la posibilidad de desarrollar un trabajo colaborativo con psiquiatría (88).
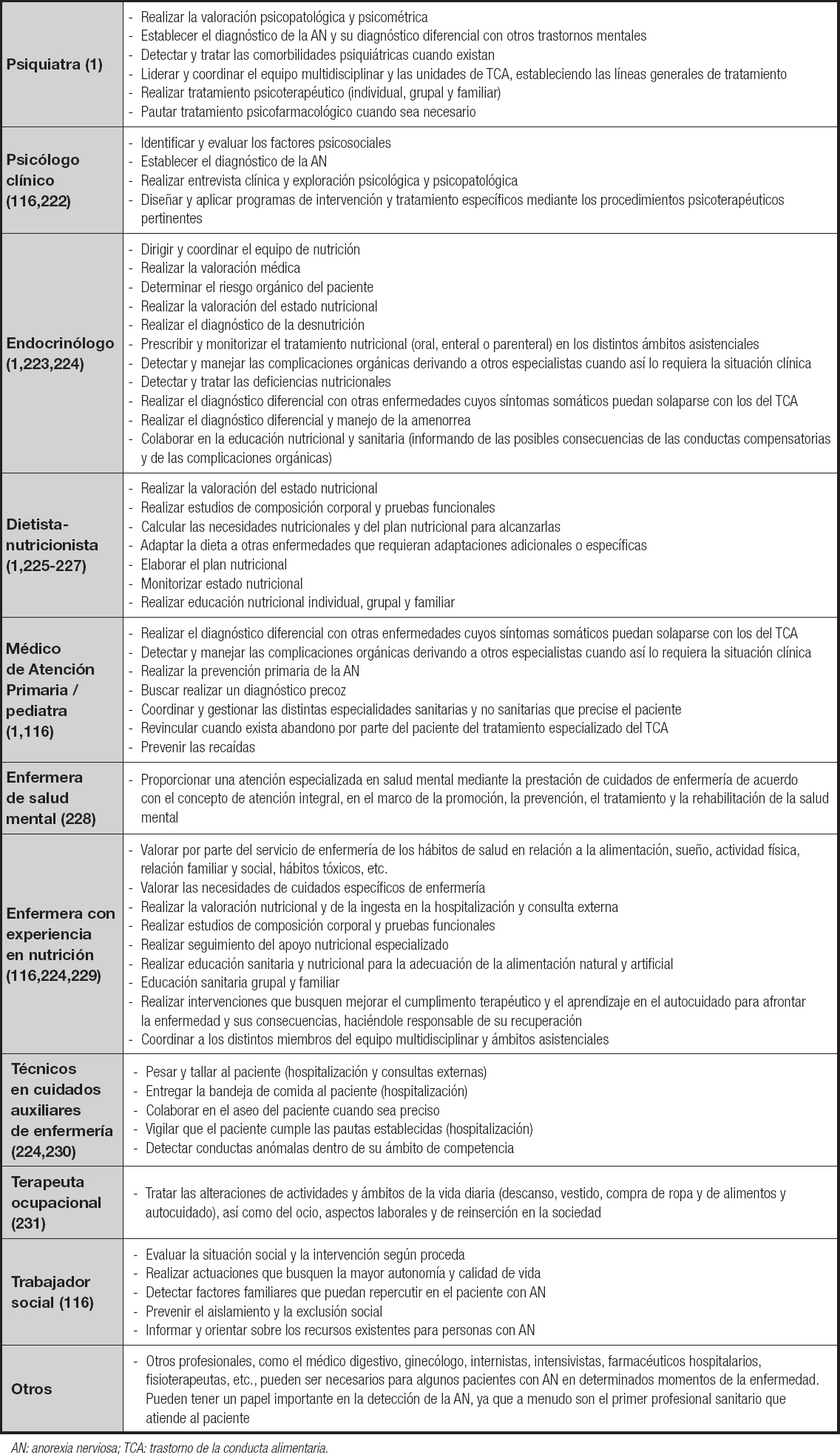
No se ha establecido de forma unánime la composición exacta del equipo terapéutico en la AN. No obstante, se considera que debe contar al menos con personal dedicado a los aspectos psicológicos / psiquiátricos y con profesionales que se encarguen de la parte médica y nutricional (1). Otros componentes del equipo multidisciplinar, como enfermeras, médicos de Atención Primaria, médicos especialistas de distintas áreas, terapeutas ocupacionales, trabajadores sociales y dietistas son también muy importantes (1). No obstante, hay que destacar el papel de los profesionales de la Atención Primaria, quienes tienen una posición privilegiada para la detección precoz de la AN, así como de la detección de recaídas.
En la tabla VII se muestran los distintos profesionales que pueden formar parte del equipo multidisciplinar, ya sea de forma continua a lo largo de la enfermedad o de manera puntual. Con frecuencia hay competencias comunes y compartidas entre distintos miembros del equipo tratante que, lejos de solaparse, pueden aportar un punto de vista y una experiencia enriquecedora desde su especialidad y su área de conocimientos. No obstante, trabajar de forma conjunta exige aclarar las competencias de cada uno y evitar interferencias que puedan repercutir negativamente en el tratamiento de los pacientes (1). Esto puede conseguirse consensuando vías clínicas de actuación y protocolos asistenciales, así como reuniones periódicas del equipo.
TRATAMIENTO PSIQUIÁTRICO EN LA ANOREXIA NERVIOSA
El tratamiento psiquiátrico de elección en la AN es el tratamiento psicológico (18), si bien el tratamiento farmacológico puede añadirse a la psicoterapia y al tratamiento nutricional en aquellos casos seleccionados que no hayan obtenido la respuesta esperada o de las comorbilidades psiquiátricas (18,40). Se recomienda que la psicoterapia esté centrada en los TCA, incluyendo la normalización de las conductas alimentarias y del control del peso, la recuperación ponderal y el abordaje de los aspectos psicológicos del trastorno, como el miedo a aumentar de peso o la distorsión de la imagen corporal (18). En el caso de que el paciente sea adolescente se recomienda un tratamiento enfocado en la familia (FBT, de sus siglas en inglés: Family Based Therapy), que debe incluir educación para el cuidador con el fin de normalizar las conductas alimentarias y del control del peso, además de la recuperación ponderal (18).
Como limitación para el tratamiento psiquiátrico, ha de precisarse que no existe ningún tratamiento farmacológico específico para la AN; es una necesidad pendiente de investigación (89). Por otra parte, muchos pacientes serán reticentes a tomar fármacos, sobre todo si ayudan a ganar peso. Los antidepresivos y los ansiolíticos no han conseguido mejorías significativas en la ingesta, en el peso o resultados psicológicos en comparación con los placebos (89). La olanzapina es de los pocos fármacos que tiene evidencia en una ganancia ponderal significativa (90) cuando el tratamiento nutricional y la psicoterapia no son suficientes para ganar peso, aunque no tiene efecto significativo en la sintomatología (91). Los inhibidores selectivos de la recaptación de serotonina (ISRS) no han demostrado ser eficaces en la ganancia ponderal ni en la prevención de las recaídas (18), aunque pueden emplearse si tras la recuperación ponderal persiste ansiedad, depresión o síntomas obsesivo-compulsivos. No se recomienda el empleo de bupropión ni antidepresivos tricíclicos por sus efectos adversos, y las benzodiacepinas tienen más riesgo que beneficios (18).
En la tabla VIII se resumen las indicaciones y las principales interacciones con alimentos de los fármacos empleados en la AN (92).
TRATAMIENTO MÉDICO-NUTRICIONAL EN LA ANOREXIA NERVIOSA
Los pacientes con TCA pueden presentar complicaciones orgánicas secundarias a las conductas compensatorias o a la desnutrición, así como a las comorbilidades asociadas, que pueden entorpecer el manejo tanto del trastorno alimentario como de la propia enfermedad. Es por ello que resulta fundamental que los pacientes reciban una valoración y un tratamiento médico-nutricional acorde a la situación clínica que presenten.
Los objetivos generales del tratamiento médico-nutricional en la AN son:
− Mejorar la alimentación, las actitudes y las conductas respecto a la comida, buscando normalizar la dieta a través de la adquisición de una alimentación variada y equilibrada.
− Revertir la desnutrición. El objetivo ponderal debe establecerse de forma individualizada. Un objetivo aconsejable es aquel peso que permita reanudar la función fisiológica reproductora (los ciclos menstruales en las mujeres y la función testicular en los varones).
− Garantizar el adecuado aporte de micronutrientes.
− Desmitificar creencias y actitudes potencialmente peligrosas con respecto a la alimentación o a las conductas compensatorias.
− Resolver las complicaciones médicas derivadas de la desnutrición o de las conductas compensatorias.
− Evitar un impacto negativo en el manejo de comorbilidades (por ejemplo, diabetes, enfermedad inflamatoria intestinal, etc.).
− En mujeres con amenorrea hipotalámica funcional secundaria a la AN se buscará la recuperación de los ciclos menstruales. Para ello, se precisa alcanzar al menos el 90-95 % del m%BMI, que supone, según algunos autores, alrededor de 2 kg extra del peso previo a la aparición de la amenorrea. También se ha señalado como útil obtener un porcentaje de masa grasa medida por BIA superior al 21,2 % (48).
− Conseguir un adecuado crecimiento en niños y adolescentes.
− Colaborar en la adquisición de conciencia de enfermedad y mejorar las disfunciones relacionadas con las conductas compensatorias / purgativas.
− Contribuir en la prevención de recaídas.
Para lograr estos objetivos deben abordarse dos aspectos: 1) de índole médica, en el que una adecuada valoración permitirá la detección de distintas complicaciones y su tratamiento, y 2) de tipo nutricional, tanto para el restablecimiento de un adecuado estado nutricional como para alcanzar una alimentación saludable y mantenida en el tiempo.
Respecto a este último punto, la esencia de la rehabilitación nutricional en la AN se basa en la adecuación de la alimentación oral junto con un programa de EN. Otras herramientas, como los suplementos orales nutricionales (SON), la nutrición enteral (NE) o incluso la nutrición parenteral (NP), pueden ser necesarias a lo largo de la recuperación del paciente según su situación clínica y el entorno asistencial que requiera.
De las herramientas disponibles de nutrición artificial, los SON resultan los más empleados en cualquiera de los ámbitos asistenciales. Aunque se dispone de pocos estudios específicos sobre el empleo de SON en pacientes con AN, los beneficios esperables con base en la evidencia disponible son (1): contribuir a una mayor y más rápida ganancia de peso, disminución de la estancia hospitalaria, acortamiento de la duración del tratamiento, evitar efectos deletéreos de la desnutrición (especialmente importante en gestantes) o cubrir los requerimientos cuando estos son elevados (por ejemplo, cuando existe saciedad precoz). Su empleo en la hospitalización (total o parcial) está ampliamente extendido. En el ámbito ambulatorio existe una mayor variabilidad en su empleo debida, por un lado, a las diferencias en cuanto a su financiación en el Sistema Nacional de Salud y, por otro, a la frecuente dificultad de cumplimiento por parte de los pacientes al tratarse de un entorno menos controlado. La prescripción de SON debe ir siempre asociada a recomendaciones sobre su consumo para evitar que desplacen a la progresión de la alimentación ordinaria e informar del tiempo y de los objetivos concretos de su pauta. Además, es frecuente que se indique su ingesta supervisada para evitar la manipulación (1). El principal inconveniente del uso de SON por parte de este colectivo es su interferencia con la adquisición de una alimentación variada y equilibrada, en la que los SON puedan tener potencial para reforzar conductas de evitación de alimentos, fomentando la dependencia de fuentes de alimentación artificial (1). Las fórmulas más frecuentemente empleadas son poliméricas hipercalóricas, ya que permiten un aporte elevado de calorías en un menor volumen.
Respecto al empleo de NE a través de sonda (y excepcionalmente ostomía), se reserva casi exclusivamente su empleo a la hospitalización. La NP, aunque se dispone de reportes de casos de NP domiciliaria, es excepcional y debe reservarse a aquellas situaciones en las que no puede nutrirse por vía oral ni enteral.
La decisión de qué nivel de atención inicial escoger cuando se diagnostica una AN o la decisión de cambiar de escenario clínico a lo largo del proceso depende de numerosas variables (18): conciencia de enfermedad, estabilidad médica, presencia de complicaciones que requieran un nivel determinado de atención o de monitorización, riesgo autolítico, comorbilidades, fracaso del tratamiento ambulatorio, contexto psicosocial, etc. (Tabla IX). En líneas generales el tratamiento ambulatorio es de elección como abordaje inicial en la mayoría de las ocasiones. No obstante, puede ser necesario un escenario más intensivo (hospitalización), según la gravedad del cuadro de debut (18). En una revisión de la Cochrane del año 2019 se concluye que no hay evidencia suficiente para establecer la superioridad de un ámbito terapéutico sobre otro en pacientes con AN moderada y que, por tanto, se precisan más estudios (93).
Tabla IX. Consideraciones para el ámbito de tratamiento en pacientes con anorexia nerviosa

Modificado de: American Psychiatric Association. The American Psychiatric Association Practice Guideline for the Treatment of Patients with Eating Disorders. Fourth Edition. Washington DC: American Psychiatric Association; 2023. p. 1-100 (18).
A continuación, se detallan las particularidades del manejo de la AN según el ámbito de tratamiento: ambulatorio, hospitalización, hospitalización parcial (también conocida como hospital de día de TCA [HDDTCA]) y hospitalización de media estancia para TCA.
ÁMBITO AMBULATORIO
La mayoría de los casos podrán abordarse de modo ambulatorio con un equipo multidisciplinar coordinado, salvo que presente algún factor o condicionante para tener que cambiar a un ámbito con un seguimiento más estrecho, como el ingreso hospitalario o el hospital de día (1,18). Estos factores hacen referencia al estado físico, al comportamiento, a la situación afectiva y cognitiva y a las circunstancias sociales. Si presentase algún criterio de ingreso (véase apartado específico del presente documento), debería atenderse en el ámbito de hospitalización.
La principal ventaja del tratamiento ambulatorio es que los pacientes permanecen con sus cuidadores y pueden continuar con su ritmo académico o laboral. La psicoterapia ambulatoria es menos perturbadora y más barata que en otros ámbitos de tratamiento (94). En este nivel el paciente acude de forma voluntaria y predomina el tratamiento psicoterápico (1-2 sesiones semanales individuales, grupales o familiares), con visitas médicas de manera individualizada. El soporte y la supervisión de las comidas son llevados a cabo por familiares o por los cuidadores principales. Todo el proceso se apoya en un equipo multidisciplinar con consenso previo (18). Cuando el tratamiento se comparte entre Atención Primaria y otros ámbitos asistenciales, debe haber un claro acuerdo entre los profesionales sobre la monitorización de los pacientes con AN (1).
Los objetivos del tratamiento en este ámbito son alcanzar un peso saludable y un buen estado nutricional, proporcionar EN (normalizando los patrones alimentarios), tratar complicaciones crónicas, conseguir apoyo familiar y prevenir las futuras recaídas. El peso objetivo debe individualizarse en cada paciente, considerando que un buen umbral de normalidad puede establecerse a partir de aquel en el que el paciente reanuda su función fisiológica reproductora (los ciclos menstruales en las mujeres y la función testicular en los varones) (18). Si se atiende a una de las definiciones más aceptadas de remisión, misión última del tratamiento, los objetivos se centrarían en conseguir una ausencia de criterios diagnósticos de AN (DSM-5), sin atracones, purgas o ayunos durante al menos 3 meses, alcanzar un IMC superior a 18,5 kg/m2 y obtener una puntuación en el Eating Disorder Examination-Questionnaire (EDE-Q) dentro de + 1 desviación estándar según la edad del paciente en todas sus subescalas (95).
El aumento de peso deseable se sitúa entre 0,45 y 0,9 kg a la semana (18). La ganancia ponderal precoz se relaciona con mejores resultados (96,97). Es crucial que tanto los pacientes como sus cuidadores entiendan que distintas circunstancias influirán en la consecución de los objetivos, lo que condiciona la necesidad de intensificar el ámbito del tratamiento, pasando a un ingreso hospitalario o al hospital de día si no se observa una mejoría a lo largo de 6 semanas (18).
En cuanto al aporte calórico se precisarían más estudios en el ámbito ambulatorio. Las últimas guías de la APA no establecen un dintel de calorías para comenzar la renutrición en este contexto (18). En referencias clásicas, empleando el peso real, aquella debería iniciarse con una ingesta en torno a 20 kcal/kg al día, con un incremento de 500 kcal más a los 7 días del inicio, para un aporte extra de 3500 kcal a la semana y ganancia ponderal. Durante la recuperación ponderal se alcanzarían 70-100 kcal/kg al día. Los requerimientos se estabilizarían en 30-40 kcal/kg al día a los 6 meses. No obstante, para evitar las recaídas, durante la fase de mantenimiento ponderal precoz se aconseja aumentar las calorías diarias hasta 50-60 kcal al día. El patrón dietético y la distribución de macronutrientes se corresponderá con un patrón saludable (98). Más recientemente, apoyando a la FTB en pacientes jóvenes, están utilizándose estrategias alternativas (algunas con herramientas digitales) no basadas en el cálculo de calorías consumidas, sino en la normalización de un patrón dietético estable. Por ejemplo, en la denominada Plate-by-Plate Approach® se propone un plan visual de alimentación, sin contar raciones ni calorías, centrado en proporcionar 3 comidas principales (que deben contener todos los grupos de alimentos) y 2-3 tentempiés con al menos 2 grupos de alimentos que no se centren solo en fruta o verdura, dado su bajo aporte calórico. Es importante exponer al paciente a todo tipo de alimentos habituales, ayudándole a restaurar la confianza perdida en la forma de comer. Falta por conocer evidencia clínica de este método frente al tradicional basado en calorías ingeridas (99). La supervisión de las comidas la realizarán los cuidadores siguiendo las recomendaciones que se les indiquen (1).
Los SON podrán emplearse si los requerimientos de energía son muy elevados (sobre todo por encima de las 3000 kcal). No deberían reemplazar al incremento de las ingestas ni a ninguna comida y sirven para una ganancia ponderal más rápida en aquellos pacientes que acceden a consumirlos. En algunos casos es preciso el uso de un complejo multivitamínico-mineral durante la recuperación ponderal y siempre que se detecte la existencia de una carencia de micronutrientes y minerales. Los suplementos de tiamina ambulatorios también pueden ser necesarios durante las etapas iniciales de la renutrición (1).
Inicialmente se recomienda el control ponderal semanal (después de orinar, sin zapatos y en ropa ligera), además del de otros parámetros en función de cada caso (PA si el paciente presentaba ortostatismo, análisis si realizaban purgas), así como 1 o 2 sesiones de psicoterapia semanales, con consultas adicionales si se considera necesario (18).
En la tabla X se sugiere la evaluación inicial en el medio ambulatorio, así como el seguimiento a realizar. Dichas valoraciones deben individualizarse en función de los síntomas que presente el paciente y de la gravedad de la AN (1,18).
Tabla X. Valoración de los pacientes con anorexia nerviosa en el medio ambulatorio en función de la gravedad de la enfermedad

*Para una aproximación a la cuantificación de los síntomas puede usarse el cuestionario EDE-Q (Eating Disorders Examination Questionnaire), disponible en: https://psiquiatria.com/trabajos/usr_649245308.pdf (último acceso 30 de agosto de 2023). Puede ser necesario cotejar la información con familiares o cuidadores en la sección dedicada a la anamnesis. Realizar radiología de tórax si se detecta desnutrición resistente al tratamiento, elevación de PCR, presencia de edema o leucocitosis. Puede considerarse solicitar anticuerpos antitransglutaminasa tisular IgA si se sospecha enfermedad celíaca. ACT: agua corporal total; β HCG: gonadotropina coriónica humana; DXA: densitometría de energía dual; DHEA-S: dehidroepiandrosterona sulfato; DMO: densidad mineral ósea; FC: frecuencia cardiaca; FSH: hormona folículo estimulante; IMC: índice de masa corporal; LBM: lean body mass; LH: hormona luteotropa; MG: masa grasa; MLG: masa libre de grasa; MME: masa muscular esquelética; PCR: proteína C reactiva; PRL: prolactina; PA: tensión arterial; TC: tomografía computarizada; TCA: trastorno de la conducta alimentaria. aEn caso de pacientes que realicen purgas. bSolo si deficiencias previas o datos de desnutrición / escasa ingesta en la valoración nutricional. cSolo si amenorrea, sospecha de gestación o retraso menstrual. dSolo si amenorrea o irregularidad menstrual. eSolo si síntomas de hipogonadismo (ginecomastia, disfunción eréctil…). fConsiderar criterios para asegurar validez de resultados cuando se emplean fórmulas predictivas para los compartimentos corporales. Preparación adecuada. gNo hay acuerdo sobre cuándo solicitar DXA para determinar la DMO en pacientes con AN. Se sugiere su realización cuando exista desnutrición grave o amenorrea de 6 o más meses de evolución. La reevaluación debe individualizarse, considerando un intervalo de 1-2 años. hElectrocardiograma ante la presencia de alteraciones hidroelectrolíticas, bradicardia < 50 lpm, hipotensión, pérdida de peso muy rápida, abuso de laxantes o de diuréticos, consumo excesivo de cafeína, debilidad muscular o uso de fármacos que puedan prolongar QT. iNo se precisa de rutina en todos los pacientes. En aquellos con desnutrición severa, alteraciones en el ECG, exploración física patológica (ingurgitación yugular, edemas en miembros inferiores, pulso paradójico, auscultación patológica) o síntomas cardiológicos de alarma (disnea, ortopnea, síncopes) debe realizarse un ecocardiograma para descartar alteraciones estructurales y conocer la fracción de eyección de ventrículo izquierdo.Modificado de: Gómez-Candela C, et al. Consenso sobre la evaluación y el tratamiento nutricional de los trastornos de la conducta alimentaria: anorexia nerviosa. Nutr Hosp 2018;35(Spec No1):11-48 (1). Actualizado según: American Psychiatric Association, editor. The American Psychiatric Association Practice Guideline for the Treatment of Patients with Eating Disorders. Fourth Edition. Washington DC; 2023 (18).
Debe generarse más evidencia relativa al papel de la telemedicina (100), de la autoayuda guiada por internet (101) y de las aplicaciones móviles en la consecución de objetivos nutricionales en la AN en el contexto del nivel ambulatorio de tratamiento. Algunas de estas últimas contienen técnicas de cambio de conducta que comparten algunos ítems con la terapia cognitivo-conductual y con la terapia familiar (102).
HOSPITALIZACIÓN
La hospitalización está indicada cuando existe descompensación aguda orgánica o psiquiátrica o cuando fracasa el tratamiento ambulatorio.
La hospitalización total ha demostrado mejoría tanto ponderal como de los síntomas del TCA (103). No obstante, es difícil encontrar estudios de calidad que comparen la hospitalización frente otros ámbitos. Esto se debe a la dificultad de llevar a cabo estudios de calidad en determinadas situaciones clínicas: no es aceptable realizar ensayos clínicos en pacientes con complicaciones médicas agudas en los que aleatorizar a recibir tratamiento hospitalario (frente a otro entorno asistencial) no sería ético (103). Además, los pacientes más graves no suelen estar adecuadamente representados en los estudios (103). Por ello, se acepta que la hospitalización es el entorno de elección en aquellos casos con complicaciones médicas y psiquiátricas graves (103).
Objetivos de la hospitalización en pacientes con AN
Los objetivos del ingreso hospitalario son (1,18):
− Conseguir la estabilización médica (normalizando las constantes vitales, las alteraciones hidroelectrolíticas y el balance hídrico).
− Restablecer el peso corporal. El ritmo de ganancia ponderal según la APA se recomienda en 0,5-1,8 kg a la semana.
− Corregir las secuelas médicas y psicológicas de la desnutrición.
− Reorganizar la conducta alimentaria con resolución de las principales cogniciones alteradas con respecto al peso y a la imagen corporal.
− Restablecer un adecuado patrón alimentario.
− Conseguir el cese de conductas compensatorias y de las purgas.
− Tratar la comorbilidad psiquiátrica cuando exista.
− Prevenir las recaídas.
Criterios de hospitalización en pacientes con AN
Los criterios a considerar para la hospitalización en pacientes con TCA son (1,18,104):
− Un bajo IMC. La APA recomienda un IMC < 15 kg/m2 en adultos y un m%BMI < 75 % en niños / adolescentes (18). Otras guías proponen un punto de corte para el ingreso en un IMC < 14 kg/m2. El punto de corte para indicar ingreso es variable según los centros y a menudo depende de la disponibilidad de otros recursos.
− Pérdida grave del peso corporal (> 10 % en 6 meses o > 20 % en un año) (18).
− Fracaso del manejo ambulatorio.
− Negativa a la ingesta.
− Complicaciones médicas graves: bradicardia (FC < 50 lpm), hipotensión (PA < 90/60 mmHg en adultos y < 90/45 mmHg en < 19 años) u ortostatismo (caída de PA sistólica > 20 mmHg o aumento de FC > 30 lpm en adultos y 40 lpm en < 19 años), hipotermia, hipoglucemia, deshidratación, hipopotasemia, hiponatremia, hipofosfatemia, alteraciones ECG (arritmias, intervalo QT prolongado, etc.), enfermedad médica aguda intercurrente (por ejemplo, pancreatitis, rotura gástrica, hematemesis, diabetes mellitus descompensada, alteración hematológica grave, fallo orgánico, etc.).
− Abuso incontrolado de laxantes o diuréticos.
− Pérdida de control en los episodios de voracidad o purgas.
− Falta de colaboración y fracaso del manejo ambulatorio.
− Intento autolítico o ideación suicida.
− Patología psiquiátrica aguda (por ejemplo, psicosis, manía, etc.).
Tipos de régimen y lugares de ingreso
Siempre que sea posible debe realizarse un ingreso voluntario. Es habitual que el paciente se muestre reticente a ingresar. Esta resistencia al ingreso puede venir motivada por múltiples causas: la falta de conciencia de la enfermedad y de la gravedad de la situación orgánica (a menudo potenciada por la desnutrición), la ambivalencia de los pacientes con AN respecto al tratamiento del TCA (en el que parte del tratamiento en sí mismo [la renutrición] puede generar ansiedad) (18), el temor a estar solo y encontrarse separado de familiares y amigos durante el ingreso o el miedo a que el ingreso sea en una planta de psiquiatría, entre otros. En este sentido, es importante aclarar con el paciente no solo el motivo del ingreso hospitalario, sino los objetivos concretos que se buscan y la imposibilidad de que dicho plan pueda llevarse a cabo en otros ámbitos asistenciales. En aquellos pacientes que se oponen al ingreso, puede ser necesario, y se considera legal y éticamente aceptado, el ingreso involuntario cuando existe riesgo vital y el paciente no es capaz de tomar decisiones respecto a su salud (18). El ingreso involuntario es, por tanto, una medida de protección hacia el paciente (105). Es frecuente que este tipo de ingreso esté promovido por los familiares (105). Supone una decisión difícil, ya que, tal y como recogen Baile y cols.: “No siempre existe un cuadro claro de AN o de conductas alteradas relacionadas que permita una decisión fácil declarando una urgencia vital, aun cuando la situación corporal sea de extremo bajo peso” (105). Según estos autores, tanto la negativa a alimentarse como la presencia de un bajo peso extremo (aun sin descompensación psicopatológica) deben tenerse en cuenta como motivo de ingreso involuntario (105). Hay trabajos que describen que, en general, hay una menor tendencia por parte de los psiquiatras al ingreso involuntario de aquellos pacientes más crónicos (18).
En cuanto al lugar de ingreso, siempre que la situación clínica lo permita, es conveniente que se realice en unidades específicas de TCA que sean multidisciplinares y con personal entrenado en el manejo de TCA, ya que se han demostrado mejores resultados (18). En caso de no ser posible una unidad específica de TCA, el ingreso suele ser a cargo del servicio de psiquiatría (1), donde también se cuenta con personal entrenado. En estas unidades, a diferencia de aquellas de carácter médico, es posible la supervisión de las ingestas, así como cierto manejo conductual en el que existen refuerzos positivos (“privilegios”) o consecuencias negativas que pueden aplicarse a medida que se cumplen las pautas de tratamiento (por ejemplo, cumplir con las ingestas y los reposos) o se alcanzan los objetivos (mejoría ponderal) (18). Se reserva el ingreso en unidades médicas (servicio de endocrinología y nutrición, medicina interna, medicina intensiva, gastroenterología, etc.) a aquellas situaciones en las que se precisa un tratamiento o una monitorización médica que no puedan realizarse en una unidad de hospitalización de TCA o de psiquiatría (1). La Royal College of Psychiatrists contempla la posibilidad de que aquellos pacientes con alteraciones electrolíticas con riesgo de SR puedan ser ingresados en servicios médicos o en unidades de psiquiatría que cuenten con un excelente apoyo médico que permita el adecuado seguimiento clínico-analítico (55).
Valoración clínico nutricional y determinación del riesgo orgánico
Debe realizarse una evaluación inicial lo más completa posible con el objetivo de establecer la gravedad, el riesgo de complicaciones y planificar el abordaje terapéutico y el seguimiento a lo largo del ingreso. Desde un punto de vista orgánico, existe una serie datos de alarma que asocian una mayor gravedad. Sin embargo, el riesgo del paciente con AN debe interpretarse de una manera multidimensional (riesgo físico, psicológico y social). Por ello, la valoración inicial debe incluir:
− Anamnesis: se hará énfasis en hábitos nutricionales, restricciones cualitativas y cuantitativas, recordatorio de ingesta reciente y evolución ponderal. Se interrogará asimismo sobre la ingesta hídrica y las posibles conductas purgativas en forma de ejercicio físico o consumo de sustancias con efecto diurético o laxante (fármacos, infusiones o productos de herbolario). En las mujeres en edad fértil debe constar también la historia menstrual y la fecha del último periodo.
-
− Exploración física:
Constantes vitales: son frecuentes los hallazgos de bradicardia, hipotensión arterial y ortostatismo y, en algunos pacientes, hipotermia. Temperaturas axilares inferiores a 36 °C deben ponernos en alerta y menores a 35,5 °C son marcadores de elevado riesgo orgánico (55). Algunos mecanismos propuestos para estas alteraciones son el hipometabolismo o el aumento del tono parasimpático con reducción del simpático (106). Por último, se medirá la glucemia capilar. La hipoglucemia es un indicador de depleción grave de glucógeno y los síntomas adrenérgicos pueden están ausentes en estos pacientes, con el riesgo de debutar en forma de convulsiones, coma o incluso muerte súbita (59).
Antropometría: talla, peso y cálculo del IMC. A pesar de la limitación del IMC en la valoración nutricional, es un método sencillo y ampliamente disponible. De acuerdo con la clasificación del Royal College of Psychiatrists, se establece como grave un IMC inferior a 13 kg/m2 en adultos y m%BMI inferior al 70 % en menores de 18 años (55).
Exploración física: se hará una exploración completa por aparatos y sistemas. Merece especial atención el estado de hidratación, la auscultación cardiopulmonar, la palpación abdominal y la inspección de extremidades inferiores en busca de edemas. También se evaluarán posibles estigmas de vómitos autoinducidos, como alteraciones dentales o erosiones en el dorso de las manos.
-
− Pruebas complementarias:
-
Analítica de sangre: los datos analíticos deben integrarse como un elemento de la evaluación global, dado que en muchos pacientes de riesgo elevado la analítica basal no presenta alteraciones significativas.
○ Bioquímica básica con glucosa, gasometría, función renal, iones (sodio, potasio, calcio, cloro, fósforo y magnesio) y perfil hepático, así como hemograma y coagulación. En pacientes con conductas purgativas los hallazgos más frecuentes serán la alcalosis metabólica y la hipopotasemia, acompañadas o no de fracaso renal. La elevación inicial de transaminasas (particularmente ALT) puede responder a la apoptosis hepatocelular secundaria a la desnutrición (59). En el hemograma es posible encontrar citopenias de una o más de las series. La causa fundamental parece una hematopoyesis disminuida por degeneración gelatinosa de la médula ósea (55). Por último, podemos objetivar alteraciones de coagulación, como el incremento del tiempo de protrombina en relación a déficit de vitamina K.
○ De cara al ingreso se dejará solicitada una analítica completa que incluya TSH, T4 libre, T3 libre, ácido fólico, vitamina B12, 25 OH vitamina D y perfil ferrocinético. Se valorará también la inclusión de otros parámetros como vitaminas A, D y E, cobre, y zinc.
Sistemático de orina: una osmolaridad urinaria baja sugiere abundante ingesta hídrica. La determinación de iones en la orina es de interés en caso de alteraciones iónicas para filiar su etiología. También es habitual incluir un despistaje de tóxicos y drogas de abuso, así como un test de embarazo en los casos que proceda.
ECG: la bradicardia sinusal constituye el hallazgo más frecuente y no es un marcador de riesgo, salvo en su forma extrema. Merece especial atención la prolongación del intervalo QT como predictor de riesgo de arritmias potencialmente fatales. Su prolongación en pacientes con AN se debe a alteraciones electrolíticas (más frecuentemente, la hipopotasemia) o a determinados fármacos (59,106). Intervalos QT corregidos por FC ≥ 500 ms son un factor predisponente a arritmias ventriculares y el riesgo de muerte súbita es particularmente elevado para intervalos extremos (≥ 600 ms) (106).
Otras pruebas específicas en el momento inicial se decidirán en función de la situación clínica.
-
-
− Evaluación de otros aspectos que determinan la gravedad y el riesgo vital:
Seguimiento durante el ingreso hospitalario y detección de las principales complicaciones
Un adecuado manejo durante la hospitalización requiere de la colaboración estrecha entre todo el equipo implicado en el tratamiento del paciente. La coordinación entre psiquiatría, el equipo de nutrición y el personal de planta serán indispensables durante las distintas fases del ingreso.
Entre las competencias del personal de planta de hospitalización (enfermería y técnico en cuidados auxiliares de enfermería) destacan:
-
− Facilitar el cumplimiento de las normas relativas a la unidad de hospitalización y aquellas específicas establecidas por los médicos responsables.
− Registro de constantes vitales:
PA y FC. A lo largo del seguimiento, un aumento de FC > 20 lpm respecto a la basal se ha señalado como indicador precoz de SR (1).
Glucemia capilar: solo se monitorizará en pacientes muy graves o en las que se haya objetivado hipoglucemia en la valoración inicial.
− Control de peso: se recomienda su monitorización 2-3 veces por semana (1,55). Las condiciones deben ser de ayuno, después de la primera diuresis de la mañana y en ropa interior o con vestimenta ligera (55).
− Vigilancia y cuantificación de ingestas dietéticas y actividad en cada turno.
− Registro de otros aportes nutricionales vía oral o enteral.
− Ingesta hídrica y diuresis: se cuantificará en todos los pacientes en las fases iniciales; posteriormente, la necesidad puede individualizarse. También se registrará el hábito intestinal. El acceso al aseo debe realizarse bajo la supervisión necesaria para prevenir posibles conductas purgativas.
Desde el punto de vista médico, los elementos del seguimiento serán:
− Seguimiento clínico: se realizará periódicamente una anamnesis dirigida, con énfasis en la clínica cardiológica y respiratoria que pueda sugerir un SR. Por otra parte, es habitual que los pacientes refieran síntomas gastrointestinales como plenitud, estreñimiento o meteorismo. El origen suele ser funcional, secundario a la ralentización del tránsito digestivo, y se espera una mejoría durante la renutrición. Los pacientes con abuso crónico de laxantes pueden beneficiarse de su prescripción a dosis controladas si no se regula el hábito intestinal espontáneamente. Una complicación potencialmente grave de frecuencia desconocida en estos pacientes es el síndrome de la arteria mesentérica superior (59).
− Exploración física: se repetirá la exploración física completa diariamente al inicio y, tras los primeros 7-14 días, su frecuencia podrá espaciarse. Merece especial atención la auscultación y la exploración de los miembros inferiores en busca de edemas para evaluar datos incipientes de un posible SR.
− Electrocardiograma: se realizará de nuevo en caso de alteraciones iniciales que precisen monitorización o en presencia de cambios clínicos o analíticos.
-
− Analítica de sangre:
Se recomienda la monitorización diaria de la función renal y de los iones los primeros 7-10 días y, posteriormente, 1-2 veces por semana (1,55). En casos de alteraciones iónicas graves, puede ser necesaria la monitorización inicial cada 12 horas.
El perfil hepático y los parámetros hematológicos pueden controlarse 1-2 veces a la semana o en función de los hallazgos iniciales (55).
-
Otras determinaciones a considerar:
○ Propéptido natriurético cerebral N-terminal (NT-proBNP): se han descrito niveles elevados en algunos pacientes con AN, al igual que en otras situaciones de caquexia cardiaca, y se ha sugerido que puede ser factor causal y, simultáneamente, consecuencia de las modificaciones metabólicas y cardiovasculares derivadas de la desnutrición (107). Elevaciones significativas también pueden relacionarse con una sobrecarga de volumen en un SR. Sin embargo, su interpretación no está estandarizada en este contexto y las guías actuales no mencionan su inclusión en los protocolos analíticos.
○ Creatina cinasa (CK): pueden encontrarse elevaciones marcadas en relación con rabdomiólisis en contexto de un SR (55).
-
− Otras pruebas complementarias: se valorarán en función de la situación clínica y de la disponibilidad.
Ecocardiograma: los hallazgos estructurales más frecuentes serán la disminución de la masa ventricular con prolapso mitral secundario y el derrame pericárdico (106). Estas alteraciones suelen ser leves-moderadas, sin repercusión clínica y reversibles con la renutrición. La fracción de eyección está conservada en la mayoría de pacientes. Un derrame pericárdico grave con o sin compromiso de la fracción de eyección pueden alertar sobre el desarrollo de un SR. Por último, se han descrito casos de miocardiomiopatía de tako-tsubo que podrían relacionarse con la descarga adrenérgica ante una hipoglucemia (59).
Monitorización cardíaca mediante telemetría. La evidencia reciente señala que el desarrollo de arritmias en pacientes con TCA está directamente relacionado con la presencia de alteraciones electrolíticas (108). Por tanto, la telemetría podrá valorarse en pacientes con alteraciones electrolíticas graves o QTc ≥ 500 ms (59). Por tanto, de acuerdo con lo mencionado en el apartado previo, el beneficio de este recurso debe individualizarse frente al manejo global en una unidad de psiquiatría.
Ecografía abdominal: la elevación inicial de transaminasas que revierte con el tratamiento nutricional no precisa evaluación adicional. Sin embargo, en ocasiones, las alteraciones aparecen o empeoran en el transcurso de la renutrición como resultado de una lipogénesis aumentada con infiltración grasa del hígado. En caso de alteraciones marcadas, la ecografía abdominal se considerará como parte del estudio de hepatopatía.
BIA: en pacientes ingresados, su realización periódica podría permitir una monitorización más completa de los cambios cualitativos en la renutrición, pero actualmente no existen recomendaciones al respecto en el ámbito de ingreso.
Tratamiento nutricional: dieta oral, SON, NE, NP
Respecto al abordaje nutricional inicial, los esquemas tradicionales planteaban estrategias eminentemente conservadoras, poniendo el foco en la prevención de un SR. Algunas de las recomendaciones eran posponer la renutrición hasta la normalización de iones o iniciar con aportes energéticos tan reducidos como 5-10 kcal/kg al día (108). Sin embargo, la tendencia actual es buscar un equilibrio entre la renutrición cautelosa y el abordaje efectivo de las complicaciones agudas y crónicas de la desnutrición. En general, existe consenso en iniciar el tratamiento nutricional sin demora, con reposición iónica simultánea, si es preciso. Sobre el aporte energético, en los últimos años ha habido resultados favorables en beneficios y seguridad para protocolos más agresivos de renutrición. Sin embargo, la evidencia es más concluyente en el subgrupo de pacientes menos graves, particularmente los de edad adolescente (109), y faltan datos para extrapolarla a todos los casos. Un trabajo retrospectivo reciente defiende también una pauta inicial agresiva (2000 kcal de media) en adultos con IMC < 13 kg/m2 (110). No obstante, la falta de reporte de casos de SR en esta serie podría atribuirse a una definición subjetiva, ya que la prevalencia de hipervolemia fue elevada y se realizó suplementación sistemática con fosfato.
Una aproximación intermedia es la propuesta por las guías del Royal College of Psychiatrists para la detección y el manejo de las emergencias médicas en TCA. En ellas se establecen diferentes recomendaciones atendiendo a la edad y al riesgo de SR. Algunos de los criterios que plantean para definir el alto riesgo de SR son: peso extremadamente bajo (IMC < 13 kg/m2 en el adulto o m%BMI < 70 % en < 18 años) o pérdida ponderal > 15 % en 3 meses, ingesta escasa o nula durante más de 3-4 días, niveles séricos bajos de fósforo, de potasio o de magnesio en analítica basal, leucopenia o enfermedad / complicación médica intercurrente (por ejemplo, infección activa, cardiopatía, hepatopatía o abuso enólico). En pacientes adultos que cumplan algunos de estos ítems, se sugiere una pauta de inicio a 10-20 kcal/kg al día e incrementos de 5 kcal/kg al día cada 2 días. En adultos estables sin datos de alto riesgo, proponen iniciar con 30-35 kcal/kg al día e incrementar a 200-300 kcal cada 2-3 días. En adolescentes < 18 años, se proponen 1400 kcal iniciales (o hasta 2000 kcal en los de bajo riesgo) e incrementos de 200 kcal cada 24 o 48 horas. Un aspecto fundamental es no iniciar con menos calorías de las consumidas por el paciente antes del ingreso. El objetivo propuesto es de unas 60 kcal/kg al día (o hasta 2400 kcal) (55). En la práctica clínica pueden requerirse aportes de hasta 100 kcal/kg al día en algunos pacientes. Las recomendaciones más recientes acerca del objetivo del incremento ponderal semanal oscilan entre un mínimo de 0,5 a 0,9 kg y un máximo de 1,8-2 kg (18,55) a partir de la primera semana de ingreso.
En cuanto a la vía de nutrición, el pilar de tratamiento es la alimentación oral siempre que sea posible. El tratamiento dietético es la opción más fisiológica y económica y facilita el inicio de la EN. Se prescribirá una dieta variada, dividida en 3 comidas principales y 1-2 snacks, y la composición no será negociable con los pacientes. Los aportes energéticos irán progresándose según lo mencionado previamente. En la medida de lo posible, las ingestas tendrán un límite de duración y se contará con la supervisión directa del personal de planta durante y después de estas (1). No existen ensayos aleatorizados que avalen una distribución concreta de macronutrientes, aunque algunos autores plantean que evitar un excesivo aporte de carbohidratos limita el riesgo de SR (55).
La incorporación de SON hipercalóricos puede facilitar el alcance del objetivo de aportes nutricionales. Las indicaciones más frecuentes son el estancamiento ponderal pese a la optimización de aportes dietéticos, y la de complemento o, en casos seleccionados, alternativa a la dieta antes de recurrir a una NE.
La indicación más frecuente para la NE es la negativa a la ingesta oral a expensas de dieta o SON. La SNG es de primera elección, por ser la opción menos invasiva y que permite su colocación al pie de la cama. A ser posible, en pacientes estables se permitirá un margen de 24 horas, ofreciendo la vía oral antes de definir la necesidad de SNG (55). La NE por SNG también se ha propuesto como medida inicial en pacientes inestables o de riesgo orgánico extremo (1,55), especialmente aquellos con hipoglucemia (59). En estos escenarios la decisión sobre su indicación no es demorable. En la elección de la fórmula y de la pauta de administración deben considerarse la situación clínica, las necesidades y la tolerancia individuales. De manera general, una fórmula hipercalórica y una pauta intermitente tienen la ventaja de acortar el tiempo de administración, lo que evita manipulaciones por parte de los pacientes y limita la duración del estrés derivado de recibir la NE. En pacientes que precisen contenciones para recibir la NE, se ha sugerido prescribir el mínimo de tomas al máximo volumen tolerado y priorizar el uso de jeringas frente a sistemas de gravedad o bombas (111). Sin embargo, en pacientes que hayan presentado hipoglucemias, una pauta continua podría ser más útil para garantizar un aporte lento y constante de carbohidratos. Cabe mencionar que las fórmulas hiperproteicas se han asociado a incrementos de urea; en estos casos se considerará el cambio a otras con menor densidad proteica (111). Por último, la NE por SNG puede indicarse como complemento a la vía oral cuando no se alcanza el objetivo ponderal pese a la optimización de dieta y SON. En estos casos, una de las alternativas es la pauta cíclica nocturna, aunque debe valorarse el potencial riesgo de manipulaciones de la bomba y de broncoaspiraciones en caso de gastroparesia (55). En todos los casos es importante establecer desde el inicio los requisitos para la retirada de la SNG y ofrecer siempre la vía oral tan pronto como lo permitan la situación clínica y el grado de colaboración. Una forma segura de realizar la transición es prescribir las tomas de NE tras la ingesta para completar aportes en función de esta.
La NP es una medida de último recurso para pacientes sin posibilidad de realizar los aportes por vía enteral. En este contexto, las indicaciones serían superponibles a las de otras situaciones clínicas. Debemos tener en cuenta que el riesgo de complicaciones infecciosas y metabólicas y su potencial gravedad es mayor en estos pacientes.
Síndrome de realimentación (SR)
Definición de síndrome de realimentación
Bajo el concepto de SR se engloban el conjunto de alteraciones metabólicas y clínicas derivadas de la reversión brusca de una situación de deprivación nutricional prolongada y catabolismo. El resultado es un cuadro de gravedad variable, desde los hallazgos analíticos asintomáticos hasta el fracaso multiorgánico con potencial letalidad. Dentro de este espectro, las manifestaciones más frecuentes son las alteraciones iónicas y el desequilibrio de fluidos. Entre los mecanismos subyacentes destacan el hiperinsulinismo reactivo a la provisión de carbohidratos y el déficit de tiamina. La tiamina actúa como cofactor enzimático de procesos anabólicos y un aumento de sus requerimientos se suma al frecuente déficit previo en pacientes desnutridos.
La hipofosfatemia es la manifestación analítica más precoz y característica del SR, seguida de la hipopotasemia y de la hipomagnesemia. Las consecuencias potenciales del descenso de iones séricos incluyen miopatía / rabdomiólisis, debilidad diafragmática, convulsiones y alteraciones cardíacas tanto a nivel contráctil como bioeléctrico, con riesgo de insuficiencia cardíaca y arritmias, respectivamente. Además, el déficit de tiamina y la inhibición de la natriuresis mediada por insulina contribuyen a cuadros de insuficiencia cardíaca de alto gasto, con edema periférico, disnea y congestión pulmonar. Cabe destacar que el edema periférico no siempre se debe a una insuficiencia cardíaca: en pacientes con conductas purgativas, la hipovolemia sostenida conduce a un hiperaldosteronismo secundario que ocasiona retención hidrosalina al restaurar los aportes de fluidos (59). Estos casos suelen acompañarse de alcalosis e hipopotasemia marcadas. La encefalopatía de Wernicke es la manifestación neurológica más característica del déficit de tiamina (108). Su diagnóstico es fundamentalmente clínico. Es característica la triada formada por cambios en el estado mental (confusión, desorientación, etc.), ataxia y alteraciones oculares como nistagmo horizontal u oftalmoplejía; sin embargo, solo una minoría de casos debuta con el cuadro completo (112). En sujetos no tratados puede evolucionar a un síndrome de Korsakoff, complicación severa e irreversible que asocia amnesia retro- y anterógrada con confabulación. Otras repercusiones del déficit de tiamina incluyen la neuropatía periférica sensitivomotora y la acidosis láctica, esta última mediada por la disfunción de la lactatodeshidrogenasa (108). La hepatopatía es otra complicación descrita en el transcurso del SR, aunque en sus presentaciones más graves con fallo hepático agudo es necesario descartar otras causas concomitantes (55) (fármacos, infecciones, etc.). Debido a esta variabilidad clínica, los criterios para definir el SR han sido heterogéneos y controvertidos a lo largo del tiempo. En un intento de unificación, el consenso de la American Society For Parenteral And Enteral Nutrition (ASPEN) propone una definición basada en criterios analíticos: 1) disminución en al menos uno de los electrolitos claves (fósforo, potasio o magnesio), y 2) que ocurra durante los primeros 5 días de iniciar o incrementar aportes energéticos. La clasificación de gravedad propuesta por este grupo es: SR leve en caso de disminuciones en los niveles de electrolitos del 10-20 %; moderado para el 20-30 % y grave para > 30 % o disfunción orgánica asociada a las alteraciones iónicas o al déficit de tiamina (108).
Prevención del síndrome de realimentación
Las medidas de prevención incluirán la renutrición gradual, la suplementación profiláctica de micronutrientes y la monitorización electrolítica estrecha con reposición precoz de déficits.
− Aportes energéticos: el objetivo de aportes energéticos fijado para la renutrición debe alcanzarse gradualmente para mitigar los cambios metabólicos implicados en el SR y facilitar el manejo precoz de posibles alteraciones. Los aportes iniciales y el ritmo de progresión deberán individualizarse según la estratificación basal de riesgo de SR. Se ha planteado la utilidad de limitar las calorías procedentes de carbohidratos a un máximo del 40 % (1). Cabe destacar que los pacientes con TCA se han incluido entre los colectivos de especial riesgo de SR. Sin embargo, la ausencia de inflamación concomitante hace que este riesgo sea comparativamente menor al de otras condiciones médicas que cursan con respuesta inflamatoria significativa. Esto, unido a las frecuentes complicaciones derivadas de la desnutrición, ha llevado a plantear en los últimos años estrategias más agresivas en estos pacientes, según lo mencionado previamente.
− En cuanto a los micronutrientes, se recomienda la profilaxis con tiamina a dosis de 100-200 mg diarias y asociar un complejo multivitamínico y mineral, dada la frecuencia de carencias de micronutrientes en el contexto de las restricciones dietéticas. Estas medidas se mantendrán al menos los primeros diez días o hasta la estabilización clínica (1,55).
− Además de la reposición electrolítica guiada por analítica, existe controversia sobre la administración profiláctica de fósforo si los valores iniciales son normales. Las guías del Royal College of Psychiatrists plantean su utilidad en el subgrupo de población adulta con alto riesgo de SR (55). En el resto de casos, se procederá a la reposición de fosfato ante valores analíticos disminuidos o en el límite inferior y clara tendencia descendente.
− Otros: algunos autores proponen la restricción del aporte de volumen y de sodio (20-30 ml/kg al día de fluidos y < 1 mmol/kg al día de sodio) (1).
Todas estas medidas son de especial importancia en el abordaje inicial, dado que la ventana de mayor riesgo de SR son los primeros 5 días de la renutrición y especialmente las primeras 72 horas. No obstante, se han descrito casos tardíos, por lo que debería mantenerse cierto grado de monitorización unas 3 semanas tras el inicio del tratamiento médico-nutricional (55).
Tratamiento del síndrome de realimentación
Una vez instaurado no existe un tratamiento específico para el SR, sino que las actuaciones incluirán: tratamiento de apoyo con corrección agresiva de las alteraciones electrolíticas, ajuste cauteloso de los aportes nutricionales y de fluidos o manejo de la sobrecarga hídrica con diuréticos si es preciso. En pacientes inestables, estas medidas pueden requerir el ingreso en una unidad de cuidados intensivos para su monitorización y manejo. La administración de tiamina parenteral a dosis elevadas se ha recomendado para los síndromes clínicos derivados del déficit de tiamina (dosis iniciales de 200 y de hasta 500 mg 3 veces al día para la encefalopatía de Wernicke) (112), pero no existen recomendaciones específicas al respecto en TCA.
Reposo en cama y actividad física durante el ingreso hospitalario
El reposo absoluto en cama ha sido una de las medidas clásicas a llevar a cabo en los pacientes hospitalizados con AN. Los principales motivos que lo justificaban eran la disminución del gasto energético y el compromiso a nivel cardiovascular (113). No obstante, no hay estudios que demuestren un claro beneficio del reposo en cama en términos de mayor ganancia ponderal o seguridad (113). En cambio, se han documentado numerosos efectos deletéreos derivados de dicha inmovilización, como: mayores niveles de angustia, aparición de úlceras por presión, infecciones, trombosis venosa profunda, atrofia muscular y disminución de la densidad mineral ósea (113). En una revisión sobre el tema, se concluye que el reposo en cama es innecesario en la mayoría de las ocasiones y que, por tanto, su empleo debe evitarse de forma sistemática. Puede ser necesario en casos seleccionados y durante el menor tiempo posible (113). Guías recientes sugieren que la realización de actividad ligera (como pasear con el personal o los familiares) no entraña mayor riesgo y puede contribuir a disminuir la angustia (55). En pacientes con desnutrición grave con hipotensión ortostática y riesgo de caídas puede ser necesario de manera transitoria el uso de una silla de ruedas para los desplazamientos por la unidad, hasta que la reposición nutricional mejore el ortostatismo (113).
Duración de la hospitalización en pacientes con AN
La duración de la hospitalización varía en función del subtipo de AN, de la edad del paciente, del grado de desnutrición, del motivo que propició el ingreso o de las diferencias en cuanto a protocolos de ingreso y de alta en los distintos centros, entre otros. En un metaanálisis sobre estancia hospitalaria en pacientes con AN se objetivó una media de 76 días de ingreso (rango de 11,9 a 327 días) (114). En dicho estudio se vio que, por cada año que aumentaba la edad del paciente, se incrementaba en 3,25 días la estancia hospitalaria (114); por el contrario, se reducía en 17 días la estancia hospitalaria por cada kg/m2 de más que presentaban los pacientes al ingreso (114). Por otro lado, en estudios recientes se ha evidenciado una disminución de la estancia hospitalaria gracias al empleo de pautas más agresivas de renutrición (103).
En general podríamos decir que existen dos perfiles de ingreso según la duración. Aquellos ingresos más cortos, que buscan no tanto un peso objetivo, sino la estabilización médica o romper el ciclo de “atracones / purgas”, y aquellos ingresos más prolongados, en los que habitualmente el motivo de ingreso está estrechamente relacionado con un bajo IMC o una importante pérdida de peso y en el que la ganancia ponderal específica constituye un objetivo para el alta. Los estudios que tratan de averiguar qué enfoque es mejor son difíciles de comparar entre sí (104). La heterogeneidad en cuanto a los criterios de ingreso, la gravedad de la desnutrición, las pautas de alimentación (oral frente a sonda) y la posibilidad de disponer al alta de programas de hospitalización parcial nos obliga a individualizar con cada paciente. No obstante, la tendencia en general es a realizar ingresos más cortos que lo que tradicionalmente venía haciéndose, ya que el mayor beneficio se encuentra al inicio del ingreso (103).
La Royal College of Psychiatrist considera adecuada en el paciente pediátrico / adolescente una duración aproximada de 3 semanas de ingreso hospitalario (aunque sujeta a variación según la gravedad, el apoyo al alta, etc.) (55). Los resultados de algunos trabajos plantean la posibilidad (al menos en pacientes jóvenes) de acortar la estancia hospitalaria cuando se garantizan al alta programas de hospital de día de TCA, o incluso plantear dicho recurso como alternativa a un ingreso hospitalario completo en presencia de estabilidad médica (104).
En algunos centros se establecen programas de transición, con salidas del hospital inicialmente por las tardes y durante un fin de semana después, con el fin de valorar la readaptación del paciente cuando está fuera del centro (1).
Criterios de alta hospitalaria en pacientes con AN
El alta hospitalaria requiere, en primer lugar, la resolución del motivo que indicó el ingreso (ya sea médico o psiquiátrico), pero, además, debe contemplar:
− Estabilidad médica y psiquiátrica.
− Restablecimiento del peso corporal. El peso objetivo debe ser individualizado para cada paciente dependiendo de su situación clínica, de la capacidad y motivación para seguir el tratamiento al alta y del tipo de recurso asistencial tras la hospitalización. Si bien es cierto que alcanzar un peso lo más cercano al peso objetivo del paciente se asocia a un menor riesgo reingreso (18), hay que hacer balance y tener en cuenta también el impacto en la esfera psicosocial en relación a ingresos demasiado prolongados (103). El mantenimiento del peso objetivo durante un periodo de tiempo antes del alta hospitalaria disminuye el riesgo de recaída (18).
− Control significativo de las alteraciones conductuales.
− Asegurar la continuidad asistencial al alta.
Es importante que se mantenga una estrecha coordinación y comunicación entre niveles asistenciales que permita la adecuada transición del paciente entre los distintos ámbitos clínicos. Es de utilidad que dicha coordinación recaiga en un profesional asignado (18).
HOSPITALIZACIÓN PARCIAL
La hospitalización parcial o HDDTCA es una modalidad de tratamiento para los TCA a medio camino entre el tratamiento ambulatorio tradicional y la hospitalización completa (1). Esta modalidad de tratamiento permite un manejo intensivo durante el día (con aspectos similares a una hospitalización completa), pero con la ventaja de mantener al paciente en su entorno familiar y social (1,103).
El HDDTCA es un recurso asistencial muy valioso para el manejo de la AN. Ha demostrado mejoría del peso, de los síntomas de la AN y de las comorbilidades, del funcionamiento social y de calidad de vida (103). En muchas ocasiones (especialmente en jóvenes) permite acortar la estancia hospitalaria cuando se garantiza al alta un programa en el HDDTCA (115). Algunos autores consideran la hospitalización parcial como una alternativa al ingreso hospitalario completo en presencia de estabilidad médica (103,104,115). Este planteamiento ofrece la ventaja de mantener el entorno controlado de ingestas sin el aislamiento que supone la hospitalización completa, todo ello con un menor coste económico (103). Cabe destacar el trabajo de Serrano-Troncoso y cols., en el que un programa de HDDTCA de 11 horas diarias evitó la hospitalización completa en 7 de cada 10 pacientes tratados, y en aquellos ya hospitalizados, permitió la disminución de la estancia hospitalaria un tercio (115).
Objetivos de la hospitalización parcial
Los objetivos del HDDTCA son (1,18,103,116):
− Rehabilitación nutricional alcanzando el peso objetivo que se haya determinado de forma individualizada en cada paciente. La APA recomienda una ganancia ponderal de 0,45 a 1,3 kg a la semana para pacientes en régimen de hospital de día (18).
− Adquisición de hábitos alimentarios y de patrón de ingesta saludable.
− Cese de las conductas compensatorias.
− Control de los síntomas del TCA.
− Detectar y tratar los factores mantenedores del trastorno alimentario.
− Promover la integración laboral o académica y social del paciente.
− Resolver la conflictividad familiar normalizando las relaciones familiares.
− Evitar o disminuir el número de ingresos en hospitalización completa.
Derivación del paciente con AN al HDDTCA
Para considerar que un paciente se beneficia de la hospitalización parcial debemos tener en cuenta dos aspectos: que presente indicación para ello y que cumpla un mínimo de requisitos.
La indicación y el acceso al HDDTCA puede ocurrir (115,116):
Como continuidad tras la hospitalización completa (como transición hacia el manejo ambulatorio).
-
Desde el ámbito ambulatorio, cuando, en ausencia de criterios de hospitalización completa, se cumpla una o más de las siguientes circunstancias:
- Gravedad de los síntomas o la interferencia en la vida de la persona que requiere un tratamiento más intensivo.
- Fracaso del tratamiento ambulatorio por ausencia objetiva de mejoría ponderal.
- Presencia de recaídas frecuentes en régimen ambulatorio.
- Conflicto en las relaciones familiares o psicopatología familiar que no se pueda manejar ambulatoriamente.
Además de contar con la correcta indicación, para poder remitir a un paciente al HDDTCA deben cumplirse los siguientes requisitos (1):
− Tener un diagnóstico de TCA de acuerdo con los criterios DSM-5.
− Presentar motivación para el cambio y compromiso de cumplimiento que garanticen una adherencia adecuada.
-
− Ausencia de contraindicaciones. Se consideran como tal las siguientes:
- Abuso / dependencia de drogas.
- Desnutrición grave. Es necesario que el paciente presente un estado nutricional mínimo para poder recibir tratamiento psicológico y EN, por lo que habitualmente no se aceptan pacientes con grados de desnutrición muy graves. Algunos centros ponen un punto de corte de IMC determinado (15-16 kg/m2, frecuentemente). No obstante, algunas guías desaconsejan emplear puntos concretos de corte de IMC para decidir la admisión de un paciente en un programa de hospitalización parcial (40).
- Complicaciones agudas que requieran un ingreso hospitalario.
- Comorbilidades / complicaciones o trastornos psiquiátricos graves (intento de suicidio, trastorno psicótico, depresión mayor, trastorno de personalidad descompensado, etc.).
- Ausencia de apoyo familiar.
Modalidades y programas de hospitalización parcial
Existen distintas modalidades de hospitalización parcial según la duración, así como diferencias en cuanto a las prestaciones disponibles. Según las necesidades del paciente, el HDDTCA puede ofrecer atención de intensidad variable tanto en número de días (diario, los días laborables o días sueltos) como en número de horas al día (día completo o parcial, en horario de mañana o tarde, abarcando las principales ingestas). La atención por parte de un equipo multidisciplinar incluye: tratamiento médico, terapia nutricional (comidas acompañadas / vigiladas), educación nutricional y atención psiquiátrica y psicológica en modalidad individual o grupal. Es especialmente importante en este tipo de recurso asistencial la terapia ocupacional y el apoyo social (1). En la tabla XI se resumen las distintas modalidades y recursos de un HDDTCA.
Tras un proceso de evaluación inicial debe realizarse un plan individualizado de tratamiento en el que se detalle la terapia psicológica, el tratamiento farmacológico si es necesario, los objetivos terapéuticos, el plan de alimentación, el objetivo de peso, la intervención familiar, las actividades grupales, la intervención de otros profesionales (trabajo social, terapeuta ocupacional, etc.), los plazos para la reevaluación, etc. (116). Debe informarse de dicho plan terapéutico al paciente y al familiar (previo consentimiento del paciente para ello) y cerciorarse de que se comprende y se acepta (116). Algunos centros optan por la realización de un “contrato terapéutico” con el paciente (1). Se recomienda la entrega de información de acogida (folleto o tríptico) que incluya detalles sobre los horarios, las normas y las actividades.
Desde el punto de vista nutricional, cabe resaltar el comedor terapéutico, donde no solo se sirven las distintas comidas según el régimen de hospitalización parcial que precise el paciente, sino que constituye una herramienta más de la EN de los pacientes con AN. Los pacientes deben recibir una dieta variada, equilibrada y ajustada a las necesidades según su circunstancia clínica. Cuando los requerimientos son elevados y es difícil que se cubran a través de la dieta ordinaria, existe la posibilidad de añadir SON de forma temporal y supervisado por el personal de la unidad. La necesidad de NE por sonda es poco habitual en este escenario clínico, ya que su necesidad suele ir asociada al ingreso hospitalario completo.
Criterios de finalización de la atención en hospitalización parcial
La finalización del programa de HDDTCA puede ocurrir en las siguientes circunstancias (1):
− Necesidad de transferir al paciente a hospitalización completa por empeoramiento del TCA o aparición de complicaciones que requieran manejo o monitorización más estrecha.
− Alta del HDDTCA a régimen ambulatorio tras alcanzar los objetivos terapéuticos establecidos de forma individualizada al ingreso (corregir los comportamientos alimentarios alterados, mejoría de los síntomas de AN, restablecimiento ponderal hasta el objetivo, asegurar un apoyo sociofamiliar adecuado, etc.). Debe garantizarse el seguimiento, la continuidad de los cuidados y la atención al alta.
− Falta de colaboración y de adherencia al tratamiento.
HOSPITALIZACIÓN DE MEDIA ESTANCIA PARA TCA
La hospitalización de media estancia para TCA consiste en centros o unidades de hospitalización de psiquiatría específicas para TCA que se reservan para aquellos pacientes más complejos, con múltiples recaídas, con o sin otras comorbilidades psiquiátricas, en los que los recursos previos han fracasado y que precisan estancias más prolongadas de hospitalización completa (hasta de 6 meses). Este ámbito de tratamiento ha demostrado ser beneficioso en cuanto a mejoría a medio-largo plazo de la psicopatología del TCA y en el IMC (103).
Los objetivos generales de esta modalidad no difieren de aquellos descritos en la hospitalización. No obstante, por el perfil de paciente para el que está enfocado, se persigue especialmente la promoción de una mayor autonomía que favorezca la posterior reinserción al alta y que se mantenga en el tiempo.
EDUCACIÓN NUTRICIONAL EN PACIENTES CON ANOREXIA NERVIOSA
Dentro de la educación para la salud se encuentra la rama de la EN, cuyo fin es lograr el cambio de la conducta alimentaria hacia patrones más saludables. Para alcanzar este objetivo es necesario el desarrollo de programas de EN dirigidos tanto al paciente como a su entorno, incidiendo en los diferentes factores que condicionan las elecciones alimentarias y las actitudes hacia la alimentación y la nutrición (3).
La EN dirige sus recursos hacia el aprendizaje, la adecuación y la aceptación de hábitos alimentarios saludables con base en la propia cultura alimentaria y con los conocimientos científicos en materia de nutrición. La información adecuada puede motivar al cambio y promover el desarrollo de habilidades que permitan una elección adecuada de alimentos y que faciliten adquirir y mantener esta conducta positiva en el tiempo (1). En el caso de la AN, dicha EN puede llevarse a cabo en los distintos ámbitos de tratamiento (hospitalización, hospital de día, consultas externas, etc.), teniendo en cuenta distintos objetivos y diferentes estrategias educativas en cada una de ellas (117).
En lo que respecta a los TCA (concretamente, a la AN), la EN es un componente esencial del tratamiento y se enmarca en los siguientes objetivos (1,117):
− Promover la educación individualizada dentro del marco de una alimentación saludable.
− Mejorar la actitud y el comportamiento en relación con la comida.
− Lograr un número adecuado de comidas al día.
− Corregir la ingesta energética, así como de micro- y macronutrientes.
− Alcanzar una mejora en el patrón alimentario cumpliendo con la ingesta recomendada de los grupos básicos de alimentos.
− Aclarar mitos y errores derivados de fuentes inadecuadas de información que condicionan y limitan la alimentación.
− Favorecer con todos estos cambios la recuperación del estado nutricional.
− Orientar al paciente y a su entorno respecto de la conducta a seguir e incrementar su motivación para que coopere en el tratamiento.
Los pacientes con TCA, especialmente con AN, suelen tener abundante información sobre la energía que aportan los alimentos, pero carecen de conocimientos más amplios sobre nutrición, que les harían ser capaces de planificar su consumo de alimentos de una forma más razonada y amplia. Estos pacientes a menudo tienen creencias muy difíciles de cambiar referidas a los alimentos “saludables” y “no saludables” y con frecuencia recurren a fuentes de información no científicas (3). Por este motivo, la EN profundiza más allá de aportar conocimientos o información sobre los alimentos y sus nutrientes. Persigue un cambio de comportamiento, procurando que el paciente tome conciencia del problema y ayudándole a descubrir los beneficios que los cambios pueden reportarse, proporcionándole herramientas que favorezcan el desarrollo de habilidades que propicien una elección alimentaria adecuada y duradera en el tiempo: en definitiva, ayudándole a saber qué hacer y cómo actuar para mejorar la nutrición (117).
Según la APA, el consejo nutricional puede resultar útil como coadyuvante de otras modalidades terapéuticas, ya que minimiza la restricción de alimentos, aumenta la variedad de la comida y fomenta el ejercicio moderado (1,118). De esta manera, las diferentes estrategias de EN llevadas a cabo deberán estar protocolizadas y deben formar parte de la atención especializada y multidisciplinar que recibe el paciente. Asimismo, resulta de gran valor que la EN sea recibida tanto por el paciente como por su entorno (3,18). Es importante que se extienda a las familias, ya que mejora la eficacia de las intervenciones educativas al facilitar la aplicación práctica y la adherencia de todos los miembros a los nuevos modelos conductuales propuestos (119).
La correcta indicación de la EN es un aspecto sustancial, dado que el momento de su implementación y la adecuada selección de sus beneficiarios son claves para su aprovechamiento (1). Será fundamental que el paciente posea un estado nutricional mínimo que garantice el aprovechamiento de la educación (120), esté motivado y preparado para el cambio, esté de acuerdo en recibirla y comprenda los beneficios de la EN sobre su estado de salud (1).
Es importante que la EN la lleve a cabo un profesional con formación en nutrición, con conocimientos de psicología, con capacitación y experiencia en el tratamiento de los TCA y que, además, posea características personales adecuadas, como flexibilidad, empatía y paciencia (1), que facilitarán el vínculo profesional-paciente, de vital importancia en los TCA.
La EN también tiene un papel relevante en el área de prevención de los TCA. La prevención primaria de los TCA puede desarrollarse en los colegios y en diferentes poblaciones de riesgo, como deportistas, entrenadores, modelos, familias con adolescentes, etc. (3). Las acciones preventivas en los TCA son complejas debido a su etiología multifactorial y a la particularidad que entrañan los factores de riesgo de los trastornos psiquiátricos a causa del amplio número de sinergias entre sus factores de riesgo (121).
La EN puede plantearse fundamentalmente de dos maneras: individual o grupal. La elección de una u otra dependerá del momento, de la situación y de las necesidades que tenga el paciente. En ciertos casos ambas modalidades podrían ser complementarias. La EN individualizada suele aplicarse al inicio del tratamiento o en caso de recaída (3). Una vez que se ha realizado la educación individualizada contemplando las particularidades y las necesidades de cada individuo, puede plantearse el desarrollo de sesiones grupales con uno o varios profesionales sanitarios para orientarles en algunas situaciones frecuentes (122). Deberán establecerse unos criterios de inclusión bien definidos de entrada a un programa grupal con la finalidad de incluir en él a los pacientes que tengan conciencia de enfermedad, quieran cambiar su situación y accedan de manera voluntaria. Además, se ha sugerido la formación de grupos que contengan un número muy limitado de participantes (entre 6-8) e intentar que sean lo más homogéneos posible (3,122).
Existen protocolos de tratamiento en los que se sustituye la EN por la utilización de dietas programadas con diferente aporte lórico (1). Sin embargo, el paciente con una dieta estructurada sin EN se organizará de manera tal que puede permanecer durante años aferrado a una dieta o a un menú, incrementando el riesgo de desarrollar o de mantener comportamientos inadecuados en relación con la comida (123). Esto no solo resulta incorrecto desde el punto de vista nutricional, sino que también es socialmente inadmisible, ya que el paciente acaba condicionando sus actividades y su vida social a “su dieta” (1). La restricción disminuye las emociones positivas relacionadas con el alimento y produce un refuerzo positivo sobre la privación (123).
PATRÓN ALIMENTARIO
Uno de los aspectos claves para la planificación de la EN será el patrón alimentario del paciente. En la tabla II se resumen los diferentes hábitos y comportamientos que pueden orientar a la caracterización del patrón alimentario del paciente. En la tabla III se muestran las herramientas recomendadas para la valoración de la ingesta (3). Además, el empleo de fotografías o de aplicaciones móviles que reflejen la ingesta del paciente puede ser de utilidad para el seguimiento nutricional de los pacientes con AN. No obstante, su indicación debe ser individualizada y usarse con cautela para evitar promover comportamientos obsesivos en los pacientes.
En términos generales, podemos describir tres tipos posibles de patrones alimentarios en los pacientes con AN, lo que posteriormente nos ayudará en la planificación de la EN (Fig. 1). En la figura 2 se esquematizan las diferentes unidades didácticas según los patrones alimentarios que pueden abordarse en los pacientes con AN.
Figura 1. Patrones alimentarios y características en personas con anorexia nerviosa. Modificado de: Loria-Kohen V, et al. Nutritional education protocol in the treatment of eating disorders in the clinical and care settings. Nutr Hosp 2021;38(4):857-70 (3).
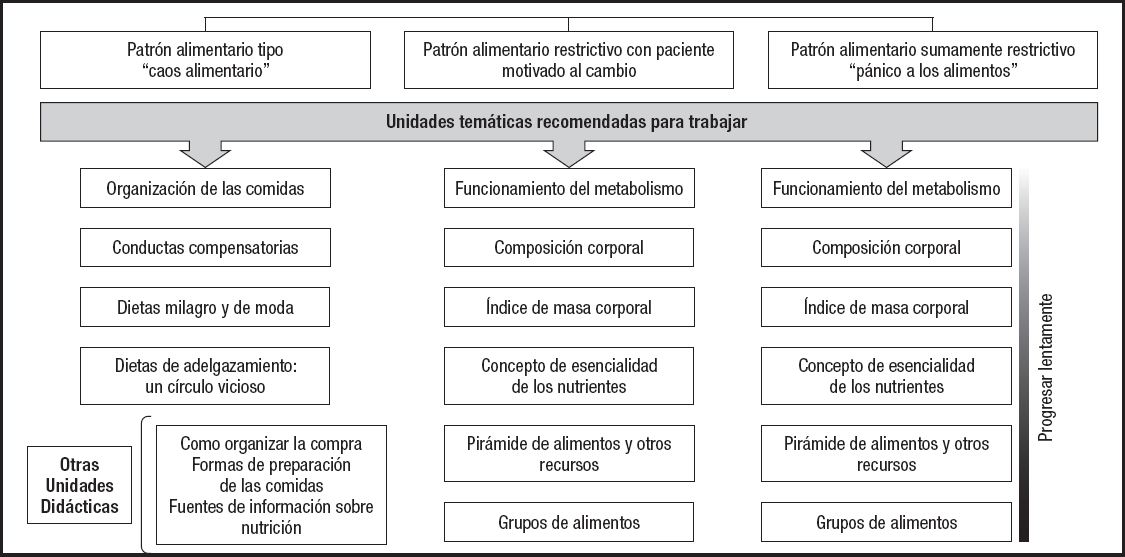
Figura 2. Contenidos educativos según el patrón alimentario del paciente con anorexia nerviosa. Tomado de: Loria-Kohen V, et al. Nutritional education protocol in the treatment of eating disorders in the clinical and care settings. Nutr Hosp 2021;38(4):857-70 (3).
Patrón alimentario tipo “caos alimentario”
En los pacientes en los que se identifica este patrón alimentario las acciones educativas irán dirigidas principalmente a la organización de los horarios de las comidas, a la mejoría de las conductas compensatorias y a la motivación a seguir un patrón de alimentación saludable, sin que esto suponga el “hacer dieta”. La propuesta de objetivos debe llevar a un ritmo lento para evitar el retroceso del paciente en busca de alternativas rápidas, como ayunos o dietas de moda, a la vez que se evalúan los avances en el estado nutricional y se proporciona al paciente información fiable con base en evidencia de manera clara y sencilla, que pueda ser fácilmente asimilable.
Patrón alimentario tipo restrictivo en paciente motivado al cambio
Cuando existe un patrón alimentario con estas características, los temas a desarrollar tienen como finalidad que el paciente conozca en qué consiste una alimentación saludable y equilibrada y comprenda que esto no significa “engordar” o ganar peso de manera inmediata (1).
El trabajo deberá hacerse de forma paulatina y mantenida en el tiempo, preferentemente con un grupo de alimentos cada vez, trabajando qué alimentos lo componen, qué nutrientes aportan, los mitos y los errores con relación a ellos y las raciones recomendadas de cada grupo en función de nuestro objetivo nutricional (3,119).
Después de indicar las raciones recomendadas de cada grupo de alimentos, deberán contrastarse con las raciones consumidas por el paciente, representadas a través del registro alimentario. Esto permitirá que el paciente, de una forma muy práctica y concreta, sea consciente en cuanto se aleja o se acerca de la recomendación. El paciente debe comprender que la finalidad de este trabajo es lograr un patrón alimentario que le conduzca a una alimentación equilibrada y saludable, que a su vez le permitirá tener una mejor calidad de vida (1). A partir de aquí, se pactarán “deberes” o “compromisos” para ir logrando un aumento gradual del número o del tamaño de las raciones y de la variedad de alimentos. Estos pactos o compromisos con el paciente deben ser lentos, graduales y adaptados a la motivación y a la capacidad de cambio del paciente. Si los objetivos planteados suponen pasos muy bruscos, probablemente se asuste y se sienta incapaz de llevarlos a cabo (1).
En aquellos pacientes en los que se suman conductas purgativas, como vómitos o ejercicio físico compensatorio, resultará muy útil trabajar sobre las consecuencias que tienen sobre su salud y su recuperación, promoviendo un aumento de la ingesta muy gradual que pueda ser sobrellevado por el paciente (1).
Patrón alimentario sumamente restrictivo
En esta etapa de la enfermedad la labor educativa es muy limitada, ya que con una ingesta energética tan reducida nos hallamos con un paciente incapaz de mantener la concentración, el interés y la motivación para realizar cambios del presente estado de salud (1).
Lo ideal es trabajar sobre el registro alimentario, negociando pequeños cambios que muchas veces se limitan a un yogur desnatado o un par de galletas más.
En ocasiones, se hace indispensable recurrir al empleo de suplementos nutricionales, ya que, a pesar de ser rechazados, es prioritario mantener una ingesta mínima y recuperar el estado nutricional. Cuando es necesaria la suplementación, seguirá siendo útil trabajar sobre pequeños cambios en el registro alimentario, ya que los suplementos no deben ser sustitutos de los alimentos, sino servir como complemento mientras que la alimentación continúe siendo peligrosamente limitada (1). En ciertos casos, y cuando el estado nutricional del paciente junto con la baja ingesta representan un riesgo vital, será necesario plantear un ingreso hospitalario y suspender la EN hasta que el paciente logre avanzar (1).
EVIDENCIA DE LOS PROGRAMAS DE EDUCACIÓN NUTRICIONAL EN LA AN
Si bien la efectividad de la EN en pacientes con AN se encuentra poco documentada, existen evidencias que demuestran que desarrollar la capacidad de propiciar una selección de alimentos basada en el concepto de alimentación saludable mejora la elección y el comportamiento con relación a la comida, favorece la recuperación nutricional y reduce las recaídas (120,121,123).
Ladrón-Arana y cols. (2023) realizaron una revisión sistemática para evaluar el impacto de las intervenciones educativas en pacientes con TCA. Destacaron que las EN pueden influir en mejorar el nivel de conocimientos, habilidades, actitudes y comportamientos de los pacientes con TCA y tener un efecto positivo en los resultados de salud, como la antropometría y mejoría de la sintomatología psiquiátrica (124).
Ruiz-Prieto y cols. (2013) evaluaron la modificación en la calidad de la alimentación tras un año de EN realizada por nutricionistas en 31 pacientes con AN. Tras un año de intervención lograron que los pacientes mejoraran su estado nutricional, redujeran los tiempos para seleccionar el menú, mejoraran la ingesta total de energía y el porcentaje de carbohidrato y de grasas consumido, aunque la evolución mostró un retroceso en los últimos 3 meses, lo que indicaba el desarrollo de una mayor habilidad para seleccionar su dieta y el conocimiento sobre alimentación saludable (123).
Como pioneros en España, en el Hospital Universitario La Paz se desarrolló un programa de EN con visitas semanales / quincenales durante 4-6 meses, en el que cada paciente recibió de 15 a 20 sesiones llevadas a cabo por una dietista-nutricionista (DN), que empleó material didáctico de diseño propio que incluyó medidas caseras, fotografías y formas de alimentos. Se desarrolló un estudio longitudinal para evaluar su utilidad, en el que se incluyeron 89 pacientes con TCA (59 % con diagnóstico de AN). El programa demostró ser útil para mejorar el estado nutricional de estos pacientes, tanto en lo referente a la evolución de los parámetros antropométricos como a su ingesta dietética. Al mismo tiempo, los pacientes mejoraron su actitud y comportamiento en relación con la comida y con su patrón alimentario y redujeron las conductas compensatorias (125).
Otro ejemplo de programa de EN en el contexto de la terapia psicológica lo encontramos en el Plate-by-Plate Approach®. Este método, que se explicará con más detalle en el apartado destinado al paciente pediátrico con AN, pretende la EN a través de recursos visuales, sin cantidades ni pesos (126).
Si bien la EN es una práctica común en el tratamiento de la AN, es necesario generar más evidencia científica para evaluar la efectividad de los programas educativos, con más estudios de investigación, especialmente ensayos controlados y aleatorizados (124). Los programas de EN llevados a cabo por profesionales cualificados y expertos deben formar parte del tratamiento de los TCA, junto al seguimiento médico y psicológico, y dentro del marco de la interdisciplinariedad y del trabajo en equipo (1).
PARTICULARIDADES DE LA EDUCACIÓN NUTRICIONAL EN EL PACIENTE PEDIÁTRICO CON AN
La OMS establece que la adolescencia ocurre entre los 10 y los 19 años. Se considera una etapa de crecimiento (aumento de peso y de talla y cambios en la composición corporal) en la que se completa el desarrollo del organismo y en la que la pubertad (maduración sexual) es el evento madurativo característico (16). A los cambios orgánicos se suman otros de índole psicológica (cambios en el estado de ánimo, preocupación por el aspecto físico, deseo de independencia de los padres o búsqueda del apoyo y de la aprobación de sus iguales, entre otros) (16). Todo ello contribuye a que sea una etapa de riesgo nutricional y a que puedan aparecer determinados problemas de salud, entre ellos, los TCA. De hecho, la adolescencia es la etapa de la vida en la que es más frecuente el debut de la AN.
Los niños con AN menores de 14 años, cuando se comparan con adolescentes y adultos, presentan más frecuentemente formas incompletas de la enfermedad, un menor tiempo de evolución del TCA antes del diagnóstico y menos deterioro del estado de salud inicial (127). A la hora de abordar al paciente en etapa adolescente, debe recordarse que, en general, consultan poco al médico o a la enfermería, y cuando lo hacen suele ser por otros síntomas o complicaciones secundarios, como amenorrea, fatiga, caída del pelo o síntomas gastrointestinales, menos frecuentemente por el TCA en sí mismo. En ocasiones, los familiares llevan al paciente en contra de su voluntad cuando el deterioro físico está avanzado. Es frecuente la falta de conciencia del problema, la vergüenza, el temor al ingreso, a aumentar su peso o a ser catalogado como enfermo mental. Es necesario, por tanto, establecer una buena relación terapéutica desde la empatía, la confianza y el respeto. La EN del paciente pediátrico requiere de profesionales (DN y enfermera de nutrición) con competencias y experiencia en el ámbito de la pediatría y de los TCA que trabajen de forma coordinada en el equipo multidisciplinar y con la familia (39,128).
Los principales aspectos que van a marcar la diferencia en cuanto al manejo del paciente adolescente (también usado el término “pediátrico” en adelante) respecto del adulto son dos: 1) los mayores requerimientos de este colectivo, que contempla la elevada demanda del crecimiento y del desarrollo, la actividad física y la enfermedad (16), y 2) el importante papel de los padres / cuidadores en el tratamiento.
Para comprender mejor el papel de los padres / cuidadores en el tratamiento del paciente pediátrico con AN, es necesario conocer algunos aspectos sobre la FBT. La FBT, tal y como se ha comentado previamente, se considera la terapia psicológica de elección en el adolescente con AN (18). El objetivo principal de esta terapia es establecer de forma eficiente la restauración ponderal y la salud del adolescente, ayudándose de los padres / cuidadores para alimentar a su hijo hasta que este pueda reanudar la actividad normal y comer de forma independiente (18). Inicialmente la FBT se enfoca en la realimentación y en el restablecimiento de un peso adecuado. En ella, los padres / cuidadores asumen la responsabilidad de los patrones de alimentación del paciente y el terapeuta brinda un apoyo continuo. Los padres son los responsables totales del control de la comida del paciente. Esto quiere decir que se ocupan de hacer la compra, elegir los alimentos que se compran, cocinar y preparar todas las comidas y tentempiés, supervisar y servir las comidas, ocuparse de poner las cantidades adecuadas y no negociar cantidades ni alimentos, así como de enseñarles a identificar y entender cuándo aparece la enfermedad. Si al mes no existe mejoría ponderal se intensifica el entrenamiento de los padres o se busca un nivel de atención más intensivo (18). En una segunda fase, una vez se ha restablecido el peso corporal, se busca conseguir la autonomía en la alimentación por parte del paciente, mientras que los padres o cuidadores continúan observando y supervisando las ingestas. No obstante, la FBT no establece cómo indicar a los padres lo que debe comer el paciente, sino que se asume que los padres van a saber alimentar correctamente a su hijo. No obstante, es preciso hacer una evaluación exhaustiva en este aspecto, ya que numerosas familias van a necesitar un apoyo considerable por parte de los profesionales de la nutrición para poder llevar a cabo esta tarea (129).
Respecto a los métodos para orientar a los padres en cómo nutrir a su hijo con AN (ya sea en contexto de una FBT u otras terapias), existen distintas posibilidades en la literatura, pero podemos diferenciar dos abordajes diferenciados. Uno consiste en entregar dietas cerradas con aportes calóricos concretos en las que los padres deben pesar los alimentos y llevar un contaje de las calorías diarias. Esta modalidad, relativamente frecuente en nuestro medio (88), es considerada por algunos expertos como un método rígido que podría contribuir a la obsesión de los pacientes por el control de las cantidades, y dificultar la introducción de alimentos que no constan en la dieta o a la realización de comidas fuera de casa (126). Además, puede generar cierto desconcierto y desconfianza en el equipo terapéutico cuando, en la transición a adulto, se desecha este tipo de manejo.
El segundo abordaje consiste en instruir a la familia (paciente y padres / cuidadores) sin emplear dietas fijas, ofreciendo otros recursos didácticos que permitan una mayor flexibilidad en la elección de la alimentación sin descuidar asegurar los apoyos necesarios a través del adecuado seguimiento por parte del profesional de la nutrición. En este sentido, encontramos un buen ejemplo en la literatura: el Plate-by-Plate Approach®. Se trata de un enfoque diseñado específicamente para la EN de los TCA adolescentes en el contexto de la FBT. Con este método se pretende enseñar las proporciones en el plato de los diferentes grupos de alimentos según las necesidades nutricionales del paciente a través de recursos visuales, sin cantidades ni pesos, con orientaciones de medidas caseras sencillas, para que sean los padres quienes se encarguen de establecer la alimentación basándose en una dieta variada, flexible y suficiente (Fig. 3) (126). En caso de necesitar una ingesta alta de nutrientes y de energía, los carbohidratos pueden representar hasta el 50 % del aporte del plato (de 25 cm); las proteínas, el 25 %, y el otro 25 %, las frutas y las verduras. El DN puede adaptar estos porcentajes de manera individualizada (126). Al plato, además, se le añaden alimentos que representen la grasa y una ración de lácteo (126). En caso de necesitar una ingesta menos energética, las cantidades pueden ir adaptándose para que todos los componentes del plato queden en proporciones iguales (un tercio de carbohidratos, proteínas y frutas / verduras) (126). Para realizar correctamente el método, deben ofrecerse 3 comidas principales, en la que cada plato de 25 cm de diámetro debe llenarse por completo, y 2-3 refrigerios compuestos de 2 a 4 alimentos, según las necesidades nutricionales del paciente (126). Las cantidades y las proporciones va controlándolas el DN según la evolución ponderal y otros aspectos dependientes del paciente y de la familia (126). Atendiendo a la evolución, puede ser necesario que el especialista observe a través de fotos las proporciones de las comidas para ir guiando a los padres en las cantidades y asegurarse de que se llenan los platos de manera adecuada.
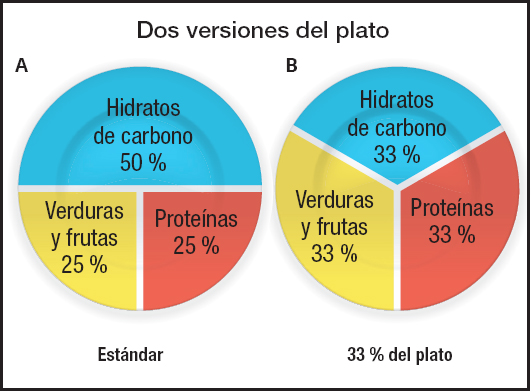
Figura 3. Ejemplo visual del Plate-by-Plate Approach®. A. Versión estándar o de altos requerimientos. B. Versión del 33 % o de moderados requerimientos. Modificado de: Hellner M, Steinberg D, Baker JH, Blanton C. Digitally Delivered Dietary Interventions for Patients with Eating Disorders Undergoing Family-Based Treatment: Protocol for a Randomized Feasibility Trial. JMIR Res Protoc 2023;12e41837. DOI: 10.2196/41837 (99).
El método del Plate-by-Plate Approach® no debe confundirse ni equipararse con otros métodos de “plato saludable” no diseñados para pacientes con TCA, como es el ejemplo de MyPlate® (126). MyPlate® es una modalidad de plato saludable creada por el Departamento de Agricultura de Estados Unidos para educar a la población general sobre nutrición (teniendo en cuenta el problema de sobrepeso / obesidad existente) que recomienda un plato con todos los grupos de alimentos, con la mitad del plato a base de frutas y verduras, por lo que tiene una baja densidad calórica y es insuficiente para adolescentes con trastornos alimentarios, especialmente para aquellos con altos requerimientos energéticos (126). Además, MyPlate® aconseja productos lácteos bajos en grasa, cuando dicha recomendación iría en contra de las recomendaciones para aumentar la densidad energética de la dieta en personas desnutridas con AN (126).
Los defensores del Plate-by-Plate Approach® sostienen que con este método (126,129):
− Los padres se sienten más empoderados para gestionar la alimentación de sus hijos junto con orientaciones del DN.
− Permite poder realizar comidas fuera de casa con mayor facilidad.
− La transición hacia una mayor autonomía del paciente es más fácil, pues ha adquirido cierto conocimiento práctico de las proporciones adecuadas. Además, los padres se sienten más seguros durante dicha transición, puesto que pueden seguir supervisando las proporciones de forma visual.
− Cuando el paciente no necesita una ingesta energética tan alta, la adaptación de las cantidades se realiza de manera más fluida, sin que el paciente lo perciba como una restricción o un cambio brusco en la ingesta.
− No se contribuye a la posible obsesión del paciente por el control de cantidades.
− Permite seguir haciendo comidas típicas y tradicionales de la familia, que quizás el paciente dejó de consumir, por lo que facilita la conciliación familiar.
− Permite la variedad de alimentos, de combinaciones y de comidas. Pueden utilizarse los diferentes grupos de alimentos y de ingredientes de varias maneras, por ejemplo, el lácteo como postre o como salsa.
− Facilita a los padres la inclusión de todos los grupos de alimentos en distintas ingestas y la flexibilización de las comidas, cocinando un plato único completo y con las cantidades y proporciones adecuadas, o realizar un primero y un segundo plato.
No existen en el momento actual estudios que comparen los distintos métodos de EN en el contexto del tratamiento de la AN. No obstante, hay en marcha un ensayo clínico en el que pretende evaluarse, en adolescentes con AN y terapia con FBT, la eficacia y la aceptación del plan nutricional basado en el contaje de calorías comparándolo con el Plate-by-Plate Approach® (99).
En resumen, la EN busca la mejoría del estado nutricional cambiando los hábitos inadecuados detectados en la valoración y ayudando a que sea posible una alimentación suficiente, variada, saludable, equilibrada y flexible, con mejoría en el patrón alimentario y con un número adecuado de ingestas, asegurando aporte energético de micro- y macronutrientes. Además, debe perseguir la mejoría de la actitud y del comportamiento en relación con la comida, trabajando los miedos, la actitud en las ingestas y eliminando los mitos y los errores derivados de fuentes inadecuadas de información que condicionan y limitan la alimentación (1). Cuando sea posible por edad y mejoría de la enfermedad, debe trabajarse en la motivación para adquirir autonomía hacia un patrón de alimentación normal y adecuado a sus necesidades por edad, sexo y situación clínica.
MANEJO E INDICACIÓN DE LA ACTIVIDAD Y DEL EJERCICIO FÍSICO EN EL PACIENTE CON ANOREXIA NERVIOSA
La actividad física (“entendida como todo movimiento corporal producido por los músculos esqueléticos y que exige un mayor gasto energético que estar en reposo”) es reconocida por su papel clave en la prevención y en el tratamiento de problemas psicológicos. Por este motivo, recientemente se han actualizado las recomendaciones de su práctica para mantener y mejorar la salud mental (130). Sin embargo, en lo que respecta a los TCA, la actividad física en exceso se ha considerado históricamente como uno de los síntomas de estos pacientes. Los pacientes hacen excesiva actividad física para perder peso y alcanzar su deseada delgadez. Además, se conoce bien el efecto a nivel neurofisiológico del exceso de actividad física, que puede producir una disminución del apetito y de la ingesta, y esta restricción, un incremento de la actividad, por lo que durante mucho tiempo se ha considerado que su práctica debía restringirse o hasta incluso prohibirse y no estaba considerada como parte del tratamiento en estos pacientes.
Sabemos que la práctica de ejercicio físico (entendido como “aquella actividad física planificada, estructurada y repetitiva que tiene como objetivo mejorar o mantener el rendimiento, la condición física o la salud”) representa un factor de riesgo para el desarrollo de AN. La etiología de los TCA es compleja y multifactorial y la práctica deportiva se ha descrito ampliamente dentro de los factores involucrados. Así, se ha observado que entre los deportistas de élite que compiten en deportes con categoría de peso es frecuente el uso de dietas y de medidas de control ponderal extremas para lograr un peso determinado antes de competir; algo que también se ha observado en los deportes estéticos (danza, patinaje, etc.) (131).
Además de su papel como factor de riesgo, el desarrollo de actividad física compulsiva o “ejercicio problemático” es un síntoma frecuente en los pacientes con AN. En estas circunstancias la actividad física se realiza con un rasgo de compulsividad y rigidez en el que (como sucede con el control de la comida y la restricción) su desarrollo tiene prioridad sobre otras actividades cotidianas para el paciente (como trabajar, estudiar, disfrutar de salidas o incluso sentirse extenuado o enfermo). La frecuencia con la que este síntoma aparece es difícil de determinar, ya que no existe un término único para definirlo. Algunos autores hablan de “hiperactividad”, “ejercicio excesivo” o “ejercicio compulsivo”. También se ha definido como “ejercicio problemático” aquel en el que se unirían dos aspectos: criterios cuantitativos (duración e intensidad) y criterio cualitativo (compulsión con la que se desarrolla). Teniendo en cuenta esta variabilidad en su definición (incluso en la distinción entre actividad y ejercicio físico), se ha descrito su presencia en un amplio rango de pacientes con AN 5-54 % (132). Otros autores describen su presencia en un 23,2 % de su muestra estudiada (133). A pesar de que su frecuencia es elevada, no debería asumirse como un síntoma presente en todos los pacientes ni igualarse las indicaciones para todos.
En los últimos años, varios autores han propuesto que la inclusión del ejercicio físico en el tratamiento convencional de los pacientes que padecen TCA puede ser de gran utilidad. Se han descrito diferentes efectos positivos (134-138):
− Protección frente a la menor densidad mineral ósea.
− Recuperación o mantenimiento de masa muscular.
− Efecto sobre la bradicardia y los síntomas gastrointestinales (como estreñimiento).
− Mejora de la función cognitiva, de la autoestima y disminución de la insatisfacción corporal.
− Mejora de la calidad de vida.
− Posible efecto modulador de la microbiota intestinal.
En algunos casos se recomienda la restricción de la actividad y del ejercicio hasta que el paciente esté médicamente estable, tenga un peso suficiente y sea capaz de compensar el gasto energético que conlleva con una suficiente ingesta energética (139).
En general no hay estudios en intervención durante fases agudas del tratamiento o durante periodos de hospitalización, lo que hace complejo establecer una recomendación al respecto. No obstante, la APA recomienda que el ejercicio en pacientes con AN gravemente desnutridos debe limitarse a 1,5 horas a la semana (18).
Superado este periodo, debe realizarse una reintroducción y una promoción del ejercicio saludable de manera graduada y supervisada.
Cook y cols. (2016) realizaron una revisión sistemática de estudios con la finalidad de proponer un protocolo de actuación en actividad física y sugiriendo una serie de aspectos claves, que debe incluir un programa de ejercicio terapéutico en el tratamiento con TCA (140):
− Emplear un equipo de expertos en la materia.
− Controlar en todo momento el estado médico del paciente.
− Proteger del ejercicio patológico o compulsivo, identificando los pacientes de riesgo (“ejercicio problemático”) y reconociendo cuándo el ejercicio está volviéndose problemático.
− Crear un contrato escrito de cómo se utilizará el ejercicio terapéutico.
− Hacer un uso apropiado del ejercicio para los beneficios de la salud (el ejercicio como salud y como diversión y no como medio para consumir calorías, diferencia entre el ejercicio problemático y la actividad física saludable).
− Trabajar la conciencia corporal (es decir, comprender los estados fisiológicos, la lesión y el dolor).
Además, estos autores sugieren el desarrollo de un programa de ejercicios de forma gradual, comenzando con ejercicios de baja intensidad y adaptar el ejercicio a las necesidades del paciente. Un límite superior razonable puede ser de 30 a 40 min al 70-80 % del esfuerzo máximo. Hay que incluir siempre el seguimiento nutricional (la alimentación deberá adaptarse). El estado nutricional debe estar monitorizado y el ejercicio no deberá incluirse hasta que se logre una mejoría en el peso corporal (140).
La indicación y la prescripción del ejercicio por especialistas como parte del equipo multidisciplinar siempre serán la situación ideal. Sería razonable comenzar con actividades como: paseos, bolos, juegos de pelota, equitación, ejercicios de fuerza, natación, gimnasia acuática, taichí, chi kung y yoga (141).
Hay evidencia de que la participación en programas de ejercicios estructurados y supervisados durante el tratamiento en los TCA es seguro (no compromete el aumento del peso ni tiene un efecto negativo en la antropometría), siempre y cuando se cubran las necesidades nutricionales (140,142).
Una revisión sistemática realizada en 2022, en la que se incluyeron 6 ensayos clínicos aleatorizados (ECA) con un total de 176 pacientes con AN, informó de que tras las intervenciones mejoraba la fuerza muscular, el comportamiento alimentario, la actitud hacia la comida, el estado de ánimo y la calidad de vida de los pacientes. Tres de los estudios incluían de forma paralela intervenciones nutricionales y cuatro terapias psicológicas. Ninguno de los estudios informó de efectos adversos. En dos de los ECA incluidos en esta revisión sistemática, el entrenamiento de fuerza y la resistencia de alta intensidad mejoraron la fuerza muscular de pacientes con AN. Además, la calidad de vida mejoró en dos estudios en los que se incluían estiramientos, ejercicios isométricos (ejercicios corporales que implican una tensión muscular, pero que no generan movimiento de contracción y extensión de los músculos), ejercicios cardiovasculares y musculares de resistencia. No obstante, los autores recomiendan la interpretación de los resultados con precaución y validarlos con nuevos estudios de mayor tamaño muestral y mejor calidad de diseño que permitan comparar diferentes tipos de intervenciones (143). Resultados similares se han reportado en otras revisiones sistemáticas recientes (144,145).
Por lo tanto, el ejercicio físico puede constituir una eficaz herramienta terapéutica, aunque es necesaria una prescripción adaptada y específica que contribuya a aprovechar los efectos positivos que puede tener su práctica y minimizar los riesgos para estos pacientes (146).
SITUACIONES ESPECIALES
ANOREXIA NERVIOSA Y DIABETES MELLITUS DE TIPO 1
Los TCA son relativamente frecuentes en personas con diabetes, especialmente en mujeres adolescentes y adultas jóvenes con diabetes mellitus de tipo 1 (DM1) (147). Esto puede relacionarse con la mayor preocupación y cuidados en torno a la alimentación, el peso y el ejercicio físico en los pacientes con diabetes. Además, los pacientes con DM1 y TCA tienen un control metabólico más deficiente, requieren hospitalizaciones más frecuentes y tienen más probabilidades de desarrollar complicaciones crónicas (especialmente microvasculares, entre las que destaca la retinopatía diabética) en comparación con aquellos sin TCA. También tienen una mayor tasa de mortalidad en comparación con los pacientes que solo tienen DM1 o solo un TCA (40). Por todo lo anterior, es importante evaluar a las personas con DM1 (especialmente a las mujeres jóvenes) para descartar un TCA y organizar el asesoramiento y el apoyo psicológico y nutricional adecuados cuando estén indicados (148).
La detección de un TCA en un paciente con DM1 puede resultar difícil, por lo que se requiere un alto índice de sospecha. En este contexto, destacan algunos signos y síntomas considerados “de alerta” en pacientes con DM1 que deben hacernos pensar en un TCA (149):
− Alteraciones bioquímicas: alta variabilidad glucémica, múltiples ingresos hospitalarios por descompensaciones agudas de la diabetes, cetosis recurrente e hipoglucemia grave recurrente.
− Creencias, comportamientos y funcionamiento en torno a la conducta alimentaria y a la diabetes: ejercicio físico excesivo, alteración de la percepción de hipoglucemia, restricción dietética extrema, atracones, antecedentes de pérdida de peso, miedo a aumentar de peso, preocupaciones sobre la imagen corporal, ansiedad por la diabetes, miedo a la hipoglucemia y comorbilidad psiquiátrica.
− A nivel psicosocial: secreto sobre el control de la diabetes, falta de adherencia al tratamiento (que se observa, por ejemplo, con la falta de solicitud de recetas de forma regular o con la desvinculación de los servicios de seguimiento de la diabetes), bajo rendimiento o absentismo escolar o laboral, conflicto en el hogar en torno a las comidas y a la alimentación o el control de la diabetes.
Ante la sospecha de un trastorno alimentario en relación a uno o más datos de alarma mencionados, debe investigarse un posible TCA. Además, algunas sociedades científicas recomiendan el cribado de los TCA para todos los pacientes con DM1, comenzando entre los 10 y los 12 años (150). Para ello, disponemos, traducidas y validadas al español, de la Encuesta de Problemas Alimentarios en Diabetes (EPAD), que se corresponde con su original en inglés: DEPS (Diabestes Eating Problem Survey) y de la Encuesta de Problemas Alimentarios en Diabetes Resumida (EPAD-R, que se corresponde con DEPS-R [Diabetes Eating Problem Survey - Revised]) (151).
En los pacientes con DM1, un TCA puede manifestarse con prácticas para el control del peso, como restricción alimentaria o ejercicio físico compulsivo; conductas purgativas, como vómitos o el uso de laxantes y diuréticos o con la omisión deliberada de la administración de insulina con el fin de perder peso (práctica a veces denominada “diabulimia”). En concreto, la restricción de insulina puede ser “directa” (omisión deliberada con el fin de perder peso, “diabulimia” como tal) o “indirecta” (disminución de la dosis de insulina secundaria a la disminución de la ingesta).
Se han propuesto algunos criterios para la conceptualización de la entidad de “paciente con DM1 y TCA”. Se trata de los siguientes (149):
− Diagnóstico de DM1.
− Miedo intenso a aumentar de peso, preocupaciones sobre la imagen corporal o miedo a que la insulina promueva el aumento de peso.
− Restricción directa o indirecta inapropiada y recurrente de insulina u otro comportamiento compensatorio para prevenir el aumento de peso.
− Restricción de insulina, trastornos alimentarios o conductas compensatorias que causen al menos uno de los siguientes: daño a la salud, malestar psicológico clínicamente significativo por la diabetes o deterioro del funcionamiento diario.
El manejo de pacientes con DM1 y AN va a requerir la estrecha colaboración de un equipo multidisciplinar, que incluirá (149): médicos especialistas en endocrinología y nutrición, enfermería especializada en educación diabetológica en contacto con enfermería especializada en salud mental y DN especializados en diabetes y TCA, así como psiquiatras y psicólogos especializados. En la valoración inicial y en las revisiones periódicas destacan como puntos claves la evaluación del IMC, la evaluación de la desnutrición, la necesidad de la rehabilitación nutricional y la necesidad de la reinsulinización y de la educación diabetológica actualizada.
Los sistemas de monitorización de la glucosa intersticial (ya sean sistemas flash o de monitorización continua en tiempo real) permiten una monitorización de glucosa más cercana y menos invasiva (siempre que el tejido graso subcutáneo permita la inserción del sensor y que este no afecte al bienestar físico y psicológico del paciente), con la opción de monitorización remota (que puede ser útil para coordinarse con el equipo terapéutico, para el control y el ajuste del tratamiento). La menor necesidad de realización de glucemias capilares también puede reducir la ansiedad relacionada con la diabetes y ser útil para las personas con fobia a las agujas. No obstante, la decisión de usar estos sistemas debe individualizarse en cada paciente, ya que en algunos casos puede empeorar el TCA y aumentar la ansiedad relacionada con la DM1 al incrementar la atención sobre las calorías y los carbohidratos (149).
Como un buen control metabólico puede asociarse con un aumento de peso, los cambios en los niveles objetivos de glucemia deben ser graduales. Establecer, inicialmente, objetivos de glucemia más laxos que los estándares (preprandial, entre 120-150 mg/dl, y posprandial, < 200 mg/dl) puede generar más beneficios a largo plazo (152). Lograr un control excelente de forma rápida puede resultar en un aumento de peso marcado, con las posibles consecuencias en la clínica psicológica y conductual. Por otra parte, un control más estricto de la glucemia se relaciona con un mayor riesgo de hipoglucemia, lo que puede resultar en un aumento de la ingesta. Los profesionales responsables deben tener en cuenta que estos pacientes pueden pasar con frecuencia de un comportamiento alterado a otro; por ejemplo, de la omisión de insulina a una alimentación restrictiva o atracones. Por lo tanto, debe realizarse una actualización en la educación diabetológica y nutricional en al que destaque la importancia de explicar el riesgo que supone la omisión de dosis de insulina.
Cuando tiene lugar un ingreso por descompensación del TCA en un paciente con DM1, conviene considerar, dentro del complicado manejo de estos pacientes, factores como el grado de desnutrición y de riesgo de SR, las dificultades en la reinsulinización o el riesgo de cetoacidosis. A modo de orientación, se tendrán en cuenta los siguientes puntos (149):
− En general, se recomienda el tratamiento con múltiples dosis de insulina (MDI). En el caso de los pacientes en tratamiento con ISCI (infusión subcutánea continua de insulina o bomba de insulina) que ingresan por un TCA, se recomienda el cambio a MDI. En casos excepcionales, el uso de ISCI puede continuarse durante la hospitalización, siempre que el personal encargado de supervisar al paciente haya recibido la capacitación adecuada en lo referido a manejo de nuevas tecnologías de la diabetes. Debe confirmarse por parte del equipo que el paciente puede usar su dispositivo de manera segura y deben revisarse regularmente las descargas y las configuraciones. Para prevenir la cetoacidosis debida a problemas con la cánula o el equipo de infusión, puede considerarse una dosis baja de un análogo de insulina basal de acción prolongada junto con la terapia con bomba de insulina.
− Si el paciente estaba omitiendo la administración de insulina, la usaba esporádicamente o en cantidades mínimas, puede iniciarse la reinsulinización con una dosis diaria de insulina de acción prolongada, calculada en aproximadamente 0,2 unidades/kg de peso corporal, con aumentos progresivos para cumplir objetivos. La pauta debe asegurar la supresión de formación de cuerpos cetónicos y acidosis. Además, se pautarán dosis fijas de 2 unidades de insulina de acción rápida antes de las comidas principales (inicialmente, sin insulina con los refrigerios). Con cada aumento de comida, se intentará aumentar la dosis inicial de insulina preprandial. Otra posibilidad es usar ratios; por ejemplo, una proporción inicial de una unidad de insulina de acción rápida por 2 raciones (20 g) de carbohidratos. Igualmente, esta proporción debe aumentarse y ajustarse progresivamente.
− En las fases iniciales del tratamiento nutricional y de reinsulinización, la glucosa puede permanecer elevada en sangre. Deben determinarse los niveles de cetonas en sangre ante hiperglucemia significativa.
− Se realizarán los aumentos progresivos de dosis y se introducirá también, si se requiere, insulina rápida antes de los refrigerios. A medida que se normalicen la conducta alimentaria y la administración de insulina, mejorará el control glucémico.
− Debe advertirse, además, que el uso de glucagón para tratar la hipoglucemia puede ser menos efectivo en aquellos pacientes DM1 con depósitos de glucógeno disminuidos en relación con una restricción importante de la ingesta de carbohidratos o ejercicio excesivo.
En cuanto al manejo ambulatorio de estos pacientes, más allá de la reintroducción inicial de insulina y de alimentos, y a medida que los niveles de glucosa en sangre se normalizan (junto con la mejoría de la clínica del TCA), las opciones incluyen (152): raciones predeterminadas de carbohidratos y dosis fijas de insulina o la reintroducción del contaje de raciones de carbohidratos y dosis variables de insulina (usando proporciones). Esta decisión también debe individualizarse en cada paciente.
Por otra parte, en lo referido al uso de ISCI en el medio ambulatorio, algunos estudios han objetivado una disminución de las conductas alimentarias alteradas en adolescentes con DM1 a los 6 meses del inicio de la terapia con ISCI, que presentan, además, una HbA1c menor, comparados con los pacientes con DM1 y TCA que usan MDI (152). No obstante, el control metabólico en pacientes con TCA y DM1 sigue siendo significativamente peor (ya sea en tratamiento con ISCI o con MDI) comparados con los que no tienen TCA, y no existe evidencia suficiente que apoye la indicación de inicio de terapia con ISCI tras el diagnóstico de TCA en un paciente con DM1.
Finalmente, destacamos de nuevo la relevancia de los TCA en pacientes con DM1 por su elevada prevalencia, sus peores resultados clínicos y sus potenciales riesgos para la salud. Es necesario continuar investigando para conseguir mejorar las estrategias de prevención y de detección precoz de TCA en pacientes con DM1, así como para optimizar su tratamiento, especialmente complejo (153).
ANOREXIA NERVIOSA Y VEGETARIANISMO
Se entiende por dieta vegetariana aquella alimentación a base de plantas (verduras, frutas, cereales, semillas, frutos secos, legumbres y tubérculos) que excluye productos de origen animal como carne, pescado, aves de corral y productos que contienen estos alimentos (154). Este término incluye patrones alimentarios muy diferentes que dan lugar a una terminología particular (ovovegetariano, ovolactovegetariano, lactovegetariano, vegano / vegano total o semivegetariano / flexitariano) y que no se comportan igual desde el punto de vista de la conducta alimentaria ni de la motivación que conlleva adoptar dicho patrón alimentario. En general, la dieta vegetariana, bien planificada y suplementada, se considera un patrón de alimentación saludable y adecuado como estrategia para mejorar el estado de salud, apta en cualquier etapa de la vida (154). No obstante, el incremento de la adherencia en los últimos años a este tipo de alimentación por parte de la población y su posible papel en la etiología o en el mantenimiento de los TCA motiva prestar atención cuando la adoptan pacientes con AN.
La British Dietetic Association (BDA) sostiene que una proporción significativa de pacientes con AN han practicado de alguna manera el vegetarianismo (155). En el Reino Unido se realizó una encuesta para conocer cuántos pacientes hospitalizados con TCA se identificaban como veganos en el momento de la admisión. Respecto a los adultos, aproximadamente el 11 % en hospitalización completa y el 6,4 % en la hospitalización parcial se identificaron como veganos. En el área de niños y de adolescentes, estas tasas fueron mayores: del 16 % en hospitalización completa y del 8,1 % en la parcial (156).
Según la American Dietetic Association and Dietitians of Canada, el vegetarianismo en sí mismo no se asocia directamente con los trastornos alimentarios (154). No obstante, algunos expertos sugieren que para algunas personas el vegetarianismo puede servir para intentar “camuflar” un TCA establecido (155) y hay estudios que apuntarían a una posible relación de una dieta vegetariana como un factor en el inicio o en el mantenimiento de comportamientos alimentarios alterados. Esta discrepancia obedece probablemente a las siguientes limitaciones y dificultades en los estudios: 1) se ha englobado bajo el término de “vegetarianismo” patrones alimentarios distintos; 2) las muestras de “veganos totales” son pequeñas en los estudios; 3) existe incertidumbre sobe la adecuación de las herramientas de evaluación del comportamiento alimentario para los vegetarianos, y 4) la naturaleza transversal de la mayoría de los trabajos no permite establecer causalidad.
Los trabajos que estudian la posible correlación entre el vegetarianismo y los TCA abarcan distintos aspectos: la motivación para seguir el patrón alimentario, su relación con una mayor alteración de la conducta alimentaria, las dimensiones psicológicas, los síntomas de TCA, las estrategias de afrontamiento o la calidad de vida, entre otros.
Algunos estudios revelan que los semivegetarianos tienen tasas más altas de cogniciones y de comportamientos alimentarios desordenados en comparación con los no vegetarianos y veganos (157). Además, los semivegetarianos que adoptan la dieta por razones de peso o de salud tienen un mayor riesgo de presentar comportamientos alimentarios alterados (157). Mathieu y cols. (158) sostienen que, en aquellas personas que eligen el vegetarianismo por motivos éticos y no relacionados con el peso, las preocupaciones por el cuerpo podrían existir antes de adoptar la dieta vegetariana, incluso si la justificación principal es ética. Hanras y cols. (159) han observado que los vegetarianos y los veganos tienden a estar más motivados por la ética, la salud y el contenido natural, lo que se refleja en un mayor consumo de productos orgánicos, ya que son más respetuosos con el medioambiente, mientras que los omnívoros prefieren alimentos familiares y convenientes para cocinar y poder ser flexibles para socializar. Esta diferencia refleja la tendencia de los vegetarianos y de los veganos a preocuparse por consumir alimentos más éticos y saludables. Además, según este mismo autor, los veganos, a diferencia de los omnívoros, tienen un IMC más bajo, menos comportamientos alimentarios relacionados con el estado de ánimo y una mejor calidad de vida física. En situaciones estresantes, los veganos tienden a recurrir a la resolución de problemas como estrategia activa de afrontamiento, mientras que los omnívoros buscan más el apoyo social (una estrategia pasiva). Esta diferencia podría estar relacionada con la forma en que los veganos manejan la disonancia cognitiva asociada con sus elecciones alimentarias. Los vegetarianos parciales (flexitarianos) se sienten más motivados por el control de peso en comparación con los vegetarianos estrictos y los veganos. Esto sugiere que algunas personas que siguen este tipo de dieta podrían enfrentar dificultades alimentarias y que el flexitarianismo podría ser un pródromo para un trastorno alimentario o una transición a un vegetarianismo más estricto.
En individuos susceptibles, aquellos con antecedentes familiares de problemas de salud mental, con baja autoestima o con rasgos obsesivos, seguir una dieta vegetariana sí podría generar comportamientos alimentarios obsesivos o restrictivos adicionales (155).
La motivación de una mejoría en la salud para adherirse a una dieta vegetariana por parte de algunas personas ha propiciado que numerosos estudios se centren en la ortorexia nerviosa (ON) u obsesión extrema e irracional por comer sano y por la calidad de los alimentos. En un estudio de prevalencia de ON se observó una asociación de esta entidad a un menor nivel educativo, a la presencia de síntomas depresivos y a la realización de una dieta vegetariana (160). Por otra parte, Mathieu y cols. (158) sostienen que no es la dieta en sí lo que contribuye al riesgo de desarrollar ON, sino la forma en que la persona se adhiere a la dieta o al patrón alimentario, ya que se observa que la adherencia estricta y rígida parece estar más relacionada con la ON que la dieta vegetariana en sí misma.
Respecto al posible papel del vegetarianismo en la gravedad del TCA, Heiss y cols. (161) recopilaron datos demográficos, estado vegetariano, diagnóstico de TCA, de IMC y de puntuaciones en pruebas de evaluación de trastornos alimentarios de 124 pacientes (mayoritariamente mujeres) ingresadas en un programa intensivo de pacientes externos con TCA. Los resultados mostraron que no había diferencias significativas en las medidas de gravedad del TCA entre los grupos de omnívoros, reductores de carne, vegetarianos y veganos con TCA. Además, cuando se compararon los grupos combinados de reductores de carne y omnívoros, tampoco se encontraron diferencias significativas en las medidas demográficas o de síntomas de TCA. Por el contrario, Yackobovitch-Gavan y cols. (162), en su análisis sobre factores que influyen en la recuperación de los pacientes con AN, objetivan que el vegetarianismo (pasado o presente) se asoció a la no remisión de la AN.
En resumen, el papel del vegetarianismo en la AN debe contemplar la motivación que lleve al paciente a seguirla y determinar si constituye un factor de mantenimiento con potencial para entorpecer la recuperación de estos pacientes (163). La evidencia nos indica que es necesaria una investigación cuidadosa de los motivos y de los comportamientos alimentarios cuando una persona realiza una restricción de productos de origen animal, sobre todo cuando la motivación puede venir derivada por la preocupación por el peso o la salud. En la tabla XII se muestran los puntos claves para identificar el papel de la dieta vegetariana en un paciente con TCA (155).
Tabla XII. Puntos claves para identificar el papel de la dieta vegetariana en un paciente con TCA

Adaptada de: Fuller S. The British Dietetic Association Practice Guidance: Veganism and Eating Disorders. Version 3. 2020 (155).
Particularidades del manejo de la AN en el contexto del veganismo
La dificultad, incluso la controversia, en cuanto al manejo de la AN en el contexto del veganismo se encuentra en si el cambio de patrón alimentario debe ser el objetivo terapéutico en todos los pacientes o existen excepciones y a qué niveles. Por un lado, el artículo 9 del Convenio Europeo de Derechos Humanos establece la libertad de pensamiento, de conciencia y de religión. En este sentido, en el Reino Unido, el veganismo se considera una creencia protegida por The Equality Act 2010 (155). Por su parte, la APA señala que las prácticas religiosas y culturales de los pacientes deben considerarse y tenerse en cuenta en el tratamiento de los pacientes con TCA (18). La Sociedad Europea de Nutrición Clínica y Metabolismo (ESPEN) reconoce también el derecho a elegir una dieta vegetariana por motivos religiosos y la considera adecuada siempre que consiga cubrir los requerimientos (164). No obstante, desaconseja las dietas totalmente veganas en pacientes hospitalizados por el riesgo de desnutrición (164).
Para poder tomar la mejor decisión en cada paciente y para cada circunstancia clínica o momento de la enfermedad conviene tener en cuenta algunas consideraciones:
− Las prácticas religiosas y culturales de los pacientes deben ser consideradas y respetadas en la medida de lo posible (155). Dado que muchos pacientes con TCA adoptan el vegetarianismo como forma socialmente aceptada de restricción, es necesario determinar la verdadera motivación que lleva a un paciente a realizar una dieta vegana, tarea frecuentemente difícil.
− Enfrentarse con el paciente para que elimine y cambie su patrón alimenticio puede ocasionar un problema de confianza y dificultar el vínculo con el equipo tratante, aspectos importantes durante el tratamiento y la recuperación del paciente, por lo que se requiere evaluar los cambios con cuidado.
− Se considera que en pacientes con AN llevar un patrón vegetariano puede entorpecer la recuperación (163), ya que es una forma de mantener restricciones dietéticas. No obstante, hay autores, como Fuller y cols. (156), que sostienen que en algunos casos el veganismo puede ser beneficioso en la recuperación de un trastorno alimentario, ya que permite a las personas explorar nuevos alimentos, cocinar de manera diferente y cambiar su relación con la comida.
− Cuando el paciente sea adolescente o joven y conviva con su familia, será clave identificar lo que los padres pueden manejar, si están de acuerdo con una dieta vegetariana y si son capaces de llevarla a cabo. Sin embargo, si la familia no está de acuerdo, entonces debe considerarse lo que los padres pueden realizar (155).
− La propia definición de veganismo de la Vegan Society reconoce evitar el uso de productos de origen animal “en la medida de lo posible”, por lo que, en situaciones de alto riesgo médico, como la realimentación en pacientes muy graves o críticos, puede no ser posible llevar a cabo este tipo de patrón alimentario y requerirse el uso de productos con ingredientes de origen animal para el adecuado tratamiento y recuperación del paciente (155).
− Es importante que el equipo multidisciplinar de TCA adopte una postura terapéutica en común respecto al vegetarianismo para no entrar en contradicciones (155).
Antes de intervenir en el cambio de este patrón alimentario, es recomendable hacer una valoración exhaustiva y tener en cuenta determinados aspectos como: la motivación del paciente para llevarlo a cabo, su relación etiológica y temporal con el TCA, el papel en el mantenimiento del trastorno, el estado nutricional del paciente y la posibilidad real de llevar a cabo una dieta vegetariana equilibrada y adecuadamente supervisada y suplementada.
Según la BDA, si tras realizar la valoración del paciente se determina que la dieta está relacionada con el TCA, la recomendación es restablecer a un patrón de alimentación variado y equilibrado en el que se incluyan todos los grupos de alimentos (155). Una estrategia para ayudar a pasar a un patrón alimenticio más variado es animar al paciente a buscar otras acciones éticas relacionadas (pero no alimenticias), como comprar productos libres de crueldad animal, evitar prendas o artículos de cuero y usar productos que respeten el medioambiente. Más adelante, una vez que la salud se restaure, pueden abordarse las restricciones dietéticas de manera más profunda (155). El ingreso hospitalario puede ser un momento idóneo para iniciar el cambio de hábitos hacia un patrón dietético sin exclusiones alimentarias y lo suficientemente variado. Puede ser menos angustioso, siempre que la situación clínica lo permita (pacientes no graves), comenzar con un patrón vegetariano y, a medida que disminuye la dificultad y la evolución ponderal es adecuada, puede ampliarse otros grupos de alimentos (155).
En pacientes en los que se determina que el vegetarianismo no está relacionado con el TCA, es posible realizar una realimentación con una dieta vegana, salvo en situaciones de riesgo para la vida y de emergencias médicas, en las que no sea posible evitar productos de origen animal (155). En estos casos en los que se mantiene el patrón vegetariano es esencial considerar los siguientes puntos:
− Asegurar que se satisfacen las necesidades nutricionales adecuadamente, realizando una planificación nutricional cuidadosa por parte de un especialista en nutrición (155).
− Cubrir las deficiencias nutricionales intercurrentes. Es necesario saber que la propia naturaleza de la dieta la hace susceptible de desarrollar déficits nutricionales, especialmente de vitamina B12, que obliga a una suplementación sistemática en veganos. Otros nutrientes que pueden verse afectados son el calcio, el hierro, el zinc, la vitamina D, el yodo y los ácidos grasos omega-3 (154).
− Se recomienda monitorizar de forma regular y cuidadosa los aumentos de energía, los síntomas físicos y los análisis bioquímicos de los pacientes para identificar deficiencias (155).
− Tener en cuenta limitaciones presentes de la dieta vegetariana a la hora de renutrir a un paciente desnutrido: problemas añadidos en el vaciado gástrico y plenitud posprandial por el mayor volumen de alimentos en la dieta vegetariana (155) y el alto volumen de alimentos, que puede resultar en angustia psicológica (al no estar acostumbrados a tales proporciones y al comparar sus porciones con las de pacientes no veganos) (156).
− Dificultad para disponer de menús veganos en las unidades de TCA y en las hospitalizaciones (156).
− Falta de personal entrenado y con experiencia en vegetarianismo en TCA, en especial profesionales de la salud encargados de la planificación nutricional (155).
− Los suplementos vitamínicos específicos para veganos pueden ser adecuados en situaciones en las que no existe riesgo médico. No obstante, cuando se requiere de una suplementación más específica con una composición determinada para cubrir los requerimientos en los pacientes críticos o desnutridos, dichos suplementos pueden no ser adecuados (155).
− Dificultad en la disponibilidad de fármacos veganos (155). Respecto a las fórmulas de NE y SON, aunque recientemente se dispone en el mercado de fórmulas veganas, estas pueden no estar siempre disponibles en todos los centros o no adaptarse a todas las circunstancias clínicas. Una alternativa aceptable para la mayoría de los pacientes vegetarianos consiste en elegir fórmulas cuya proteína es de origen vegetal (soja, guisante, etc.), pero que contiene otros componentes de origen animal, como colorantes (E120 o cochinilla),aceites de pescado y vitaminas derivadas de fuentes no veganas en sus productos (vitamina D derivada de la lana de ovejas, el ácido carmínico o el uso de gelatina de pescado como vehículo para la vitamina A) (155).
ANOREXIA NERVIOSA Y GESTACIÓN
La AN ocurre con mayor frecuencia en mujeres en edad fértil, por lo que es importante tener en cuenta su presencia durante la gestación. La prevalencia de AN en embarazadas oscila entre el 0,05 y el 0,5 % (165). Su incidencia es mayor cuando se analizan series de mujeres que buscan tratamiento de fertilidad (70).
Por un lado, la elevada frecuencia de oligomenorrea (6-8%) y amenorrea (68-89%) en mujeres con AN puede dar lugar a un estado de subfertilidad o infertilidad (70). Algunos trabajos señalan que la fertilidad de las mujeres con AN varía según el número de años de atención psiquiátrica, mientras que otros concluyen que, una vez superada la AN, no existe alteración en la capacidad de concebir (70). Las menores tasas de embarazo en este colectivo se han relacionado también con un deseo ambivalente (o incluso de rechazo) respecto a la maternidad (70). Lo que parece claro es que, cuanto mejor se maneje el TCA con adecuada recuperación del peso corporal y estado psicológico, menor será el impacto en la capacidad reproductiva (70). Por otro lado, se ha reportado que existe una mayor tasa de embarazos no planeados en mujeres con AN, probablemente relacionada con la fluctuación (recuperación) del peso, lo que favorece la ovulación (70,165,166).
El manejo de una paciente gestante con AN supone un reto si tenemos en cuenta las siguientes barreras:
La dificultad en la detección del TCA en las revisiones obstétricas o en la consulta preconcepcional. Esto está motivado, por un lado, por el estigma y la ausencia de conciencia de enfermedad de las propias pacientes, que frecuentemente omiten el diagnóstico de AN (70), y, por otro, por la falta de formación en TCA por parte del personal sanitario.
La complejidad del propio trastorno alimentario, cuyo espectro clínico es amplio en cuanto a la gravedad de la afectación orgánica y psicológica.
Las potenciales consecuencias deletéreas de TCA a nivel materno-fetal.
Los escasos estudios sobre el tratamiento de pacientes con AN durante la gestación.
Impacto de la anorexia nerviosa en el embarazo
En estudios epidemiológicos se ha evidenciado una asociación de numerosas enfermedades no transmisibles en la infancia y en la edad adulta con factores como la nutrición materna antes y durante la gestación, la adecuada ganancia ponderal durante el embarazo y el peso del recién nacido. No obstante, se desconoce de forma precisa el impacto a largo plazo de la AN materna durante la gestación. Sí disponemos de datos sobre la repercusión a nivel obstétrico y neonatal derivados de la ingesta disminuida, los déficits vitamínico-minerales y un bajo IMC, todo ello con potencial afectación de la función útero-placentaria (165). Las principales complicaciones de la AN activa durante el embarazo son: el retraso del crecimiento fetal, el bajo peso al nacer, el aumento de fetos clasificados como pequeños para edad gestacional, una baja puntuación APGAR, el mayor riesgo de parto pretérmino y un mayor riesgo de muerte perinatal (165). También se ha reportado una menor tasa de lactancia materna (LM) en madres con AN, probablemente secundaria a alteraciones en la imagen corporal, dificultad para cubrir la mayor demanda de requerimientos energéticos que supone la LM y otros aspectos psicológicos (165). Además, los riesgos de una AN no tratada durante el embarazo van más allá de los puramente orgánicos, ya que afectan a la esfera psicosocial de la madre y del hijo.
Manejo médico y nutricional preconcepcional de la paciente con AN
En pacientes con AN la planificación preconcepcional a través de una intervención multidisciplinar que permita el control de la enfermedad y de sus comorbilidades supone el entorno más adecuado para alcanzar un embarazo sin riesgos (70,165).
Un escenario de planificación preconcepcional en el que poder intervenir en pacientes con TCA es la consulta de fertilidad. La prevalencia de AN en mujeres sometidas a tratamientos de fertilidad puede ser 4-5 veces mayor que en la población general (70), por lo que es un contexto en el que se hace imprescindible la detección y el manejo de los trastornos alimentarios.
La mayoría de expertos considera importante realizar un screening de TCA a aquellas mujeres que buscan tratamiento de fertilidad (70). Además, coinciden en que aquellas con un trastorno alimentario reciban tratamiento especializado para el TCA antes de someterse a técnicas asistidas de reproducción (TRA) (70). A nivel legislativo, según la cartera común de servicios sobre reproducción humana asistida (Real Decreto 1030/2006, de 15 de septiembre), para poder llevarse a cabo TRA “la mujer no presentará ningún tipo de patología en la que el embarazo pueda entrañarle un grave e incontrolable riesgo, tanto para su salud como para la de su posible descendencia”, y se considerará motivo de exclusión, entre otros “la existencia de contraindicación médica documentada para la gestación”, así como la “imposibilidad para cumplir el tratamiento por motivos relacionados con la salud u otros motivos familiares o relacionados con el entorno social”. Dado el amplio espectro clínico y de gravedad de la AN, es importante individualizar y, en cualquier caso, demorar el tratamiento de fertilidad a la estabilización del trastorno alimentario. La Endocrine Society recomienda inducir la ovulación en mujeres con amenorrea hipotalámica funcional solo tras la normalización del equilibrio energético y con IMC > 18,5 kg/m2 (42).
La evaluación médico-nutricional preconcepcional de las pacientes con AN es básica. De forma específica, hay autores que recomiendan incluir una analítica completa, un ECG y una densitometría ósea (165). Según la situación clínica, algunas pacientes podrían beneficiarse de la realización de un ecocardiograma (165). En mujeres con AN que buscan gestación deben revertirse la desnutrición y los posibles déficits nutricionales y buscar el cese de conductas compensatorias. Es recomendable la toma de un multivitamínico específico que garantice los aportes diarios recomendados en la etapa periconcepcional para ácido fólico (400 µg/día en ausencia de riesgo de hijo afectado con defecto del tubo neural; dosis mayores en casos seleccionados) y yoduro potásico (200 µg) (167) y ajustar los aportes adicionales concretos si es preciso. Debe informarse sobre los potenciales riesgos materno-fetales de la AN, sobre la necesidad de una atención multidisciplinar y sobre un seguimiento obstétrico más estrecho y que incluya el puerperio (70). Como en otras pacientes buscando embarazo, hay que revisar la medicación con el fin de evitar aquellos fármacos no aptos durante la gestación y advertir del riesgo y del efecto deletéreo del consumo de tabaco, alcohol y otras drogas.
Manejo médico y nutricional de la paciente con AN durante la gestación
El mayor riesgo de complicaciones materno-fetales en relación a un TCA hace recomendable la detección precoz de un eventual trastorno alimentario por parte del obstetra o de la matrona. A pesar de que numerosos expertos recomiendan la búsqueda activa de los TCA en el embarazo, la ausencia de recomendaciones específicas en las principales guías de obstetricia dificulta su implementación. De hecho, algunos trabajos estiman que solo la mitad de estos profesionales interroga de forma activa y específica sobre TCA en sus pacientes gestantes. La detección temprana de un TCA puede realizarse (70,168) a través de herramientas de cribado como el EAT-8 o el SCOFF, realizando preguntas directas acerca del peso mínimo alcanzado, de fluctuaciones importantes de peso, de la presencia de periodos de amenorrea, de insatisfacción con la imagen corporal y de la presencia de conductas compensatorias, o de la presencia de signos de alarma a lo largo de la gestación (hiperémesis gravídica, falta de aumento de peso durante dos visitas prenatales consecutivas en el segundo trimestre de gestación o alteraciones electrolíticas sugestivas de abuso de laxantes o diuréticos). Debe remitirse para una valoración más específica a aquellas gestantes con sospecha de TCA por cualquiera de los supuestos anteriores (168).
El manejo de las pacientes con AN durante la gestación exige de un equipo multidisciplinar (obstetra, matrona, psiquiatra, psicólogo, DN, endocrinólogo, pediatra, entre otros) con experiencia en gestaciones de riesgo y TCA donde el seguimiento se mantenga tras el parto (165). El objetivo debe ser garantizar el adecuado desarrollo fetal, evitar y tratar la desnutrición y los déficits nutricionales y asegurar el bienestar psicológico de la madre que permita una adecuada relación madre-hijo. Cabe señalar que no existen guías específicas y la evidencia disponible para su manejo se basa en reportes de casos, opinión de expertos y extrapolación de recomendaciones generales de gestantes sin TCA o gestantes con desnutrición en países en vías de desarrollo (169).
El ámbito de tratamiento es fundamentalmente ambulatorio. Sin embargo, puede ser necesario el ingreso hospitalario parcial / total en casos seleccionados (por ejemplo, fracaso ambulatorio en la ganancia ponderal, presencia de alteraciones hidroelectrolíticas graves, hipoglucemias, arritmias o ideación autolítica).
La evaluación y la monitorización de gestantes con AN es fundamental para adecuar el tratamiento nutricional y detectar complicaciones materno-fetales derivadas de la desnutrición o las conductas compensatorias. Se recomienda que incluya:
− Seguimiento obstétrico considerándose gestación de riesgo. Algunos expertos recomiendan screening de preeclampsia en el primer trimestre y controles ecográficos cada 4 semanas desde el segundo trimestre (165).
− Evaluación y seguimiento psicológico / psiquiátrico.
− Evaluación y seguimiento nutricional para un adecuado consejo nutricional adaptado a la situación clínica de la paciente y a su evolución ponderal.
-
− Evaluación médica periódica, cuya frecuencia se establecerá de forma individualizada en función de la gravedad del TCA, del estado nutricional o de la presencia de complicaciones materno-fetales, pero que será, como mínimo, en cada trimestre de gestación. En cada visita se valorarán:
Constantes vitales (PA, FC, ortostatismo y temperatura).
Exploración física. La presencia de edema es relativamente frecuente a medida que avanza la gestación en pacientes sin AN. No obstante, en pacientes con TCA debe tenerse en cuenta la posibilidad de que se deba a otras complicaciones relacionadas con el trastorno alimentario, como el SR o la insuficiencia cardiaca (165).
Interrogar sobre el uso de laxantes y otras conductas compensatorias. Cabe recordar que el estreñimiento es habitual tanto en AN como en el embarazo.
− Controles analíticos periódicos para detectar alteraciones hidroelectrolíticas, anemia o déficits vitamínico-minerales. Se recomienda la determinación de: función renal, glucosa, sodio, potasio, magnesio, cloro, fósforo, calcio, perfil ferrocinético, función hepática, hemograma, vitaminas D, A, E y B12, ácido fólico, zinc y proteína C reactiva (165).
− ECG en cada trimestre (165). Según la situación clínica puede ser conveniente un ecocardiograma en el tercer trimestre (165).
− En caso de presentar diabetes, la omisión de la insulina con la intención de favorecer la pérdida de peso se ha asociado a un mayor riesgo materno-fetal y debe preguntarse de forma específica.
Los pilares terapéuticos a tener en cuenta desde el punto de vista médico y nutricional en gestantes con AN son: 1) el consejo dietético que garantice un adecuado aporte de macro- y de micronutrientes; 2) asegurar una adecuada ganancia ponderal a lo largo del embarazo; 3) el cese de las conductas compensatorias; y 4) la suplementación vitamínico-mineral.
El consejo nutricional irá dirigido a una alimentación saludable y sin restricciones, ajustada a los requerimientos de la paciente y que permita un aporte energético adecuado para la madre y el feto (167). No hay que olvidar que debe contemplar también las normas de seguridad alimentaria. El embarazo puede ser un buen momento para instaurar hábitos saludables en pacientes con TCA, dado que se encuentran más predispuestas a realizar cambios en este contexto.
No disponemos de recomendaciones específicas para gestantes con AN, por lo que aquellas propuestas para el embarazo normal pueden servir de punto de partida, a partir de las cuales adaptar a la paciente con AN en función de su situación clínica:
− Aporte dietético de 175 g/día de carbohidratos (167).
− Asegurar 1 g/kg al día de proteínas (165).
− Garantizar el aporte diario de 200 mg de ácido docosahexaenoico (DHA) (167), ya sea a través de la dieta (2-3 raciones a la semana de pescado azul, evitando aquellos con mayor contenido en mercurio) o suplementos.
− Cubrir los requerimientos hídricos: 35-45 ml/kg (165).
El IMC es el parámetro recomendado para determinar el estado nutricional durante la gestación, ya que es fácil de determinar y permite además orientar la ganancia de peso deseable durante el embarazo. Un IMC < 18,5 kg/m2 se ha asociado a un bajo peso al nacer y a parto pretérmino, especialmente cuando se sitúa por debajo de 16 kg/m2 (que se considera desnutrición grave en gestantes) (169). Hay que tener precaución en cómo se aborda la ganancia ponderal en gestantes con AN para no potenciar o incrementar la obsesión y el discurso centrado en el peso.
No hay guías que establezcan la ganancia ponderal recomendable en mujeres gestantes con AN. En mujeres sin TCA la ganancia de peso aconsejable se realiza con base en el IMC preconcepcional. Las pautas del Institute of Medicine son las más empleadas (167):
− En mujeres con IMC < 18,5 kg/m2: recomiendan una ganancia de 12,5 a 18 kg durante el embarazo. Esto supone una ganancia de 0,5-2 kg durante el primer trimestre y de 0,5 kg/semana durante el segundo y el tercer trimestre. No disponemos de recomendaciones específicas en casos graves de desnutrición, por lo que en estos casos debe manejarse de forma individualizada (165).
− Gestantes con IMC entre 18,5 y 24,9 kg/m2: se recomienda una ganancia de 11,5 a 16 kg durante el embarazo.
Para establecer los requerimientos calóricos en gestantes con AN gravemente desnutridas, Galbally y cols. recomiendan la siguiente fórmula en mujeres que precisan ingreso hospitalario (165): 28,6 kcal/kg x 1,4 (factor actividad) x 1,5 (factor repleción). A dicho resultado se le sumarían 334 kcal/día en el segundo trimestre y 454 kcal/día en el tercer trimestre. Recomiendan comenzar con al menos 1500 kcal/día y aumentar progresivamente 478 kcal cada 2-3 días hasta alcanzar los requerimientos (165).
Una paciente gravemente desnutrida difícilmente puede recuperarse nutricionalmente de forma autónoma, y menos en el curso de una gestación, por lo que se hace imprescindible el tratamiento nutricional guiado por los profesionales que garantice un adecuado aporte de macro- y de micronutrientes, así como ganancia ponderal suficiente. Al igual que ocurre en mujeres con AN no gestantes, es posible que el aporte calórico no pueda satisfacerse a través de la dieta ordinaria. En estos casos es fundamental el empleo de SON. Deben considerarse en pacientes desnutridas, en riesgo o ante la no adecuada ganancia ponderal materna o fetal.
La suplementación vitamínico-mineral en gestantes puede realizarse en general de dos formas: suplementando lo considerado imprescindible en cualquier embarazada (ácido fólico y yoduro potásico) (167) o formando parte de complejos multivitamínico-minerales más completos específicamente diseñados para la gestación. Aunque no disponemos de estudios al respecto, y la elección debe realizarse de forma individualizada según la situación de cada paciente, hay que tener en cuenta que la evidencia apunta a que los multivitamínicos específicos podrían disminuir la tasa de bajo peso al nacer en algunos estudios. Teniendo en cuenta además la elevada frecuencia de déficits de micronutrientes en la AN fuera de la gestación, así como una posible carencia de micronutrientes en el contexto de la restricción alimentaria que caracteriza este trastorno, parece razonable emplear la suplementación multivitamínica completa y específica para gestantes con AN. No obstante, cuando la paciente necesite tomar SON se debe comprobar que no se sobrepasa la dosis máxima de algunos nutrientes (por ejemplo, en el caso de la vitamina A, no sobrepasar 2800-3000 µg/día) (165).
Los controles analíticos periódicos permiten detectar déficits concretos que requieran un ajuste adicional (por ejemplo, vitamina B12 en vegetarianas). Las pacientes desnutridas con AN presentan un riesgo aumentado de anemia ferropénica; de hecho, es una de las complicaciones más frecuentes, por lo que debe suplementarse con hierro oral si se confirma en los análisis (167). Además, debe asegurarse, a través de la dieta o mediante suplementación, que se cubren los requerimientos de calcio (1000-1300 mg/día), ya que su déficit se ha asociado a preeclampsia (165,167). El déficit de vitamina D se ha relacionado con preeclampsia, bajo peso al nacimiento, retraso del crecimiento intrauterino y alteración en el desarrollo óseo fetal (167). Por ello, se recomienda la determinación de vitamina D en colectivos de riesgo de deficiencia, como ocurre en mujeres con dietas restrictivas. Es necesario suplementar con tiamina en caso de vómitos de repetición en el contexto de hiperémesis gravídica o conductas compensatorias del TCA para evitar la aparición de un síndrome de Wernicke. En caso de que la paciente necesite la administración de sueros glucosados, la tiamina debe administrarse por vía parenteral y antes del inicio de dichos sueros. El déficit de zinc debe investigarse, ya que se ha relacionado con parto pretérmino, bajo peso al nacer y hemorragia posparto por atonía uterina (169).
TRANSICIÓN PEDIATRÍA-ADULTO EN PACIENTES CON ANOREXIA NERVIOSA
Como ya se ha expuesto anteriormente, los TCA suelen aparecer durante la adolescencia. Aunque la mayoría de los casos evoluciona favorablemente a largo plazo, en algunos casos se produce una duración más prolongada que requiere de atención durante la edad adulta (170).
De acuerdo con la OMS la adolescencia se extiende entre los 10-19 años. La atención sanitaria cambia a adultos tradicionalmente a los 14-18 años, justo cuando suelen llevarse a cabo los procesos de transición. En este momento no suele darse la madurez de la edad adulta, por lo que los riesgos para la evolución de los pacientes pueden aumentar de forma importante (171).
En el caso de que no se produzca una adecuada transición a los equipos de adultos pueden generarse importantes problemas, como malestar de pacientes y familias, retraso en el acceso o continuación de tratamientos, pérdida de seguimiento e incluso la muerte (172). Hasta un 25 % de jóvenes trasferidos a equipos de salud mental de adultos no asisten a la primera cita con el nuevo equipo (173), con los consiguientes riesgos de falta de continuidad terapéutica, aumento de ingresos, insatisfacción, desvinculación con los servicios sanitarios y, en definitiva, con peores resultados clínicos.
Para evitar estos problemas se proponen modelos en los que la atención al paciente se realice de forma conjunta entre los servicios de menores y de adultos (172,174) o, al menos, que el proceso se realice en función de la preparación del paciente con un plan de transición detallado y estructurado (175). Cuando se plantea un proceso de transición a la atención sanitaria de adultos pueden surgir una serie de barreras que dificultan su adecuado desarrollo del mismo, como son:
− Mayores tiempos de espera en la atención de adultos respecto a la pediátrica, lo que podría tener un peor impacto en los jóvenes.
− Múltiples cambios vitales en el grupo de jóvenes.
− Autonomía en las decisiones sobre la asistencia a los servicios de salud y en la información que puede trasladarse a los progenitores. Algunos expertos recomiendan recabar autorización para reportar cierta información sobre la evolución y la asistencia a las citas a la familia (176). En casos graves, los padres pueden solicitar autorización judicial para tutelar las decisiones médicas.
Hay que tener en cuenta estas barreras para prever mecanismos que permitan superarlas con éxito en beneficio de los pacientes.
En cuanto a la organización del proceso de transición, debe buscarse el mejor funcionamiento del paciente a través de unos servicios de atención sanitaria de alta calidad, adecuados a su grado de desarrollo y que permitan la continuidad asistencial. Por lo tanto, la transición debe ser un paso planificado en el que los adolescentes con enfermedades médicas crónicas sigan recibiendo los servicios y los cuidados que precisan al cambiar de una atención sanitaria centrada en el niño a una orientada al adulto. No se trata, por tanto, de una transferencia meramente administrativa, sino que la transición debe planificarse conjuntamente con el paciente y su familia, así como con los servicios pediátricos y de adultos, anticipándose a los riesgos y teniendo en cuenta el nivel madurativo del sujeto y la evolución de la enfermedad (177,178).
Respecto a la planificación y a la realización del proceso de transición, en general se recomienda a los 16-18 años (puede variar en fuunción del grado de madurez), debe ser gradual y en situación de estabilidad de la enfermedad. Se recomienda la creación de consultas específicas que ayuden a preparar al paciente y a su familia sobre los cambios en el funcionamiento del sistema de salud en la población adulta, en los circuitos de atención al paciente y en el acceso a los recursos del centro sanitario. Se recomienda realizar al menos una visita conjunta (pediatría y adulto) para que la unidad de menores introduzca al resto de profesionales. Esto aumenta la confianza y la adherencia del paciente y de su familia al proceso. Todo ello debe programarse y debe quedar reflejado en un calendario que facilite la correcta planificación del tiempo y del número de visitas y que pueda actualizarse periódicamente. El proceso de transición debe estar integrado en los protocolos de atención a los TCA, contando con especialistas de menores y de adultos. Asimismo, debe implicarse a los profesionales médicos y de enfermería de Atención Primaria, asegurando la continuidad asistencial en la atención en todos los niveles de salud.
EVOLUCIÓN Y PRONÓSTICO DE LA ANOREXIA NERVIOSA
La AN es una enfermedad psiquiátrica compleja de pronóstico variable en la que la gravedad y la duración difieren entre individuos dependiendo, fundamentalmente, de la detección temprana, de la intervención precoz y de la atención por equipos multidisciplinares (1). Aproximadamente la mitad de los pacientes con AN se cura, pero se estima que el 20-25 % del otro 50 % que no se recupera experimenta un curso crónico (179). Además, es importante señalar que la AN está infradiagnosticada. Solo se diagnostican un 50 % de los casos, y de los que se detectan, no todos reciben tratamiento. Entre los pacientes que reciben tratamiento existe una elevada tasa de abandonos o de rechazos: se estima que el 20-51 % de los pacientes tratados intrahospitalariamente y un 23-73 % de los pacientes tratados de forma ambulatoria están en esta situación (180). La cronificación es potencialmente posible tanto en población tratada como en la no tratada.
El pronóstico es variable y puede verse influenciado por factores como la gravedad de la enfermedad, la presencia de comorbilidades y la efectividad de los tratamientos (18). La detección temprana de la AN optimiza los resultados, sobre todo en niños y adolescentes, así como la intervención de equipos multidisciplinares, que permite abordar de forma completa los aspectos psicológicos, psiquiátricos y nutricionales, buscando los mejores resultados (181). Las tasas de recuperación son más elevadas cuando la patología se inicia en la adolescencia y mejoran con el tiempo de seguimiento, llegando hasta el 70-80 %. La recuperación es posible incluso a los 10 años después de iniciado el tratamiento. También existen factores genéticos asociados a la gravedad de la enfermedad, aunque hace falta más investigación en este campo (182).
La AN presenta la tasa de mortalidad más alta que cualquier otra enfermedad psiquiátrica. En un metaanálisis de 36 estudios sobre AN y otros TCA realizado en todo el mundo se observó que la tasa de mortalidad cruda fue de 5,1 muertes por 1000 personas y año (IC 95 %: 4-6,1) y la tasa de mortalidad estandarizada fue del 5,9 % (IC 95 %: 4,2-8,3), aproximadamente 6 veces más riesgo de mortalidad que en la población sana (183). En otro estudio reciente realizado en pacientes gravemente desnutridos durante 5 años de seguimiento tras ingreso hospitalario, la tasa de mortalidad estandarizada fue del 5,9 % (IC 95 %: 6-21,4) (5). Estos datos son muy similares a los obtenidos en Alemania, donde, en una muestra de 5839 pacientes que habían estado ingresados por TCA (de los que 1639 presentaban AN), se observó que la tasa de mortalidad estandarizada para AN fue del 5,35 % y que los pacientes con AN fallecían más precozmente que otros TCA (184). En cuanto a las causas de muerte en AN en dicho trabajo, el 83,7 % falleció por una causa orgánica (colapso circulatorio, lo más frecuente, seguido de caquexia), y el 16,3 % fue de origen no natural (suicidio, lo más frecuente) (184). Cabe destacar que, en dicho trabajo, la media de tiempo de evolución hasta el inicio del tratamiento de la AN fue de 7,1 años, pero que un mayor tiempo de evolución previo al ingreso no se asoció a una mayor mortalidad, según sus datos (184).
El manejo de las pacientes con TCA en el contexto de equipos multidisciplinares parece apuntar a que podría asociarse a una menor mortalidad, según algunos estudios (85,86).
La evolución de la enfermedad puede ser muy larga y diferente en cada individuo. Los síntomas bulímicos a menudo ocurren en el curso de AN, especialmente dentro de los 2-3 primeros años después del comienzo de la enfermedad (180). La detección temprana, el seguimiento a largo plazo y la intervención de equipos multidisciplinares son factores claves para alcanzar los mejores resultados. El mejor conocimiento del curso de la AN puede contribuir a crear programas terapéuticos mejor adaptados a las necesidades individuales de cada paciente en cada estadio de la enfermedad.
CRITERIOS DE CURACIÓN DE LA ANOREXIA NERVIOSA
Un problema que se plantea en el estudio de la evolución de la enfermedad es que no existe consenso en la definición y en los criterios de lo que es curación. Además, existen distintos términos en la literatura en torno a la curación de la AN que en ocasiones sí hacen referencia al mismo concepto, pero que, en otras, representan conceptos distintos. Así, encontramos expresiones como recuperación (recovery), remisión (remission), remisión total (full remission) o remisión parcial (partial remission), cuya definición varía según autores y que se resume en la tabla XIII. La falta de acuerdo en los distintos términos genera publicaciones con una gran dispersión en los datos que no permite comparar las tasas de remisión y poder estudiar cuáles son los tratamientos más adecuados.
Tabla XIII. Criterios empleados de curación en anorexia nerviosa según distintos autores
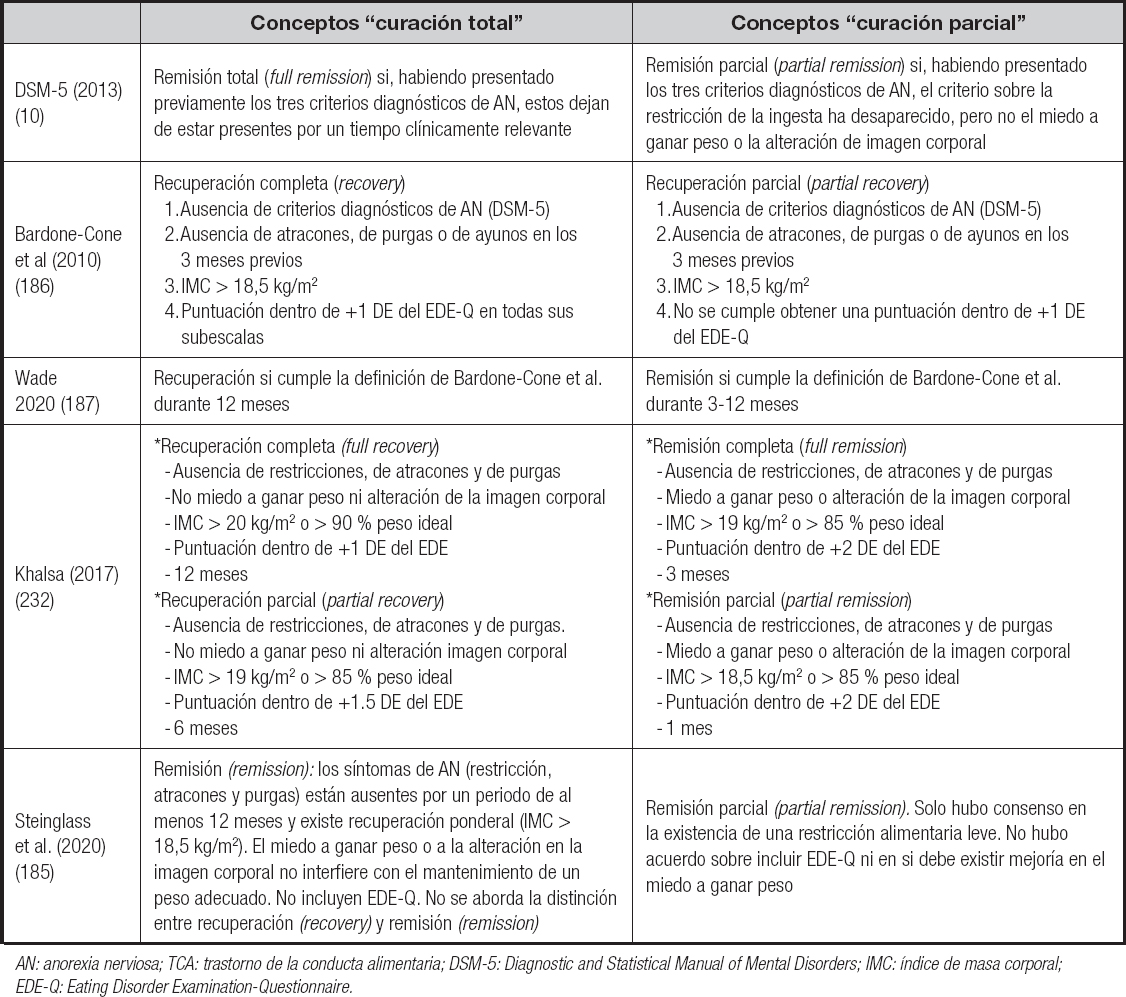
AN: anorexia nerviosa; TCA: trastorno de la conducta alimentaria; DSM-5: Diagnostic and Statistical Manual of Mental Disorders; IMC: índice de masa corporal; EDE-Q: Eating Disorder Examination-Questionnaire.
Por un lado, el DSM-5 habla de remisión total y parcial (full remission / partial remission) (10). La remisión total ocurre cuando, habiendo presentado los tres criterios diagnósticos de AN previamente, estos dejan de estar presentes por un tiempo clínicamente relevante (10). En el caso de remisión parcial, el criterio sobre la restricción de la ingesta y el bajo peso ha desaparecido, pero no el miedo intenso a ganar peso o la alteración de la percepción de la silueta corporal (10).
Otros autores se refieren a los conceptos de recuperación (recovery) y remisión (remission) como conceptos relacionados, pero diferentes (185). La remisión haría referencia a aquella situación en la que los pacientes siguen necesitando apoyo y tratamiento para mantener sus progresos y que puede valorarse usando criterios como la ausencia de algunos síntomas (como comportamientos restrictivos, ejercicio físico excesivo y purga) y alcanzar cierta mejoría física y psicológica. La remisión representa un paso positivo hacia la recuperación y la mejora de la calidad de vida de los pacientes que sufren la enfermedad. Indica una mejoría temporal de la enfermedad del paciente. Los pacientes pueden experimentar recaídas y retornos a la presencia de síntomas después de un periodo de mejoría.
La recuperación sería un proceso más complejo y multifacético, que comprende no solo la ausencia de síntomas, sino la restauración de la salud física y psicosocial y una relación saludable con los alimentos y con la imagen corporal. La recuperación es el objetivo a largo plazo que debe alcanzarse con el tratamiento (94). Una de las definiciones más aceptadas en la literatura para hablar de recuperación completa (full recovery) es la de Bardone-Cone cols. en 2010, que propone que se cumplan los siguientes 4 criterios: 1) ausencia de criterios diagnósticos de AN según DSM-5; 2) ausencia de atracones, purgas o ayunos en los 3 meses previos; 3) presentar un IMC > 18,5 kg/m2, y 4) obtener una puntuación dentro de +1 desviación estándar del EDE-Q en todas sus subescalas (186). En un trabajo posterior llevado a cabo por Wade, se estableció que, para hablar de recuperación completa con la definición de Bardone-Cone y cols., se requería mantener los criterios antes citados por un periodo de al menos 12 meses (187). La propuesta de Bardone-Cone se ha validado en una muestra de 66 pacientes con AN seguidas durante un periodo de 7-8 años (188). Dicho estudio, además, demostró la robustez de los citados criterios en cuanto a que el 80 % de los sujetos con recuperación completa al inicio la mantuvieron a los 7-8 años (188). Otros autores proponen un modelo de recuperación centrado en la persona y que tiene en cuenta las experiencias individuales (189). En el esfuerzo para establecer una definición estándar, hay quienes proponen un modelo centrado en dos aspectos: cuantitativo, en el que se proponen criterios y validación empírica, y cualitativo, que se focaliza en la historia de cada paciente en relación a sus distintas experiencias en la recuperación. Ambos aspectos tienen fortalezas y limitaciones. El aspecto cuantitativo enfatiza la reducción de síntomas y el aspecto cualitativo se focaliza en el crecimiento personal. La investigación cualitativa se centra en la inclusión de factores como la experiencia, la autoaceptación y el apoyo de otros como parte integral del proceso (95). Este enfoque se basa en que, probablemente, una sola definición de recuperación no puede encajar en todos los individuos con experiencias diferentes sobre la vivencia de su enfermedad.
En el proceso de recuperación, el fallo en el tratamiento y las recaídas son dos factores a tener en cuenta para alcanzar este objetivo. El riesgo de recaídas es más importante durante el primer y el segundo año que sigue al tratamiento (18). Muchos individuos tratados no alcanzan la recuperación, y a pesar de la intervención terapéutica, continúan con patrones obsesivos o restrictivos respecto a la alimentación. Es necesario realizar una investigación para la búsqueda de una definición universal de recuperación basada en la evidencia que pueda utilizarse en la práctica clínica y en la armonización de los resultados de la investigación.
ANOREXIA NERVIOSA GRAVE Y DE LARGA DURACIÓN
En el estudio del paciente de larga evolución y que se cronifica no existen criterios diagnósticos y una definición unánime para referirse a ello. El concepto de AN grave y de larga duración (SE-AN en adelante, de sus siglas en inglés: severe and enduring anorexia nervosa) se ha desarrollado para categorizar pacientes con AN que previamente se mencionaban como “resistentes al tratamiento” o “crónicos” (190). La definición y el reconocimiento de esta población de pacientes son muy importantes para aplicar los tratamientos adecuados.
Hay poca consistencia y acuerdo en la definición de SE-AN. Las etiquetas más utilizadas para definirla han sido crónica, grave y duradera. Los criterios más empleados en la definición han sido la duración de la enfermedad y el fallo en los tratamientos (191). La definición de SE-AN puede incluir consideraciones de remisión, de recuperación y de recaída que tampoco están bien definidas. Los criterios más utilizados para su definición, recopilados en una revisión recientemente publicada, fueron la duración de la enfermedad y la resistencia al tratamiento. Con respecto a la duración de la enfermedad, la mayoría de las fuentes utiliza este criterio en la definición, y más de 7 años de duración fue lo más común para establecer el concepto de SE-AN. La resistencia al tratamiento es otro de los criterios a los que se hace referencia y se explica como la falta de respuesta cuando se aplica el tratamiento estándar indicado para esta condición. En el contexto de SE-AN la resistencia al tratamiento puede ser caracterizada por un fallo en la recuperación sostenida en el tiempo a pesar de haber recibido el tratamiento establecido en la práctica clínica. El concepto de resistencia al tratamiento nos lleva a la necesidad de buscar tratamientos alternativos no tradicionales para el tratamiento de estos individuos (191).
Algunos autores han propuesto la utilización de criterios medibles para definir la SE-AN, pero advierten de las limitaciones de estos criterios y animan a utilizarlos comprendiendo dichas limitaciones. Los criterios propuestos son: 1) un estado permanente de dieta restrictiva, bajo peso y sobrevaloración del peso y de la figura corporal; 2) duración de más de 3 años de la AN, y 3) haber sido sometidos a al menos dos tratamientos que se recomienden en las guías, administrados tras una evaluación diagnóstica según los actuales criterios (192).
Es importante evitar estigmatizar a este subgrupo de pacientes y desarrollar guías para mejorar su manejo. En este sentido, deben desecharse términos como “resistente al tratamiento”, ya que, en ocasiones, el término “resistente” simplemente hace referencia a que no han recibido un tratamiento adecuado y adaptado a sus necesidades. Además, dicho término puede conllevar un sentimiento de culpabilidad o de responsabilidad en el paciente o en los familiares.
Tal y como se ha apuntado previamente, la evolución de la gravedad y de los distintos estadios en esta enfermedad no tiene una definición consensuada. En otras enfermedades, como ocurre con el cáncer, existen criterios que permiten saber qué pacientes se encuentran en situación terminal o establecer una supervivencia aproximada. Sin embargo, en la mayoría de pacientes con SE-AN con persistencia y gravedad de los síntomas, con una duración larga de la enfermedad, o con numerosos intentos de tratamiento fallido, no podemos considerar que sean pacientes terminales ni predecir el fallecimiento en un corto periodo de tiempo. Por tanto, aunque en la literatura se hace referencia al término AN terminal, existe mucho debate y controversia al respecto (193). La evolución de la SE-AN pasa por distintos estadios y en la mayoría de ellos pueden obtenerse buenos resultados clínicos. Solo un pequeño número de pacientes progresa a un estado en el que los tratamientos han fallado y se requieren medidas para disminuir el sufrimiento. Etiquetar a un paciente de AN terminal, de forma análoga a lo que ocurre con el término de “resistente al tratamiento”, puede generar una estigmatización en el paciente. Más aún, puede causar mucho daño al limitar algunos tratamientos en individuos que necesiten periodos más largos para su posible recuperación, lo que entorpece todavía más la probabilidad de curación de dichos pacientes (194).
En resumen, el tratamiento de la SE-AN requiere un enfoque individualizado, con una intervención global y multidisciplinar con apoyo y monitorización continua (55). La inconsistencia en la definición y en las características para definir la SE-AN supone un reto en el contexto clínico y de investigación, pues resulta complicado reclutar pacientes para estudios con criterios homogéneos y que no pueden identificarse claramente. Es necesaria más investigación para determinar las características de este grupo de pacientes con el fin de mejorar los resultados.
Factores de riesgo de cronicidad y mal pronóstico
La AN puede tener un curso crónico y discapacitante, con un impacto significativo en la salud y en la calidad de vida de quienes la padecen. Como se ha comentado previamente, en el curso de la AN las tasas de recuperación y de cronificación son muy dispares debido a los distintos criterios utilizados para la recuperación, la duración del seguimiento, la duración del tiempo de remisión de los síntomas, el grupo estudiado y el tipo de manejo.
Existe la necesidad de entender la evolución y los resultados en los TCA, incluyendo conocer los factores que minimicen el impacto de la discapacidad y optimicen la recuperación. Sin embargo, hay debate y desacuerdos para definir y medir los resultados, tal y como ocurre con la remisión, la recuperación y la recaída.
En una reciente revisión llevada a cabo en Australia se observó que la proporción de artículos que se focalizan en resultados de TCA son escasos, con menos del 9 % que incluyan variables que examinen específicamente resultados en TCA. Los resultados obtenidos indican una baja tasa de remisiones y un gran riesgo de mortalidad, particularmente en AN, a pesar de la implementación de tratamientos basados en la evidencia. En esta revisión, factores como la edad de presentación, la presencia de comorbilidades psiquiátrica o médicas, la no adherencia al tratamiento y el acceso restringido a programas de prevención de recaídas se asociaron con una mala evolución, incluida la tasa de mortalidad. Las comorbilidades médicas, como desnutrición, DM1, infecciones virales o dolor, se asocian con peores resultados. Otros factores asociados a malos resultados son la ansiedad, las experiencias disociativas, la impulsividad, el uso de psicótropos y los rasgos autistas. Los factores que contribuyen a un mayor riesgo de recaídas son la gravedad de los síntomas en el pre- y en el postratamiento, la presencia de comorbilidades, la mayor duración de la enfermedad, la adherencia a tratamientos previos y su duración y haber tenido ingresos. Estos factores pueden indicar enfermedad más grave y necesitarían una mayor intensidad de tratamiento. Por otro lado, la interpretación de los resultados fue complicada debido a la ya mencionada inconsistencia en la definición de remisión, recuperación y recaída y al corto tiempo de seguimiento. El artículo enfatiza la necesidad de priorizar en la investigación con estudios a largo plazo usando variables y metodologías más consistentes que permitan entender la evolución de la enfermedad y valorar las tasas de remisión y de recuperación para mejorar los resultados (195).
Otro factor de riesgo para la cronificación es el componente cultural, que varía según los países, por lo que es importante tener en cuenta estas diferencias culturales en el desarrollo de la patología. En un estudio que compara los factores de riesgo de mujeres japonesas con AN o BN con mujeres de Estados Unidos, aunque objetiva numerosas coincidencias en los factores de riesgo, el grupo japonés con AN reportó más factores de riesgo relacionados con la salud mental individual y menor número de factores de riesgo relacionados con los hábitos alimenticios familiares y el sobrepeso en la familia (196).
Parece que los resultados mejoran con el seguimiento a largo plazo, como se evidenció en un estudio realizado en la comunidad, en la que se incluyeron un total de 51 individuos con una edad media de comienzo de 14,3 años y un seguimiento durante 30 años. Los participantes fueron valorados 4 veces durante el seguimiento. El 64 % de los participantes tuvo una recuperación completa de los síntomas durante 6 meses consecutivos. Los factores que predijeron buenos resultados fueron una edad mayor al diagnóstico en individuos con comienzo de la enfermedad en la adolescencia y el perfeccionismo premórbido. Se muestran a largo plazo buenos resultados en términos de mortalidad porque ningún individuo murió. Un 20 % de los individuos tuvo una evolución a la cronicidad (197).
El debut en la adolescencia temprana representa una forma más grave de la enfermedad comparado con el comienzo más tardío. Los pacientes que empiezan la enfermedad en edades tempranas en la adolescencia tienen mayor duración de la enfermedad, sintomatología más grave y mayor preocupación por la imagen corporal comparados con los que empiezan en la adolescencia más tardía, incluso tras ajustar por la duración de la enfermedad. También se ha observado en los debutantes más jóvenes una disminución de la flexibilidad cognitiva. Aunque son necesarios más estudios para comprender la influencia del debut temprano en la enfermedad, estos hallazgos sugieren que el comienzo en la adolescencia temprana representa una forma más grave de la enfermedad y que es necesario dirigir estrategias de tratamiento específicamente para este subgrupo de cara a mejorar los resultados a largo plazo y la recuperación completa. Son necesarios más estudios para comprender la influencia del debut temprano en la enfermedad (198).
Los predictores de resultados negativos a largo plazo en pacientes ingresados son un IMC bajo, una mayor edad al ingreso, la mayor gravedad de los síntomas y un menor seguimiento tras el alta. En un estudio alemán realizado en 1693 pacientes que fueron ingresados y seguidos posteriormente al alta durante más de 10 años, se observó una tasa de remisión del 30 % en el total de la muestra y del 40 % en una submuestra que se siguió durante 20 años. Durante el periodo de seguimiento se observó mejoría del IMC, del comportamiento alimentario y de la psicopatología, pero sin llegar a los niveles de los controles sanos. El estado de ánimo de la madre se relacionó con mejores resultados (184).
El tratamiento ambulatorio con psicoterapia familiar o individual es preferible al tratamiento intrahospitalario, pues tiene los mejores resultados. El tratamiento intrahospitalario se reserva para los casos más graves, ya que es más costoso y disruptivo. La intervención temprana en todos los casos es crucial para optimizar los resultados y disminuir el riesgo de cronificación (94).
Claves del manejo del paciente con SE-AN: prevención terciaria y calidad de vida
La AN es una enfermedad psiquiátrica tratable y la mayoría de los pacientes afectados de la enfermedad se recuperan, aunque el periodo de recuperación a veces es muy largo y ocurre incluso después de décadas con la enfermedad (199).
Algunos pacientes con SE-AN pueden rechazar algunos de los tratamientos intensivos o incluso negarse a recibir tratamiento, que en ocasiones puede ser vital (200). En este contexto se plantean problemas éticos, ya que algunos de estos pacientes pueden no tener conciencia de la gravedad de su enfermedad, lo que repercute en su capacidad para tomar decisiones en relación con tratamientos necesarios para salvarles la vida. En los países donde el tratamiento judicializado es posible, este dilema ético aumenta en lo que se refiere a cuánto tiempo y con qué frecuencia hay que mantener el tratamiento contra la voluntad del paciente. El coste para pacientes, familia y proveedores de salud es significativo, siendo este también otro factor a considerar. El pronóstico y la calidad de vida son determinantes cuando decidimos continuar o finalizar un tratamiento activo. Las partes implicadas en tomar esta decisión incluyen al paciente, a la familia, al equipo terapéutico y a la Administración. La complejidad en el caso de la SE-AN, junto con las, a veces, limitadas opciones de tratamiento, añaden más problemas a estos dilemas éticos (194).
La prevención terciaria se refiere a intervenciones y a estrategias dirigidas a reducir el impacto de la enfermedad y a prevenir las complicaciones y las recaídas. En el contexto de la AN, la prevención terciaria podría comprender medidas para el apoyo de individuos que ya han recibido tratamiento y están en fase de recuperación (94). En este sentido, el tratamiento continuado y la monitorización son cruciales. Es importante ofrecer en cada momento la intensidad de tratamiento adecuada a la situación del paciente. Debe tratarse la psicopatología, los conflictos psicológicos y los factores familiares y culturales que tienden a reforzar o a mantener los comportamientos patológicos, dirigiendo los tratamientos a mejorar sus habilidades para el funcionamiento de las relaciones sociales e interpersonales. Asimismo, debe tratar de mantenerse un estado nutricional que le permita funcionar y evitar complicaciones médicas o empeoramiento de los síntomas. Los cuidados integrados entre distintos profesionales permiten una atención global en prevención terciaria dirigida a la cronicidad de la enfermedad (18).
El seguimiento nutricional incluye la monitorización del progreso clínico del paciente, la exploración física y el control del peso y de la ingesta alimentaria. Forma parte del tratamiento continuado del paciente y trabaja la integración del paciente en la vida familiar, social y profesional (1). Los pacientes con AN grave deben ser remitidos a unidades específicas de TCA para su tratamiento.
Es imprescindible disponer de recursos y de equipos con experiencia para el manejo de pacientes con SE-AN y asegurar que todos los pacientes en esta situación tienen acceso a este tipo de cuidados. Es necesario desarrollar investigación sobre cuál es el mejor manejo en cada individuo de los que tienen menos probabilidades de recuperarse de su enfermedad.
ESTUDIOS DE COSTE-EFECTIVIDAD EN EL MANEJO DE LA ANOREXIA NERVIOSA
La carga que la AN puede suponer para el propio paciente, su entorno familiar, para el sistema sanitario y para la sociedad suele valorarse en: a) años de vida perdidos (mortalidad; years of life lost: YLLs, por sus siglas en inglés); b) años perdidos por discapacidad (years lost due to disability [YLDs]); estos dos se unen en el concepto años de vida ajustados por discapacidad (disability adjusted life years [DALYs]); c) calidad de vida; y d) coste económico (coste del tratamiento y pérdida de ganancia económica para el paciente y para sus cuidadores) (201).
La valoración de los tratamientos destinados a la AN en sistemas sanitarios, utilizando análisis de coste-efectividad (estudio económico del tratamiento a aplicar relativo a sus beneficios clínicos) y de coste-utilidad (cuyo desenlace se mide en años de vida ajustados por calidad [AVAC]; quality-adjusted life years [QALYs], por sus siglas en inglés-) son escasos. Las decisiones en salud pueden llevarse a cabo teniendo en cuenta la razón de coste-efectividad incremental (coste económico incremental por cada AVAC ganado con la intervención frente a un comparador) y la curva de aceptabilidad, no exenta de incertidumbre, que indica gráficamente cuál es la probabilidad (tanto por ciento en el eje de ordenadas) de que una nueva tecnología sea coste-efectiva (coste económico menor o igual que el umbral fijado según la disposición a pagar en cada sistema sanitario por AVAC ganado) comparada con su alternativa. Además, debe estimarse el impacto sanitario (puede ser bajo cuando la razón coste-efectividad incremental es elevada, pero son pocos los pacientes tratados, y alto cuando dicha razón es baja, pero la población diana es muy alta) (202).
Muchos de estos datos no se conocen en todos los tratamientos aplicados a la AN. Los estudios publicados se han basado bien en ensayos clínicos o en estudios observacionales, con un número definido de casos, o en modelos matemáticos, generalmente sobre TCA en general, en diferentes rangos de edad, valorando la predicción durante un tiempo determinado, en un contexto geográfico y con eventos asociados a efectividad o a utilidad, dependiendo del diseño del estudio. Cada vez hay más publicaciones destinadas a esta materia y de mayor calidad, pero, de momento, varias consideraciones sobre coste-efectividad / utilidad de las intervenciones se basan más en estudios de eficacia / efectividad que en análisis económicos rigurosos.
En la actualización más reciente de la guía práctica para el tratamiento de los TCA de la APA no se revisan los aspectos relacionados con coste-efectividad. Los autores aseguran que, aunque el coste relacionado con el tratamiento puede ser una barrera para recibirlo, dicho coste puede variar entre países y áreas geográficas. Además, los estudios sobre coste-efectividad de alta calidad son escasos, lo que dificulta su empleo con la finalidad de intervenir en las políticas sanitarias. No obstante, aseguran la revisión de los costes asociados a los tratamientos (directos e indirectos, incluyendo el coste de oportunidad) y otros aspectos negativos que pueden influir en las decisiones del paciente, del clínico o de ambos (18).
A continuación, se resume el razonamiento lógico que acompañaría a la descripción de acciones coste-efectivas y a la evidencia que existe publicada sobre estas.
No existen datos de los costes asociados al tratamiento de la AN en todos los países. En EE. UU., el coste económico estimado de los TCA en el año fiscal 2018-2019 fue de 64,7 billones de dólares americanos, a los que deberían sumarse 326,5 billones más, atribuibles a la reducción en el bienestar de estos pacientes. El coste de la AN supuso un 17 % de dicha carga (203). Cerca de nuestro entorno, en Alemania, se ha descrito un coste mediano de 14 249 euros en mujeres y de 14 088 euros en hombres durante 5 años de seguimiento; la valoración comenzó 2 años antes del diagnóstico (204). Además, el impacto de la AN se ha estimado en 9,4 YLD (tasa estandarizada por edad / 100 000 habitantes), con un incremento del 6,2 % entre 2007 y 2017 (201). En el último informe sobre la carga de los trastornos mentales en más de 200 países y territorios, solo pudieron estimarse los años perdidos en los TCA, con una cifra de 17 361,5 YLL en 2019. El diagnóstico de AN se asoció a aproximadamente a un 84 % de las muertes (el resto estuvo relacionado con la BN). Los YLD y los DALY de forma global oscilaron en 35-67 y 63-105, respectivamente, para hombres, y entre 18-60 y 35-101 para mujeres en diferentes grupos de edad, sin que el informe ofrezca datos separados para AN (205).
Los resultados sobre coste-efectividad y coste-utilidad de los tratamientos dirigidos a la AN en particular, y a los TCA en general, pueden depender de diversos factores: del tipo de terapia, de la gravedad de los síntomas, de la respuesta individual al tratamiento y del sistema sanitario en el que el tratamiento se administre. Revisada la evidencia en Europa sobre una atención cualificada a través de servicios hipotéticamente más coste-efectivos, para mejorar el pronóstico de estos enfermos debería plantearse: optimizar la detección en Atención Primaria para facilitar la entrada en el tratamiento, reducir el tiempo para acudir a una atención especializada en TCA, incrementar la efectividad del tratamiento ambulatorio (medicina personalizada [dada la heterogeneidad de la patología] y monitorización continua para escalar en el tratamiento de manera precoz), realizar una transición cuidadosa desde la hospitalización o desde el hospital de día con la participación del entorno del paciente e implementar tratamientos rehabilitadores y nuevas terapias para aquellos que no responden al tratamiento convencional (206).
Desde un punto de vista puramente conceptual, la implementación de estrategias preventivas en un contexto de riesgo elevado de cronicidad, carga sanitaria y mortalidad podría considerarse a priori coste-efectiva. En el Documento de Consenso para la Prevención de los Trastornos de la Conducta Alimentaria SENPE-SENC-SEPEAP-SEMERGEN, en el capítulo dedicado a la prevención de los TCA en la comunidad, se recomienda la prevención selectiva en los grupos con más riesgo, pues es más coste-efectiva que la comunitaria universal, más costosa y difícil de evaluar, sin distinguir entre AN y otro tipo de trastorno (207).
La realización de estudios clínicos en este campo es compleja y, por ello, los diseños basados en modelos matemáticos son fundamentales en la evaluación económica de la prevención de enfermedades. Sus ventajas son que consideran todas las alternativas relevantes requeridas para las decisiones políticas, hacen los resultados aplicables al contexto de la toma de decisiones, reflejan toda la evidencia notable que no está recogida en los ensayos clínicos, tienen la habilidad de reflejar eventos relevantes finales y no intermedios, poseen la capacidad de extrapolar la evaluación a un horizonte de tiempo medio o prolongado y son más baratos que los ensayos clínicos. Sin embargo, la falta de experiencia en este tipo de análisis puede dar lugar a resultados no fiables que limitan la difusión de intervenciones decisivas en el entorno de los sistemas de salud. El modelo más utilizado ha sido el de Markov (que asume que el paciente se encuentra siempre en uno de un número finito de estados de salud, que deben ser exhaustivos [es decir, todos los posibles], mutuamente excluyentes [un individuo no puede estar en dos estados al mismo tiempo] y que transita por ellos en un tiempo definido), aunque no es el único (208). En el terreno de los TCA existen algunos ejemplos sobre este tipo de evidencia. En un trabajo que analizaba un modelo de microsimulación en una cohorte en adolescentes y adultos jóvenes (10-40 años) a partir de datos publicados entre 2001 y 2017, aplicando 5 acciones de prevención primaria y secundaria de TCA (cribado escolar, cribado en Atención Primaria, prevención primaria escolar universal [a partir de una intervención que promovía un patrón de dieta saludable, ejercicio físico y código de conducta en los medios], impuestos añadidos para píldoras servidas sin receta y acceso restringido a fármacos sin prescripción médica a jóvenes), la estrategia basada de prevención universal en escuelas fue la que se asoció a mayor beneficio monetario neto (3634 dólares por persona), pero no se ofrecieron datos separados para la AN (209). Otro trabajo evaluó, a través de nuevo de un modelo matemático, el coste-efectividad de una intervención basada en disonancia cognitiva para la prevención de AN y BN en chicas de entre 15 y 18 años australianas con preocupación por su imagen corporal. Los DALY evitados con dicha intervención fueron de media 16, con una razón de coste-efectividad incremental de 103 980 dólares por cada DALY evitado, por encima del umbral fijado según la disposición a pagar en Australia. Los autores concluyen que varias asunciones del modelo podrían haber tenido impacto en los resultados, como la falta de datos relativos a los costes derivados de la baja productividad de los pacientes (este hecho infraestima el ahorro descrito) y la baja tasa de respuesta prevista por parte de la población diana (210). En un ensayo clínico sobre más de 600 mujeres universitarias revisando la eficacia de la disonancia cognitiva basada en el plan Body Project a través de grupos liderados por clínicos o por pares, o a través de varios módulos de Internet, comparada con una sesión educativa sobre TCA, las sesiones lideradas por jóvenes resultaron en un mayor ahorro de casos con diagnóstico de TCA durante 4 años de seguimiento y en una razón de coste-efectividad incremental (desde una perspectiva social) de 740 dólares americanos por cada caso evitado de TCA (sin datos separados para AN-211).
Por otra parte, se sabe que una intervención temprana es más efectiva que un tratamiento demorado, ya que evita la progresión hacia un estado más grave que necesitaría de un tratamiento intensivo más costoso posteriormente. Así, medidas encaminadas a un reconocimiento precoz del trastorno desde Atención Primaria y a la reducción de la demora en la derivación a un servicio especializado se considerarían coste-efectivas en el abordaje de la AN (206). La USPSTF considera que la evidencia es insuficiente para recomendar el cribado de trastornos alimentarios (por ejemplo, TA, BN y AN) en adolescentes y adultos asintomáticos de 10 años o más. Puede considerarse en situaciones de riesgo como en atletas, mujeres, adultos jóvenes de 18 a 29 años, personas transgénero o en sujetos con síntomas sugerentes (19). En cuanto a las evidencias disponibles, en un modelo matemático extrapolado sobre una muestra de 1000 estudiantes universitarios americanos se evaluó un plan de tratamiento por pasos encaminado a la prevención (primaria en pacientes cribados con bajo riesgo de TCA, más específica en pacientes con riesgo elevado) y al tratamiento precoz (programa de autoayuda para aquellos con TCA clínico o subclínico, salvo AN) a través de herramientas digitales. Los pacientes con síntomas de TCA sugerentes de requerir un tratamiento más intensificado y aquellos con AN franca (estimando una prevalencia del 0,7 % de los cribados) se suponían derivados a un tratamiento personalizado. Este modelo de intervención por pasos supuso un ahorro de 13 862,54 dólares frente al tratamiento convencional. Entre los pacientes con TCA subclínico y con riesgo de TCA, la necesidad de requerir posteriormente tratamiento personalizado se vislumbró en 114 sujetos frente a 146 bajo tratamiento convencional. Pero, como se ha explicado, la AN quedó fuera de este plan de tratamiento por pasos apoyado en estrategias digitales (212). En este aspecto es importante considerar que muchos de los pacientes con AN presentan ambivalencia con respecto al deseo de tratamiento y dicha terapia precoz puede verse más favorecida con el compromiso de su entorno más cercano, lo que probablemente limita la efectividad de la autoayuda, salvo cuando el paciente reconoce la existencia del diagnóstico. Se han publicado otros estudios sobre coste-efectividad de dichos programas digitales, pero hasta donde alcanza nuestro conocimiento, no centrados en abordar de forma única la AN, por lo que escapan a los objetivos de esta revisión.
De forma general, podría plantearse si el tratamiento de la AN, con diferentes enfoques, es coste-efectivo atendiendo a diferentes eventos clínicos. Una revisión sistemática ha resumido la evidencia sobre coste-efectividad del tratamiento de la AN a través de 3 estudios con diseños diferentes (dos ensayos clínicos con una perspectiva de 2 años y un modelo matemático con una prospección vital), algo alejados en el tiempo. A modo de resumen, sin significación estadística en ambos casos, tanto la terapia psicodinámica focal como la cognitiva conductual (TCC) fueron más efectivas y con un coste más bajo que un tratamiento optimizado convencional, y el tratamiento ambulatorio especializado fue más coste-efectivo que el tratamiento en régimen de internamiento o que el tratamiento habitual. Restaurar el peso del paciente cerca del 100 % del peso ideal durante la hospitalización, con una estrategia posterior de cuidados, condujo a una razón coste-efectividad incremental de 30 180 dólares americanos por año salvado frente al tratamiento usual; sin embargo, no se analizó la incertidumbre ni se hicieron análisis de sensibilidad, por lo que no se considera concluyente (213). En otro pequeño estudio prospectivo de 2 años de seguimiento sobre 39 pacientes con AN, el coste del tratamiento supuso entre 5296 (en el mejor escenario posible) y 64 440 dólares por AVAC ganado, ambos valores aceptables desde el punto de vista de la disposición a pagar por el sistema sanitario (214).
En cuanto al tratamiento psicoterápico, en un estudio que analizaba la TCC optimizada (enhanced cognitive behaviour therapy) (n = 87) en pacientes con AN frente al tratamiento no especializado (n = 75) en ambos entornos (ambulatorio y hospitalario) se observó una mayor recuperación ponderal tras el tratamiento psicoterápico después de un año de seguimiento, sin diferencias en las tasas de remisión. Se describió un cociente incremental de coste-efectividad de 51 081 dólares, con una probabilidad mayor del 50 % de ser coste-efectivo, teniendo en cuenta la voluntad de pagar por el sistema sanitario (215). En otro modelo, el tratamiento con FBT en pacientes con AN entre 11 y 18 años de edad, con una duración hipotética del trastorno de menos de 3 años, y con una perspectiva de 6 años de seguimiento, fue más coste-efectivo que la terapia individual centrada en el adolescente (adolescent-focused individual therapy), proporcionando una razón de coste-efectividad incremental de 5089 y de 51 897 dólares, respectivamente, por cada DALY evitado, con una probabilidad del 100 % y del 45 % de ser coste-efectivos en cada caso, teniendo en cuenta la disposición a pagar por el sistema sanitario (216). En este sentido, en la última guía de la APA se recomienda que los adolescentes y los adultos con AN de corta evolución que tienen un cuidador involucrado reciban FBT con el fin de normalizar las conductas asociadas a la ingesta y al control del peso y con el objetivo de restaurar el peso perdido (18).
El tratamiento ambulatorio especializado es en general menos caro que un tratamiento más intensivo en el hospital o en el entorno residencial (213). En un estudio, ya antiguo, se aleatorizaron 167 jóvenes de entre 11 y 18 años a recibir o tratamiento hospitalario, TCC ambulatoria en centros especializados o tratamiento en centros generalistas de salud mental. Los eventos principales estudiados fueron similares tras 2 y 5 años de seguimiento (con mejorías significativas en todos los entornos), pero el tratamiento generalista fue más caro debido a una mayor necesidad de ingreso en el hospital. La terapia ambulatoria especializada fue la más coste-efectiva (217). En las guías sobre emergencias médicas en los TCA se reseña que en niños y jóvenes se ha observado que un ingreso breve seguido por un tratamiento inmediato basado en la evidencia en el medio ambulatorio es tan coste-efectivo, o más en algunos casos, que ingresos más prolongados tratando de conseguir la restauración ponderal. De hecho, los autores consideran esta estancia prolongada una pérdida de recursos cuando estos son escasos. Se recomienda que dichos ingresos duren menos de 3 semanas y se aborden de forma paralela los dominios físicos y mentales. No obstante, no existe la misma evidencia para adultos (55). En otro trabajo se testó si un tratamiento realizado en el ámbito hospitalario o bajo hospitalización parcial (n = 314) podía ser más coste-efectivo, desde el punto de vista de la optimización de la recuperación ponderal, que el realizado en el entorno residencial (datos históricos). La probabilidad de alcanzar un peso adecuado fue menor en el entorno residencial, con una estancia media más larga que en los programas hospitalarios, por lo que resultó menos coste-efectivo para el evento de peso ganado. Otros aspectos psicosociales no se tuvieron en cuenta en el estudio (218).
Una vez ingresado el paciente, la forma de realizar la renutrición para alcanzar la estabilidad clínica o un peso objetivo también debería estudiarse desde el punto de vista de su coste-efectividad. Varios estudios han abordado este tema, sugiriendo que una renutrición menos hipocalórica se asocia a mejoría ponderal más precoz y a una estancia media más corta. En un ensayo clínico en pacientes ingresados con AN y con AN atípica de entre 12 y 24 años, una renutrición realizada a partir de 2000 kcal, aumentando 200 kcal/día los días sucesivos, fue más efectiva para conseguir la estabilidad clínica que la iniciada desde las 1400 kcal. Esto se asoció a un ahorro hospitalario neto de 19 056 (IC 95 %, -28 819-9293) dólares por participante. Cabe decir que los investigadores excluyeron a sujetos con IMC inferior al 60 % de las referencias para la edad y el sexo (109). Las guías elaboradas por el Royal College of Psychiatrists abogan por pautas más agresivas de renutrición en pacientes adolescentes con grados leves-moderados de desnutrición sin factores de riesgo de SR. En cambio, muestran cautela en la extrapolación de estas recomendaciones a otros grupos de edad o grados avanzados de desnutrición o factores de riesgo de SR (55).
También la duración del tratamiento puede tener impacto en la relación coste-efectividad. Tratamientos más prolongados pueden incurrir en gastos más elevados, pero pueden conducir a un mejor pronóstico a largo plazo, reduciendo la probabilidad de recaída y la necesidad de tratamiento adicional. Del mismo modo, invertir en la prevención de dichas recaídas podría ser una estrategia coste-efectiva a largo plazo, lo que evita la necesidad de reproducir tratamientos previos. Recientemente se ha publicado una herramienta más flexible para el análisis de coste-efectividad de las intervenciones dirigidas a la AN, Trimbos Institute health economic cost-effectiveness model for Anorexia Nervosa, bajo una perspectiva social holandesa, dirigida a adolescentes mayores y adultos con un horizonte temporal de 20 años. Aplicando el modelo sobre un tratamiento hipotético, los autores pudieron demostrar que una intervención cara, con efectos solo modestos, puede ser coste-efectiva a largo plazo, dada la carga que la AN supone tanto para el coste sanitario como para una perspectiva social (219).
El lugar en el que se proporciona el tratamiento también podría influir en la relación coste-efectividad, que puede ser menor en centros especializados que en centros generales de salud mental. En un trabajo realizado en el Reino Unido y en la República de Irlanda sobre niños y adolescentes entre los 8 y los 17 años con diagnóstico reciente de AN, el tratamiento durante 12 meses en centros especializados (n = 192) presentó mayor probabilidad de ser coste-efectivo que el tratamiento realizado en centros generalistas (n = 106) de salud mental. Tanto la evolución de la escala Children’s Global Assessment Scale, que mide la función psicosocial, como del IMC fueron similares en ambos grupos con el mismo coste generado. Sin embargo, tras ajustar por variables basales relacionadas con mayor gravedad en los centros especializados, el tratamiento en estos tuvo mayor probabilidad de ser coste-efectivo (entre el 50 y el 90 %), dependiendo de la disposición a pagar por el sistema sanitario, con una razón de coste-efectividad incremental en torno a 10 932 libras asociada a la mejoría de la función psicosocial. No obstante, los autores mencionan que en un sistema con bajos umbrales de disposición a pagar las políticas sanitarias favorecerían la opción más barata, mientras que, si dichos niveles son elevados, el sistema será indiferente con respecto a las dos opciones, dada la escasa diferencia en el efecto conseguido. En este sentido, las preferencias del paciente y de sus cuidadores cobrarían más sentido (220,221).
La presencia de comorbilidad psiquiátrica, como la ansiedad o la depresión, puede requerir tratamiento simultáneo al de la AN, lo que hace aumentar los costes. No obstante, puede mejorar el curso clínico final. En este contexto, la revisión bibliográfica no ha ofrecido estudios sobre coste-efectividad.
A modo de conclusión, los estudios sobre coste-efectividad, además de escasos en el contexto de la AN, son complejos, dada la heterogeneidad de la población estudiada, los estados por los que puede transitar el paciente y la dificultad para predecir resultados a largo plazo. Los ensayos clínicos están limitados por el número de enfermos incluidos y por la baja adherencia de algunos de ellos, con una perspectiva temporal generalmente corta. Los modelos matemáticos ofrecen una alternativa muy atractiva en esta situación, pero pueden dejarse fuera de ellos variables que necesariamente tienen impacto en los costes y en la valoración de la efectividad del tratamiento, lo que conduce a resultados no siempre fiables con posibilidad de inferir en las políticas sanitarias.
Debe recordarse que, aunque el análisis de coste-efectividad de las intervenciones es crucial, el objetivo primario de los TCA es promover la salud individual. Tomar decisiones solo basadas en los costes puede no alinearse con el interés de la persona que está buscando tratamiento, que debe ser el más apropiado y el más efectivo, dependiendo de cada caso (18). Además, debe tenerse en cuenta que la cobertura económica de los TCA en los sistemas sanitarios varía de forma relevante en distintas áreas geográficas. Este hecho puede tener un impacto significativo en el coste individual del enfermo que busca ayuda.
En la tabla XIV se resumen las acciones que pueden ser coste-efectivas en AN y la evidencia que acompaña a cada una de ellas.