Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO  Similares en Google
Similares en Google
Compartir
Anales de Medicina Interna
versión impresa ISSN 0212-7199
An. Med. Interna (Madrid) vol.18 no.7 jul. 2001
ORIGINAL
Las lesiones anátomo-patológicas de la hepatitis crónica C
como factores predictivos de respuesta mantenida
al tratamiento con interferón
Sociedad Castellano-Leonesa para el Estudio de las Enfermedades Hepáticas.
E. Gento Peña, A. López Morante, J. Cordero Guevara,C. Echevarría Iturbe, J. L. Martín Lorente,
J. L. Olcoz Goñi, F. González San Martín, A.Caro-Patón Gómez, F. Jorquera Plaza,
R. Velicia Llames, F. Sáez-Royuela
Sección de Aparato Digestivo. Hospital General Yagüe. Burgos.
Complejo Hospitalario de León. Hospital Río Hortega. Valladolid.
RESUMEN
Introducción: Aunque se han realizado múltiples estudios para conocer los factores pre-tratamiento que pueden predecir la respuesta al tratamiento con interferón (IFN), se desconoce si las lesiones histológicas características de la hepatitis crónica C (HCC) sirven para predecir dicha respuesta.
Objetivos: Valorar si los parámetros histológicos pueden predecir la respuesta mantenida al tratamiento con IFN en los pacientes con HCC, y estudiar otros parámetros (epidemiológicos y analíticos) ya descritos como factores predictivos de respuesta.
Métodos: Se estudiaron de forma retrospectiva 201 pacientes, tratados con IFN durante al menos 3 meses en cuatro hospitales de Castilla y León. La variable dependiente analizada fue la respuesta mantenida al tratamiento. Como factores predictivos de respuesta se estudiaron las siguientes variables histológicas: diagnóstico histológico, índice de Knodell total y por apartados, grado y estadio, y lesiones características de la HCC. Además, se analizaron parámetros epidemiológicos y analíticos.
Resultados: El 16% de los pacientes presentó una respuesta mantenida. Ninguno de los parámetros histológicos sirvió para predecir dicha respuesta. Demostraron ser factores predictivos en el análisis bivariante la edad, el tiempo de evolución de la HCC, la vía de transmisión, la GGT, la ferritina y el genotipo viral. El factor predictivo más importante fue el genotipo viral, y el único asociado independientemente a la respuesta mantenida ("odds ratio" de respuesta al tratamiento de 8,6).
Conclusiones: Los parámetros histológicos no predicen la respuesta al tratamiento con IFN. Otros factores, fundamentalmente el genotipo viral, se asocian a un mayor porcentaje de respuestas, aunque ninguno sirve para decidir con exactitud qué pacientes responderán.
PALABRAS CLAVE: Interferón. Hepatitis crónica C. Virus de la hepatitis C. Anatomía patológica.
The histological lesions of chronic hepatitis C as predicting factors of sustained response to rhe treatment with interferon
ABSTRACT
Background: Although many studies have been implemented in order to determine the pre-treatment factors that can predict patients' response to interferon (IFN) therapy, it is not yet clear whether characteristic histologic abnormalities in chronic hepatitis C can predict such response.
Aims: The aims of this study were to evaluate, in patients with chronic hepatitis C, (i) the predictive value of histologic lesions for the sustained response to IFN therapy (ii) other pre-treatment (epidemiological and analytical) factors known to be predictive of response.
Patients and methods: Sustained response was retrospectively evaluated in two hundred one patients who had been treated with IFN for at least 3 months in four different hospitals from Castilla y León. The following histological parameters were studied as predictors of response: histological diagnosis, Knodell index, grading and stage, characteristic histologic lesions of HCV infection. Epidemiological and analitycal parameters were also evaluated.
Results: The rate of patient's sustained response to IFN treatment was 16%. None of the histological parameters was useful to predict this response. By univariate analysis, age, disease evolution time, mode of viral transmission, GGT, ferritin and viral genotype were associated with a sustained response. The most powerful, and only independent predictive factor, however, was the genotype (the response odds ratio was 8.6).
Conclusions: Histological parameters do not predict the response to IFN treatment. Other factors (mainly the viral genotype) are associated with a higher response percentage, although no one is useful to decide which patients are going to respond.
KEY WORDS: Interferon. Chronic hepatitis C. Hepatitis C virus. Histopathology
Trabajo aceptado:14 de Febrero de 2001
Correspondencia: Federico Sáez-Royuela. Sección de Aparato Digestivo. Hospital "General Yagüe". Avenida del Cid, 96. 09005 Burgos.
INTRODUCCIÓN
Desde hace una década los enfermos con infección crónica por el virus de la hepatitis C (VHC) han sido tratados habitualmente con interferón (IFN), obteniéndose una respuesta mantenida en el 15-20% de los casos (1-3). El único modo de incrementar esta proporción de respuestas al tratamiento exclusivo con IFN es administrarlo a los pacientes con más posibilidades de responder (4), evitando, además, al resto de los pacientes un tratamiento con frecuentes efectos adversos y un coste elevado (5).
Se han realizado numerosos estudios para intentar conocer los factores que pueden predecir la respuesta al tratamiento con IFN en los pacientes con hepatitis crónica C (HCC) (6-11). Muchos de ellos han analizado los factores predictivos de respuesta al tratamiento considerando ésta como respuesta al final del tratamiento, y no como respuesta mantenida, o han analizado únicamente la normalización de las transaminasas, sin considerar la desaparición de la viremia (5). Además, gran parte de estos estudios han sido bivariantes, por lo que describen asociaciones más que verdaderos factores predictivos (5). Así, se ha podido conocer que responden mejor al tratamiento los enfermos más jóvenes, con menos tiempo de evolución de la enfermedad, transaminasas más bajas y gammaglutamil transpeptidasa (GGT) y ferritina normales (12). El genotipo distinto del 1 y los bajos niveles de viremia condicionan también una mejor respuesta (10-11).
Por otro lado, se conoce ya desde hace algunos años que los pacientes con HCC tienen un patrón de lesiones histológicas hepáticas característico, aunque no específico (13-19). Sin embargo, hasta el momento no se ha estudiado si las lesiones histológicas características de la HCC condicionan una mejor o peor respuesta al IFN.
Los objetivos de este estudio son: a) determinar si las lesiones anatomo-patológicas de la HCC pueden predecir la respuesta mantenida al tratamiento con IFN; b) valorar otra serie de factores predictivos de respuesta al tratamiento que raramente se han evaluado simultáneamente, e intentar construir un modelo estadístico que permita predecir qué pacientes van a responder al IFN.
PACIENTES Y MÉTODOS
PACIENTES
Se efectuó un estudio multicéntrico retrospectivo en cuatro hospitales de Castilla y León. Se incluyeron inicialmente 201 pacientes mayores de 18 años con HCC tratados con IFN durante los años 1990 a 1998. Los criterios de inclusión fueron: elevación de la alanina aminotransferasa sérica (ALT) al menos durante 1 año, anticuerpos anti-VHC positivos en suero, diagnóstico histológico de hepatitis crónica en la biopsia hepática efectuada durante el año previo al comienzo del tratamiento, y tratamiento con IFN durante al menos 3 meses. Se consideraron criterios de exclusión: antecedentes de descompensación de enfermedad hepática, coinfección por el virus de la hepatitis B o por el virus de la inmunodeficiencia humana, trasplante hepático previo, ingestión de más de 80 gramos de etanol al día y presencia de cualquier otra causa de hepatopatía, incluyendo hepatotoxicidad por drogas, hemocromatosis, hepatitis autoinmune, enfermedad de Wilson y déficit de alfa1-antitripsina.
Los pacientes habían estado incluidos en varios protocolos de tratamiento con IFN: 190 con IFN-α2b (Intrón A; Schering Plough, Kenilworth, NJ, USA) y 11 con IFN linfoblastoide (Wellferon; Wellcome, London, UK.), a dosis de 3-6 mega unidades (MU), administradas subcutáneamente 3 veces a la semana, al menos durante 3 meses. En todos los protocolos se suspendía el tratamiento a los 3 meses si la ALT continuaba elevada.
Se consideró que existía una respuesta mantenida al tratamiento con IFN cuando, a los 6 meses de finalizado el mismo, la ALT era normal y el RNA del VHC era negativo. Como factores predictivos de respuesta al tratamiento se estudiaron las siguientes variables: a) histológicas: presencia o no de cirrosis, índice de Knodell total y por apartados (necrosis en sacabocados o en puentes, citolisis parenquimatosa, inflamación portal y fibrosis), nueva clasificación histológica (grado y estadio), lesiones características de la HCC (folículos y agregados linfoides, alteración de los conductos biliares, degeneración grasa macro y microvesicular, activación sinusoidal, siderosis hepática y existencia de hepatocitos multinucleados y displásicos); b) epidemiológicas: edad, sexo, vía de transmisión (transfusional u otra) y duración de la infección (estimada desde el momento de la transfusión o desde el año de inicio de la drogadicción por vía intravenosa, no pudiendo calcularse en el resto de los casos); c) analíticas pre-tratamiento: ALT, aspartato aminotransferasa (AST), bilirrubina (BI), fosfatasa alcalina (FA), gamma glutamil transpeptidasa (GGT), sideremia, ferritina, genotipo del VHC.
MÉTODOS
Estudio histológico
Un único patólogo (C. Echevarría) revisó "de forma ciega" las biopsias hepáticas realizadas en los distintos centros. Éstas fueron obtenidas con aguja tipo Tru-cut, inmediatamente fijadas en formol al 10% durante 24 horas, y posteriormente incluidas en parafina. Se realizaron tres cortes, de media, del tejido para cada técnica, a 3-4 micras, que se tiñeron con hematoxilina-eosina, tricrómico de Masson, tinción argéntica para fibras de reticulina y azul de Perls para tinción de los depósitos de hierro. Las biopsias hepáticas que contenían menos de 3 espacios porta se consideraron no valorables y se excluyeron, por tanto, del estudio.
Se estableció el diagnóstico histológico de hepatitis crónica persistente (HCP), hepatitis crónica activa (HCA) o cirrosis hepática (CI) según los criterios del Grupo Internacional (20), realizándose asimismo una valoración semicuantitativa según el índice de Knodell (21). También valoró la actividad (grado) y la evolución (estadio) de las lesiones histológicas siguiendo las modificaciones recientemente propuestas (22). Se estudiaron, además, las lesiones histológicas características de la HCC (13-19): los folículos y agregados linfoides en los espacios porta, la presencia de daño en los conductos biliares (valorando la infiltración inflamatoria y la lesión celular epitelial), la esteatosis macro o microvesicular, la activación sinusoidal (presencia de linfocitos y células de Kupffer en los sinusoides), la siderosis hepática (depósito de hierro en los hepatocitos y en las células de Kupffer), y la existencia de hepatocitos multinucleados o displásicos.
Pruebas de laboratorio
Durante el mes previo al inicio del tratamiento se determinaron: ALT, AST, FA, GGT, BI, sideremia, ferritina, anti-VHC y, en los casos en que fue posible, el RNA y el genotipo del VHC. La ALT se determinó, además, a los 3 meses de iniciado el tratamiento, al final del mismo y 6 meses después de finalizado, momento en el que también se determinó el RNA del VHC. El anti-VHC se determinó mediante enzimunoensayo de micropartículas (MEIA) (AxSYM HCV, Abbott Laboratories, Illinois, USA). La determinación cualitativa del RNA del VHC se llevó a cabo con la técnica de reacción en cadena de la polimerasa (PCR) (AmplicorTM HCV 1.0 y 2.0 Roche Diagnostic System, Hoffmann-La Roche, Basel, Switzerland). Los distintos genotipos, de acuerdo con la clasificación de Simmonds, se determinaron también mediante PCR (INNO-LiPA HCV, Innogenetics, Zwijnaarde, Belgium).
Análisis estadístico
Como variable dependiente se estudió la respuesta mantenida al tratamiento con IFN. Para los propósitos del análisis estadístico, los índices de Knodell total y por apartados se distribuyeron en dos grupos, según la gravedad de las lesiones (puntuación menor-igual frente a mayor de 10 en el índice de Knodell total, y lesiones ausentes-leves frente a moderadas-graves para cada uno de sus apartados). Las lesiones características de la HCC se distribuyeron también en dos grupos, según estuvieran ausentes o presentes en cualquier grado.
El estudio estadístico se llevó a cabo con el programa SPSS versión 7.5. El análisis descriptivo de las variables cualitativas se realizó mediante la distribución de frecuencias absolutas y relativas, y el de las variables cuantitativas, mediante la media y la desviación estándar. La distribución de las variables cualitativas se comparó mediante el test exacto de Fisher y la de las variables cuantitativas, con la t de Student. Los valores de p menores a 0,05 se consideraron estadísticamente significativos.
Para identificar las variables independientes asociadas a la respuesta al tratamiento se recurrió a un modelo de regresión logística, utilizando criterios clínicos, epidemiológicos y estadísticos para elegir las variables a incluir en el mismo. Se emplearon los métodos por pasos hacia delante (FWS (LR)) y hacia atrás (BWS (LR)) basados en la probabilidad de la razón de verosimilitud, con una probabilidad del 0,05 para la entrada y del 0,1 para la salida de las variables del modelo. La bondad de ajuste global del modelo se evaluó mediante el test de Chi cuadrado, y se permitieron un máximo de 20 iteraciones.
RESULTADOS
De los 201 pacientes reclutados, 8 fueron perdidos durante el período de seguimiento, y en otros 6 no pudo determinarse el RNA viral a los 6 meses de finalizado el tratamiento, por lo que la respuesta mantenida se evaluó finalmente en 187 pacientes. Treinta de ellos (16,0%) respondieron de forma mantenida.
ANÁLISIS BIVARIANTE
Ninguno de los 10 pacientes con cirrosis de nuestro estudio respondió al tratamiento, aunque estas diferencias no fueron estadísticamente significativas. Tampoco observamos diferencias significativas entre los pacientes respondedores y no respondedores en el índice de Knodell total ni en ninguno de sus cuatro apartados. Los pacientes con menor grado de actividad necroinflamatoria (parámetro que engloba los tres primeros puntos del índice de Knodell) y estadio menos evolucionado respondieron en una mayor proporción al tratamiento (p= 0,380 y p=0,056 respectivamente) (Tabla I).
Tampoco encontramos diferencias entre ambos grupos de pacientes en ninguna de las lesiones histológicas características de la HCC. No obstante, el porcentaje de respuestas mantenidas fue el doble entre los pacientes sin alteración de los conductos biliares (31% frente al 15%) (Tabla I). Únicamente se objetivó displasia de hepatocitos en 6 pacientes (3,2%), hepatocitos multinucleados en 3 (1,6%) y ausencia de activación sinusoidal en 1 (0,5%) (datos no mostrados).
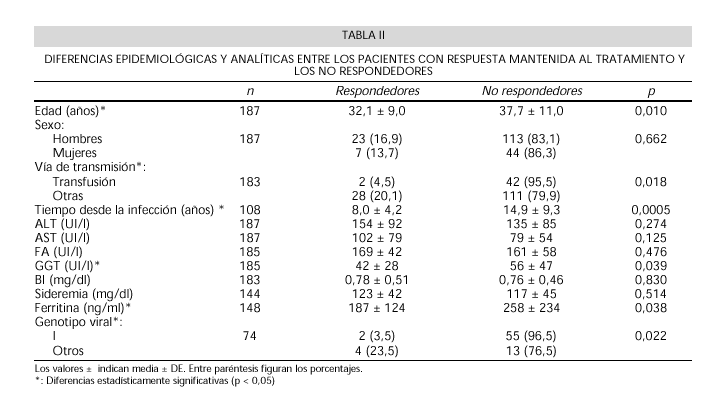
Los pacientes con respuesta mantenida al tratamiento eran más jóvenes (5,6 años menos de media) y tenían un menor tiempo de evolución de la enfermedad (6,9 años menos de media) que los no respondedores. El porcentaje de respuestas fue mayor entre los pacientes que habían adquirido la HCC por vías diferentes a la transfusional (20% frente a 5%). Estas diferencias fueron estadísticamente significativas. Además, los pacientes no respondedores tenían una GGT 14 UI/l mayor, y una ferritina 71 ng/ml de media más elevada que los que respondieron. Sólo un 3,5% de los pacientes con genotipo 1 de Simmonds respondió al tratamiento, frente al 23,5% de respuestas mantenidas entre los pacientes infectados por otros genotipos (Tabla II).
Los modelos de regresión logística se construyeron con la respuesta mantenida como variable dependiente, y la existencia o no de cirrosis hepática, el genotipo viral, la vía de transmisión, la edad, la ferritina y la GGT como variables independientes. Como mejor modelo se eligió al que incluía el genotipo como única variable independiente. Este modelo tenía un valor predictivo global del 89,83% y un valor de Chi cuadrado estadísticamente significativo (p < 0,05), con una odds Ratio (OR) de respuesta al tratamiento de los genotipos diferentes al 1 respecto al genotipo 1 de 8,60 (intervalo de confianza al 95%: 1,38 a 53,69).
DISCUSIÓN
El porcentaje de respuestas mantenidas de nuestro estudio, aunque similar a lo comunicado previamente (1-3), es relativamente bajo, probablemente por la alta prevalencia del genotipo 1 en nuestro medio (23-24), que alcanza el 77% en la serie que presentamos.
Probablemente, el número de respuestas mantenidas fue demasiado bajo como para poner de manifiesto diferencias en los parámetros histológicos entre los pacientes respondedores y no respondedores. De acuerdo con nuestro estudio, en que ninguno de los pacientes cirróticos respondió al tratamiento, otros previos han comunicado que la probabilidad de respuesta mantenida al tratamiento con IFN en estos pacientes es 2-3 veces menor que en los pacientes sin cirrosis (11, 25-26). Estos datos obligarían a reflexionar sobre la conveniencia de administrar IFN a este grupo de pacientes, más aún cuando las complicaciones del tratamiento son más frecuentes en ellos (27). No obstante, estudios recientes apuntan que el IFN puede prevenir el desarrollo de hepatocarcinoma en los pacientes cirróticos, incluso cuando no responden de forma mantenida al tratamiento (28-29).
Contrariamente a nuestros datos, en que no se observaron diferencias en ninguno de los cuatro parámetros del índice de Knodell, un estudio previo sugiere que la respuesta disminuye a mayor necrosis en sacabocados (30). Probablemente el índice de Knodell total carece de valor pronóstico de respuesta al tratamiento por valorar conjuntamente la actividad necro-inflamatoria junto con la progresión de la fibrosis (31-33).
No encontramos diferencias entre ambos grupos de pacientes en ninguna de las lesiones histológicas características de la HCC. Al contrario, estudios previos señalan que los pacientes con marcada formación de folículos linfoides (30) y sin degeneración grasa hepatocitaria (34) responden mejor al tratamiento. La activación sinusoidal, que se ha descrito en más del 80% de las biopsias hepáticas de los pacientes con HCC (17), estaba presente en la práctica totalidad de nuestros pacientes. Por el contrario, la frecuencia de hepatocitos multinucleados y displásicos fue menor en nuestra serie que la descrita en la literatura (13,16-17). La desproporción encontrada en la distribución de estos tres parámetros impide extraer conclusiones sobre si pueden influir en la respuesta al IFN.
Como en este estudio, otros previos han señalado que la menor edad, el menor tiempo de evolución de la infección y la vía de transmisión diferente a la transfusional condicionan una buena respuesta al tratamiento con IFN (6, 8, 11). Sin embargo, probablemente estos tres parámetros están relacionados entre sí, y con otros, como el genotipo viral, lo que explica que desaparezcan como factores predictivos independientes en el análisis multivariante. Además, la severidad de las lesiones histológicas aumenta en las HCC postransfusionales y con mayor tiempo de evolución (35), lo que también condicionaría la respuesta al tratamiento.
Las cifras elevadas de GGT y ferritina se han relacionado con la resistencia al tratamiento con IFN (8, 36), y varios trabajos recientes han demostrado que los pacientes con HCC que no responden al mismo tienen un mayor contenido hepático de hierro (37) que, como es sabido, se correlaciona estrechamente con las cifras de ferritina. No se ha demostrado, sin embargo, que el tratamiento de la colestasis (8) ni la depleción de los depósitos de hierro mediante flebotomías (38) consiga aumentar la respuesta al tratamiento.
El genotipo viral fue el factor predictivo más importante, y el único asociado independientemente a la respuesta mantenida. El genotipo 1 parece asociarse a mayores niveles de viremia y a lesiones histológicas más graves (9, 33), lo que puede explicar, en parte, que los pacientes infectados por este genotipo respondan en menor porcentaje al tratamiento.
El modelo de regresión logística creado, que incluye el genotipo como única variable independiente, muestra que los pacientes infectados por genotipos distintos al 1 tienen una probabilidad de responder al tratamiento de media 8,6 veces mayor que los pacientes infectados por el genotipo 1. Este modelo sería atractivo para su aplicación en la práctica clínica por su buen valor predictivo global y su sencillez y objetividad. No obstante, presenta varios inconvenientes que dificultan su uso clínico: En primer lugar, no ha podido ser validado, dado que la introducción reciente del tratamiento combinado con ribavirina nos ha impedido reclutar más enfermos para este fin. En segundo lugar, aunque el valor predictivo global del modelo es bueno, su sensibilidad es nula, lo que le hace incapaz de predecir realmente qué pacientes responderán al tratamiento. Por último, en nuestro estudio no ha sido posible analizar la viremia, lo que supone una limitación importante, teniendo en cuenta que estudios previos apuntan que la carga y el genotipo viral son los factores predictivos pre-tratamiento más reproductibles y de mayor valor (10-11).
Como se sabe, desde fechas recientes el tratamiento de elección de las HCC lo constituye la combinación de IFN y ribavirina, estando justificada la monoterapia con IFN únicamente en caso de que existan contraindicaciones para la utilización de la ribavirina. A pesar de la escasa experiencia, estudios bivariantes preliminares revelan que son, nuevamente, los pacientes más jóvenes, de sexo femenino, afectados por genotipos diferentes del 1, con menor carga viral y estadio menos evolucionado en la biopsia hepática los que tienen más posibilidades de responder al tratamiento combinado, no sirviendo, nuevamente, ninguno de ellos, para seleccionar qué pacientes deben recibir tratamiento (39-40).
Podemos concluir, por tanto, que ninguno de los factores histológicos, y ninguno de los otros factores pre-tratamiento, sirve para decidir con total precisión qué pacientes responderán al tratamiento con IFN. No obstante, algunos factores, como el genotipo viral diferente del 1 se asocian a un mayor porcentaje de respuestas, y pueden ayudar a decidir actitudes terapéuticas en casos concretos.
Bibliografía
1. Poynard T, Leroy V, Cohard M, Trevenot T, Mathurin P, Opolon P, et al. Meta-analysis of interferon randomized trials in the treatment of viral hepatitis C: effects of dose and duration. Hepatology 1996; 24: 778-789. [ Links ]
2. Carithers RL, Emerson SS. Therapy of hepatitis C: meta-analysis of interferon alfa-2b trials. Hepatology 1997; 26 (Suppl. 1): 83S-88S. [ Links ]
3. Hoofnagle JH, Di Bisceglie AM. The treatment of chronic viral hepatitis. N Engl J Med 1997; 336: 347-356. [ Links ]
4. Civeira MP, Prieto J. Early predictors of response to treatment in patients with chronic hepatitis C. J Hepatol 1999; 31 (Suppl. 1): 237-243. [ Links ]
5. Davis GL. Prediction of response to interferon treatment of chronic hepatitis C. J Hepatol 1994; 21: 1-3. [ Links ]
6. Pérez R, Pravia R, Linares A, Rodríguez M, Lombrana J.L, Suarez A, et al. Response related factors in recombinant interferon alfa-2b treatment of chronic hepatitis C. Gut 1993; 34 (Suppl.): S139-S140. [ Links ]
7. Tsubota A, Chayama K, Arase Y, Koida I, Saitoh S, Ikeda K, et al. Factors useful in predicting the response to interferon therapy in chronic hepatitis C. J Gastroenterol Hepatol 1993; 8: 535-539. [ Links ]
8. Serfaty L, Giral P, Andréani T, Legendre C, Poupon R. Factors predictive of the response to interferon in patients with chronic hepatitis C. J Hepatol 1994; 21: 12-17. [ Links ]
9. Tsubota A, Chayama K, Ikeda K, Yasuji A, Koida I, Saitoh S. et al. Factors predictive of response to interferon-a therapy in hepatitis C virus infection. Hepatology 1994; 19: 1088-1094. [ Links ]
10. Shiratori Y, Kato N, Yokosuka O, Imazeki F, Hashimoto E, Hayashi N. et al. Predictors of the efficacy of interferon therapy in chronic hepatitis C virus infection. Gastroenterology 1997; 113: 558-566. [ Links ]
11. Martinot-Peignoux M, Boyer N, Pouteau M, Castelnau C, Giuily N, Duchatelle V, et al. Predictors of sustained response to alpha interferon therapy in chronic hepatitis C. J Hepatol 1998; 29: 214-223. [ Links ]
12. Booth J.C.L, Brown J.L, Thomas H.C. The management of chronic hepatitis C virus infection. Gut 1995; 37: 449-454. [ Links ]
13. Lefkowitch JH, Apfelbaum TF. Non-A, non-B hepatitis: Characterization of liver biopsy pathology. J Clin Gastroenterol 1989; 11: 225-232. [ Links ]
14. Di Bisceglie AM, Goodman ZD, Ishak KG, Hoofnagle JH, Melpolder JJ, Alter HJ. Long-term clinical and histopathological follow-up of chronic posttransfusion hepatitis. Hepatology 1991; 14: 969-974. [ Links ]
15. Scheuer PJ, Asharafzadeh P, Sherlock S, Brown D, Dusheiko GM. The patology of hepatitis C. Hepatology 1992; 15: 567-571. [ Links ]
16. Bach N, Thung SN, Schaffner F. The histological features of chronic hepatitis C and autoimmune chronic hepatitis: A comparative analysis. Hepatology 1992; 15: 572-577. [ Links ]
17. Lefkowitch JH, Schiff ER, Davis GL, Perrillo RP, Lindsay K, Bodenheimer HC, et al. Pathological diagnosis of chronic hepatitis C: a multicenter comparative study with chronic hepatitis B. Gastroenterology 1993; 104: 595-603. [ Links ]
18. Czaja AJ, Carpenter HA. Sensitivity, specificity and predictability of biopsy interpretation in chronic hepatitis. Gastroenterology 1993; 105: 1824-1832. [ Links ]
19. Sherlock S. Viral hepatitis C. Curr Opin Gastroenterol 1993; 9: 341-348. [ Links ]
20. Bianchi L, De Groote J, Desmet VJ, Gedigk P, Korb G, Popper H, et al. Acute and chronic hepatitis revisited. Lancet 1977: 914-919. [ Links ]
21. Knodell RG, Ishak KG, Black WC, Chen TS, Craig R, Kaplowitz N, et al. Formulation and application of a numeral scoring system for assessing histological activity in asymptomatic chronic active hepatitis. Hepatology 1981; 1: 431-435. [ Links ]
22. Scheuer PJ. Classification of chronic viral hepatitis: a need for reassessment. J Hepatol 1991; 13: 372-374. [ Links ]
23. Forns X, Matuenda MD, López-Labrador FX, Ámpurdanès S, Olmedo E, Costa J, et al. Comparative study of three methods for genotyping hepatitis C virus strains in samples from Spanish patients. J Clin Microbiol 1996; 34: 2516-2521. [ Links ]
24. López-Labrador FX, Ampurdanés S, Forns X, Castells A, Sáiz JC, Costa J, et al. Hepatitis C virus (HCV) genotypes in Spanish patients with HCV infection: relationship between HCV genotype 1b, cirrhosis and hepatocellular carcinoma. J Hepatol 1997; 27: 959-965. [ Links ]
25. Rumi M, Del Ninno E, Parravicini ML, Romeo R, Soffredini R, Donato M.F, et al. A prospective, randomized trial comparing lymphoblastoid to recombinant interferon alfa 2a as therapy for chronic hepatitis. Hepatology 1996; 24: 1366-1370. [ Links ]
26. Cammà C, Di Marco V, Lo Iacono O, Almasio P, Giunta M, Fuschi P, et al. Long-term course of interferon-treated chronic hepatitis C. J Hepatol 1998; 28: 531-537. [ Links ]
27. Jansen HL, Brower JT, Nevens F, Sánchez-Tapias JM, Craxi A, Hadziyannis S. Fatal hepatic descompensation associated with interferon alfa. European concerted action on viral hepatitis (Eurohep). BMJ 1993; 306: 703-704. [ Links ]
28. Mura D, Deliperi R, Fastame L, Carlini A, Cossu PA, Pisanu G, et al. Five years follow-up after interferon therapy in HCV-positive compensated cirrhosis. Ital J Gastroenterol Hepatol 1998(Suppl. 2): A114. [ Links ]
29. Sofia S, Casali A, Buscarini E, Castagneti E, Rapaccini G.L, Levantesi F. et al. Effect of lymphoblastoid IFN in the treatment of liver cirrhosis and prevention of HCC. Ital J Gastroenterol Hepatol 1998; 30 (Suppl. 1): A31. [ Links ]
30. Kumagai N, Kuramochi S, Toda K. Assessment of histological features and outcome of interferon therapy in chronic hepatitis C. J Gastroenterol 1996; 31: 69-74. [ Links ]
31. Garcia-Buey L, García-Monzón C, García-Sánchez A, Moreno-Otero R. Hepatic histology predicts the outcome of interferon (rIFN a-2b) therapy in chronic active hepatitis C (CAH C) (Abstract). Hepatology 1991; 14: 204A. [ Links ]
32. Banner BF, Barton A.L, Cable EE, Smith L, Bonkowsky HL. A detailed analysis of the Knodell score and other histologic parameters as predictors of response to interferon therapy in chronic hepatitis C. Modern Pathology 1995; 8: 232-238. [ Links ]
33. Shindo M, Arai K, Okuno T. The clinical value of grading and staging scores for predicting a long-term response and evaluating the efficacy of interferon therapy in chronic hepatitis C. J Hepatol 1997; 26: 492-497. [ Links ]
34. Kaserer K, Fiedler R, Steindl P, Müller CH, Wrba F, Perenci P. Liver biopsy is a useful predictor of response to interferon therapy in chronic hepatitis C. Histopathology 1998; 32: 454-461. [ Links ]
35. López-Morante A, Sáez-Royuela F, Echevarría C, Llanos C, Martín-Lorente JL, Yuguero L, et al. Influence of the transmission route and disease duration in the histopathology of chronic hepatitis C: a study of 101 patients. Eur J Gastroenterol Hepatol 1993; 10: 15-19. [ Links ]
36. Pérez R, Pravia R, Linares A, Rodríguez M, González M, Díaz JM. Tratamiento de las hepatitis crónicas C con interferón alfa-2b durante 9 meses. Resultados y factores relacionados con la respuesta. Gastroenterol Hepatol 1993; 17: 157-164. [ Links ]
37. Barton AL, Banner BF, Cable EE, Bonkowsky HL. Distribution of iron in the liver predicts the response of chronic hepatitis C infection to interferon therapy. Am J Clin Pathol 1995; 103: 419-424. [ Links ]
38. Hayashi H, Takikawa T, Nishimura N, Yano M. Serum aminotransferase levels as an indicator of the effectiveness of venesection for chronic hepatitis C. J Hepatol 1995; 22: 268-271. [ Links ]
39. McHutchison JG, Gordon SC, Schiff ER, Shiffman ML, Lee WM, Rustgi VK, Goodman AD et al. Interferon alfa 2-b alone or in combination with ribavirin as initial treatment for chronic hepatitis C. N Engl J Med 1998; 339: 1485-1492. [ Links ]
40. Poynard T, Marcellin P, Lee SS, Niederau C, Minuk GS, Ideo G et al. Randomised trial of interferon α2b plus ribavirin for 48 weeks or for 24 weeks versus interferon a2b plus placebo for 48 weeks for treatment of chronic infection with hepatitis C virus. Lancet 1998; 352: 1426-1432. [ Links ]