Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO  Similares en Google
Similares en Google
Compartir
Anales de Medicina Interna
versión impresa ISSN 0212-7199
An. Med. Interna (Madrid) vol.20 no.3 mar. 2003
| Aproximación al coste del tratamiento farmacológico en la artritis reumatoide en España A. MERA VARELA. J. BLANCO RODRÍGUEZ1. M. CAAMAÑO FREIRE2 Servicio de Reumatología. Complejo Hospitalario Universitario. Facultad de Medicina. Universidad de Santiago. Santiago de Compostela
|
| APPROXIMATION TO THE COST OF PHARMACOLOGICAL TREATMENT OF RHEUMATOID ARTHRITIS IN SPAIN
| ||
| RESUMEN Objetivo: Estudiar el coste directo derivado de la utilización de fármacos en el tratamiento de la artritis reumatoide (AR) en España. Material y métodos: Un estudio prospectivo de 150 pacientes (125 mujeres/25 varones) con AR se realizó en un hospital público de la Comunidad de Galicia. La edad media fue de 60,2 años, con un tiempo de evolución de la enfermedad de 11,2 años (1-53); el 64,4% de los pacientes procedía de medio rural. Se realizó entrevista personal con registro completo de todos los datos: demográficos, actividad de la enfermedad (VSG, número de articulaciones inflamadas), estadio radiológico, estadío funcional (ACR), manifestaciones extrarticulares y enfermedades concomitantes, así como el coste mensual o anual y coste total final, según correspondiese. El estudio estadístico se realizó con el paquete Excel (Microsoft) y la herramienta Analisis Tool Pack del mismo. Resultados: El 53% de los pacientes estaban en clase funcional ACR I y 52% en estadio radiológico I o II de Steinbrocker. 16 pacientes estaban en remisión. El 82,7% de los pacientes usaban algún antinflamatorio no esteroideo, con un coste mensual de 12,71 (1,10-80,1 ); Estaban recibiendo corticoides el 90,7%, con un coste mensual 5,17 (1,24-33,7 ). Un 94% empleaban algún fármaco de acción lenta (FARAL), el más común de ellos, metotrexato y tratamiento combinado con más de un FARAL el 21%. El coste medio mensual para uso de un solo FARAL, en general MTX, fue de 3,63 . El uso de combinaciones de 2 de estos fármacos supone 13,75 /mes. El 80% de todos los pacientes usaban alguna vez fármacos gastroprotectores con un coste mensual medio de 36,9 y para otras patologías concomitantes recibían tratamiento con algún fármaco a lo largo de un año el 95%, cuyo coste sumado al de la gastroprotección supone por paciente y año 568,6 . Se han incluido 23 pacientes que recibían anti-TNF, con un coste mensual medio de 933,8 . El coste medio anual para una AR en fármacos exclusivos para artritis fue de 342,8 sin el empleo de anti-TNF, aunque con amplias variaciones (6,47-2910 ). Con la inclusión de fármacos para enfermedades concomitantes, gastroprotección y aquellos que usan anti-TNF, el coste anual por paciente es de 2.587 . El mayor gasto farmacéutico se produce en edades entre 50 y 70 años. Hemos encontrado una buena correlación entre un mayor coste total y el uso de fármacos para otras enfermedades diferentes de la artritis, el uso de gastroprotección, el uso de anti-TNF, la edad, el grupo de tiempo de evolución de la enfermedad de 5 a 10 años, el número de articulaciones inflamadas, pero no así el estadio radiológico. Conclusiones: La carga económica por consumo de fármacos en la AR es muy variable dependiendo de varias variables que incluyen la propia enfermedad y otras condiciones relacionadas. El mayor coste aparece con el uso de terapia anti-TNF. En los casos más frecuentes, la gastroprotección y la terapia para la comorbilidad suponen el 62% del gasto total anual, seguido por el uso de FARAL, y en menor medida por antinflamatorios y corticoides. PALABRAS CLAVE: Artritis. Reumatoide. Coste. Económico. Farmacológico. | ABSTRACT Objective: To study the direct cost derived of utilization of pharmaceutical compounds in the treatment of rheumatoid arthritis(RA). Material and methods: A prospective study with 150 patients (125 women/25 men) suffered of RA was carry out in Galicia-Spain public hospital. The mean age was 60,2 years , with a mean lengthy of disease of 11,2 years (1-53); the 64,4% come from rural areas. A personal interview was made with a complete registry of all data: demographic, activity score (ESR, Swollen joints), radiological status, functional class (ACR), extrarticular manifestations and co-morbid diseases. Such data was accomplished with all the medications employees with a calculation of monthly or annual cost for the different therapeutic groups and a final total cost. The statistical study was made with Excel´s (Microsoft) and the Analysis Tool Pack. Results: The 53% of patients was in functional class I and 52% in radiological stage I or II (Steinbrocker) whereas 16 patients was considered in remission. Non-steroideal ant-inflammatory drugs (NSAID) were used in the 82.7% of patients with a monthly cost of 12.71 (1.10-80). Corticosteroids at low doses were used in 90.7% with a monthly cost of 5.17 (1.24-33.7). The Disease Modifying Anti-rheumatic Drugs (DMARD) was used in 94% of cases, the most common methotrexate and association of two or more in 21%. The mean monthly cost for a single DMARD was 3,63 and for two, 13.75 . Gastroprotection and therapy for co-morbid diseases was employee in 80% and 95% of cases, with a monthly cost of 36,9 and year cost of 568.6 , respectively. The study included 23 patients under treatment with anti-TNF therapy with a monthly mean cost of 933.8 . For pharmaceuticals exclusively for RA, annual cost was 342.8 excluding anti-TNF therapy, but with wide variation (6.4-2.910 ). If we include all patients with anti-TNF therapy, gastro-protection and co-morbid situations in a calculation, the mean cost was 2,587 year. The most important cost was found in patients with 50-70 years-old and existing a good correlation between the final burden and use of medications for co-morbid conditions, gastro-protection, use of anti-TNF, age, lengthy of disease between 5-10 years and number of swollen joints, but not radiological stage. Conclusions: The economic burden for pharmaceuticals used in RA is very variable depending of some variables, including the proper disease and other related conditions. The most important cost occur in case of use of anti-TNF therapy. In the most frequent conditions, gastro-protection and therapy for co-morbid diseases lead the 62% of total annual burden, followed by the use of DMARD and in a minor load, the NSAIDs and corticosteroids. KEY WORDS: Rheumatoid. Arthritis. Economic. Cost. Pharmacological. |
Mera Varela, Blanco Rodríguez J, Caamaño Freire M. Aproximación al coste del tratamiento farmacológico en la artritis reumatoide en España. An Med Interna (Madrid) 2003; 20: 114-121.
Trabajo aceptado: 29 de noviembre de 2002
Este trabajo ha sido realizado con el fondo de investigación, PGIDT00PXI90203AF, del Plan General de I+D
Correspondencia: Antonio J. Mera Varela . Servicio de Reumatología. Complejo Hospitalario Universitario de Santiago.
C/ Choupana, s/n. 15706- Santiago de Compostela (A Coruña). e-mail: mereuma@usc.es
INTRODUCCIÓN
El coste farmacológico de las enfermedades crónicas ha despertado un interés relevante por la repercusión social que conlleva. Las enfermedades reumáticas constituyen un importante problema social y el impacto socioeconómico de las mismas ya suponía en el año 1980, en Estados Unidos el equivalente al 1% del producto interior bruto y el 5% de los ingresos hospitalarios (1). En nuestro país, en un reciente estudio, se ha estimado que la incidencia de la AR en mayores de 20 años es de un 0,5% de la población (0,2-0,8%), existiendo un aumento de la prevalencia con la edad (2).
Como enfermedad crónica que es, su tratamiento está representado por el uso de diferentes fármacos por periodos de tiempo prolongados buscando como objetivo el disminuir la inflamación articular y aliviar el dolor, retrasar o evitar la destrucción estructural y sus secuelas, preservar la función articular y muscular, y garantizar en lo posible la calidad de vida (4). Según el conocimiento actual, los fármacos que se utilizan se pueden dividir en fármacos para el control de los síntomas, fundamentalmente antinflamatorios no esteroides, corticoides a dosis bajas, y modificadores del curso de la misma, también llamados inductores de remisión, fármacos de acción lenta (FARAL) o tratamiento de fondo, entre los que se encuentran las sales de oro, el metotrexato, los derivados de la cloroquina, ciclosporina, sulfasalazina y otros (3), solos o en combinación. Recientemente han sido introducidos en la práctica clínica nuevos fármacos antagonistas de citokinas que constituyen un nuevo paso en el intento de control y prevención del daño articular que se produce en esta enfermedad (4,5), ya que los estudios sobre pronóstico evolutivo de la AR (AR) indican que la esperanza de vida de los sujetos afectos de esta enfermedad disminuye respecto a la población general, siendo la estimación actual sobre la supervivencia después de 10 años de seguimiento de un 50% menos que los controles poblacionales sanos. En un estudio prospectivo a 25 años, las expectativas de vida eran de unos 3 años menos en las mujeres y unos 7 años menos en los varones (6-8).
La finalidad de este estudio es el aportar datos sobre la situación actual del gasto farmacéutico en AR en nuestro medio, con la particularidad de incluir en el cálculo del mismo la presencia de nuevos fármacos modificadores del curso de la enfermedad, y eventualmente, comparar el uso de dichos fármacos con otros parámetros cuantificables de tipo social y de actividad de la enfermedad.
MATERIAL Y MÉTODOS
Se ha realizado un estudio sobre 150 pacientes con AR que son atendidos en la consulta externa de un hospital de ámbito regional (Complejo Hospitalario Universitario de Santiago), seleccionados de forma correlativa en un periodo de tiempo desde marzo del 2001 hasta diciembre de 2001. Todos los pacientes presentaban AR según los criterios internacionalmente aceptados del American College of Rheumatology (9) y se trataba de consultas de revisión, con tratamiento estable, al menos, en los últimos tres meses. Los datos fueron tomados tanto de las historias clínicas como del interrogatorio al propio paciente sobre aspectos demográficos, de los tratamientos que recibía de forma estable para la AR y otras patologías concomitantes, así como datos de índole socioeconómica, y trasladados a un sistema informático comercial (MS Access 2000-Microsoft®) con el fin de poder obtener una fuente de resultados con los que poder realizar los cálculos estadísticos.
Del total de 150 pacientes, 125 son mujeres y 25 varones, con una edad media de 60,23 años (17-86; DS: ± 14,56). El 64,4% procedían del medio rural (ayuntamientos de menos de 10.000 habitantes) y el resto de ciudades de la comunidad de Galicia. En el momento de recogida de los datos, 100 pacientes se encontraban en situación de jubilación, 55 de ellos a causa de su AR y 6 por otras enfermedades concomitantes o previas y, de los que permanecían activos, 4 estaban en situación de baja laboral. El tiempo medio de duración de la enfermedad desde el diagnóstico era de 11,25 años (1-53 años; DS: ± 9,12).
Entre los datos que fueron registrados, además de los de tipo demográfico, también se recogieron otros sobre la situación actual de la enfermedad en cuanto a:
1. Actividad, medida por el número de articulaciones inflamadas, y la velocidad de sedimentación globular por el método de Westergren, para valores normales entre 5 y 10 mm/1ª hora para varones y 5 y 15 mm/1ª hora para mujeres.
2. La presencia o no de factor reumatoide (nefelometría) (10).
3. El estadio radiológico, como método de detección del daño articular, utilizando el método de Steinbrocker (11), que básicamente, divide la progresión radiológica en 4 grados dependiendo de la no existencia de lesiones (estadio 0), y hasta la anquilosis (estadio IV). Para ello fueron usadas radiografías estándar de manos y pies en posición antero-posterior.
4. El grado funcional según los criterios del ACR (12), que diferencia en 4 clases funcionales, entre la I, en la que el paciente es capaz de realizar todas las actividades laborales y recreativas cotidianas y de cuidado personal, y hasta la IV, con severa limitación para todas ellas.
Se registró también la presencia de manifestaciones extrarticulares de la enfermedad o secundarias a la misma y otras enfermedades causantes de comorbilidad y que fueron usadas para el cálculo económico final. Se consideró que el paciente estaba en remisión si cumplía los criterios expuestos por Pinals y cols. (13).
Finalmente se han recogido los datos de coste farmacéutico, con los siguientes apartados: antinflamatorio empleado, corticoide empleado, el uso de fármacos como protección gástrica y enfermedades concomitantes a la AR, y finalmente, los diferentes fármacos de uso prácticamente específico en el tratamiento de la AR, llamados inductores de remisión o fármacos antirreumáticos de acción lenta. Para el cálculo del coste se ha tenido en cuenta la dosis mensual como dato básico ya que muchos fármacos empleados no son de toma diaria. Además, y dado que algunos fármacos se toman sólo por algún tiempo, se calculó el gasto total por año. Entre el total de pacientes, se incluyeron 23 que estaban recibiendo tratamiento con anticuerpos monoclonales anti-TNF. La dosis de corticoides osciló entre 2 y 10 mg de prednisona o equivalente. Las dosis de los diferentes FARAL fueron: metotrexato 5-15 mg/semana; cloroquina 125-250 mg/día; aurotiomalato sódico 50 mg/semana-50 mg/mes; auranofin 6 mg/día; leflunomida 20 mg/día; D-penicilanmina 250-500 mg/día y azatioprina 2 mg/kg/día. Para el uso de anti-TNF las dosis fueron 3-6 mg/kg por infusión, según pauta recomendada en la ficha técnica.
El cálculo del coste de los fármacos fue hecho en pesetas y euros, considerando la equivalencia actual del cambio como 1 = 166,366 pesetas. Los precios de los fármacos fueron obtenidos de los datos incluidos en el Vademécum Internacional (Libro Rojo) del año 2001, con la tasa de Impuesto de Valor Añadido (IVA) incluido.
Los cálculos estadísticos fueron realizados utilizando la hoja de cálculo Excel 2000 (Microsoft®), mejorado con la adición de la herramienta para análisis de datos Excel´s Analysis Toolpak.
RESULTADOS
DATOS DEMOGRÁFICOS
Se trata de 150 pacientes, de los que 125 eran mujeres y 25 hombres, con una edad media de 60,23 años, con un rango entre los 17 y los 86 años y una desviación estándar (DS) de ± 14,56 años. Los pacientes fueron diagnosticados de AR entre 1 y 53 años antes (media: 11,25; DS: 9,12). En general, 52 personas procedían de medio urbano y el resto de áreas rurales, 26 de zonas costeras y el resto de zonas del interior. Respecto a su situación laboral, 64 pacientes estaban sin trabajar, 54 a causa de jubilación anticipada debido a su enfermedad articular, 6 por otras enfermedades previas o concomitantes a la enfermedad articular y 4, que permanecían activos, estaban en situación de baja laboral. Mantenían la cotización a la Seguridad Social 29 pacientes. Los no jubilados, o que no mantenían cotización, estaban englobados en la prestación asistencial como cónyuge o familiar.
DATOS DE LA ENFERMEDAD
Del total, 114 pacientes presentaban positividad para la presencia de Factor reumatoide en el suero en el momento del estudio, lo que supone un porcentaje del 76%. Respecto a su grado de capacidad funcional, en la clase funcional I estaban 80 pacientes, y, por tanto, sin dificultad para la realización de su actividad cotidiana laboral, recreativa o de cuidado personal; en la clase funcional II, 42 pacientes; en la clase III, 25 pacientes y en la clase IV, y, por tanto, con un alto grado de invalidez, con necesidad del cuidado de terceras personas para su propio aseo personal, 3 pacientes. Respecto a los parámetros de actividad, la velocidad de sedimentación globular (VSG) osciló entre 1 y 110 mm/1ª h, con un valor promedio de 30,6 (DS: 20,41). El número de articulaciones inflamadas en el momento de la exploración fue de 4,56 de promedio (0- 20; DS: ±3,32). El estadio radiológico siguiendo los criterios expuestos en el apartado de material y métodos, fue: 10 pacientes no presentaban cambio radiológico alguno, 43 pacientes estaban en estadio I, 36 pacientes en estadio II, 28 pacientes en estadio III y 33 pacientes en estadio IV, y, por consiguiente con severos cambios radiológicos en las radiografías de manos y pies. Supone, por tanto, un reparto casi igual para todos los grupos de afectación radiológica. Diecisiete pacientes cumplían los requisitos para considerar que estaban en remisión según los criterios ya mencionados de Pinals.
Como complicaciones o manifestaciones extrarticulares de la AR, se encontró que 21 (13,9%) pacientes presentaban síndrome seco asociado, 6 (3,9%) nódulos subcutáneos y otros 6 (3,9%), afectación intersticial pulmonar. Amiloidosis secundaria estaba presente en 2 casos y afectación ocular en forma de escleritis en otros 2. Además, 68 presentaban alguna otra patología no reumatológica asociada, lo que supone el 45,03% de la muestra, alguno de ellos varias, considerando patología asociada como la que requería tratamiento farmacológico, de forma habitual y controles periódicos por otros especialistas. La enfermedad asociada más frecuente fue la hipertensión arterial, presente en 18 pacientes, lo que supone el 11,9% de todas la AR, seguido de diabetes en 7 (4,6%). Otros tantos recibían tratamiento por osteoporosis. Hiperlipemia, insuficiencia cardiaca, hipotiroidismo corregido, depresión o síndrome fibromiálgico fueron otros diagnósticos. Habían precisado prótesis articular de cadera o de rodilla, o ambas, 8 pacientes.
USO DE FÁRMACOS Y GASTO FARMACÉUTICO
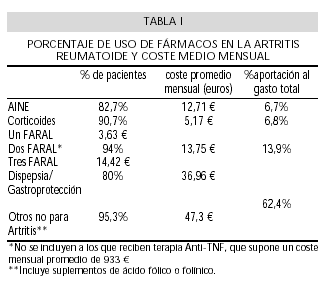
Estaban utilizando antinflamatorios no esteroideos (AINEs) 125 pacientes (82,78%). Los AINEs más usados fueron, por este orden, el naproxeno (47,2%), seguido de aceclofenaco/diclofenaco (10,4%), indometacina (8,8%) y los oxicam (5,6%). Los nuevos antinflamatorios con acción inhibidora específica sobre cicloxigenasa-2 eran empleados en el 7,2% de los casos. El precio medio mensual por AINE usado fue de 2.114,42 pesetas (12,71 ) (183-13.340 pesetas; DS: ± 2096,78) (1,10-80,18 ; DS ±12,60 ). Tomaban corticoides 137 pacientes, lo que supone el 90,73% de todos los pacientes del estudio. De ellos, 94 recibían tratamiento con metil-prednisolona, 16 prednisolona, 2 prednisona, y 25 deflazacort, esteroide de nueva generación con teóricos menos efectos secundarios. El precio medio mensual para el uso de esteroides fue de 860,04 pesetas (5,17 ) (207-5622 pesetas; DS: ± 863,48) (1,24-33,79 ; ± DS: 5,19 ). El uso de fármacos de acción lenta (FARAL), también llamados inductores de remisión o tratamiento de fondo, ha sido empleado en 142 pacientes, lo que constituye el 94,04% del total de la muestra, prácticamente su totalidad. De ellos, recibían tratamiento combinado con más de un fármaco 33 (21,85%) y 2 de ellos lo hacían con 3 fármacos, no incluyendo a aquellos que estaban bajo tratamiento con algún anti-TNF, en los que, como es sabido, se precisa combinar dicho tratamiento con metotrexato, y que, sumados a los anteriores darían una cifra final de 55 pacientes (36,42% del total) con tratamiento combinado.
El gasto medio mensual para el uso del primer FARAL, en aquellos pacientes que recibían este tratamiento, fue de 603,33 pesetas (89-16.288 pesetas; DS: ± 2125,89) equivalente a 3,63 (0,53-97,89 ; DS: ± 12,78). Para el uso de un segundo FARAL asociado, el gasto medio mensual fue de 2.287,93 pesetas (158-38.476 pesetas; DS: 1.053,67), equivalente a 13,75 . El gasto medio para un tercer FARAL asociado fue de 2.400 pesetas (14,42 ). El reparto por fármacos como primer inductor de remisión ha sido de un 76,6% de utilización de metotrexato, seguido de un 14,2% de utilización de cloroquina, un 2,8% para auranofin, un 1,4% para el uso de leflunomida y menos del 1% para D-penicilamina o azatioprina. Para un segundo FARAL asociado, el más frecuentemente usado fue la cloroquina, seguido de las Sales de oro inyectables. El 80% (120 pacientes) usaban algún fármaco para contrarrestar los síntomas de dispepsia o como gastroprotector por el uso de medicaciones potencialmente gastrolesivas. Se emplearon antiácidos simples en 17 casos (11,33%), anti-H2 en 32 casos (21,33%) y en 71 (47,33%), omeprazol/lansoprazol. El gasto que supone el emplear este tipo de fármacos para prevenir el daño gastroduodenal o la dispepsia supone una media mensual de 6.148,80 pesetas (1.012-10.266 pesetas; DS: ± 2.425,52) o lo que es lo mismo, 36,96 (6,08-61,70 ; DS: ± 14,58).
Encontramos que 143 pacientes recibían en el momento del estudio algún fármaco concomitante, lo que supone el 95,33% de todos ellos. Los más usados han sido compuestos de ácido fólico para prevenir efectos secundarios del tratamiento con metotrexato, seguidos de compuestos de calcio con vitamina D como preventivos de osteoporosis secundaria al uso de esteroides. Abundan también los fármacos antihipertensivos, los analgésicos, los hipolipemiantes y la toma de antidepresivos o tranquilizantes menores. El gasto medio por paciente y año de estas medicaciones no primariamente indicadas para la ar, incluyendo la gastroprotección, fue de 94.612,02 pesetas, (1.020-376.000 pesetas; DS ± 75.547,19) ó 568,63 (6,13-2.259,81 ; DS:± 454,05). Respecto a la carga que suponen los diferentes tratamientos, hemos encontrado que las medicaciones utilizadas tanto para la prevención del daño gastro-duodenal como para las enfermedades concomitantes suponen el 62,4% del total, seguido de los fármacos de acción lenta o tratamiento de fondo que contribuyen con el 13,9%. El uso de corticoides supone el 6,8% y el uso de antinflamatorios no esteroideos supone el 6,7%. Respecto al uso de medicaciones anti-TNF, hemos incluido a 23 pacientes que usaban dicha medicación, uno con Etanercept y el resto con Infliximab. El coste mensual de este tipo de medicación es variable dependiendo de la dosis, y ésta a su vez, del peso del paciente, sobre el que se calcula dicha dosis. El gasto promedio mensual fue de 155.372,78 pesetas (102.918-274.450; DS: ±39.950,35) ó 933,81 (618,55-1.649,48 ; DS ± 240,11) (Tabla I).
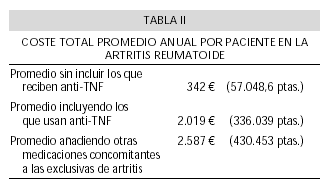
Hemos calculado cuánto era el coste al final del año para el uso de fármacos exclusivos para ar, incluyendo el uso de anti-TNF, resultando en un promedio de 336.039 pesetas (1.076-3.330.000 pesetas; DS: ± 686.901,47), 2019,64 (6,47-20.013,70 ; DS: ± 4.128,36). Prescindiendo del uso de estos fármacos, el coste medio anual fue de 57.048,61 pesetas, con amplias variaciones como era de esperar dado el diferente grado de expresividad clínica y actividad de la enfermedad (1.076-484.225 pesetas; DS: ± 65.024,49); (342,87 (6,47-2.910,25 ; DS: ± 390,81). El coste final al año para el empleo de todos los fármacos, en todos los pacientes, incluyendo anti-TNF, los exclusivos para la AR y los no exclusivos para ar, fue de 430.453,91 pesetas (4380-3.451.240 pesetas; DS: ± 684.699,62); 2.587,08 (26,32-20.742,37 ; DS: ± 4.115,13) (Tabla II).
En cuanto a las relaciones existentes entre el gasto y los diferentes parámetros de la enfermedad recogidos, los análisis de regresión han mostrado que el gasto total, tanto en fármacos de AR como de otras enfermedades concomitantes, está correlacionado globalmente con la edad y el número de articulaciones inflamadas, pero no con parámetros como el tiempo de evolución, o el estadio funcional o radiológico. Cuando se analiza el coste del empleo de otros fármacos no primariamente para ar, que incluyen la gastroprotección, los suplementos vitamínicos y los empleados en enfermedades concomitantes, existe una buena correlación con la edad actual, los años de evolución, el estadio funcional y radiológico, pero no con el número de articulaciones inflamadas. De esta manera, en todas las modalidades de gasto, la mayor correspondencia es con la edad actual del paciente.
Cuando se aplican test de correlación, existe una buena correlación entre el gasto total anual por paciente y el gasto dedicado a otros fármacos para enfermedades concomitantes y los empleados para evitar complicaciones del propio tratamiento de la AR como el Ácido Fólico o la gastroprotección. El mayor coste farmacéutico se obtiene en aquellos sujetos con edad comprendida entre los 50 y los 70 años.
Cuando se calcularon los costes totales, incluidos los de AR y otros fármacos no para AR, los resultados muestran que es el grupo de 5-10 años de evolución el que muestran genera más gasto. También, agrupando los pacientes por las variaciones en la VSG, y considerando que la VSG de 1-20 mm/1ª hora se corresponden con pacientes con baja o nula actividad teórica, encontramos que en este grupo, el gasto medio por AR al final del año fue de 278.842 pesetas (1.675,8 ). Para el grupo con VSG comprendida entre 21-50 mm/1ª hora, que podríamos considerar con actividad moderada, el gasto medio fue de 284.730 pesetas (1.711,2 ), y finalmente, en el grupo de VSG de más de 51 mm/1ª hora, el gasto casi duplicó al resto de los grupos. Así fue de 543.059 pesetas (3.263,8 ). Respecto al número de articulaciones inflamadas, el gasto medio cuando se tienen 5 ó menos articulaciones inflamadas fue de 234.643 pesetas (1.464,3 ), mientras que cuando se tienen más de 5, fue casi el doble (496.868 pesetas; 2.986,2 ). Dado que hemos encontrado una correlación positiva entre el número de articulaciones inflamadas y la elevación de la VSG, ambos factores pueden considerarse que predicen un mayor gasto en fármacos para la AR.
En relación al estadio radiológico, ambos costes, el exclusivo por AR y el gasto total anual, se incrementan de forma proporcional al daño radiológico hasta las fases II y III pero no así con otras fases del daño, de manera que en estados de destrucción radiológica avanzada el gasto es inferior, alcanzándose el máximo en el estadío III (Fig. 1). El coste farmacológico total al final del año se correlaciona bien con el gasto por AR y de una forma fuertemente positiva para el uso de anti-TNF como era de esperar.
DISCUSIÓN
La AR es uno de los mayores problemas de salud pública en términos de su prevalencia y de la invalidez que va asociada en algunos casos, afectando a la calidad de vida. Los costes vinculados al tratamiento de este proceso se pueden dividir en tratamiento farmacológico, hospitalización, rehabilitación, pérdida del trabajo habitual, compensación por jubilación anticipada y, finalmente, necesidad de servicios sociales de ayuda. Todo ello conforma una carga social económica de gran envergadura (14). En el cálculo de costes han sido varios los métodos propuestos dependiendo de la fuente de obtención de los datos, desde aquellos obtenidos de forma indirecta a través de compañías de seguros hasta los que utilizan métodos directos como la entrevista con el paciente, realización de cuestionarios telefónicos o por correo y recogida de datos en historias clínicas. A partir de aquí, y para una mayor aproximación al coste real, se ha propuesto el calcular el coste diario, extrapolando el resto de los datos, o bien costes a periodos de tiempo fijos (15). En el presente estudio nos hemos decantado por la recogida de datos en entrevista personal, que ofreciera unos datos reales y actuales, así como por realizar el cálculo basado en el coste mensual, dado que existen determinados fármacos para el tratamiento de la AR que son de toma semanal, mensual o bimensual y, para más seguridad, en algunos de ellos se ha calculado el coste anual.
El gasto en farmacia se considera un gasto directo junto con aquellos derivados de la realización de consultas, realización de pruebas complementarias de laboratorio o radiográficas y la hospitalización, constituyendo según diferentes estudios, en la AR, alrededor del 25-50% del coste total (directo e indirecto) y que representó, para el año 1996 en Estados Unidos, 5.720 $ por paciente y año (en pesetas actuales, 1.029.600; en euros 6.088) (16). En estudios anglosajones, el gasto farmacéutico varía entre un 13% y un 24% del total de los costes directos (17,18). Newhall-Perry calcula que la medicación costaba 62 ± 101 $ al mes, por paciente, en 1994 (19) y representaba el 26% del coste directo. En nuestro estudio, el gasto total en fármacos por paciente y año fue de 430.453 pesetas del año 2000 (2.587 ), algo inferior al reportado en otros estudios anglosajones, quizás debido al coste económico algo más bajo de algunas presentaciones farmacéuticas que son comunes en su prescripción en la AR, en nuestro país. No obstante, algunos trabajos utilizan metodologías diferentes y se ha calculado el coste de por vida de la AR en unos 93.296 $ (año 1998) por paciente, en base a tratamientos mantenidos, al menos 6 meses, lo que equivaldría a a unos 16,7 millones de pesetas (101.000 ) (20).
En el tratamiento con fármacos de acción lenta, los hábitos de prescripción son similares en todos los países, y tampoco hemos encontrado diferencias respecto a lo que se hace en otros lugares de nuestro país, según se recoge en el estudio emAR (21). En este sentido, comparando nuestros datos con otros estudios extranjeros estaríamos algo por debajo en el coste de los tratamientos de fondo empleados, tanto por el tipo de fármaco como por su dosificación (22), ya que las dosis empleadas de metotrexato son, a veces, superiores a las reflejadas en nuestro cálculo y éste es sensiblemente mas caro en Estados Unidos, aunque es algo menor el coste del uso de Etanercept y de Infliximab en nuestro medio, suponiendo dosis estándar en ambos casos (23-25). La combinación de 2 o más fármacos de acción lenta ocurrió en casi un tercio de nuestros pacientes, con el incremento en el coste correspondiente, que llega a ser prácticamente el doble respecto al uso de uno solo. La tendencia a usar asociación de FARAL es cada vez más frecuente, en un intento por un mejor control de la enfermedad, existiendo algunos estudios sobre coste-eficacia de esta modalidad que demuestran las ventajas de la misma, aunque a veces con mayores porcentajes de abandono de la medicación debido a los efectos secundarios (26,27).
Un capítulo importante en el gasto de pacientes con AR lo supone el uso de medicaciones concomitantes, no dirigidas primariamente contra la AR y que se pueden englobar en dos grupos: aquellas que previenen efectos secundarios de los fármacos empleados como el ácido fólico y la gastroprotección, y aquellos que son tomados como tratamiento de enfermedades concomitantes (comorbilidad). Aproximadamente el 1,5% de todos los pacientes con AR son hospitalizados cada año debido a los efectos secundarios gastrointestinales graves de los AINEs, y la prevalencia de úlceras gastrointestinales por el uso de AINEs está entre el 9 y el 22% del total de pacientes, aumentando a un 38% por encima de los 60 años (28,29). En nuestro estudio, un 80% de los pacientes usaban algún fármaco gastroprotector, de los que en el 50% prácticamente, lo era el omeprazol y derivados, contribuyendo de forma significativa al coste total del tratamiento, de lo que se deduce la necesidad de ser estrictos en la indicación del uso concomitante de estos compuestos, que, aunque con algunos descensos en el precio en los últimos meses debido a la aparición de genéricos en el mercado, siguen suponiendo costes superiores al uso de algunos AINEs, de los esteroides y de la monoterapia con Metotrexato. Recientemente la introducción de nuevos antinflamatorios del tipo de inhibidores específicos de la COX-2 (30,31) puede ir modificando las pautas de conducta en el tratamiento de las AR con estos fármacos, aunque en nuestro estudio predominó la gastroprotección sobre la prescripción de COX-2 específicos, ya que sólo un 10% tomaban dichos fármacos. Otros fármacos para prevención de patología secundaria, como la osteoporosis, suponen también un desembolso considerable para aquellos pacientes en los que se indican, con dos tipos de fármacos que acaparan prácticamente todas las prescripciones como son la calcitonina y los difosfonatos, suponiendo la primera, a las dosis recomendadas, un coste de aproximadamente el doble que el Alendronato (32,33).
La patología asociada, un 45% en el presente estudio, supone una contribución a tener en cuenta en el coste final. Algunas publicaciones hacen hincapié en este apartado que en muchas ocasiones supera en gasto al de la propia AR (34,35). En nuestro estudio, la hipertensión arterial constituyó la causa más común de comorbilidad, al igual que ocurre en la población general, pero también la presencia de diabetes, el trastorno tiroideo o la depresión y fibromialgia asociadas estuvieron presentes, apareciendo en varios pacientes más de un trastorno asociado. En este apartado, la aparición de mortalidad cardiovascular como causa frecuente de muerte en AR hace que sean cada vez más los estudios que hacen hincapié en la prevención del riesgo cardiovascular (36,37). Cuando se suma el gasto producido por estos procesos concomitantes con la introducción de la gastroprotección, el coste de ambos supone una media de 94.612 ptas. (568,6 ) al año.
Hemos tratado de relacionar el coste farmacológico con distintas categorías de pacientes, tanto desde el punto de vista de la enfermedad como de variables sociales. Así, hemos encontrado que la edad de los pacientes tiene una correlación positiva, aunque baja, respecto al coste del tratamiento, probablemente porque con el envejecimiento aparecen más enfermedades concomitantes o manifestaciones extrarticulares del proceso que requieren una mayor utilización de fármacos. Respecto a la antigüedad de la enfermedad, el gasto en fármacos se va incrementando hasta alcanzar un máximo en el grupo de pacientes que tiene entre 5 y 10 años de evolución, para luego disminuir, hasta alcanzar ya cifras menores a partir de los 15 años de evolución, quizás traduciendo la sensación que tiene el médico de que en estos casos no vale la pena ser muy agresivos en el tratamiento ya que la respuesta esperada será más pobre que en otras fases de la enfermedad.
Al igual que en otros estudios, los marcadores que predicen una enfermedad más activa y agresiva, como son la velocidad de sedimentación globular y el número de articulaciones inflamadas, se correlacionan, más en el caso del recuento articular, con una elevación mayor del coste anual como se ha referido en otros estudios de la literatura (38,39), lo que lleva a apoyar el concepto actual de que el tratamiento precoz e intenso de las AR supone, no sólo un mejor control de la enfermedad, sino también un desembolso económico futuro menor en gastos indirectos (40,41).
Se han incluido en el presente trabajo los primeros pacientes que seguían tratamiento con la nueva terapia con Anti-TNF o terapia biológica con dos motivos, calcular la influencia sobre el coste total del grupo de pacientes con AR y calcular las diferencias en el gasto de dichos pacientes. Su uso no es generalizado y se han creado unos criterios para su utilización racional por parte de las sociedades científicas, que hacen que sean empleados sólo en aquellos pacientes que cumplen dichos principios (42). También han sido publicado estudios al respecto sobre coste y eficacia que avalan el uso de dichos fármacos (43), constituyendo un arma terapéutica de relevancia en aquellos casos de enfermedad reumatoide que presentan signos de especial agresividad. El coste estimado en Estados Unidos para un año de tratamiento fue aproximadamente de 2.500.000-5.400.000 pesetas (1$: 180 pesetas) (44), mientras que en nuestro estudio resultó algo más barato, con precio anual aproximado entre 1.300.000 y 3.300.000 pesetas, teniendo en cuenta que en el caso de infliximab debe añadirse al tratamiento metotrexato semanal (45). En el cálculo se han incluido dosis reales, es decir, con las variaciones propias del peso de los pacientes, en base a lo cual se calcula la cantidad total a recibir. El uso de estos fármacos provoca que el gasto anual en AR se multiplique por 4,5, según nuestros datos.
Cuando comparamos el coste respecto al estado laboral se mostró que los pacientes que no aportaban el 40% a la dispensación farmacéutica, su gasto medio era algo inferior (288.183 pesetas de media) respecto a los que si aportaban (396.091 pesetas de media). Según diferentes estudios, a los 10 años de enfermedad, un 50% de pacientes tienen problemas para seguir trabajando en Estados Unidos (46), y en otro estudio, un 30% de los pacientes estaban jubilados de su trabajo a los 5 años, en especial trabajadores manuales (47), siendo factores predictivos de jubilación anticipada por la enfermedad, la edad, el nivel educativo, la duración de la enfermedad y el descenso de la capacidad funcional medida por aplicación de test específicos (48-50). Aunque los fármacos anti-TNF son de dispensación hospitalaria y no se aplica ninguna aportación por parte del paciente, hay que decir que 10 de los 23 pacientes que usaban dichos fármacos continuaban cotizando al sistema de Seguridad Social.
En el territorio estudiado, el tratamiento farmacológico de la AR en pacientes no hospitalizados, supone un montante de 2.880.000 (480.463.393 pesetas), equivalente al 0,008% del Producto Interior Bruto de Galicia del año 2000, o al 0,57% del gasto farmacéutico del Servicio Gallego de Salud para la población de Galicia también respecto al mismo año (51,52), aunque la progresiva implantación del uso de los fármacos denominados genéricamente como terapia biológica incrementará considerablemente este coste.
Bibliografía
1. Tornero Molina J, Vidal Fuentes J: Impacto social y económico de las enfermedades reumáticas. La discapacidad laboral. Rev Esp Reumatol 1999; 26: 357-66. [ Links ]
2. Estudio EPISER: Prevalencia e impacto de las enfermedades reumáticas en la población adulta española. Ed. MSD y Sociedad Española de Reumatología. Madrid, 2001. [ Links ]
3. Edmonds JP, Scott DL, Furst DE, Brooks DP, Paulus HE: Antirheumatic drugs: a proposed new classification. Arthritis Rheum 1993; 20: 546-7. [ Links ]
4. Spencer-Green G: Etanercept (Enbrel): update on therapeutic use. Ann Rheum Dis 2000; 59 (Supl. 1): 46-9. [ Links ]
5. Furst DE, Breedveld FC, Burmester GR, Crofford JJ, Emery P, Feldmann M, et al: Updated consensus statement on tumour necrosis factor blocking agentes for the treatment of rhematoid artritis. Ann Rheum Dis 2000; 59 (Supl. 1): 1-2. [ Links ]
6. van Zeben D, Breedveld FC: Pronostic factors in rheumatoid artritis. J Rheumatol 1996; 43 (Supl. 44): 31-3. [ Links ]
7. Mutru O, Laakso M, Koota K. Ten years mortality and causes of death in patients with rheumatoid artritis. BMJ 1985; 290: 1797-9. [ Links ]
8. Vanderbroucke JP, Hazevoer HM, Cats A: Survival and cause of death in rheumatoid artritis: a 25 years prospective follow-up. J Rheum 1984; 11: 448-53. [ Links ]
9. Arnett FC, Edworthy SM, Bloch DA et al: The American Rheumatism Association 1987 revised criteria for the classification of rheumatoid arthritis. Arthritis Rheum 1988; 31: 315-24. [ Links ]
10. Peter JB, Reyes HR: Use and interpretation of test in Rheumatology. Ed. Specialty Laboratories, 1996. p. 114-6. [ Links ]
11. Steinbrocker O, Traeger GH, Batterman RC: Therapeutic criteria in Rheumatoid Artritis. JAMA 1949; 140: 659-62. [ Links ]
12. Hochberg M, Chang RW, Dwosh I, et al: The American College of Rheumatology 1991 revised criteria for the classification of global functional status in rheumatoid arthritis. Arthritis Rheum 1992; 35: 498-502. [ Links ]
13. Pinals RS, Masi AT, Larsen RA, et al: Preliminary criteria for clinical remission in rheumatoid arthritis. Arthritis Rheum 1981; 24: 1308-15. [ Links ]
14. Heluwa A, Bombardier C, Goldsmith CH, Mendions B, Smythe HA. Costs-effectiveness of impatient and intensive outpatient treatment of rheumatoid arthritis. Arthritis Rheum 1989; 32: 1505-14. [ Links ]
15. Goossens ME, Rutten-van-Molken PMH, Vlaeyen JWS, van der Linden SMJ. The cost diary: a method to measure direct and indirect costs in cost-effectiviness research. J Clin Epidemiol 2000; 53: 688-95. [ Links ]
16. Cooper NJ: Economic burden of rheumatoid arthritis: a systematic review. Rheumatology 2000; 39: 28-33. [ Links ]
17. Yelin E: The costs of rheumatoid arthritis: absolute, incremental, and marginal estimates. J Rheumatol 1996; 23: 47-51. [ Links ]
18. Singh G, Ramey D, Terry R. Direct costs in medical care in rheumatoid arthritis: patterns and role of Rheumatology care. Arthritis Rheum 1997; 39 (Supl.) 9: 837A. [ Links ]
19. Newhall-Perry K, Law NJ, Ramos B, Sterz M, Wong WK, Bulpitt KJ: Direct and indirect costs associated with the onset of seropositive rheumatoid arthritis. J Rheumatol 2000; 27: 1156-63. [ Links ]
20. Wong JB, Ramey DR, Singh G: Long term morbidity, mortality and economics of Rheumatoid Arthritis. Arthritis Rheum 2001; 44: 2746-49. [ Links ]
21. Hernández García, C, González Alvaro I, Villaverde García V, Vargas Castrillón E: Estudio sobre el manejo de la artritis reumatoide. Editorial SER, 2001. [ Links ]
22. Cooper NJ, Mugford M, Scott DGI, Barret EM, Symmons DPM: Secondary health service care and second line drug costs of early inflammatory polyarthritis in Norfolk, UK. J Rheumatol 2000; 27: 2115-22. [ Links ]
23. Gabriel SE, Coyle D, Moreland LW: A clinical and economic review of disease-modifyng antirheumatic drugs. Pharmacoeconomics 2001; 19: 715-28. [ Links ]
24. Nuijten MJ, Engelfriet P, Duijin K, Bruijn G, Wierz D, Koopmanschap M. A cost-cost study comparing etanercept with infliximab in rheumatoid arthritis. Pharmacoeconomics 2001; 19: 1051-64. [ Links ]
25. Choi HK, Seeger JD, Kuntz KM: A cost-effectiviness analysis of treatment options for patients with methotrexate-resistant rheumatoid arthritis. Arthritis Rhem 2000; 43: 2316-27. [ Links ]
26. Tugwell P: Combination therapy in rheumatoid artritis: Metaanalysis. J Rheumatol 1996; 23 (Supl. 44): 43-6. [ Links ]
27. Verhoeven AC, Bibo JC, Boers M, Engel GL, van der Linden S, et al: Cost-effectiviness and cost-utility of combination therapy in early rheumatoid arthritis:randomised comparison of combined step-down prednisolona, methotrexate and sulphasalazine with sulphasalazine alone (COBRA TRIAL GROUP). Br J Rheumatol 1998; 37: 1102-09. [ Links ]
28. Raskin JB: Gastrointestinal effects of nonsteroidal anti-inflammatory therapy. Am J Med 1999; 106 (5B): 3S-12S. [ Links ]
29. Maetzel A, Bosi Feraz M, Bombardier C. The cost-effectiviness of misoprostol in preventing serious gastrointestinal events associated with the use of nonsteroidal antinflammatory drugs. Arthritis Rheum 1998; 41: 16-25. [ Links ]
30. Yeomans N, Wilson I, Langstrom G, Hawkey C, Naesdal J, Walan A, Wiklund I: Quality of life in chronic NSAID users: a comparison of the effect of omeprazole and misoprostol. Scand J Rheumatol 2001; 30: 328-34. [ Links ]
31. Raskin JB: Gastrointestinal effects of non-steroidal anti-inflammatory therapy. Am J Med 1999; 106: 3S-12S. [ Links ]
32. Rehman Q, Lane NE: Bone losss. Therapeutic approaches for preventing bone loss in inflammatory arthritis. Arthritis Res 2001; 3: 221-7. [ Links ]
33. Miller PD: Biphosphonates for the prevention and treatment of corticosteroid-induced osteoporosis. Osteoporos Int 2001; 12 (Supl. 3): S3-S10. [ Links ]
34. Dickens C, Creed F: The burden of depression in patients with rheumatoid arthritis. Rheumatology 2001; 40: 1327-30. [ Links ]
35. Pardell H, Tresserras R, Armario P, Hernández del Rey R: Pharmacoeconomic considerations in the menagement of hypertension. Drugs 2000; (Supl. 2): 13-20. [ Links ]
36. Kvalvik AG, Jones MA, Symmons DPM: Mortality in a cohort of Norwegian patients with rheumatoid arthritis followed from 1977 to 1992. scand J Rheumatol 2000; 29: 29-37. [ Links ]
37. Wilson PWF, D´Agostino RB, Levy D, Belanger AM, Silvershatz H, Kannel WB: Prediction of coronary heart disease using risk factor categories. Circulation 1998. p. 1837-1847. [ Links ]
38. Albers JM, Kuper HH, van Riel PL, Prevoo ML, van t´Hof MA, van Gestel AM, et al: Socio-economic consequences of rheumatoid artritis in the first years of the disease. Rheumatology 1999; 38: 423-30. [ Links ]
39. van Jaarsveld CHM, Jacobs JWG, Schrijvers JP, et al: Direct costs of rheumatoid arthritis during the first six years: a cost-of-illness study. Br J Rheumatol 1998; 37: 837-47. [ Links ]
40. Anderson JJ, Wells G, Verhooven AC, Felson DT: Factors predicting response to treatment in rheumatoid arthritis: the importance of disease duration. Arthritis rheum 2000; 43: 22-9. [ Links ]
41. ERAS Study Group: Socioeconomic deprivation and rheumatoid disease: what lessons for the health service? ERAS Study Group.Early Rheumatoid Arthritis Study. Ann Rheum Dis 2000; 59: 794-9. [ Links ]
42. Álvaro-Gracia JM, andreu sánchez JL, Batlle Gualda E y miembros del comité de Expertos de la SER: Consenso de la Sociedad de Reumatología sobre la terapia con inhibidores de TNF y otros fármacos inductores de remisión en la artristis reumatoide. Rev Esp Reumatol 2000; 27: 352-54. [ Links ]
43. Bombardier C, Maetzel A: Pharmacoeconomic evaluation of new treatments: efficacy versus effectiviness studies?. Ann Rheum Dis 1999; 58 (Supl. 1): 182-85. [ Links ]
44. American College of Rheumatology Subcommittee on Rheumatoid Arthritis Guideliness: Guideliness for the menagement of rheumatoid arthritis: 2002 update. Arthritis Rheum 2002; 46: 328-46. [ Links ]
45. Misischia RJ, Moreland LW: Use of biological agents in the treatment of Rheumatoid arthritis. JCOM 2001; 8: 54-60. [ Links ]
46. Mitchell JM, Burkhauser RV, Pincus T. The importance of age, education and comorbidity in the substantial earnings losses of individuals with symmetric polyarthritis. Arthritis Rheum 1988; 31: 348-57. [ Links ]
47. Young A, Dixey J, Kulinskaya E, Cox N, Davies P, Devlin J, et al: Which patients stop working because of rheumatoid arthritis?. Results of five years follow up in 732 patients from de early RA study (ERAS). Ann Rheum Dis 2002; 61: 335-40. [ Links ]
48. Sokka T, Pincus T: Markers for work disability in rheumatoid arthritis. J Rheumatol 2001; 28: 1718-22. [ Links ]
49. Holte HH, Tambs K, Bjerkedal T. Becoming a disability pensioner with rheumatoid arthritis in Norway 1871-1990. J Rheumatol 2001; 28: 54-61. [ Links ]
50. De Roos AJ, Callahan LF: Differences by sex in correlates of work status in rheumatoid arthritis patients. Arthritis Care Res 1999; 12: 381-91. [ Links ]
51. Gasto real por Capítulos. Distribución por programas 2000. http://www.sergas.es/gal/organización/datosinterés 13-1.htm. [ Links ]
52. Producto Interior Bruto regional de España frente a las medias europeas. http://www.comadrid.es/iestadis/npib9598.htm. [ Links ]