Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Avances en Odontoestomatología
versión On-line ISSN 2340-3152versión impresa ISSN 0213-1285
Av Odontoestomatol vol.23 no.4 Madrid jul./ago. 2007
Granuloma periférico de células gigantes: análisis inmunohistoquímico de la población celular en tres casos clínicos
Falaschini S*, Ciavarella D*, Mazzanti R**, Di Cosola M***, Turco M***, Escudero N, Bascones A****, Lo Muzio L*
* Departamento de Ciencia Quirúrgica, "Universitá di Foggia", Foggia, Italia.
** U.O. Odontoestomatología y Cirugía Oral Z.T. 6 y 7 ASUR MARCHE, Italia. Departamento de Ciencia Dental, "Universitá di Bari", Bari, Italia.
*** Departamento de Medicina y Cirugía Bucofacial, "Universidad Complutense de Madrid", Madrid, España.
**** U.O. Odontostomatologia e Chirurgia Orale Z.T 6 e 7 ASUR MARCHE, Italy.
Dirección para correspondencia
RESUMEN
El granuloma periférico de células gigantes (GPCG) es una lesión de tejido blando no neoplásica ocasionada por una reacción hiperplásica a consecuencia de un traumatismo o inflamación. Es una lesión reactiva del tejido blando que se desarrolla exclusivamente en la cavidad oral y con una ligera predilección en el sexo femenino. La localización habitual de GPCG es en la región de los premolares y la mucosa de la cresta alveolar edéntula.
Se presentan tres casos con GPCG (dos hombres y una mujer) con una edad comprendida entre los 25 y 35 años. Todos los pacientes se trataron con resección quirúrgica y ninguno sufrió recidivas. Con el propósito de determinar el posible origen de las células estromales mononucleares y de las células gigantes multinucleares, las muestras de cada caso se estudiaron mediante inmunohistoquímica (marcadores CD-68, CD-34 y α-1 antitripsina) con el fin de evaluar la expresión del linaje endotelial y del linaje monocito/macrófago.
Los resultados inmunohistoquímicos mostraron una marcada positividad difusa de CD-68 en las células estromales mononucleares y en las células gigantes multinucleadas. Estas últimas resultaron ser inmunonegativas para CD-34 y sólo puntualmente positivas para α-1 antitripsina. Estos resultados sugieren que las células gigantes multinucleares poseen un fenotipo osteoclástico, proviniendo del linaje monocito/macrófago, y que no derivan del linaje de las células endoteliales de los capilares.
Se establece la importancia de un exhaustivo diagnóstico y de una exéresis quirúrgica completa de la lesión (curetaje óseo) con el propósito de evitar la reabsorción del diente y hueso adyacente.
Palabras clave: Granuloma periférico de células gigantes (GPCG), inmunohistoquímica.
Introducción
El GPCG es una lesión exofítica infrecuente de la cavidad oral que surge como reacción a determinados estímulos. Es conocida también como épulis de células gigantes, osteoclastoma, granuloma de las células de reparación o hiperplasia de células gigantes.
Es la lesión de células gigantes más frecuente de los maxilares y se origina en el tejido conectivo del periostio o en el ligamento periodontal como respuesta a una irritación local o a traumatismo crónico (1).
Es más frecuente en mujeres que en hombres, con una prevalencia ligeramente mayor en el grupo de edad comprendida entre los 30 y 70 años, afectando más frecuentemente la mandíbula (55%) que al maxilar (la proporción referida es de 2, 4:1) (2).
Se han referido casos de GPCG en niños, donde las lesiones parecen ser más agresivas, con reabsorción de la cresta alveolar interproximal, desplazamiento de los dientes adyacentes y múltiples recidivas (3).
Clínicamente se manifiesta como una masa con consistencia variable entre blanda y firme, de aspecto similar a un nódulo brillante o a una masa sésil o pediculada, que es prevalentemente rojo azulada y con una superficie lisa brillante o lobulillada. Está localizada en el tejido gingival de la región canina e incisiva (1) o, de acuerdo con Pinborg, en su localización más frecuente, que es la zona de los premolares y molares (4). La dimensión de la lesión abarca desde una pequeña pápula hasta masas alargadas, aunque raramente se han descrito lesiones que excedan los 2 cm de diámetro y están localizados normalmente en la papila interdental, en el margen de la cresta alveolar de los edéntulos o a nivel del margen gingival (5). Es prácticamente asintomático, de hecho, el dolor no es una característica común y la lesión crece en la mayoría de los casos en respuesta a estímulos traumáticos repetidos, como oclusión traumática, en cuyo caso puede ulcerarse e infectarse (6, 7).
Aunque la patogénesis del GPCG de la cavidad oral es todavía incierta, irritantes locales como el cálculo, la placa bacteriana, cirugía periodontal, prótesis mal ajustadas, restauraciones desbordantes y extracciones dentales se han sugerido como factores etiológicos (8-10). Son lesiones de tejido blando que raramente afectan al hueso subyacente, aunque este último puede sufrir reabsorciones (5, 11). El tratamiento incluye la resección quirúrgica, con amplio legrado de la base de la lesión con la finalidad de evitar recidivas (12). El presente estudio describe tres casos de granuloma periférico de células gigantes localizados en diferentes áreas. Se ha analizado mediante inmunohistoquímica la presencia y localización de varios marcadores como son el CD-68, CD-34 y α1- antitripsina, con el propósito de evaluar el origen de las células estromales mononucleares y de las células gigantes multinucleares. Finalmente, hemos subrayado la importancia en la primera visita, del diagnóstico radiográfico e histológico para prevenir el posible daño de los dientes y del hueso adyacente.
Casos clínicos
Se realizó una valoración clínica, y un análisis histológico e inmunohistoquímico en 3 casos diferentes con GPCG, con la finalidad de determinar diversos marcadores de la población celular endotelial y estromal.
Valoración clínica
Caso 1
Mujer Boliviana de 27 años sin antecedentes personales de interés o alergias a medicamentos conocidas. Remitida para la resección y estudio histológico de un épulis gingival. La lesión estaba localizada entre el segundo y tercer molar, con una dimensión de 1,8×1,5 cm, de color púrpura y sangrante a la palpación (Fig. 1a). Las radiografías periapicales mostraban una pérdida de hueso entre 1,7 y 1,8 mm con posible afectación del ligamento periodontal (Fig. 1b).
El tratamiento consistió en la resección de la lesión bajo anestesia local, seguida de la extracción de 17 y 18. El estudio histológico confirmó el diagnóstico del granuloma periférico de células gigantes, descrito como un épulis fibroso ulcerado con infiltrado inflamatorio crónico linfoplasmocitario. El examen de control a los seis días mostraba la completa "restitutio ad integrum" del tejido. Seis meses después de la resección no había ningún signo de recidiva.
Caso 2
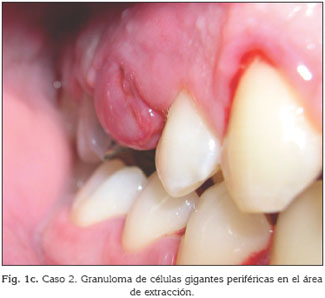
Hombre italiano de 25 años remetido para la extracción del 15 que presentaba una destrucción evidente y difícil restauración. El examen intraoral revelaba la presencia de una higiene oral deficiente, con abundantes cantidades de placa en la superficie de los dientes, ausencia de 27, 34 y 46. La extracción del 15 se realizó mediante la infiltración local de anestésico. No hubo complicaciones en el postoperatorio inmediato, pero después de una semana, cuando el paciente acudió al odontólogo para retirar la sutura, mostraba una lesión exofítica en la región tratada. Esta lesión se presentaba pediculada en su base, de consistencia blanda, de color púrpura y con dimensiones de 1,5×2 cm de tamaño (Fig. 1c). Se realizó la resección quirúrgica y los estudios histológicos mostraron la presencia del granuloma periférico de células gigantes.
Caso 3
Hombre italiano de 35 años con antecedentes de infarto de miocardio, remitido por una lesión exofítica localizada entre 42 y 43. La exploración clínica revelaba una lesión blanda, con base grande, de color púrpura y de dimensiones 1,5×2 cm (Fig. 1d). El paciente refería solamente una ligera incomodidad durante la masticación y sangrado al cepillarse. El diente 43 era vital, no había dolor a la percusión ni movilidad a la palpación. Su higiene oral era muy deficiente. El estudio radiográfico no mostró signos de destrucción ósea ni de reabsorción radicular del 43. La lesión se trató quirúrgicamente, utilizando la infiltración local de anestésico. Tras la resección se realizó raspado de la superficie radicular. El diagnóstico histológico fue de granuloma periférico de células gigantes.
Análisis histológico e inmunohistoquímico
En los 3 casos se seleccionó un área representativa de la lesión, se fijó en formalina y se incluyó en un bloque de parafina. Se efectuaron diversas secciones de 4 micras de espesor. Una de estas secciones se tiñó con hematoxilina y eosina para estudio histológico, y el resto de los cortes se estudiaron inmunohistoquímicamente con el método avidina-biotina-peroxidasa, utilizando los siguientes anticuerpos primarios monoclonales: anti CD-68 (PG-M1, DAKO, Carpinteria, CA, USA) a una concentración de 1:200, anti CD-34 (QBEND-10, DAKO, Carpinteria, CA, USA) a una concentración de 1:500, y α-1 antitripsina (N1533, DAKO, Carpinteria, CA, USA) a una concentración de 1: 1000. Inmunohistoquímicamente, los macrófagos y las células gigantes comparten marcadores inflamatorios antigénicos similares, al igual que aquellos que estudiamos nosotros (13-15).
La inmunohistoquímica se lleva a cabo en secciones amontonadas en láminas de cristal revestidas de poli-l-lisina. Secciones rehidratadas y cubiertas de parafina se incuban durante 30 minutos en H2O2/metanol al 3% para apagar la actividad de la peroxidasa endógena y después aclararse durante 20 minutos con fosfatasa salina protegida (PBS) (Bio-Óptica M107, Milán, Italia). La proteína no específica vinculante es atenuada con la incubación durante 30 minutos con suero de caballo al 5% en PBS. Los especímenes están incubados durante toda la noche con el ratón monoclonal antihumano CD34, CD68 y con α-1 proteína antitripsina. El anticuerpo es aplicado directamente sobre la sección y la lámina se incuba por la noche (48C) en una cámara de humedad. Las secciones se lavan en tres tiempos con PBS a temperatura ambiente. Los inmunocomplejos están secuencialmente tratados con el anticuerpo biotinilado secundario y después detectados con peróxido de estreptavidina, los dos incubados durante 30 minutos a temperatura ambiente (Kit de Vectastain ABC , Laboratorios Vector, Burlingame, Calif). Después del enjuague con tres transformaciones de la inmunorreactividad de la PBS se visualiza con el desarrollo durante 2 minutos con 3,3V-diaminobenzidina al 0,1% y peróxido de hidrógeno al 0,02% (Kit de sustrato de DAB, Laboratorios Vector). Las secciones son contrastadas con amoxicilina de Mayer, montadas en un portaobjetos medio permanente, y examinadas por microscopio de luz,
En cada muestra se analizaron al azar las diferentes características histológicas e inmunohistoquímicas de 25 campos aleatorios utilizando un microscopio convencional con alta potencia de magnificación (magnificación 400×) (la patología interpreta un análisis semicuantitativo de la muestra, sin usar un software de la imagen).
Las característica histológicas de estas lesiones consisten en una hiperplasia de tejido de granulación con muchas células gigantes polinucleadas (Figuras 2a y 2b). Estas células gigantes están localizadas en la profundidad del corion en un estroma vascular con forma ovoide y fibroblastos en forma de bisagra. También existen diversas características como la hemorragia, marcada por la presencia de depósitos de hierro.
En cuanto al análisis inmunohistoquímico, todas las lesiones mostraban una intensa inmunopositividad para el CD-68 en macrófagos, monocitos y, en particular en las células gigantes multinucleadas (Fig. 3a). La periferia de las lesiones mostraba una expresión moderadamente positiva para el antígeno asociado al CD-34 (Fig. 3b), sin una evidente reacción en la zona de agregación de las células gigantes. Las células estromales y los histiocitos fueron también positivos para α-1 antitripsina (Fig. 3c).
Discusión
El granuloma periférico de células gigantes periféricas (GPCG) es una lesión benigna caracterizada por una reacción hiperplástica causada por un daño local o trauma crónico, que se desarrolla únicamente en la cavidad oral (5). La localización más frecuente de GPCG es en la mucosa adherida de la zona de los premolares y de la cresta alveolar edéntula. Nunca lo encontramos a nivel de la mucosa móvil, no adherida al hueso (8). Es más común que el granuloma central de células gigantes (GCCG) con una prevalencia de 3:1. De hecho, Junquera y colaboradores (10) mencionan la rareza del GCCG (0.4%-1.9%) según lo referido en la literatura.
Histológicamente, el GPCG se presenta como una masa no bien circunscrita, constituida por colágeno fibrilar conteniendo dos tipos de células mononucleares (células fusiformes y ovoideas) y numerosas células gigantes multinucleadas similares a los osteoclastos o más grandes que los osteoclastos normales, pero sin una función normal reabsortiva de hueso. Algunas veces estas células están localizadas en la pared interna de los vasos.
También se refiere la presencia de un infiltrado crónico, muy a menudo agudo, y la presencia de macrófagos cargados de hemosiderina alrededor de un área hemorrágica (16). Se caracteriza por una rica vascularización, principalmente en el área periférica de la lesión, consistente en vasos de pequeño calibre y delgados.
Contiene numerosas células gigantes multinucleares pero, en comparación con el tumor de células gigantes, es más fibroso.
Su patogénesis no ha sido evidenciada completamente. Muchos estudios inmunohistoquímicos se han centrado en la identificación de la naturaleza y las interrelaciones entre los componentes celulares que forman el GPCG. La literatura ha sugerido que las células estromales mononucleares pueden originarse de fibroblastos y de células de origen histiocitario, mientras que el origen de las células gigantes sigue siendo todavía motivo de controversia. De hecho, algunos autores sugieren que éstas células surgen secundariamente a la alteración de las células endoteliales de los capilares (5), otros sostienen ser consecuencia de un mecanismo traumático (algunas similitudes con los osteoclastos) (17, 18). Palacios y col. sugieren que la formación de estas células gigantes es una fusión de histiocitos, células endoteliales y fibroblastos (19).
Nuestra evaluación inmunohistoquímica revela la extensa presencia de CD-68 (antígeno ampliamente expresado en el linaje monocitos/macrófagos en diferentes estados de diferenciación, incluyendo células dendríticas y osteoclastos) en una porción de células estromales redondas y células gigantes polinucleares. Estos resultados confirman que estas últimos pueden derivar de los osteoclastos, de acuerdo con estudios previos (18).
Además, es interesante mostrar el patrón de inmunotinción de los vasos sanguíneos por el antígeno asociado a CD-34 en el granuloma periférico de células gigantes. Los capilares en la periferia de la lesión aparecieron altamente positivos para este anticuerpo (Fig. 3b). En la lesión, no se observaron productos de reacción de CD-34 dentro de la agregación de las células gigantes multinucleares. Este dato sugiere que las células gigantes multinucleares no se forman de las células endoteliales de los capilares.
El presente estudio de casos se llevó a cabo también para evaluar el papel de α-1 antitripsina (α1-AT) en pacientes con GPCG. La α1-AT es un inhibidor fisiológico de la activación de la proteína C y por lo tanto disminuye la actividad de la proteína C activada (Alpha1-Antitripsina (alpha1-AT) es fisiológicamente un inhibidor de la activación de la proteína C (APC) y por tanto, provoca un descenso en la actividad del APC (19). La proteína C, derivada de la vitamina K-dependiente (enzima serín proteasa), es activada por la trombina dentro de la proteína C activa (APC). La forma activa (con la proteína S como cofactor) degrada el factor V y el factor VIII.). La α1-AT, es una gligoproteína de 52 Kd secretada principalmente por los hepatocitos, las células epiteliales pulmonares y los fagotitos. La α1-AT inhibe una variedad de proteinasas de la serina mediante su sitio activo (Met358-Ser359), pero su objetivo preferente es la elastasa de los neutrófilos humanos (HNE); reflejado por la alta constante de asociación para esta proteinasa. El análisis inmunohistoquímico muestra difusamente, una fuerte inmunopositividad de las células mononucleares y, focalmente, de las células gigantes multinucleares para α-1 antitripsina (Fig. 3c). Estos datos señalan que este antígeno es capaz de inhibir la actividad de la HNE (Fig. 3c).
El diagnóstico diferencial del GPCG se relaciona principalmente con el tumor de células gigantes, el cual contiene células gigantes microscópicamente multinucleadas, pero muestran características clínicas muy diferentes y una peor relación con la periferia del granuloma de células gigantes (21); el fibroma no-osificante que se diferencia del GPCG por consistencia y color; el granuloma piógeno que es difícil de distinguir de las lesiones de GPCG; el GCCG, que es una extensa lesión intraósea, la cual puede perforar la corteza, imitando el GPCG; el condroblastoma, que localizado en la encía, puede provocar destrucción ósea irregular debajo de la lesión exofítica; el quiste odontogénico; el párulis (también llamado "furúnculo de encía", y se presenta como un foco de pus en el tejido conectivo gingival), que frecuentemente está asociado con diente necrótico o con trastorno periodontal; el hemangioma cavernoso, que es distinguido de las lesiones de GPCG por la naturaleza pulsátil; y el épulis fisurado (9).
El tratamiento de elección es la escisión quirúrgica con la supresión de los factores etiológicos (5). El periostio debe ser incluido en la escisión para prevenir recidivas. De hecho, la recidiva es frecuente y se observa en el 5% y 11% de los casos de acuerdo con lo visto por Eversole (22) y Mighell (23) respectivamente. Además de la escisión quirúrgica, también se sugiere el curetaje del fondo de la lesión. La recidiva de GPCG está descrita en un rango entre el 5 y el 70,6%. Esta amplia variación puede atribuirse a la técnica quirúrgica utilizada en la escisión (8-10).
En conclusión, nuestro estudio inmunohistoquímico sugiere, de acuerdo con estudios inmunohistoquímicos previos, que las células gigantes multinucleares muestran el fenotipo de los osteoclastos, y que probablemente derivan del linaje monocito/macrófago, y las células gigantes no derivan de las células endoteliales de los capilares.
En segundo lugar, un diagnóstico cuidadoso y precoz de GPCG basado en la clínica, hallazgos radiológicos y estudios histológicos, permite un manejo conservador, con un menor riesgo para los dientes y el hueso adyacente. En todos los casos descritos anteriormente, el tratamiento aplicado fue el que se describe en la literatura (4, 5), consistente en la escisión quirúrgica y posterior curetaje, con el fin de remover la base de la lesión y todos los factores irritantes asociados (9).
Bibliografía
1. Shafer WG, Hine MK, Levi BM. Tratado de patologìa Bucal. eds. 4th. Rio de Janeiro: Guanabara-Koogan; 1987. p.143-5. [ Links ]
2. Reichart PA, Philipsen H. Atlas de Patologìa Oral. eds.1 Masson; 2000. p. 164. [ Links ]
3. Wolfson L, Tal H, Covo S. Peripheral giant cell granuloma during orthodontic treatment. Am J Orthod Dentofac Orthop 96: 519-23. [ Links ]
4. Bagàn Sebastiàn JV. Atlas de enfermedales de la mucosa oral. eds. 5th Barcelona; 1995. p. 186. [ Links ]
5. Flaitz CM. Peripheral giant cell granuloma: a potentially aggressive lesion in children. Pediatr Dent 2000; 22: 232-3. [ Links ]
6. Nedir R, Lombardi T, Samson J. Recurrent peripheral giant cell granuloma associated with cervical resorption. J Periodontol 1997; 67: 381-4. [ Links ]
7. Pandolfi PJ, Felefli S, Flaitz CM, Johnson JV.An aggressive peripheral giant cell granuloma in a child. J Clin Pediatr Dent 1999; 23: 353-5. [ Links ]
8. Breault LG, Fowler EB, Wolfgang MJ, Lewis DM. Peripheral giant cell granuloma: a case report. Gen Dent 2000; 48:716-9. [ Links ]
9. Gandara-Rey JM, Pacheco Martins Carneiro JL, Gandara-Vila P, Blanco-Carrion A, Garcia-Garcia A, Madrinan-Grana P, Martin MS. Peripheral giant cell granuloma. Review of 13 cases. Med Oral 2002; 7: 254-9. [ Links ]
10. Junquera LM, Lupi E, Lombardia E, Fresno MF. Multiple and synchronous peripheral giant cell granulomas of the gums. Ann Otol Rhinol Laryngol 2002; 111: 751-3. [ Links ]
11. Ceballos-Salobrena A. Tumores benignos de la mucosa oral. En: Bagàn-Sebastian JV, Ceballos-Salobrena A, Bermejo-Fenoll A, Aguirre-Urizar JV, Penarrocha-Diago M. Medicina Oral; 1995. p.182-3. [ Links ]
12. Kfir Y, Buchner A, Hansen LS. Reactive lesions of the gingiva. A clinicopathological study of 741 cases. J Periodontol 1980; 51: 655-61. [ Links ]
13. Regezi JA, Zarbo RJ, Lloyd RV. Muramidase, alpha-1 antitrypsin, alpha-1 antichymotrypsin, and S-100 protein immunoreactivity in giant cell lesions. Cancer. 1987 Jan 1;59(1):64-8 [ Links ]
14. Regezi JA, Nickoloff BJ, Headington JT Oral submucosal dendrocytes: factor XIIIa+ and CD34+ dendritic cell populations in normal tissue and fibrovascular lesions. J Cutan Pathol. 1992 Oct;19(5):398-406. [ Links ]
15. Panico L, Passeretti U, De Rosa N, DAntonio A, De Rosa G. Giant cell reparative granuloma of the distal skeletal bones. A report of five cases with immunohistochemical findings. Virchows Arch. 1994;425(3):315-20. [ Links ]
16. Wood NK. Diagnòstico diferencial de las lesiones orales y maxilofaciales. Madrid: Harcourt Brace de Espana SA;1998. p. 141-2. [ Links ]
17. Matsumura T, Sugahara T, Wada T, Kawakatsu K. Recurrent giant-cell reparative granuloma: report of case and histochemical patterns. J Oral Surg 1971; 29: 212-6. [ Links ]
18. Sapp JP. Ultrastructure and histogenesis of peripheral giant cell reparative granuloma of the jaws. Cancer 1972; 30: 1119-29. [ Links ]
19. Palacios E, Valvassori G. Giant cell reparative granuloma. Ear Nose Throat J 2000; 79: 688. [ Links ]
20. Burghaus B, Langer C, Thedieck S, Nowak-Gottl U. Elevated alpha1-antitrypsin is a risk factor for arterial ischemic stroke in childhood. Acta Haematol. 2006;115(3-4):186-91 [ Links ]
21. Chaparro-Avendano AV, Berini-Aytes L, Gay-Escoda C. Peripheral giant cell granuloma. A report of five cases and review of the literature.Med Oral Patol Oral Cir Bucal. 2005; 10(1):53-7. [ Links ]
22. Eversole LF, Rovin S. Reactive lesions of the gingiva. J Oral Pathol 1972; 1: 30-8. [ Links ]
23. Mighell AJ, Robinson PA, Hume WJ. Peripheral giant cell granuloma: a clinical study of 77 cases from 62 patients, and literature review. Oral Dis1995;1: 12-9. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Prof. Lorenzo Lo Muzio
Via Carelli 28
71100 Foggia – Italia.
Teléfono y Fax 0039 0881 685809
Correo electrónico: lomuziol@tin.it o llomuzio@tin.it
Fecha de recepción: Abril 2007.
Aceptado para publicación: Mayo 2007.











 texto en
texto en