INTRODUCCIÓN
El tumor odontogénico adenomatoide (TOA) es un tumor atípico de origen epitelial (1); fue descrito por primera vez por Steensland en 1905 (2) y fue considerado por Dreibladt como un pseudoadenoameloblastoma en 1907 (3). Reportado por primera vez en 1915 por Harbitz con el nombre de “Adamantoma Quístico” (4). En 1969, Philipsen y Birn (5) lo renombraron como “tumor odontogénico adenomatoide” término que luego fue adoptado por la Organización Mundial de la Salud en su clasificación de tumores odontogénicos de 1971; varias denominaciones han sido usadas en el tiempo para nombrarla: adenoameloblastoma, tumor adenomatoide ameloblástico, adamantinoma, epitelioma adamantino y odontoma teratomatoso (6, 7).
Es una neoplasia benigna de crecimiento lento, aunque muchos autores lo categorizan como un hamartoma dadas sus características (8). Se observa cómo un aumento de volumen tanto extra como intraoral es asintomático, no invasivo que, con frecuencia, se ha diagnosticado mal como un quiste odontogénico.
Históricamente se le ha llamado “el tumor de los dos tercios” porque: es 2/3 más frecuente en el maxilar que en la mandíbula, está asociado con un diente no erupcionado que en 2/3 es un canino, es 2/3 más frecuente en mujeres jóvenes y 2/3 son diagnosticados en la segunda década de la vida (8, 9).
El TOA ha sido clasificado por la OMS en 2005 como tumor odontogénico epitelial con un variado patrón histoarquitectural de un estroma fibroso maduro sin ectomesénquima odontogénico (9), con estructuras pseudoductales y con inducción en el tejido conectivo de grado variable (3, 10).
El objetivo de este artículo es revisar un caso clínico con diagnóstico de TOA y hacer una revisión de la literatura del mismo.
ETIOLOGÍA
Aunque hay muchas publicaciones sobre TOA, el conocimiento actual sobre su etiología es pobre y los argumentos sobre su origen son controvertidos (11). Se ha tenido la idea de ser derivado del epitelio odontogénico por originarse de un área donde se forman los dientes, debido a que presenta varios componentes del órgano del esmalte, de la lámina dental, y del epitelio reducido del esmalte (8, 12, 13).
Philipsen et al, en 1992 (14), hipotetizó que el TOA se origina del gubernaculum dentis o también lámina dental accesional (un canal preconformado que va del folículo dental a la encía y que permite la erupción del diente permanente) durante el periodo de dentición mixta. Esta hipótesis puede explicar por qué un TOA raras veces se asocia a un diente deciduo (15, 16). Walker LM, en el 2004 (17), pública un caso excepcional de un TOA asociado a un diente deciduo. Surge entonces la pregunta porque se han encontrado TOAs relacionados con molares permanentes los cuales no tienen diente predecesor, aunque estos casos son menos del 4% (18, 19). Adicionalmente sugirió que el TOA puede originarse de residuos epiteliales en estrecha proximidad a la corona de un diente permanente y algunos tumores pueden moverse durante la erupción del diente a lo largo del canal gubernacular.
Esta teoría ha sido recientemente avalada por Ide et al (11), quienes reportaron un caso clínico en 2011 en el cual se publica una radiografía panorámica donde se aprecia un canino permanente mandibular involucrado en un TOA y donde se ve claramente la conexión a través del gubernaculum dentis con el canino deciduo predecesor (19).
Ide et al (19) también consideraron que el diente sucedáneo o la lámina dental (sucesional) aportaba elementos a la conformación del TOA y publicaron un caso que presentaba microscópicamente gran cantidad de remanentes de la lámina dental, pero el cirujano no incluyó el diente en el espécimen, lo que dificultó clarificar el parentesco del TOA con el diente sucedáneo y su gubernaculum dentis a nivel histológico. Sin embargo, estima que no necesariamente todo TOA se origina de los restos de la lámina dental ubicados dentro o adyacentes al canal gubernacular, pues algunas de estas lesiones se originan después del desarrollo de los dientes deciduos que tienen gubernaculum dentis (19).
Thoma, en 1970 (20), sugirió un posible origen a partir del epitelio reducido del esmalte que rodea la corona del diente el cual posteriormente quedaba embebido dentro del tumor. Lucas, en 1957 (21), y Shear M, en 1962 (22), sugirieron que el TOA se formaba originándose en el órgano del esmalte. Bhaskaren, 1964 (23), sugiere que se origina de la lámina epitelial de un quiste dentígero. Chambers, en 1973 (24), y Thoma, en 1955 (25), sugieren que se desarrolla de los restos epiteliales de Malassez de un diente deciduo o permanente. Shear, 1962 (22), y Courtneyen, 1975 (26), consideraron que provenía de los remanentes de a lamina dental, pero ninguna de esas teorías ha sido bien sustentada.
EPIDEMIOLOGÍA
EL TOA tiene mayor predilección por mujeres que por hombres en una proporción 1,9:1, y esta proporción es más marcada en poblaciones asiáticas (1). Es más frecuente antes de la tercera década de la vida aunque se han reportado casos entre los 3 y los 28 años, con un promedio de edad de 13,2 años. (27) Representa el 3% de todos los tumores odontogénicos (3), esta cifra puede variar según la etnia, aunque Philips (18) considera que el rango frecuencia de la lesión en la población es mayor (entre 0,6% y 38,5%). En muchos reportes sobre TOA se ha visto que la mayoría de los casos provienen de la población asiática (11) presentándose más frecuentemente en la región anterior del maxilar (28). Batra, en 2005 (29), reporta que puede representar entre el 2,2 y 13% de todos los tumores odontogénicos y el cuarto tumor odontogénico más común (18, 30) después de los odontomas, cementoblastomas, mixomas y ameloblastomas (31, 32).
ASPECTO CLÍNICO
Presenta mayor predilección por el maxilar que por la mandíbula en una relación 2:1 (33) y es más común en la parte anterior que en la posterior del maxilar (8). Giansanti et al, en 1970 (34), reportaron un 65% en el maxilar y un 35% en la mandíbula distribuido así: 80%, en la región anterior; 14%, en la región premolar, y pocos, en la región molar del maxilar superior. De la mandíbula, el 69% eran en la región anterior; el 27%, en la región premolar, y pocos, en la región molar (35).
Existen dos variantes clínicas: Intraóseo (97,7%) y extraóseo (2,3%). El intraóseo se subdivide en: a) Pericoronal o folicular (70,8%) y b) Extracoronal o extrafolicular (26,9%) (12). Cuando se da extraóseo el sitio de predilección es la encía anteroinferior. El TOA intraóseo pericoronal está asociado con un diente impactado en el que aproximadamente el 60% de los casos es un canino, predominando en el arco superior (36); muy escasamente pueden estar comprometidos incisivos permanentes, molares y premolares y aún dientes deciduos. El tipo extrafolicular también es intraóseo pero no se relaciona con un diente impactado (29).
Puede desplazar dientes vecinos y/o retardar su erupción (1). Es más frecuente que produzca desplazamiento del diente a que produzca reabsorción (37), aunque tumores de gran tamaño aumentan la posibilidad de producir reabsorción radicular en los dientes adyacentes a la lesión (38).
Baby, en 2010 (39), lo describe como un tumor pequeño de no más de 3 cm, otros autores como More CB (1), lo han descrito de mayor tamaño. Debido a su lento crecimiento, el intraóseo puede expandir la cortical ósea y causar una asimetría facial como un aumento de volumen de consistencia dura, sin invadir tejidos blandos, poco doloroso por lo que el paciente consulta tardíamente cuando ya hay una verdadera deformidad (1). La variante extraósea periférica o gingival puede generar desplazamiento de dientes y generar rizólisis (30).
Rick, en 2004 (30), reportó que el TOA podía presentarse asociado a varios tipos de quistes y tumores, como el quiste dentígero, el quiste odontogénico calcificante, un odontoma o un ameloblastoma. Con el quiste dentígero, el TOA puede mostrar relación tanto a nivel macro como microscópicamente y raras veces estos se asocian. En la literatura se han reportado 9 casos caracterizados por cavidades quísticas tapizadas por epitelio escamoso estratificado no queratinizado similar al revestimiento del quiste dentígero aunque puede presentar membranas menos estructuradas con extensiones de tejido conectivo. En el reporte histopatológico, puede encontrarse un área quística compuesta por tejido fibroso denso recubierto por unas tres capas de epitelio escamoso estratificado no queratinizado (30).
Agarwal y cols., en 2012 (36), reportaron un TOA asociado a un quiste dentígero, en una paciente de 15 años natural de la India, localizado en el maxilar superior, que contenía dentro del tumor el canino superior izquierdo, ocasionando desplazamiento y reabsorción de raíces de primero y segundo premolar izquierdos. Concluye que la lesión hallada puede generar ambigüedad respecto a si se trata de un quiste odontogénico que pudiera contener epitelio y mesénquima o de un tumor híbrido.
ASPECTO RADIOGRÁFICO
La variante intraósea puede presentar distintos aspectos y, frecuentemente, se observa una radiolucidez o una imagen mixta radiolúcida-radiopaca unilocular bien demarcada, con un borde esclerótico de hueso bien definido, o una cortical suave, asociada con la corona y a menudo parte de la raíz de un diente sin erupcionar imitando un quiste dentígero pero se diferencia de éste último en que el dentígero no involucra la raíz (1).
El TOA puede contener múltiples calcificaciones de forma y tamaño variable dispersos o agrupados, o un foco radiopaco que puede aparecer como un racimo de guijarros pequeños visto aproximadamente en el 78% de los casos y raras veces carece de componente radiopaco (39, 40) para lo cual se ha recomendado el uso de la radiografía intraoral periapical como método esencial para la correcta interpretación ya que permite apreciar mejor las radiopacidades o calcificaciones, a veces muy tenues (41). El canino constituye un 60% de los casos involucrados con TOA y los caninos maxilares son los de mayor predominancia (40%) (30).
La modalidad intraósea extrafolicular se presenta como una radiolucidez unilocular bien definida que se encuentra entre, arriba o superpuesta a las raíces de los dientes permanentes erupcionados (37). Pocos casos multiloculares han sido reportados (30, 38). La variante extraósea es raramente detectable radiográ- ficamente, pero puede presentarse una ligera erosión de la cresta subyacente del hueso alveolar (30).
La rizólisis irregular y el desplazamiento de raíces, son raras pero se han visto casos (8, 36), es más común que ocurra desplazamiento a que se dé la reabsorción de raíces (6).
Los hallazgos radiográficos de diferentes tumores muestran lesiones con aspecto similar, por lo que se debe hacer un diagnóstico diferencial con: un quiste dentígero, quiste odontogénico calcificante, tumor odontogénico epitelial calcificante, quiste globulomaxilar, ameloblastoma unilocular, fibroodontoma ameloblástico, tumor odontogénico queratoquístico, y un odontoma en proceso de maduración (42).
TRATAMIENTO
Usualmente, es suficiente con hacer sólo un manejo quirúrgico conservador del tumor, incluyendo el diente impactado y un curetaje simple, ya que esta patología no es localmente invasiva, está bien encapsulada, da clivaje fácil (40) y la recurrencia es sólo de un 0,2%. (39) Históricamente se ha reportado recurrencia en tres pacientes japoneses (43), por tanto, el pronóstico, en general, es excelente.
En grandes tumores, puede requerirse resección parcial o en bloque, o puede haber el riesgo de fracturas patológicas. Es conveniente hacer regeneración tisular guiada empleando hueso liofilizado y membranas, especialmente en grandes cavidades óseas (1).
HISTOPATOLOGÍA
El TOA es altamente atípico, ya que se presenta con una variedad de patrones arquitectónicos y celulares (28). El patrón más característico es el que se presenta en forma nodular sólida de células cuboidales y/o fusiformes de epitelio odontogénico, formando nidos celulares en hojas o estructuras similares a rosetas; esta estructura se encuentra rodeado por un estroma de tejido conectivo bien desarrollado con vasos de paredes delgadas, con presencia de una delgada capa epitelial (3). En algunas zonas se puede observar material amorfo eosinófilo (calcificaciones distróficas) entre las células epiteliales y en el centro de la estructura en forma de roseta (1, 30, 11). El tumor puede presentarse como una masa sólida, o parcialmente quístico y generalmente tiene masas globulares de tejido calcificado (12).
Hay espacios similares a conductos (pseudoductos) formados por una fila de células epiteliales cilíndricas con el núcleo polarizado en sentido opuesto al lumen (28), dicho lumen puede estar vacío o contener material hialino eosinofílico amorfo (“gotas eosinófilas”) o detritos celulares. Las células cuboidales o cilíndricas pueden formar cordones en complicados patrones que pueden exhibir invaginación (9).
De Matos, 2012 (44), reportó que, junto con el TOA, pueden encontrarse áreas de tumor odontogénico epitelial calcificante, caracterizado por nódulos de células epiteliales eosinófilas de apariencia escamosa con distintos límites celulares y puentes intercelulares, usualmente rodeados por un tejido conectivo bien desarrollado.
Algunos autores han reportado la presencia de un material dentinoide o similar a osteodentina, en cambio la presencia de matriz de esmalte es extremadamente rara (31, 45).
Gómez RS et al, 2013 (46) reportaron un caso raro de TOA asociado a un odontoma. Este artículo cuestiona muchos aspectos de la entidad encontrada en su caso clínico, ya que presenta un comportamiento clínico de odontoma, pero histológico con elementos propios del TOA. Estos autores realizaron una revisión de 11 artículos publicados en la literatura de esta lesión combinada y encontraron que el TOA se presenta principalmente en la zona anterior del maxilar superior, y la mayoría de los casos reportados con estas mismas características (TOA asociados a odontomas) se presentaron en la zona posterior de la mandíbula.
MECANISMOS MOLECULARES RELACIONADOS CON EL TOA
Muchos tumores se originan en los maxilares y surgen de las células que forman los dientes o de sus remanentes. En general, las lesiones son clasificadas como hamartomas, tumores benignos o tumores malignos (9). Debido a su etiología relacionada con la odontogénesis, su presentación histológica muestra estructuras similares a las células que forman la embriología dental como el epitelio reducido del esmalte, el retículo estrellado o la papila dental y a las estructuras que estas células forman. Algunos tumores contienen células semejantes a ameloblastos y otros contienen estructuras calcificadas semejantes a esmalte, dentina y cemento (47). Algunas investigaciones han estudiado proteínas de la matriz que se expresan durante la formación del esmalte como: enamelina, amelogenina, amelotina, ameloblastina y proteínas asociado a ameloblastos odontogénicos que representes marcadores útiles en tumores odontogénicos (48).
Saku et al, en 1992 (49), investigaron mediante inmunohistoquímica la expresión de las proteínas amelogenina y enamelina en los tumores: TOA, tumor odontogénico epitelial calcificante (TOE) y quiste odontogénico calcificante (COC) los cuales mostraron diferenciación ameloblástica a diferencia del ameloblastoma donde los ameloblastos no llegan a la etapa de maduración, lo que puede indicar diferencias en el comportamiento y la patogénesis de estos tumores. La ameloblastina, enamelina y la sheatlina son glicoproteínas específicas secretadas por los ameloblastos en la formación del esmalte durante la amelogénesis (50). La amelogenina fue detectada por inmunohistoquímica en los focos de calcificación del epitelio odontogénicos del TOA y del tumor odontogénico quístico, pero no fue observado en los ameloblastomas (51).
Krishna A y cols., 2012 (52), publicaron un estudio en el cual se realizó inmunohistoquímica en ameloblastomas y TOAs con anticuerpos para p53 y MDM2 (gen llamado “murine doble minute 2”, regulador negativo del gen supresor tumoral p53) y encontraron que había mayor expresión del MDM2 en los ameloblastomas.
En resumen, un estudio con mayor expresión de MDM2 en los ameloblastomas comparados con los TOA sugiere mayor agresividad en el comportamiento de los ameloblastomas ya que el gen p53 es un gen protector al ser un supresor tumoral.
El TOA clásico presenta un tipo de citoqueratina (CK) con un perfil similar al quiste folicular y/o epitelio gingival, oral con tinción positiva con CK5, CK17 y CK19 (53). También se ha demostrado un TOA clá- sico que es negativo para CK4, CK10, CK13 y CK18. Crivelini et al, en 2003 (54), han demostrado la expresión de CK 14 en el TOA concluyendo que tenía su origen en el epitelio reducido del esmalte el cual también expresa esta citoqueratina. Abiko y cols., en 2001 (51), también encontraron reacciones positivas para amelogenina en zonas limitadas del TOA, proteína propia del ameloblasto y de la matriz de esmalte inmaduro. Takahashi et al, en 2001 (55), observaron una tinción positiva para proteínas asociadas a hierro (transferasa, ferritina) y el inhibidor de proteínas alfa-uno antitripsina en varias células del TOA. Gao, en 1997 (56), estudió la expresión de proteína morfogenética ósea (BMP) y encontró que ésta era positiva en los fibromas cementificantes, los dentinomas y odontomas compuestos mientras que el TOA, ameloblastoma, y el tumor epitelial calcificante eran negativos.
PRESENTACIÓN DEL CASO
Paciente de 17 años, soltera, mestiza, que consulta al servicio de Cirugía Maxilofacial del HUSVF por presentar “aumento de volumen en pómulo izquierdo” de 5 meses de evolución que ha ido aumentando rápidamente de tamaño (Fig. 1a); a la inspección se aprecia tumefacción en maxilar izquierdo sin presencia de ningún tipo de sintomatología. Clínicamente se observa asimetría facial en maxilar izquierdo con borramiento de surco nasogeniano izquierdo sin signos inflamatorios. A la palpación, masa de consistencia sólida de bordes bien definidos que altera la forma de la apertura piriforme ipsilateral y produce abombamiento de piso nasal de la fosa nasal izquierda, pero se conserva la permeabilidad de dicha fosa. En radiografía panorámica (Fg. 1b), se observa zona radiolúcida circunscrita de bordes bien delimitados que se extiende de los dientes 22 al 26 haciendo desplazamiento radicular distal de las raíces de los bicúspides, rechaza el seno maxilar e involucra la totalidad del diente 23 con presencia de imágenes compatibles con calcificaciones internas.
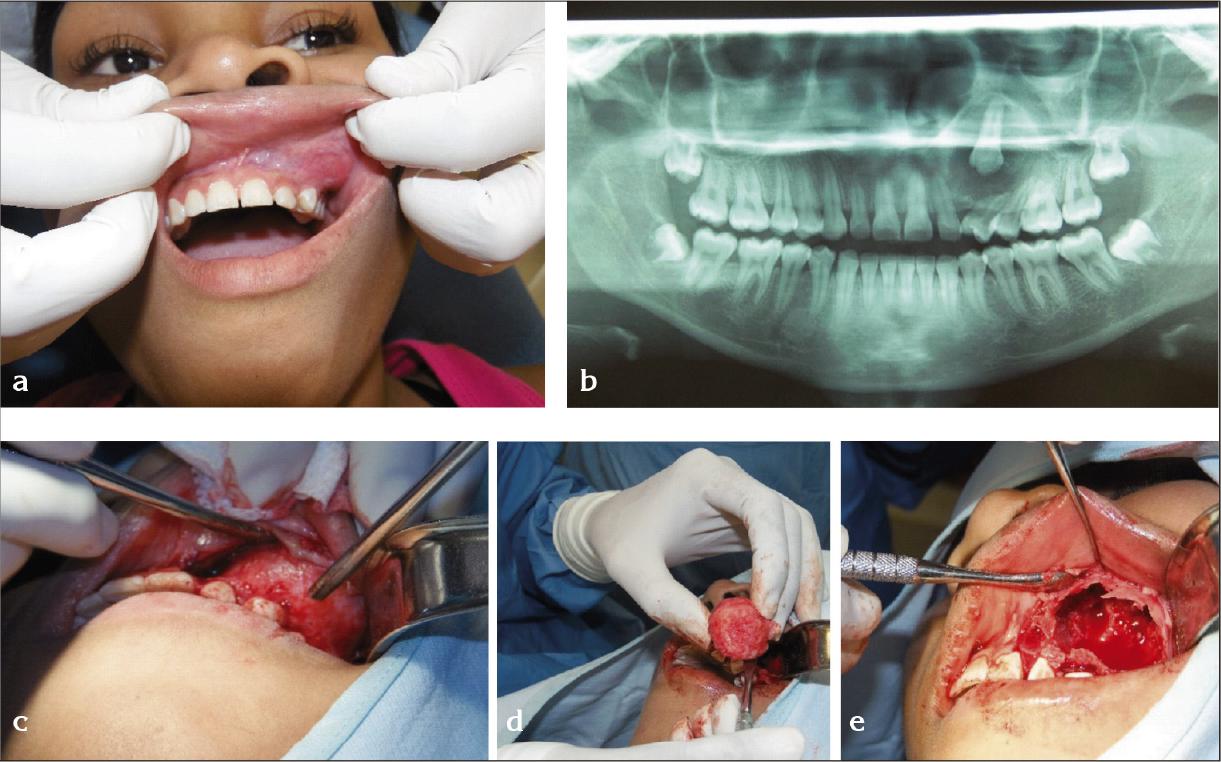
Fig. 1 a) Aumento de volumen con borramiento de fondo surco vestibular que causo asimetría facial. b) Rx panorámica preliminar. Se aprecia 23 retenido dentro de masa que ocupa maxilar superior izquierdo. c) Masa sólida visible al levantar el colgajo. d) Masa redonda de aproximadamente 5 cm de diámetro de consistencia firme. e) Defecto óseo dejado por el tumor.
Al momento de la resección de la lesión (Fig. 1c), se encuentra una masa de consistencia sólida de aproximadamente 5 centímetros de diámetro, recubierta por una membrana gruesa y de aspecto fibroso (Fig. 1d). Posterior a la enucleación de la lesión queda un defecto óseo en el maxilar superior de aproximadamente 5 centímetros de diámetro donde estaba respetado el seno maxilar (Fig. 1e). En la periferia de la lesión se palpa la presencia del diente involucrado.
El estudio histopatológico describe tejido que incluye diente dentro del tumor. Muestra la presencia de una porción quística delimitada por tejido fibroconectivo con células de disposición paralela. Hay neoformación ósea en la zona adyacente a la pared (Fig. 2a). En la zona central de la cavidad hay una proliferación de células epiteliales cilíndricas y algunas fusocelulares que forman varios nódulos intercalados con bandas de tejido eosinófilo hialinizado a manera de membrana (Fig. 2b). En la proliferación celular hay múltiples calcificaciones de forma irregular. Además hay pequeñas estructuras tubulares revestidas por epitelio cilíndrico que contienen material eosinó- filo en el lumen.

Fig. 2 Imágenes con tinción hematoxilina eosina. a) Presencia de neoformación ósea en la zona adyacente a la pared (40×). b) Se observa zona central de proliferación de células fusiformes basofílicas hipercromáticas que forman nódulos arremolinados; en zonas se observa presencia de material hialino eosinofílico amorfo (“gotas eosinófilas”) y focos de mineralización distrófica (10×).
DISCUSIÓN
El TOA es una entidad muy variable, de la cual no ha sido posible precisar si es una neoplasia o un hamartoma, y aún otros autores lo consideran como un quiste odontogénico. Thakur A et al, 2016 (13), plantean que el TOA no debe ser considerado como un quiste, y su verdadero carácter quístico sigue siendo cuestionable. Para esclarecer este punto se requerirían nuevos estudios sobre la histogénesis que permitiría cambiar la nomenclatura de TOA, a quiste odontogénico adenomatoide (QOA), ya que en su origen no es un verdadero quiste. Si el TOA existe como un verdadero quiste debería encontrarse TOAs quísticos periféricos y extrafoliculares, pero sólo se ha reportado un caso (57).
Esta entidad presenta un comportamiento irregular en el cual se da una mezcla de características propias de otras entidades a nivel clínico, radiográfico e histopatológico.
Santiago Gómez et al, en 2013 (58) reporta un caso que muestra histopatológicamente una mezcla entre odontoma y TOA; los autores hicieron una revisión sistemática de todos los casos publicados con componentes de TOA y de tejido dental, quienes cuestionan si se trata de la misma entidad o es una lesión diferente, ya que el TOA se caracteriza por presentarse en la región anterior del maxilar y usualmente el diente comprometido es un canino, mientras que estas lesiones con elementos de tejido dental se presentan en la región posterior mandibular. En la revisión presentada por este autor solo había 1 de 11 casos reportados en el maxilar, el resto era en la mandíbula. (59), que no es lo común de un TOA.
El TOA puede parecerse mucho a un queratoquiste y a un ameloblastoma uniquístico, sobre todo si el TOA tiene una localización pericoronal. Ambas lesiones se diagnostican entre la segunda y tercera década de la vida, semejante al TOA, pero estas son más comunes en el área posterior de la mandíbula (60), al contrario de lo que ocurre con el TOA. Otra lesión que debe diferenciarse del TOA es el tumor odontogénico epitelial calcificante, que también se encuentra en la región anterior de los maxilares y asociado con un diente no erupcionado, y puede contener radiopacidades, e igualmente se diagnostica en la segunda década de la vida, con lo que se concluyen una variedad de similitudes entre ambos, que hace difícil diferenciarlos (61). También puede semejarse con un fibroodontoma ameloblástico, en donde ambas lesiones se localizan principalmente en la parte posterior de la mandíbula, pero el fibroodontoma es común principalmente en niños de 10 años (45).
CONCLUSIONES
Las neoplasias benignas tienen una etiología y evolución compleja dado que en muchas ocasiones una lesión presenta características similares a otras, lo que daría para pensar que desde el origen hasta la madurez de la lesión hay etapas que se pueden confundir con otras entidades. Es el caso del TOA que presenta múltiples aspectos histopatológicos hasta el punto de parecer que el conocimiento acerca de él aún es rudimentario, a pesar de que se han hechos muchos estudios, y revisiones de casos clínicos. En este documento, presentamos una lesión clásica en una paciente de 17 años de raza mestiza que consultó cuando presentó una asimetría facial sin sintomatología dolorosa; el motivo de la consulta principalmente es estético. Se presentó su manejo y revisión de literatura.














