INTRODUCCIÓN
La pérdida permanente de los dientes ocasiona en los maxilares una atrofia progresiva que en los casos más avanzados puede dificultar notablemente la inserción de los implantes y posterior rehabilitación prostodóncica. En los casos más severos es necesaria la realización de técnicas quirúrgicas avanzadas que eviten las estructuras nobles maxilares como son el seno maxilar y el nervio dentario inferior 1 .
En la mandíbula, el aumento de las áreas atróficas a menudo supone un prerrequisito para obtener el volumen idóneo de hueso para la colocación de implantes en una posición guiada protésicamente y así lograr estabilidad a largo plazo, función y buenos resultados estéticos 2 .
En este sentido, la rehabilitación posterior mandibular supone en determinadas situaciones, un reto constante para el clínico, especialmente debido a la presencia del nervio dentario inferior, reduciendo notablemente la altura disponible para la colocación de implantes dentales 3 .
Una altura de hueso insuficiente obligará a buscar diversas alternativas quirúrgicas; tales como la realización de injertos óseos onlay/inlay, la transposición del nervio dentario, con el consiguiente riesgo de parestesia temporal o permanente, el empleo de implantes cortos, procedimientos de distracción osteogénica, y la regeneración ósea guiada 4 - 8 .
INJERTOS ÓSEOS INLAY
La técnica interposicional “inlay” o técnica de “sándwich”, se sustenta en la teoría de que si se posiciona hueso autólogo o biomaterial entre dos pedículos de hueso esponjoso, se logra una rápida incorporación del injerto con una mínima reabsorción 5 .
La osteotomía a realizar permite un posicionamiento estable del injerto en una zona bien delimitada, con un adecuado aporte sanguíneo al mantener íntegro el periostio lingual; de esta forma, se ofrece un adecuado suministro para el desarrollo del injerto interpuesto. Este procedimiento permite corregir la relación intermaxilar y evitar proporciones corono-implante desfavorables 9 .
La técnica quirúrgica consiste en realizar una incisión en la mucosa vestibular adyacente a la cresta alveolar. Se eleva el colgajo, manteniendo intacto el periostio lingual y exponiendo la superficie ósea vestibular 10. En primer lugar, se realiza una osteotomía vertical y una oblicua 2 mm por encima del foramen mentoniano. El fragmento craneal se eleva para lograr un espacio para el injerto óseo sin afectar al periostio lingual. El injerto óseo se puede obtener de zonas donantes como la cresta ilíaca y se interpone entre ambos segmentos (basal y craneal). A partir de los 3 meses del procedimiento, se pueden colocar los implantes dentales 10 .
Posteriormente, se ha modificado la técnica en el diseño de la osteotomía. La incorporación del bisturí ultrasónico o piezosurgery permite realizar un corte horizontal a 2-4 mm por encima del canal mandibular y después dos cortes oblicuos en el tercio coronal del hueso mandibular. La fijación de los segmentos, se realiza mediante la utilización de tornillos miniplacas de titanio atornilladas 11 .
INJERTOS ÓSEOS ONLAY
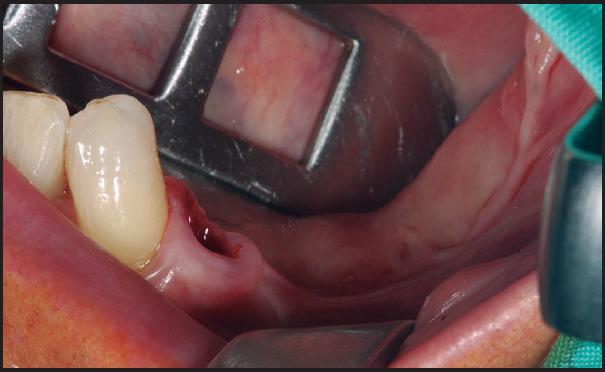
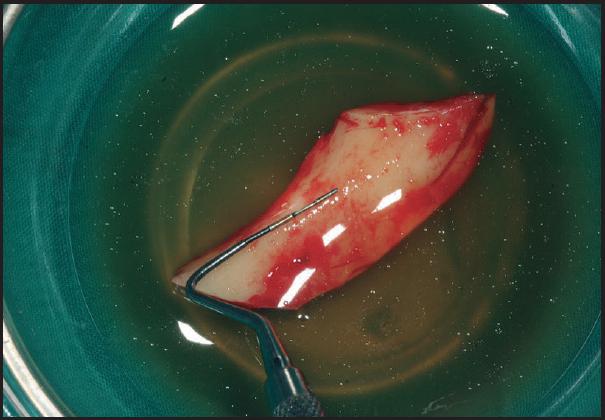
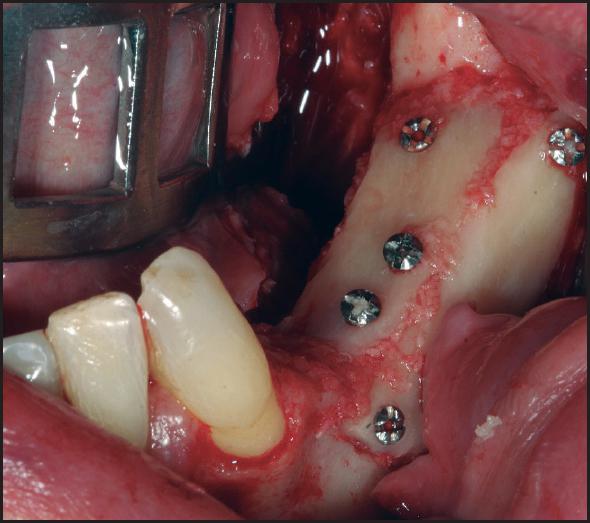
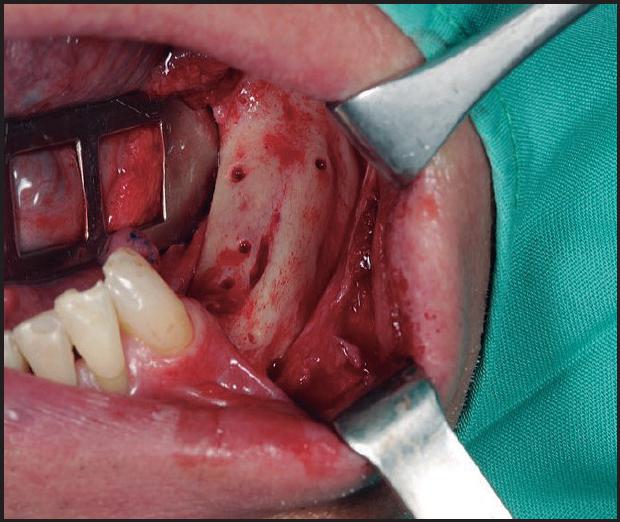
Técnica quirúrgica que se basa en la obtención de un injerto en bloque intraoral o extraoral o bien en el empleo de biomateriales, para su posterior colocación mediante tornillos de osteosíntesis en la zona del defecto y lograr aumentos tanto en anchura como en altura de hueso (Figuras 1 - 7 ).
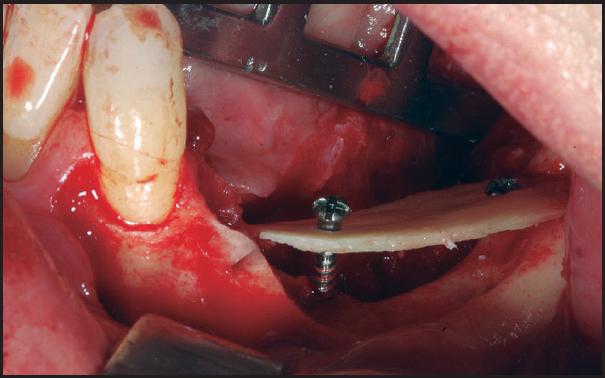
Figura 4 Colocación del injerto óseo para técnica onlay dejando un espacio inferior de ganancia para relleno con injerto óseo particulado
A pesar del desarrollo de nuevos biomateriales, el hueso autólogo sigue considerándose el gold estándard en los procedimientos de aumento óseo, principalmente por sus características osteoinductivas y no inmunogénicas. Los injertos autólogos onlays se asocian con una rápida reabsorción al recibir carga mecánica y tensión de los tejidos blandos; por ello y los inconvenientes asociados a la necesidad de una segunda zona quirúrgica, son más los autores que emplean los biomateriales en este procedimiento de aumento óseo 12 - 13 .
La zona receptora será la primera en exponerse, para medir previamente las dimensiones del defecto óseo y minimizar posteriormente, el tiempo transcurrido entre seleccionar el injerto óseo y su colocación ( Figura 1 ). Se realiza una incisión en la región edéntula y dos verticales mesial y distal a la horizontal para elevar el colgajo mucoperióstico y exponer la región del defecto. Mediante el empleo de una fresa o instrumental piezoeléctrico se realizará unas perforaciones en la cortical 14 . Se piensa que las perforaciones podrían contribuir a la liberación de proteínas morfogenéticas óseas (BMP) que activarían la transformación de células mesenquimales en osteoblastos, acelerando el proceso de neoformación ósea 15 . Un estudio más reciente confirma, que incrementa el número de vasos sanguíneos (angiogénesis) aumentando a su vez a la cantidad de hueso formado 16 .
Posteriormente, una vez obtenido el injerto (varía según localización), se procede a posicionarlo en la zona receptora y se fija con microtornillos, los espacios vacíos se rellenan generalmente con biomaterial particulado y cierre de la herida quirúrgica libre de tensión (Figuras 2 - 5 ). Después de un periodo no inferior a 4-6 meses se colocan los implantes para su rehabilitación posterior (Figuras 6 - 7 ) 12 , 14 .
Cuando se utilicen membranas reabsorbibles, es recomendable emplear membranas con entramado reticular, ya que han demostrado mantener mejor la morfología inicial durante el periodo inicial de curación del injerto onlay, en comparación con membranas sin dicha conformación de colágeno 13 .
La principal ventaja de esta técnica es que permite la corrección de defectos mixtos (anchura y altura) para la posterior rehabilitación con implantes dentales 12 , 14 . La hipoestesia temporal del nervio dentario o mentoniano son la principal desventaja asociada con la obtención del injerto onlay intraoral, siendo mayor la comorbilidad cuando se trata de regiones extraorales, así como mayor tiempo quirúrgico o la necesidad de anestesia general. El empleo de hueso autólogo limita la cantidad de hueso disponible, presenta una impredecible reabsorción y necesita para el desarrollo de la técnica de una alta habilidad quirúrgica. En la zona receptora la complicación de mayor prevalencia es la pérdida parcial o total del injerto por dehiscencia de la herida quirúrgica 14 , 17 .
BIOMATERIALES
Hueso Autólogo
El hueso autólogo ha sido aplicado como material para el aumento óseo con muy buenos resultados. Presenta las propiedades ideales del injerto, osteogénico, osteoconductor y osteoinductor; además de su rápida cicatrización, incomparable con ningún otro material, convirtiéndose en el “gold standard” para la cirugía ósea reconstructiva 18 . No obstante, posee varios inconvenientes, entre ellos una rápida revascularización y reabsorción del material, dificultando conseguir grandes aumentos de cresta o elevaciones del seno maxilar y obligando a una rápida inserción del implante para prevenir la resorción. Otras limitaciones a añadir son la morbilidad y las complicaciones relacionadas con el sitio donante, tales infección, sangrado, dolor, edema y daño a nervios y vasos sanguíneos; así como la limitada disponibilidad del injerto, no permitiendo obtener cantidad ilimitadas de material 19 - 20 .
En un primer momento, el injerto de hueso autólogo sufre una necrosis parcial, y posteriormente va reabsorbiéndose, a la vez que actúa de soporte para la neoformación de hueso. Su manipulación rápida y fijación en el lecho permitirá la supervivencia celular y la revitalización del injerto en su nueva localización 21 . La supervivencia de los osteocitos está determinada por la proximidad del suministro vascular; no pudiendo sobrevivir si se encuentran alejados más de 200 µm de un vaso sanguíneo 22 .
Los injertos autógenos pueden contener hueso cortical, esponjoso o cortico-esponjoso y presentarse bien en forma de bloque 23 - 24 . Los injertos corticales presentan menor cantidad de células osteogénicas, por lo que podrían no ser capaces de mantener la viabilidad celular; en cambio, los esponjosos presentan en principio una mayor supervivencia debido a la mayor difusión de nutrientes y grado de revascularización desde el lecho receptor 25 . La curación del injerto autólogo implica tanto la osteoconducción, donde el nuevo hueso se forma alrededor del injerto a medida que éste se va reabsorbiendo, como la osteoinducción, donde las proteínas presentes en el hueso son capaces de estimular a osteoblastos o a sus células precursoras para la neoformación ósea 25 .
Otro aspecto importante, es el origen embriológico del injerto, ya que se sugiere que la tasa de reabsorción del injerto depende de su origen embriológico, los de origen membranoso (injerto de calota o mandíbula) no se reabsorben tanto como los de origen endocondral (injertos de cresta ilíaca). Los injertos óseos esponjosos se reabsorben más rápidamente que los injertos corticales, lo que indica que la reabsorción depende principalmente de la estructura y microarquitectura del injerto 25 - 27 .
Desde un punto de vista clínico, los injertos en bloque presentan una mayor dificultad de adaptación a la zona receptora; por lo que comúnmente se combina con particulado para relleno de defectos y así evitar espacios vacíos y disminuir el riesgo de invasión de tejido blando a la región regenerada 3 , 19 .
Aloinjertos
Las complicaciones asociadas con la obtención de injertos autólogos, especialmente los extraorales; así como, la limitada disponibilidad en algunos pacientes explica la necesidad de emplear sustitutos óseos para minimizar estas complicaciones y restricciones 19 .
Los aloinjertos provienen de tejido óseo de individuos de la misma especie; presentan propiedades osteoconductoras, que estimulan la formación de hueso. Ejemplos son el hueso fresco-congelado, el hueso deshidratado congela y hueso desmineralizado liofilizado 28 .
Los bancos de hueso posibilitan disponer de una cantidad ilimitada de hueso y sin la morbilidad de su extracción. Inevitablemente, se plantea el riesgo de transmisión de enfermedades para los receptores de los aloinjertos, por lo que el reto de mantener los injertos seguros resulta esencial y una premisa fundamental, consiste en contar con un adecuado y fiable banco de huesos y tejidos 29 - 30 .
Los aloinjertos presentan una serie de ventajas frente al autólogo, evitan la morbilidad del sitio donante y el compromiso de tejidos sanos del huésped; disponibilidad inmediata, posibilidad de obtener tamaños, formas y cantidad apropiada, y almacenamiento durante largos periodos de tiempo. Sin embargo, no se debe olvidar sus inconvenientes, como la transmisión potencial de enfermedad y respuesta antigénica 28 .
Xenoinjertos
El xenoinjerto es un sustituto óseo procedente de especies distintas al receptor, bien de animales o minerales semejantes al hueso, derivados de corales o algas 18 . Son biocompatibles y presentan propiedades osteoconductoras, soportando el crecimiento vascular, la migración y diferenciación celular y la consecuente formación de hueso siempre en un medio osteogénico propicio. Con el tiempo se observa que los espacios interparticulares se rellenan con hueso nuevo 31 .
Los xenoinjertos presentan una fácil disponibilidad y están íntegramente libres de peligro de transmisión de enfermedades, siempre y cuando se cumplan los protocolos de procesamiento de esterilización. Los xenoinjertos más empleados en la práctica diaria son, los derivados de hueso bovino, porcino y equino 31 - 33 .
El xenoinjerto más documentado clínica e histológicamente es el de origen bovino. Estudios previos demostraron la integración de implantes dentales en áreas regeneradas con este biomaterial; presentando una lenta reabsorción, al observarse partículas del biomaterial incluso hasta 3 años de la intervención quirúrgica 34 . Dentro de este grupo. el hueso bovino mineralizado es el que mayor soporte científico tiene en la literatura, ya que ha sido testado tanto in vitro como in vivo en un gran número de estudios 34 .
Con respecto a los del origen porcino, Nannmark & Sennerby 31 confirmaron las propiedades osteoconductoras de este material, y observaron cómo se fue reabsorbiendo y remodelando con la formación de osteonas en las proximidades a las partículas de xenoinjerto.
Recientemente, Scarano y cols. 33 rellenaron defectos óseos con diferentes xenoinjertos, que cubrieron con una membrana de colágeno, con el fin de evaluar el porcentaje (%) de relleno del defecto a los 4 meses de estudio. Se comparó el hueso particulado corticoesponjoso porcino con/sin gel de colágeno, con el bloque de hueso equino y con un grupo control (sólo membrana). El grupo de hueso particulado porcino sin colágeno presentó el mayor relleno del defecto, seguido del particulado con colágeno y posteriormente del bloque. No hubo diferencias significativas entre los tres grupos, exceptuando con el grupo control. Estos datos sugieren que estos biomateriales presentan una alta biocompatibilidad y son capaces de formar con mayor rapidez tejido óseo 33 . Si se compara el hueso cortico-esponjoso porcino colagenado con el porcino cortical, el primero presenta mejores propiedades en cuanto a que presenta una menor reducción volumétrica al cabo de 3 meses de estudio 33 .
Otro estudio reciente se comparó un biomaterial sintético (60% hidroxiapatita/40% fosfato tricálcico) con el porcino, y se observó que este último presentaba una mayor velocidad de reabsorción, al observarse un porcentaje menor de biomaterial residual. Así mismo presentó una mayor ganancia de nuevo hueso regenerado 35 .
La adición de colágeno en gel para prehidratar las partículas de hueso colagenado de origen porcino, proporciona un mejor presentación y mayor capacidad adhesiva del biomaterial facilitando su manejo clínico, sin influir en las propiedades osteoconductoras del material 31 - 33 .
El injerto de hueso esponjoso equino se introdujo recientemente en el mercado. En su fabricación se somete a un método que evita el recubrimiento cerámico de los cristales de hidroxiapatita, acelerando así la velocidad de reabsorción fisiológica; se degrada más rápidamente que las partículas de hueso bovino. Contienen colágeno, lo que hace que los bloques de este tipo de injertos sean más compactos y menos frágiles al manipularlos y adaptarlos a la zona receptora, disminuyendo en gran medida el riesgo de fractura sin necesidad de emplear para la fijación placas ni tornillos de osteosíntesis 36 .
El bloque de hueso equino para aumento de un sector posterior mandibular ha sido utilizado con la técnica inlay. En este sentido, se puede obtener una ganancia media de hueso en altura de 4,8 mm. En estos casos, la histología de las biopsias muestra un hueso nuevo en íntimo contacto con el biomaterial, sin signos de inflamación o reacción de cuerpo extraño 36 . Estos hallazgos ya fueron previamente observados en otro estudio, no apreciándose gaps ni tejido conectivo en la interfase hueso-biomaterial 37 .
Aloplásticos
Los sustitutos óseos aloplásticos son materiales de naturaleza inerte (no orgánica), sintéticos y al igual que los xenoinjertos osteoconductores. Existe una amplia variedad de materiales, biocerámicas y cristales bioactivos. Existen diferencias estructurales entre ellos, también en su composición y en sus propiedades mecánicas, así como biológicas 38 .
Los más comercializados son los cristales bioactivos, entre ellos el betafosfato tricálcico (β-TCP) y la hidroxiapatita (HA), ambos permiten la formación de nuevo tejido óseo permitiendo estabilizar el coágulo de sangre y dar soporte a la osteogénesis durante las primeras fases de la regeneración 39 . La mezcla de estos cristales bioactivos ha demostrado tener una bioactividad y osteoconductividad satisfactoria 40 .
Artzi y cols 41 demostraron que el ritmo de reabsorción es completamente diferente entre el hueso bovino y el β-TCP. Este último se fué reabsorbiéndose hasta su completa desaparición a los 4 años, mientras que en el hueso bovino, la fracción de partícula permaneció prácticamente invariable durante el tiempo de evaluación.
Los sustitutos aloplásticos han demostrado tener capacidad de atracción para las células gigantes multinucleadas en distintas etapas de remodelación del injerto. Se piensa que estas células son las responsables del proceso de degradación de estos sustitutos óseos, participando al unísono en la activación de factores de crecimiento vascular y liberación de enzimas inflamatorias, como las citoquinas 42 .