INTRODUCCIÓN
Los fibroblastos son células mesenquimatosas ubicuitarias mononucleadas, de forma alargada e involucradas en diferentes funciones vitales como la embriogénesis, la homeostasia y la reparación tisular. Se localizan mayoritariamente en tejidos conjuntivos blandos y participan en la síntesis de colágenos y glicoproteínas(1). En su estado fisiológico, los fibroblastos son células quiescentes sometidas a pocas señales, pero aunque no proliferan, son metabólicamente activas y capaces de sintetizar y degradar los diversos elementos de la matriz extracelular (MEC). Durante el periodo de quiescencia, los fibroblastos mantienen una interacción bidireccional con los elementos de la MEC y otras células vecinas a través de uniones ligando-receptor favoreciendo la homeostasis tisular(2).
En condiciones inflamatorias, los fibroblastos son capaces de modificar su fenotipo. Esta transformación fenotípica hace posible la proliferación, migración, remodelación de los elementos de la MEC y síntesis de citoquinas implicadas en la cicatrización(3). Aunque todas estas características son comunes a todos los fibroblastos, existe una variación fenotípica entre los fibroblastos de tejidos diferentes, conocida como heterogeneidad inter-tisular mientras que la variación de fenotipo al interior de un mismo tejido, se denominada heterogeneidad intra-tisular. La perturbación de las células fibroblásticas a lo largo de su morfogénesis o en el transcurso de su participación en los procesos de cicatrización, puede generar diversos procesos patológicos, entre ellos, la alteración de la interacción con las células inflamatorias, evento que da origen a procesos patológicos(4). Alteraciones en la reparación tisular puede dar lugar a una producción excesiva de tejido fibroso cicatricial, provocando una cicatriz hipertrófica o queloides. Así mismo, los fibroblastos, como cualquier otra célula del organismo, pueden ser objeto de una transformación maligna que desencadenaría en un proceso cancerígeno de tejido conjuntivo(5).
En la cavidad bucal, los fibroblastos gingivales (FGs) constituyen entre un 60-70% de las células del tejido conjuntivo gingival, es decir, un promedio de 200.106 células por cm3(6). Los FGs participan en el mantenimiento de la homeostasis del tejido conjuntivo, su cicatrización y en los proceso de respuesta y tolerancia inmunitaria(7). Con un perfil de expresión genético especifico, los FGs presentan aspectos fenotípicos y funcionales únicos que le permiten llevar a cabo la reparación y curación de heridas a un ritmo mayor en comparación con otros tejidos del organismo, incluso sin generar la formación de lesiones causada por el crecimiento exagerado de tejido cicatrizal. Esta característica es atribuible al rol del tejido vascular, que aporta los elementos nutritivos necesarios; las células epiteliales, que iniciada una lesión, migran para reconstruir el epitelio; la saliva, que favorece una humedad favorable en la cicatrización, además de contener los factores de crecimiento EGF, TGF-ß, FGF y, los iones, que favorecen las reacciones enzimáticas(8). In vivo, los FGs son células fusiformes constituida de un núcleo voluminoso, retículo endoplásmico y aparato de Golgi bien desarrollado junto a numerosas mitocondrias, vacuolas y vesículas. In vitro, a diferencia de su aspecto in vivo, los FGs presentan un número considerado de contactos intercelulares (uniones gap y uniones adherentes) con un citoesqueleto integrado por microfilamentos de actina y vimentina(8).
El potencial de cicatrización y/o regeneración de la encía humana ha permitido posicionar a los FGs como células claves en este proceso. En consecuencia, los FGs autólogos parecen ser un candidato en la terapia celular con miras en la reparación de otros tejidos. Sin embargo, la obtención de un crecimiento adecuado de los FGs mediante el cultivo celular, conservando su fenotipo y aspectos fisiológicos, requiere de condiciones estrictamente definidas y acorde a las características micro-ambientales en las que se encuentran estas células in vivo, respetando el pH, osmolaridad, temperatura y el oxígeno(9). Este micro-ambiente deberá ser proporcionado por las condiciones de cultivo celular. De una parte, el soporte del cultivo preverá las condiciones apropiadas por medio de su revestimiento, para la fijación de las células. Y de otro lado, el medio de cultivo, aprovisionará los nutrientes, sales, hormonas y factores de crecimiento a las células(9). De manera casi sistemática, los medios de cultivo celular son suplementados con Suero Fetal Bovino (SFB). El SFB es una mezcla compuesta de un variado número de factores como glucosa, proteínas, vitaminas, oligoelementos, hormonas y factores de crecimiento esenciales para el mantenimiento, crecimiento y proliferación de las células(10).
La utilización de SFB en los cultivos celulares es objeto de muchos debates, de una parte, por la existencia de una amplia variación en su composición, que permitiría la introducción de elementos que pueden ocasionar efectos inhibidores en el desarrollo y la diferenciación de las células, y por otro lado, la posibilidad de una contaminación biológica proveniente de la línea de producción del SFB, que representa un riesgo biológico importante en su utilización(11). Sin embargo, a pesar de la discusión y los riesgos biológicos que representa la utilización del SFB, este suplemento continua siendo utilizando de manera rutinaria en el cultivo de células dada su provisión de factores de crecimiento y en consecuencia, su rol en la proliferación y supervivencia de las células cultivadas(12).
Para comprender los mecanismos implicados en la regeneración de la encía, el desarrollo de un modelo in vitro a partir de los fibroblastos gingivales se hace necesario. Así, la comprensión de los aspectos fisiológicos de estas células requiere prioritariamente la caracterización de los elementos necesario para su cultivo, entre ellos, el SFB y su influencia en el desarrollo de los procesos fisiológicos de los FGs. El presente trabajo busca evaluar el efecto concentración-dependiente de la suplementación de SFB en el medio de cultivo sobre el comportamiento, crecimiento, proliferación y supervivencia de los fibroblastos gingivales humanos.
MATERIALES Y MéTODOS
Cultivo celular
Los fibroblastos gingivales fueron amplificados a partir de biopsias provenientes de donantes clínicamente sanos. La biopsia fue realizada en la zona de premolares superiores de paciente sometido a la extracción de dichos órganos dentales por razones ortodonticas. El tejido gingival recuperado fue lavado dos veces en una solución salina tamponada con fosfato (PBS 1X, Gibco™) suplementada con 1% de penicilina-estreptomicina (10,000 U/mL) (Gibco™). A continuación, el tejido gingival fue seccionado con un bisturí estéril en porciones de 1-2 mm3 y luego incluidos en cajas de Petri (Gosselin™) para su cultivo. El medio de cultivo utilizado estaba compuesto por DMEM (Dulbecco's modification of Eagle médium) (1X) con GlutaMAX™ (Gibco™), 20% de Suero Fetal Bovino-SFB (Gibco™), 1% de penicilina-estreptomicina (10,000 U/mL) (Gibco™), 0,5 de Anfotericina B (Gibco™) y 50 µm/mL de ácido ascórbico (Gibco™). La caja de Petri con el tejido y el medio de cultivo fueron incubados a 37°C en una atmosfera húmeda que contenía 5% de CO2, siendo posteriormente reemplazado dos veces por semana hasta la obtención de células a una confluencia de 70-80%.
Una vez obtenida la confluencia deseada, las células fueron disociadas de su soporte mediante Trysine EDTA (Gibco™) y cultivadas en frascos de 25 cm2 en tres medios de cultivo diferentes: Medio de cultivo 1 (DMEM + SFB 10%), compuesto de DMEM (1X) con GlutaMAX™ (Gibco™), 10% de Suero Fetal Bovino-SFB (Gibco™), 1% de penicilina-estreptomicina (10,000 U/mL) (Gibco™), 0,5 de Anfotericina B (Gibco™). Medio de cultivo 2 (DMEM + SFB 0.5%), constituido por los mismos elementos del medio de cultivo 1 pero con 0.5% de Suero Fetal Bovino-SFB (Gibco™). Medio de cultivo 3 (DMEM + SFB 0%), compuesto por los elementos descritos en el medio de cultivo 1 en ausencia de SFB. Cada pasaje celular correspondía alrededor de una semana de cultivo. Las células fueros tripsinisadas cuando las células se encontraban entre 80-90% de confluencia.
Análisis Morfológico
La forma de las células fue observada a lo largo del proceso de proliferación y en estado confluente mediante un microscopio de contraste de fases (Zeiss) equipado de una cámara fotográfica.
Proliferación
Con el fin de comparar la proliferación celular, posterior a ser tripsinisadas y contadas, 2000 células/pozo fueron cultivadas por triplicado en placas de 24 pozos en los medios de cultivo 1 (DMEM + SFB 10%), medio de cultivo 2 (DMEM + SFB 0.5%) y medio de cultivo 3 (DMEM + SFB 0%). La proliferación fue evaluada a 24, 48, 72 y 96 horas mediante el contaje de células gracias a la coloración fluorescente en azul del ADN de las células cultivadas mediante Hoechst 33342 (Thermo Fisher Scientific) y registradas mediante un microscopio de contraste de fases (Zeiss) equipado de una cámara fotográfica. El análisis fue llevado a cabo mediante el software ImageJ.
Inmunohistoquímica
A los 7 días de cultivo celular, las células destinadas a la detención inmunológica fueron fijadas mediante la utilización de una solución de PBS1X (Gibco™) que contenía 4% de paraformaldehído (Sigma-Aldrich®) durante 12 minutos. Con el fin de una mejor detención de las moléculas intracelulares, las células fueron permeabilizadas utilizando 0.5% de Triton X-100 (Sigma-Aldrich®), para evitar una eventual coloración no especifica, las células fueron incubadas durante 20 minutos en PBS1X que contenía 1% de BSA (Sigma-Aldrich®) / 1% de glicina (Sigma-Aldrich®) a temperatura ambiente. Posteriormente, las células fueron puestas en contacto con los anticuerpos primarios a 4°C durante toda la noche. Para la doble inmunofluorescencia, los anticuerpos primarios se incubaron conjuntamente. Pasado este tiempo, las células fueron colocadas en contacto con los anticuerpos secundarios apropiados durante 2h a temperatura ambiente. Los núcleos celulares fueron coloreados con DAPI (Life Technologies Corporation), seguido por el montaje de las células mediante la solución Immu-MountTM (Thermo Scientific).
Los anticuerpos primarios utilizados para la coloración inmunológica fueron: anti-Fibronectin sc-71113 (Santa Cruz Biotechnology, INC) (1/200), anti-Vimentin (Sigma-Aldrich®) 1/200. Los anticuerpos secundarios fueron Alexa Fluor 488 donkey anti-ratón (Life Technologies Corporation) -1/400 y Alexa Fluor 594 donkey anti-ratón (Life Technologies Corporation) -1/400, respectivamente. La coloración mediante la faloidina fue realizada después de la incubación del segundo anticuerpo, utilizando Alexa FluorTM 594 Phalloidin (Thermo Fisher Scientific) durante 15 minutos y siguiendo las recomendaciones del fabricante. Todas las coloraciones fueron observadas utilizando el microscopio confocal Zeiss LSM 710.
Análisis estadístico
Se debutó con los cálculos estadísticos descriptivos para identificar la dinámica de la variable respuesta (proliferación), luego se definió las hipótesis del diseño experimental y posteriormente se llevó a cabo un análisis factorial de varianza (ANOVA) con el fin de validar las hipótesis. Las diferencias entre los periodos de tiempo se llevó a cabo por medio de un análisis post Hoc (Prueba de Turkey). Finalmente, se comprobó la validez del modelo y resultados mediante la validación de supuestos teniendo en cuenta la homocedasticidad (prueba de Bartlett), independencia (test Durbin-watson) y normalidad de los residuos (prueba de Shapiro-Wilk). Los cálculos y graficas fueron obtenidos a través del software R Project versión 3.4. Los resultados fueron considerados como significativos con un valor de p<0,05.
RESULTADOS
La influencia sobre los fibroblastos gingivales en tres condiciones de cultivo celular con concentraciones de 0%, 0.5% y 10% de SFB fueron estudiadas en este trabajo. En todas las condiciones testadas, los fibroblastos sobrevivieron a lo largo de 7 días y, al ser observados microscópicamente, estas células mostraron un aspecto fusiforme, acompañado de un núcleo voluminoso durante la proliferación y/o confluencia. (Figura 1, A-I). En función de la concentración del suero fetal bovino, una variación en el número y confluencia de los fibroblastos gingivales fue constatada (Figura 2, A-I). En la condición de cultivo 1 (DMEM + SFB 10%), se pudo apreciar que los FGs alcanzaron una confluencia de aproximadamente 80% luego de 24 horas de ser cultivadas (Figura 2,A). Por su parte, en la condición de cultivo 2 (DMEM + SFB 0.5%), los FGs se vieron con una confluencia de alrededor 80% a los 3 días de cultivo (Figura 2, E) mientras que en la condición de cultivo 3 (DMEM + SFB 0%), los FGs alcanzaron una confluencia estimada de 50-60% a los 7 días después de ser cultivadas (Figura 2, I).

Figura 1 Microfotografías muestran marcaje de los núcleos en azul (Hoechst) de los fibroblastos gingivales después de ser cultivadas con SFB 10% (A,B,C), SFB 0,5% (D,E,F) y SFB 0% (G,H,I) a 24, 3d, y 7d. SFB: Suero Fetal Bovino. Barra blanca: 200 µm

Figura 2 Microfotografías muestran la migración de las células fibroblásticas de la encía después de ser cultivadas con SFB 10% (A,B,C), SFB 0,5% (D,E,F) y SFB 0% (G,H,I) a 24 horas, 3 y 7 días. DMEM: Dulbecco's modification of Eagle médium. SFB: Suero Fetal Bovino. Barra blanca: 1000 µm
Una cantidad no cuantificable de células flotantes fueron observadas especialmente durante la proliferación celular en la condición de cultivo 3 (DMEM + SFB 0%), pero estas células fueron desapareciendo con el paso de los días luego de los cambios respectivos del medio de cultivo (Figura 2. G,H,I).
Proliferación
En promedio la proliferación de los FGs cultivados a 24 horas en las concentraciones de SFB 0%, 0.5% y 10% fueron de 34.76, 45.89 y 53.96 respectivamente. Hubo un aumento progresivo constante en la proliferación de los FGs hasta alcanzar un promedio a las 96 h de 54.67, 65.88 y 84.73 en las concentraciones de SFB 0%, 0.5% y 10%, respectivamente. El coeficiente de variación fue casi idéntico en todos los periodos de tiempo dentro de un rango de 22%-23%, indicando una dispersión baja y homogénea en los periodos mencionados (Figura 3A). La mediana de proliferación fueron similares al promedio de la proliferación de los FGs, confirmando la homogeneidad de los datos. La prueba de contraste de hipótesis permitió inferir que hubo diferencias estadísticamente significativas en al menos dos periodos de tiempo durante la proliferación de FGs. La prueba de Turkey identifico que hubo diferencia estadísticamente significativa en el periodo de proliferación celular comprendido entre 24 a 72h, 24 a 96h y 48 a 96h. Estos resultados son validados en la Figura 3B. La validación de supuestos permiten mencionar que existe la suficiente evidencia estadística para afirmar que el tiempo suele influir en la proliferación de los FGs.
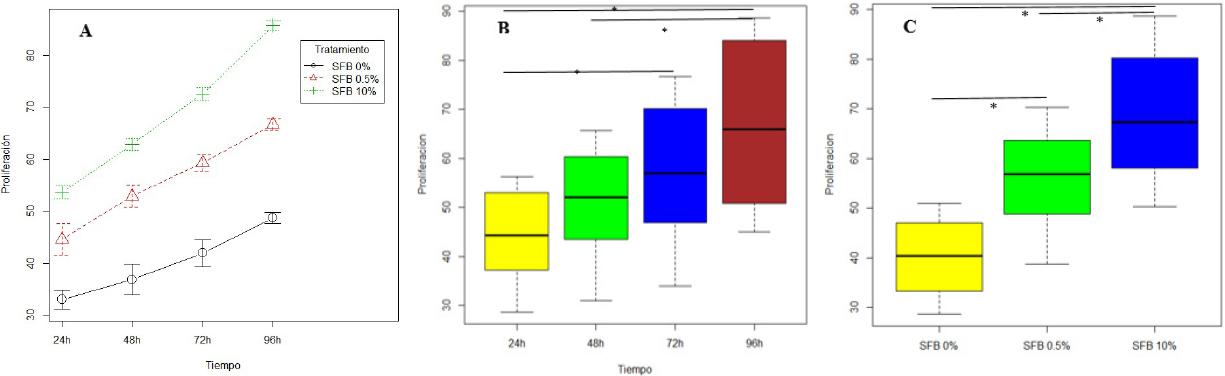
Figura 3 Proliferación celular de Fibroblastos gingivales. (A) Gráfico de medias de la proliferación de los fibroblastos gingivales con diferentes concentraciones de SFB a las 24,48,72 y 96 horas. (B) Diferencias estadísticamente significativa en la proliferación de fibroblastos gingivales entre 24 a 72h (p=0.02078); 24 a 96h (p=0.00004) y 48 a 96h (p=0.00637). (C) Diferencias estadísticamente significativa en la proliferación de fibroblastos gingivales cultivados a concentraciones entre SFB 0% a 0.5% (p=0.00001); SFB 0% a 10% (p=0.00000) y SFB 0.5% a 10% (p=0.00045). SFB: Suero Fetal Bovino. * p<0,05.
La concentración del SFB arrojaron en promedio diferentes niveles de penetración, sin embargo, la razón de cambio fue similar aun cuando el cambio de SFB 0% - SFB 0.5% no es igual de proporcional a una concentración de SFB 0,5% - SFB10%. Se cumplieron los supuestos del análisis de varianza (homocedasticidad, independencia y normalidad de los residuos del modelo). La ANOVA evidencia que la concentración de SFB influye significativamente en la proliferación de las células. La prueba Tukey evidenció que existieron diferencias estadísticamente significativas entre las concentraciones de SFB, confirmando que esta variable afecta la proliferación de FGs (Figura 3C). Sin embargo, la efectividad de la concentración del SFB 0,5% fue mucho más alta en relación a la concentración del SFB 10%, indicando que la efectividad en la proliferación de FGs estudiada no fue lineal.
Matriz extracelular y citoesqueleto
La unión, adhesión e incluso la migración celular son procesos realizados entre las diferentes moléculas de la MEC y las células que la componen. Después de 7 días, los fibroblastos gingivales cultivados a diferentes concentraciones de SFB mostraron mediante inmunohistoquímica la expresión de la fibronectina y la actina. La expresión de la fibronectina fue detectada, aunque con una notable variación en las diferentes condiciones de cultivo (Figura 4. A,B,C). Los FGs tratados con el cultivo 1 (DMEM + SFB 10%) demuestran una importante y compacta red de uniones en su MEC a través del inmunomarcaje de la fibronectina (coloración verde) (Figura 4. A) en comparación a la evidenciada en los FGs cultivados con el medio de cultivo 2 (DMEM + SFB 0.5%) (Figura 4.B) y el medios de cultivo 3 (DMEM + SFB 0%) (Figura 4.C). Los FGs expuestos con el medio de cultivo 3 (DMEM + SFB 0%) aunque registran cierta cantidad de núcleos marcados (en azul) exponen visiblemente una cantidad reducida de interacciones y por ende, mayor cantidad de espacio intercelular (Figura 4.C).

Figura 4 Microfotografías muestran proteína de la matriz extracelular y el citoesqueleto mediante inmunofluorescencia de fibroblastos gingivales a diferentes concentraciones de SFB. Inmunomarcaje de la fibronectina (A,B,C) y los filamentos de actina por medio de la faloidina (D,E,F) de fibroblastos gingivales a los 7 días de cultivo en SFB 10%, SFB 0,5% y SFB 0%. Los núcleos fueron coloreados con DAPI (azul). DMEM: Dulbecco's modification of Eagle médium. SFB: Suero Fetal Bovino. Barra blanca: 200 µm.
Con el objetivo de constatar la estructura del citoesqueleto, el inmunomarcaje de la actina de los fibroblastos gingivales mediante la faloidina fue positiva e independiente de las diferentes condiciones de cultivos utilizadas en el presente estudio (Figura 4. D,E,F). No obstante, en el medio de cultivo 1 (DMEM + SFB 10%) (Figura 4.D), seguramente por la mayor cantidad de células presente, el marcaje de la faloidina mostró la existencia de una relación muy próxima entre los FGs, aspecto que no fue similar en los FGs cultivados con el medio de cultivo 2 (DMEM + SFB 0.5%) (Figura 4. E) y el medio de cultivo 3 (DMEM + SFB 0%) (Figura 4.F).
Mediante doble inmunofluorescencia, la monocapa de células gingivales cultivadas a diferentes concentraciones de SFB reflejaron la expresión de las proteínas: vimentina y fibronectina (Figura 5.A-I). De manera similar a los resultados hallados precedentemente, los fibroblastos gingivales en contacto con el medio de cultivo 1 (DMEM + SFB 10%) registraron una mayor red entre las moléculas de la MEC y las células, de acuerdo a lo identificado con la fibronectina y, una significativa apreciación de la vimentina, proteínas fibrosas que forman los filamentos intermedios del citoesqueleto (Figura 5.A,B,C). En las células cultivas con el medio 2 (DMEM + SFB 0.5%) (Figura 5, D,E,F) y el medio de cultivo 3 (DMEM + SFB 0%) (Figura 5, G,H,I) aunque fue evidente la expresión de la fibronectina y la vimentina, se evidenció una red menos compacta en comparación con los FGs cultivados con el medio de cultivo 1.
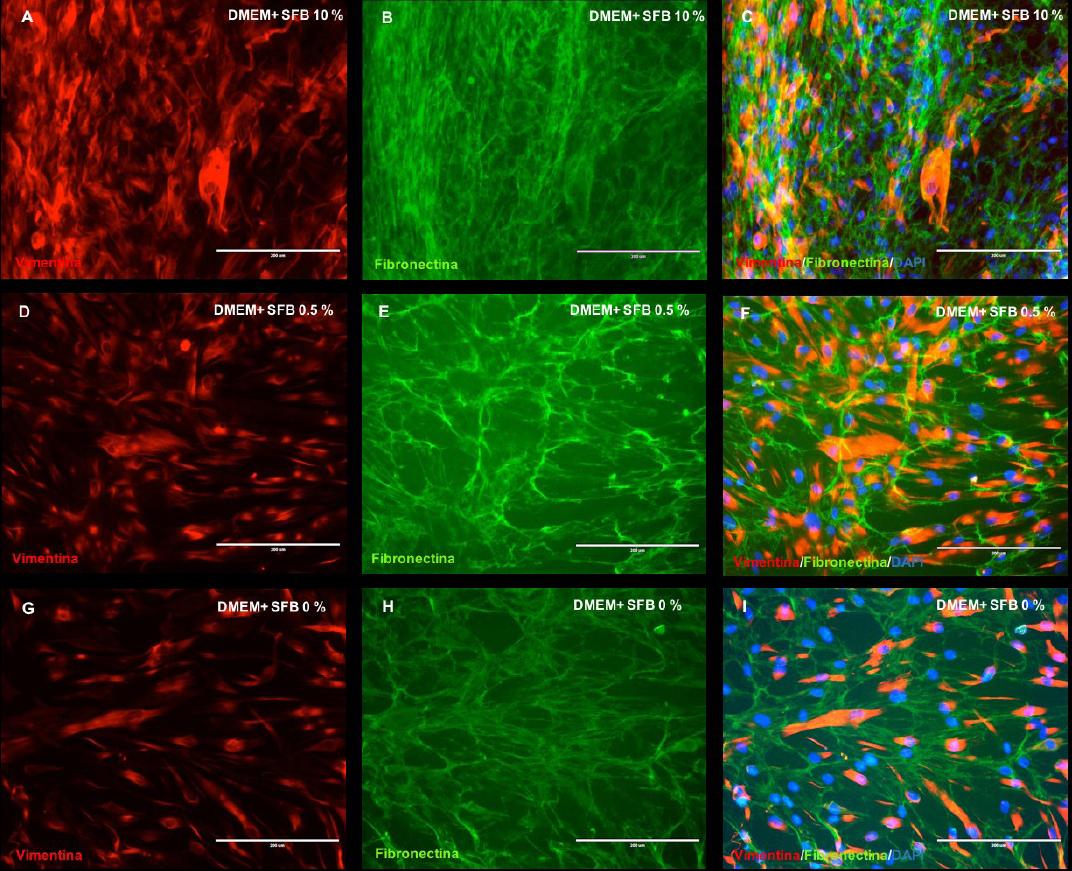
Figura 5 Análisis del citoesqueleto y matriz extracelular. Microfotografías muestran la expresión de la vimentina y la fibronectina fibroblastos gingivales a diferentes concentraciones de SFB. Inmunomarcaje de la vimentina, fibronectina y DAPI a 7 días de cultivo en: SFB 10% (A,B,C); SFB 0,5% (D,E,F); SFB 0% (G,H,I). DMEM: Dulbecco's modification of Eagle médium. SFB: Suero Fetal Bovino. Barra blanca: 200 µm.
DISCUSIÓN
Este estudio ha permitido mostrar in vitro la supervivencia, proliferación, comportamiento y organización en forma de monocapa de los FGs humanos cultivados a diferentes concentraciones de SFB. El suero fetal bovino contiene una variedad de factores de crecimiento, que inciden en la supervivencia, proliferación y diferenciación celular(13). La elección de una concentración diferencial de SFB nos faculta a decir que este componente es vital en los cultivos de células y tiene un influencia determinante en la vida, proliferación y ciertamente, en las funciones fisiológicas de los fibroblastos gingivales. En las tres condiciones testadas, hemos constatado que los FGs son capaces de continuar proliferando durante una semana y alcanzar su confluencia en tiempos diferentes. Constancia de ello y conservando una misma cantidad de células desde el inicio del cultivo en las tres concentraciones de SFB, los FGs cultivados con una concentración de 10% de SFB presentaron una adherencia y confluencia mucho más temprana en comparación la concentración de 0.5% y 0% de SFB. De hecho, en esta última concentración, los FGs, luego de una semana de cultivo, no presentaron una confluencia completa ni igual a la obtenida comparadas con células que fueron cultivadas a 0.5% y 10% de SFB.
El SFB, quien desempeña un rol esencial en el crecimiento de las células en cultivo, su metabolismo y estimulación de su proliferación, ha sido probablemente el responsable de la variación en la confluencia de las células fibroblásticas estudiadas en este trabajo. Intuimos que la ausencia de SFB en el medio de cultivo 3, seguramente fue un factor determinante en el ausencia de hormonas estimulantes en el crecimiento y proliferación de las células tales como: el factor de crecimiento epidérmico (EGF), factor de crecimiento derivado de plaquetas (PDGF), factor de crecimiento de fibroblastos (FGF), factores de crecimiento similares a la insulina I y II (IGF-I, IGF-II)(14). Probablemente la ausencia de SFB minimizara la presencia de factores de estabilización y de detoxificación que inhiben las proteasas como la Alfa 1-antitripsina o la Alfa-2 macroglobulina y otras moléculas toxicas, necesarios para el mantenimiento del pH celular. Otro aspecto que también pudo haber afectado el crecimiento de las células fibroblásticas en ausencia de SFB fue la disminución y/o ausencia del transporte de proteínas portadoras de las hormonas, minerales, elementos como la transferrina y el transporte de lípidos como las lipoproteínas(14).
Independientemente del porcentaje de confluencia que los FGs presentaron a lo largo de su cultivo a diferentes concentraciones de SFB, anatómicamente estos se distinguieron por presentar un núcleo ovalado, un aspecto fusiforme y dimensiones variables. De acuerdo a los resultados, los FGs cultivados con 10% de SFB alcanzaron un desarrollo morfológico más notorio y en menor tiempo comparados con los FGs cultivados a 0.5% y 0% de SFB. De hecho, los fibroblastos cultivados a 0% de SFB no llegaron a alcanzar el mismo desarrollo morfológico en comparación con los otros dos grupos de fibroblastos, incluso luego de 21 días de cultivo celular (resultados no mostrados). Probablemente, este aspecto fue la consecuencia de un número reducido de factores de crecimientos dada la ausencia del SFB, que dificultó la principal función de los fibroblastos como es la producción, organización, y remodelación de la MEC(3). En consecuencia, la alteración del buen funcionamiento de los fibroblastos impidió su comunicación con otros tipos de células por contacto directo, mediante la creación de una red de comunicación celular o incluso mediante la secreción y liberación de moléculas como factores de crecimiento y/o citoquinas en la MEC. Estos diferentes métodos de interacciones hacen posible que los fibroblastos contribuyan a la homeostasis tisular, es decir, les permite intervenir en el equilibrio cualitativo y cuantitativo de los componentes de la MEC necesarios para la funcionalidad tisular(2).
Con una representación cercana a un tercio de células del tejido conjuntivo gingival, los FGs sintetizan colágeno, glicoproteínas, glucosaminoglicanos entre otras proteínas, pero a diferencia de otras MEC, ciertos componentes puede ser cuantitativamente menos sintetizados(6). Nuestros resultados demuestran la presencia de la fibronectina, glicoproteína estructural cuya función es asegurar las uniones entre las moléculas de la MEC y las células, fue observada en todas las condiciones de cultivo utilizadas en este estudio. Sin embargo, una menor distribución de la fibronectina fue encontrada en las células fibroblásticas cultivas con 0% de SFB, revelando eventualmente la dificultad en la adhesión y migración de los FGs carentes de diversos factores de crecimiento cuyo efecto fue constatado con la observación de una cantidad no cuantificable de células flotantes los primeros días de cultivo. Aunque una de las principales moléculas secretadas por la MEC presenta una menor distribución entre los fibroblasto cultivados con 0% de SFB, un análisis de la expresión de ARN de la fibronectina pudiese ser necesaria en la determinación de una probable alteración de esta molecular en las tres condiciones de cultivo presentadas.
La visualización de la distribución de la actina (gracias a la faloidina) y de la vimentina, una proteína fibrosa que participa en la formación de los filamentos intermedios del citoesqueleto sirviendo de soporte para las organelas intracelulares, estuvieron presentes en los FGs cultivados y estudiados en nuestro trabajo. Si bien, la visualización de la actina y la vimentina fueron siempre más notorias en los fibroblastos gingivales tratados con 10% y 0.5% de SFB, su expresión también fue visualizada en la condición de cultivo con 0% de SFB. Una caracterización morfológica mediante microscopia electrónica a transmisión y de barrido podría revelar si existe diferencias significativas en la estructura de la MEC de los FGs, influenciados por la variación de la concentración de SFB. La existencia de una óptima organización de la MEC producida por los fibroblastos gingivales nos permitiría confirmar que los fibroblastos se encuentras fisiológicamente activos y capaces de responder de manera adecuada en un eventual proceso de cicatrización.
Gracias a este estudio, se ha constatado la importancia de SFB en la supervivencia y proliferación de los FGs humanos. Sin embargo, es necesario continuar explorando el impacto de diferentes condiciones de cultivo celular sobre las organelas citoplasmáticas de los FGs in vitro. Un mejor conocimiento de todos los aspectos fisiológicos celulares de los fibroblastos gingivales nos permitirá comprender los mecanismos implicados en el poder regenerativo de la encía y la probable utilización de estas células en la terapia celular, no solo a nivel de cavidad bucal sino como tratamiento de procesos patológicos sistémicos.
CONCLUSIÓN
Este estudio sugiere que los fibroblastos gingivales humanos presentan una mejor capacidad de supervivencia, desarrollo y proliferación cuando son cultivados en presencia de SFB. En efecto, un análisis exhaustivo de los componentes del medio de cultivo, así como la concentración y los componentes del SFB deben ser considerados en detalle con el fin de recrear un ambiente in vitro los más cercano posible a las condiciones in vivo en la que se hallan inmersas los FGs humanos.














