INTRODUCCIÓN
La rehabilitación oral mediante implantes dentales oseointegrados es una tècnica utilizada desde hace varias dècadas por profesionales de todo el mundo con tasas de èxito elevadas(1). Este hecho hace que sea una de las principales opciones de tratamiento con las que contamos a la hora de rehabilitar a pacientes parcial o totalmente edèntulos(2,3).
No obstante, si bien los implantes dentales tienen una larga durabilidad, pueden sufrir pèrdida de oseointegración por reabsorción ósea, que puede provocar el fracaso del implante. Desde su inicio se empezaron a observar las primeras pèrdidas de oseointegración y se ha estudiado en profundidad las diferentes variables que influyen en la pèrdida ósea con el fin de evitarla. Así, conocemos que las principales causas de la pèrdida del implante dental son la calidad ósea pobre de la zona quirúrgica, la periodontitis crónica, las enfermedades sistèmicas, el hábito tabáquico, edad avanzada, la localización del implante, los hábitos parafuncionales, la pèrdida de la integración del implante y la restauración con una prótesis inadecuada(4-6).
Es por lo anterior que uno de los retos más importantes hoy en día en el campo de la implantología oral, es prevenir la pèrdida ósea alrededor de los implantes oseointegrados y funcionales con el paso del tiempo. Desde hace unos años se sabe que los dos factores principales de la pèrdida ósea periimplantaria son la sobrecarga del implante y la proliferación bacteriana hacia el interior de la unión hueso-implante(7-10).
La enfermedad periimplantaria se inicia por un desequilibrio entre la carga bacteriana y las defensas del huèsped(11). La mucosa oral protege los tejidos periodontales frente a bacterias y otros estímulos dañinos, pero cuando se coloca un implante, esta barrera se rompe y se crea una discontinuidad, favoreciendo la penetración de bacterias por este margen. Además el epitelio oral tiene una capacidad inferior para sellar el implante que para sellar un diente natural(12).
Con el fin de intentar solucionar este problema se han diseñado diferentes tipos de implantes y pilares, así como modificaciones en la tècnica de su colocación, con el propósito de lograr que exista una mejor unión de los tejidos blandos al implante y minimizar la pèrdida ósea(13). Uno de los mètodos que se ha desarrollado con este objetivo es conseguir una superficie de implante que permite un correcto sellado perifèrico de los tejidos blandos en su zona cervical; de este modo, se forma una barrera fisiológica que evita el desarrollo de la enfermedad periimplantaria y su consecuente pèrdida ósea(14).
Para ello existe un tratamiento en la zona cervical del implante, que se crea mediante espiras similares a las existentes en el cuerpo del implante, pero con una separación entre ellas de menor tamaño, tambièn denominadas microespiras(15). En un trabajo en animales, se compararon implantes de cuello mecanizado con implantes con microespiras e implantes con cuello tratado mediante láser(16) (Fig. 1). Tras su estudio histológico se llegó a la conclusión de que en los implantes tratados con láser en su zona cervical y en los que tenían microespiras la integración del tejido conectivo era mejor, siendo algo superior en los implantes con microsurcos creados mediante láser.
La microtexturización mediante láser es una de las superficies que se ha desarrollado intensamente en los últimos años (Fig. 2), y que se utiliza tanto en implantes como en pilares implantológicos. Nuestro grupo publicó una revisión sistemática donde se evaluaron diferentes tipos de tratamiento de superficie en pilares implantológicos en lugar de en implantes(17), que tuviesen repercusión en el sellado biológico entre la encía y el pilar. Se encontró que el tratamiento de superficie basado en la creación de microsurcos mediante láser pueden aportar un beneficio en la unión del tejido conectivo al pilar(17).

Figura 2. Microcanales Laser-Lok®. Imagen de microscopía electrónica donde se observan los microcanales de 8 y 10 micras. (Imágen cedida por Biohorizons®).
Por otro lado, otros estudios centrados en la modificación de superficie de los implantes en lugar de los pilares, han demostrado la adhesión del tejido conectivo a las superficies tratadas con láser en la zona cervical de los implantes oseointegrados, consiguièndose de este modo un sellado biológico a este nivel(18-22).
En este contexto, Weiner et al.(18) estudiaron por primera vez en modelo animal el efecto que producía sobre el hueso, los cuellos microtexturizados con láser en implantes, así como en el tejido conectivo y en las cèlulas epiteliales circundantes. Llegaron a la conclusión de que este tratamiento estimulaba la adhesión ósea y del tejido blando, facilitando el desarrollo de un ancho biológico correcto. Por otro lado, Nevins et al.(19) analizaron muestras histológicas humanas, y demostraron la eficacia de los microsurcos creados mediante láser en los cuellos de los implantes, para conseguir una conexión directa del tejido conectivo al implante. De este modo se inhibe la migración apical del epitelio de unión. Pecora et al.(20) observaron radiográficamente una pèrdida ósea de 0,59 mm en implantes tratados con láser, mientras que en implantes control tuvieron una pèrdida ósea de 1,94 mm. Posteriormente, Shapoff et al.(21) observaron una pèrdida ósea mínima en 49 implantes con cuello tratados con láser de 0,44 mm a los 2 años y de 0,46 mm a los 3 años, demostrando un correcto sellado biológico entre las fibras de tejido conectivo y el implante. En este mismo tema, un estudio posterior de Botos et al.(22) demostró, que además de encontrar menor pèrdida ósea alrededor de implantes con cuellos tratados con láser, tambièn las profundidades de sondaje eran inferiores en estos implantes en comparación a implantes convencionales.
Tras estudiar estas evidencias en implantes, los autores publicamos un estudio clínico en humanos más reciente, donde evaluamos las diferencias histológicas entre los tejidos blandos alrededor de pilares lisos y pilares tratados con láser en su zona cervical(23). En el estudio encontramos diferencias estadísticamente significativas entre el porcentaje de unión existente entre el grupo de pilares tratados con láser y el grupo de pilares sin tratamiento; y llegamos a la conclusión principal de que el tejido conectivo tiene una mejor adhesión a los pilares tratados con láser en comparación a los pilares lisos. El nivel de adhesión de los tejidos blandos pudo comprobarse mediante la observación de muestras histológicas con microscopio óptico (Fig. 3).

Figura 3 a) Pilar con tratamiento láser. b) Pilar de superficie lisa. Fotografías tomadas de las muestras histológicas del estudio clínico de Blázquez-Hinarejos et al. (23).
Toda esta bibliografía mencionada apoya la teoría de que el tratamiento láser, tanto en implantes como en los pilares, puede ayudar a una mejor inserción de los tejidos y por consiguiente a una menor pèrdida ósea en el tiempo. Clínicamente esta modificación de la superficie de la zona cervical del implante nos ayuda a prolongar el èxito de nuestras restauraciones a largo plazo.
Con el fin de mostrar el beneficio del tratamiento láser en la zona cervical de los implantes, presentamos un caso clínico donde puede evidenciarse el correcto sellado de los tejidos blandos, así como la ausencia de reabsorción ósea alrededor de este tipo de implantes.
CASO CLÍNICO
1.- Se trata de una paciente de 48 años que acude al servicio del Máster de Medicina, Cirurgia i implantología Oral de la Facultat d'Odontologia de la Universitat de Barcelona. La paciente tras un accidente de tráfico había sufrido la pèrdida del incisivo central superior derecho y como medida temporal era portadora de una prótesis provisional removible (Fig. 4). La paciente no padecía ninguna enfermedad sistèmica, no tomaba medicación de forma habitual y no presentaba ningún hábito tóxico.
2.- Se procede a realizar modelos de estudio para realizar el posterior encerado diagnóstico. Se solicita una ortopantomografía (Fig. 5A). Además se realiza un mapeo de 3 en 3 mm de la zona, previa anestesia infiltrativa, midiendo mediante sonda periodontal y compás el grosor gingival hasta el reborde alveolar tanto en palatino como en vestibular, así como el grosor óseo (Fig. 5B).
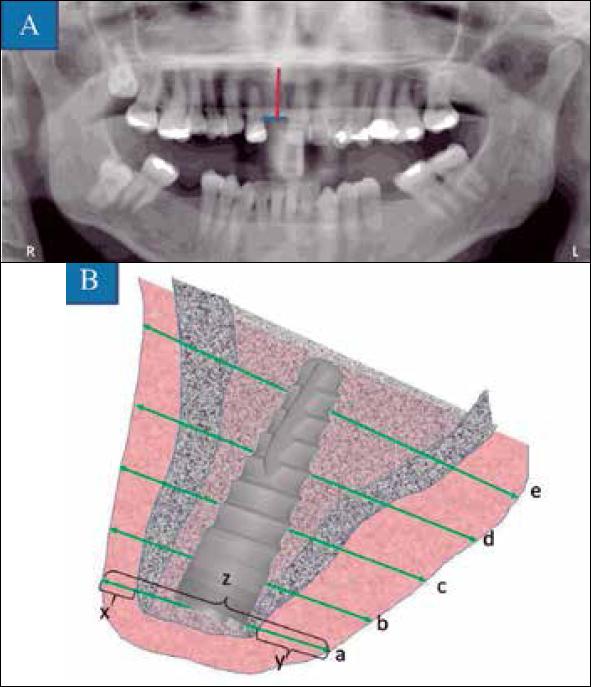
Figura 5 A) Ortopantomografía inicial. B) Simulación del alveolo mediante mapeo [cada 3 mm] con sonda y con compas. Mediciones realizadas desde a hasta e con 3 mm de distancia entre ellas. Nomenclatura = [x/z/y], donde x es grosor de encía vestibular; y: medición total y z: medición grosor de encía palatina. a = [2/14/3]; b= [2/15/5]; c = [2/15/6]; d = [3/20/8] y e = [5/25/9].
3.- Analizado el caso se decide realizar implante con carga y provisionalización diferida. Se utiliza un implante Biohorizons® tapered Laser-Lok® (Fig. 6).

Figura 6. Implante Biohorizons tapered internal Laser-Lok®. En el caso clínico se utilizó uno de 12mm de longitud y diámetro de 4,6 mm (Imagen cedida por Biohorizons®).
Es un implante de conexión interna, con cuerpo de forma cónica y en su zona cervical dispone de una zona tratada mediante láser, con el cual se crean unos microsurcos o microcanales Laser-Lok®. Estos microsurcos consisten en una serie de canales circunferenciales del tamaño celular, son extremadamente consistentes y tienen el tamaño óptimo para adherir y organizar tanto a los fibroblastos como a los osteoblastos. La microestructura Laser-Lok® tambièn incluye una nanoestructura repetitiva que maximiza el área de superficie y permite que los pseudópodos y las microfibrillas de colágeno se entrelacen con la superficie Laser-Lok®.
4.- Previo a la intervención quirúrgica de inserción del implante dental se prescribe a la paciente la cobertura antibiótica de 2g de amoxicilina 1 hora antes de la intervención y 750mg repartidos en 3 dosis diarias los 5 días posteriores(24). Como tratamiento coadyuvante domiciliario, se prescribieron enjuagues con solución de clorhexidina 0,12 % durante los 7 primeros días y al 0,05 los restantes 7 días y con una posología de 3 veces al día.
Se realiza una incisión sulcular discretamente palatinizada con una descarga a distal del 12, respetando la papila y un despegamiento de espesor total. El implante se inserta según el protocolo recomendado por la casa comercial y la sutura empleada fue de 6.0 (Monofilamento de polièter poliuretánico no absorbible, Normon®, Barcelona, España). Su diámetro reducido permitió reducir el acúmulo de placa alrededor de la herida quirúrgica.
5.- A los 14 días de la intervención quirúrgica se realizó una visita postoperatoria para la retirada de la sutura y el control de la herida (Fig. 7).
6.- Posteriormente se realizaron controles pasados 30 y 60 días desde la intervención quirúrgica. A los 90 días post inserción del implante se realizó otra visita de control, donde se obtuvo una ortopantomografía y se procedió a provisionalizar el implante (Fig. 8). De esta forma se pretende preservar al máximo y modelar en la medida de lo posible los tejidos blandos circundantes al implante. Para ello se confecciona una prótesis provisional atornillada mediante un pilar de PEEK (Polyetheretherketone).

Figura 8 a y b) Ortopantomografía de control e implante sin tapón de cierre; b y c) Confección de corona provisional mediante pilar PEEK; d y e) Control tras 30 días con prótesis provisional.
7.- Al mes y con el fin de reproducir la anatomía de los tejidos blandos lo más exacta posible se realiza la impresión del implante utilizando la corona provisional. Ya que se había obtenido un margen gingival correcto, se hace una copia en resina de este margen, reproduciendo la zona gingival de la corona provisional y trasladándolo en resina a un pilar de impresión (Fig. 9). Finalmente, una vez realizadas las diferentes pruebas se coloca una corona definitiva sobre el implante en posición 11, confeccionada en cerámica e.max Press de Ivoclar Vivadent®, Barcelona, España (Fig. 10).
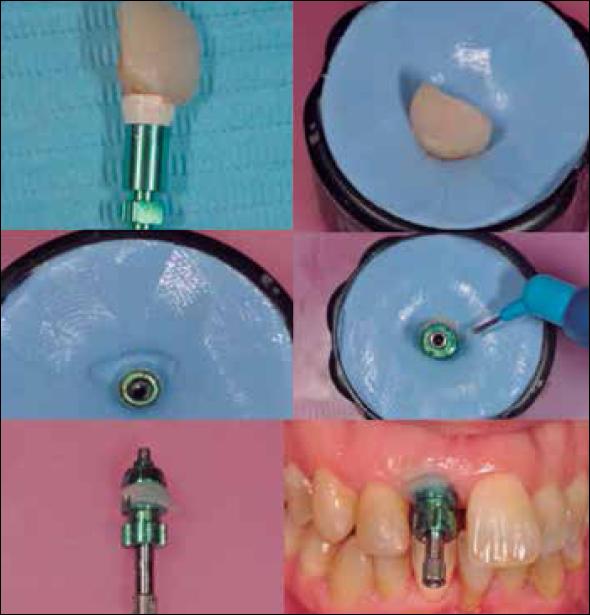
Figura 9. Pasos para obtener una impresión sobre el implante copiando los tejidos blandos mediante la corona provisional atornillada.

Figura 10. Colocación de la prótesis definitiva, en la que se observa la buena adaptación de los tejidos blandos.
8.- Seguimiento del caso. Una vez colocada la prótesis definitiva, la paciente sigue acudiendo al Hospital Odontológico a visitas de control semestrales durante los 2 primeros años. En estas visitas se realiza control radiográfico y pruebas de sondaje. No se evidencia ni inflamación ni sangrado al sondaje y la profundidad es de unos 2 mm en todo el contorno del margen gingival. Radiográficamente no se observa pèrdida ósea marginal alrededor del implante.
Una vez transcurridos estos 24 meses, la paciente no acude a las citas anuales y en un control a los 6 años de finalizado el caso (acude debido a otro problema en su cavidad oral), se constata la buena evolución y el mantenimiento correcto los tejidos blandos circundantes (Fig.11).
DISCUSIÓN
Este caso clínico nos permite mostrar la óptima respuesta de los tejidos blandos al tratamiento láser en la zona cervical del implante dental. Diferentes estudios clínicos en humanos(17,18) han comprobado los beneficios de los microsurcos creados con láser en los implantes dentales, ya sea mejorando la integración de los tejidos blandos como minimizando la pèrdida ósea tanto en sentido vertical como horizontal.
En un estudio in vitro(25) en el que se comparaba la morfología y la proliferación celular sobre superficies tratadas con láser, de titanio y de zirconio se demostró que la morfología celular observada mediante microscopía electrónica era sustancialmente diferente en las superficies tratadas con láser en comparación al resto de superficies. Los autores observaron que la mayor parte de las cèlulas epiteliales del grupo Laser-Lok® eran fusiformes y con procesos parecidos a pseudópodos y las cèlulas redondas se encontraban en una proporción menor. Por otro lado, en el tejido gingival circundante a los pilares de zirconio observaron mayoritariamente cèlulas redondas. En el grupo de pilares de titanio mecanizado observaron cèlulas redondas y fusiformes en la misma proporción, aunque las cèlulas fusiformes eran menos alargadas que en el grupo Laser-Lok®.
Los autores concluyeron que en cuanto a la viabilidad celular, el tejido gingival correspondiente a las superficies Laser-Lok® tuvo una mayor proliferación celular. Además, la cantidad de fibronectina existente fue significativamente superior en tejido gingival integrado a los pilares Laser-Lok® en comparación a los pilares de titanio lisos sin tratamiento de superficie.
Estos hallazgos revelan que la morfología celular es muy importante para determinar la afinidad de las cèlulas por una determinada superficie. De hecho, las cèlulas con morfología fusiforme más longitudinal pueden tener una mayor integración a las superficies, debido a sus pseudópodos citoplasmáticos en comparación a las cèlulas de componente más circular(25).
Nosotros publicamos un estudio clínico(17) en el que comparamos las diferencias histológicas en humanos entre los pilares sin tratamiento de superficie y los pilares con tratamiento láser, donde observamos y calculamos las diferencias de adhesión entre ambas superficies. Se observó que en los pilares con tratamiento láser frecuentemente se establecía un contacto óseo cercano en la superficie del pilar en su aspecto crestal.
El estudio cuantificó la cantidad de tejido conectivo subepitelial en contacto con la superficie del pilar y se observó que había una mayor integración del tejido conectivo a las superficies Laser-Lok® en comparación a los pilares sin tratamiento de superficie. Estos hallazgos suponen un beneficio clínico en cuanto al mantenimiento de los tejidos blandos a largo plazo.
CONCLUSIONES
El tratamiento mediante láser en la zona cervical de los implantes dentales puede ser una muy buena opción para preservar el sellado biológico de los tejidos. Al existir un firme sellado de los tejidos blandos se impide la proliferación bacteriana hacia la zona de contacto entre hueso e implante y este hecho se traduce en una menor pèrdida de hueso y en una tasa de èxito superior de este tipo de implantes a largo plazo.


















