INTRODUCCIÓN
En la actualidad, la rehabilitación estética y funcional con implantes, se ha convertido en una opción terapéutica eficaz y predecible ante ausencias dentales ocasionadas por agenesia (33% de los casos), avulsión traumática (20%), complicaciones endodónticas (15%), exodoncias programadas (11%), enfermedad periodontal (4%), caries (13%), o dientes impactados(1). Sin embargo, el establecimiento de una adecuada barrera de tejido blando alrededor del implante, es un prerrequisito para el éxito del mismo a largo plazo (2).
Para conseguir este buen sellado periimplantario de tejido blando, debemos comprender la diferencia entre la mucosa periodontoal y la mucosa periimplantaria. El tejido periodontal se origina principalmente del ectomesénquima y con la erupción dental constituye un tejido organizado alrededor del diente mediante la unión dento-gingival, el cemento radicular, el ligamento periodontal, y el hueso alveolar (3). Tras la pérdida de un diente, el tejido periodontal se modifica y cuando rehabilitamos con un implante dental, la mucosa pasa a unirse a una superficie de titanio y al material de restauración coronaria, convirtiéndose en la mucosa periimplantaria (4). Esta mucosa periimplantaria está formada por un epitelio plano estratificado queratinizado, el cual establece una unión con la superficie del implante mediante un delgado epitelio de unión (5). Inmediatamente por debajo del epitelio y lateral al epitelio de unión, encontramos un tejido conectivo ocupado por un gran volumen de colágeno, y con menos contenido en fibroblastos que en la mucosa periodontal (6). Además, el tejido conectivo de la mucosa periimplantaria, tiene una alta densidad de vasos sanguíneos (5).
En este sentido, debemos analizar el proceso de cicatrización del tejido blando periimplantario tras la cirugía, el cual dará lugar a una mucosa periimplantaria estable. Después de la cirugía, la cicatrización del tejido blando alrededor de la porción transmucosa de un implante, comienza con la formación de un coágulo sanguíneo y la inducción de un proceso inflamatorio dirigido a la formación y remodelación tisular (7-10). Si esa formación y remodelación tisular del tejido blando es la adecuada, el proceso de cicatrización dará lugar a una efectiva mucosa de unión alrededor de la porción tansmucosa del implante (2). Esta mucosa de unión periimplantaria, debe estar compuesta en su porción superior por 2 mm de epitelio y en su porción inferior por entre 1 y 1,5 mm de tejido conectivo, como ha quedado demostrado en numerosos modelos animales (4,11-15), y en biopsias obtenidas en humanos (16,17).
Para obtener esta adecuada mucosa periimplantaria, es importante que se produzca un proceso de cicatrización correcto. Este proceso incluye el reclutamiento de células inflamatorias y un proceso de angiogénesis (18-21); y si ambos procesos se desarrollan correctamente, todas las fases de la cicatrización mucosa (hemostasis, inflamación, proliferación, y remodelación de la matriz colágena) se producirán con éxito (22,23). Respecto al reclutamiento de células inflamatorias, entenderemos la respuesta inflamatoria en la mucosa oral, si comprendemos que, a diferencia de la piel (donde se producen cicatrices), la cicatrización de la mucosa oral se produce sin cicatrices, y por lo tanto la respuesta inflamatoria debe ser menor, para conseguir una correcta organización de las fibras de colágeno alrededor del implante, pilares, o restauración protética (24-26). En este sentido, debemos observar menor cantidad de células inflamatorias que en la piel, con una disminución en la producción de citoquinas. La menor producción de ILs (IL-8, IL-10, y sobre todo la IL-6) puede ser la responsable de una reducción en el reclutamiento de macrófagos y PMNs. La reducción de la respuesta celular inflamatoria, va unida a una menor expresión del TGF-β1, que es una citoquina pro-inflamatoria y pro-fibrótica, estrechamente relacionada con la formación de cicatrices hipertróficas (27). Finalmente, respecto a la angiogénesis, cuando se produce una herida, las células responden con un incremento en la producción de VEGF (28), que es el mediador más significativo en la angiogénesis de una herida. Su producción estimula el crecimiento capilar, que permite proporciona un adecuado aporte de nutrientes, oxígeno, y células inflamatorias; hasta tal punto que, durante la cicatrización de una herida, la densidad capilar llega a ser el doble que la de un tejido sano (29). Esta situación, causa un aumento en los niveles de oxígeno tisular; sin embargo, cuando se alcanza la normoxia, se producen señales que inhiben el período pro-angiogénico de la cicatrización, produciéndose una reducción capilar, que permitirá que la nueva mucosa periimplantaria tenga una densidad vascular normal (30). Por lo tanto, en el proceso de cicatrización de la mucosa oral, es importante que se produzca un aumento de la densidad vascular a muy corto plazo, pero que se inhiba parcialmente a las pocas semanas, para que se produzca una reepitelización normal del tejido periimplantario (31).
Por lo tanto, conseguir la formación de una adecuada mucosa periimplantaria que permita el rápido sellado biológico periimplantario, es crucial para el éxito del implante, fundamentalmente por la exposición a microorganismos (2). Por ello, la adhesión del epitelio y el tejido conectivo a la superficie de los pilares protéticos, es muy importante para la viabilidad de un implante dental (32). En este sentido, en los últimos años se ha modificado la morfología de los pilares protéticos, tanto a nivel del tamaño del cuerpo del pilar (33). Sin embargo, el diseño de pilares estrechos cuyo diámetro a nivel de la conexión es menor que el de la plataforma del implante (comúnmente conocidos como platform switching), parece ser el que mejor sellado mucoso proporcionaría al implante, al reducir el componente vertical del ancho biológico, y crear una mayor distancia horizontal (34).
Sin embargo, en la actualidad el desconocimiento de cómo la modificación del diseño de un pilar protético, con un cambio en el diámetro del cuello tipo platform switching (PS) con geomeetría axial cóncava tipo PS, puede influir en la formación de una adecuada mucosa periimplantaria; nos motivó a plantearnos los siguientes objetivos de estudio: 1. Comparar la respuesta inflamatoria de la mucosa periimplantaria localizada alrededor de pilares estéticos convencionales y los nuevos pilares slim; mediante el análisis de células T, células B, macrófagos, y PMNs; 2. Analizar y comparar la densidad vascular de la mucosa periimplantaria localizada alrededor de pilares estéticos convencionales y los nuevos pilares slim; 3. Estudiar y comparar el espesor epitelial y la orientación de las fibras de colágeno de la mucosa periimplantaria localizada alrededor de pilares estéticos convencionales y los nuevos pilares slim. 4. Determinar y comparar la presencia de tejido blando remanente y/o microorganismos en la superficie de pilares estéticos convencionales y los nuevos pilares slim.
MATERIAL Y MÉTODOS
La población de estudio está compuesta por un total de 30 pacientes a los que se colocaron 60 implantes dentales (estudio a boca partida). El tamaño muestral para obtener un tamaño de muestra representativo, fue calculado con una potencia del 80% y un nivel α del 5%. El estudio fue realizado tras la aprobación del Comité de Bioética (3598/2021) y el de Bioseguridad en Experimentación (437/2021) de la Universidad de Murcia.
Los criterios de inclusión fueron: ser mayor de edad, no ser desdentados completos, ausencias bilaterales de al menos dos dientes (uno por hemimaxilar) en zona posterior (del primer premolar a segundo molar) con o sin extremos libres a distal que no precisen técnicas regenerativas, que permitan la colocación de implantes IPX Galimplant® (Galimplant S.l., Sarria, España) de 4,5 o 5 mm de diámetro en zonas edéntulas con hueso maduro de al menos 3 meses de cicatrización y con espacio protético de al menos 8 mm. En caso de existir ausencias impares, se colocaron un pilar cóncavo tipo PS, siendo el grupo a testar siempre mayoritario. Los pacientes deben tener condiciones sistémicas favorables para la realización de procedimientos quirúrgicos bucales (ASA I/II). Además, deberán haber consentido su participación en el estudio mediante la firma del consentimiento informado habilitado a tal efecto.
Los criterios de exclusión fueron: presencia de alguna enfermedad, condición o medicación que pueda comprometer la cicatrización y/o la osteointegración de los implantes dentales (diabetes mellitus descontrolada, inmunosupresión, administración fármacos modificadores del hueso, presencia de algún desorden mental severo, y pacientes que hayan recibido radioterapia de cabeza y cuello durante los 18 meses previos. Asimismo, se excluyeron aquellos pacientes que no presentaban suficiente encía queratinizada periimplantaria para permitir al menos 1 mm de encía residual tras la exéresis del tejido a estudio. Se excluyeron las zonas edéntulas estéticas de 13-23, implantes con estabilidad primaria con ISQ < 50 o <40N, o con pilares que no puedan recibir torque a 30N.
Todos los procedimientos diagnósticos y terapéuticos son respaldados por las guías publicadas por el Consejo General de Dentistas http://www.consejodentistas.es/dentistas/practicas-y-recomendaciones-clinicas/exploracion.html. En base a lo anterior los pacientes fueron atendidos con arreglo a los protocolos clínicos de las Clínicas Odontológicas Universitarias que participan en el estudio, para la colocación de implantes dentales en hueso maduro, mediante anestesia loco-regional. En el mismo acto los pacientes recibieron dos implantes y dos pilares transepiteliales (control vs test) (Figura 1). A los 3 meses se extrajeron conjuntamente dichos pilares junto con una banda de tejido epitelioconectivo de 1.0-1.5mm circundante que fueron analizadas histológicamente e inmunohistoquímica, colocando unos nuevos pilares transepiteliales antirotacionales de plataforma 4.8 en todos los implantes para continuar con la fase de rehabilitación protésica sobre los mismos.

Figura 1. Radiografía panorámica extraoral donde se observan pilares transepiteliales con geometría cóncava o pilares Slim colocados en tercer cuadrante y pilares con geometría recta colocados cuarto cuadrante.
La valoración del seguimiento fue mediante preguntas al paciente al inicio del estudio (datos sociodemográficos y conductuales) así como exploración radiográfica preoperatorio, a los 3 meses y al año.
PROCEDIMIENTO QUIRÚRGICO
Un total de 60 implantes dentales Implantes de Conexión Interna Hexagonal (Modelo IPX), Galimplant® (Galimplant S.L., Sarria, Spain) fueron utilizados en este estudio multicéncrico, para la reposición de las ausencias dentales maxilares posteriores bilaterales de 30 pacientes (estudio a boca partida). Para la designación del tipo del pilar transepitelial que colocamos en cada hemimaxilar (derecho o izquierdo), usamos un servicio online de randomización (www.randomization.com). La cirugía se realizó bajo anestesia local (articaina con epinefrina 0,5%) y levantando un colgajo mucoperióstico. Tras la cirugía, a 30 pacientes le colocamos un pilar estético recto convencional de 3 mm de altura (grupo control), y a los otros 30 un pilar transepitelial cóncavo tipo PS de la misma altura (grupo test); en ningún caso colocamos el pilar de cierre transepitelial para conseguir el contacto de la mucosa periimplantaria con la superficie de los pilares transepiteliales. La colocación del implante se realizó siguiendo instrucciones del fabricante y la pericia del operador para conseguir la estabilidad con un torque de inserción de al menos 40 N, registrando el torque final con llave dinamométrica calibrada. El implante se colocó siempre que la disponibilidad ósea y gingival lo permitieron yuxtaóseo para evitar daños colaterales en la exéresis del tejido blando periimplantario perimetral. La colocación del pilar fue a 30 N como marca el fabricante.
OBTENCIÓN DE LAS MUESTRAS PARA EL ESTUDIO HISTOLÓGICO E INMUNOHISTOQUÍMICO
A los 3 meses se extrajeron conjuntamente dichos pilares junto con una banda de tejido epitelio conectivo de 1.0-1.5mm circundante que fueron analizadas histológica e inmunohistoquímica (Figuras 2 y 3), colocando unos nuevos pilares transepiteliales antirotacionales de plataforma 4.8 en todos los implantes para continuar con la fase de rehabilitación protésica sobre los mismos.
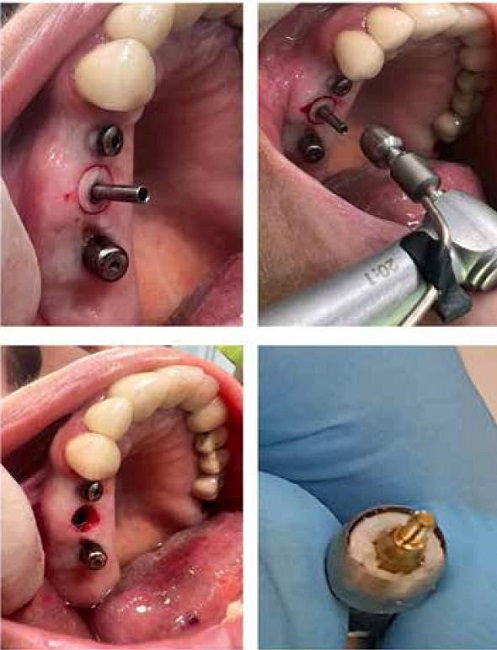
Figura 2. Biopsia del tejido periimplantario alrededor del pilar transepitelial con bisturí circular.
PREPARACIÓN DE LAS MUESTRAS
Todas las muestras de mucosa periimplantaria y los pilares obtenidos de manera multicéntrica, fueron fijadas en una solución de formaldehido al 10% y se trasladaron a la Universidad de Murcia para su estudio histológico e inmunohistoquímico. Tras la recepción de las muestras en la Universidad de Murcia, la mucosa periimplantaria fue incluida en parafina, para obtener cortes de 5 μm de espesor para su estudio histológico e inmunohistoquímico; mientras que la superficie de los pilares transepiteliales fue preparada para su análisis con microscopio electrónico de barrido (SEM).
ANÁLISIS HISTOLÓGICO E INMUNOHISTOQUÍMICO
Antes de proceder a la obtención de cortes de 5 μm de espesor, los discos de mucosa periimplantaria se dividieron en 6 porciones homogéneas usadas para analizar: porción 1 (células T), porción 2 (células B), porción 3 (macrófagos), porción 4 (PMNs), porción 5 (vasos sanguíneos), y porción 6 (espesor epitelial y la orientación de las fibras de colágeno). Para las porciones 1, 2, 3, 4, y 5 usamos los anticuerpos monoclonales CD3, CD20, CD68, Elastasa, y CD31 respectivamente (Figura 4).

Figura 4. Distribución del tejido periimplantario biopsiado para cada uno de los estudios histológicos e inmunohistoquímicos.
Las secciones 1-5 fueron desparafinadas e incubadas en una solución de recuperación antigénica a 60ºC. La solución antigénica retroviral DIVA (BIocaer medical, Condord, CA, EEUU), fue utilizada para teñir con CD31, mientras el buffer se usó para las tinciones con los Acs CD3, CD20, y CD68. Las secciones se incubaron con los anticuerpos primarios durante 30 minutos, y posteriormente se detectarán con EnVIsion + System-HPR, DAB (Dako-cytomation, Grlostrup, Dinamarca) contrarrestada con hematoxilina. En la porción 4, para la detección de elastasa usarmos Proteinasa K (Dakocytomation S3020), durante 6 minutos.
El análisis cuantitativo de la inmunoreactividad a los 5 Acs se calculó por el porcentaje de inmunopositividad. Realizaremos tres fotografías de cada una de las muestras a 10X (en áreas de 1200 x 800 μm). Las imágenes fueron analizadas usando el software de análisis de imagen (Leica Microsystems Ltd., Barcelona, España), por un investigador cegado. Finalmente, calculamos el porcentaje de inmunopositividad medio para cada una de las porciones.
Por último, para el estudio del espesor epitelial y la orientación de las fibras de colágeno, la porción 6 de mucosa periimplantaria fue desparafinada obteniendo dos secciones de 5 μm cada una. Para cuantificar el espesor epitelial de la mucosa periimplantaria, una de las secciones fue teñida con HE, y posteriormente usamos el software de análisis de imagen Image J versión 1.46 (U.S National Insitutes of Health, Bethesda, EEUU), calculando la media de 25 medidas de espesor por cada una de las muestras. La otra sección de 5 μm fue teñida con tricrómicro de Masson-Goldner, como tinción birrefringente para facilitar la precisión del estudio. Con esta tinción, se aumenta la intensidad de la luz para la visualización de las muestras con un microscopio de luz polarizada. Las fibras de colágeno alineadas transversalmente a la dirección de propagación de la luz (paralelas al plano de sección), aparecerán brillantes debido a un cambio en la refracción de la luz existente, mientras que las fibras de colágeno alineadas a lo largo del eje de propagación de la luz (perpendicular al plano de sección), aparecerán oscuras porque no se produce refracción. Cada muestra fue observada a 5X, 10X, y 20W, para que el campo de análisis se ubicara en el tercio coronal. La región de interés (ROI) fue poligonal y contenía todo el tejido conectivo supracrestal, cuyos límites fueron: medial (epitelio sulcular de unión que estaba en contacto con el pilar transepitelial), lateral (tejido conectivo perteneciente a la mucosa periimplantaria vestibular o lingual), coronal (mucosa periimplantaria coronal), y basal (la porción inferior de la mucosa periimplantaria, próxima a la cresta ósea).
Posteriormente, superpusimos sobre la imagen, una cuadrícula de 8 mm de largo x 8 mm de ancho con un total de 396 microáreas de 100 μm x 100 μm. La imagen fue entonces dividida en 3 tercios verticales (interna, media, y externa), y 3 tercios horizontales (coronal, media, y basal) de iguales dimensiones, obteniendo un total de 9 áreas de estudio: BI (basal interna), BM (basal media), BE (basal externa), MI (media interna), MM (media media), ME (media externa), CI (coronal interna), CM (coronal media), CE (coronal externa), Cada una de las 9 áreas de estudio (BI, BM, BE, MI, MM, ME, CI, CM, y CE) estaba formada a su vez por 44 microáreas, por lo que se estudiaron un total de 9 x 44 = 396 microáreas.
Finalmente, estudiamos en cada microárea la orientación de las fibras de colágeno en relación al eje axial del pilar transpetilelial, usando la herramienta de medición de ángulo del software de análisis de imagen Image J versión 1.46 (U.S National Insitutes of Health, Bethesda, EEUU). Registramos la angulación, tomando como referencia la posición de las fibras de la dirección coronal a la basal en el sentido de las agujas del reloj.
Cuando en una microárea, aparecían dos o más orientaciones de las fibras, seleccionamos la orientación más prevalente, con el objetivo de que de cada microárea se obtenga un único valor de orientación. Las fibras fueron consideradas: paralelas (de 0º a 22,5º o entre 157,5º y 180º), perpendiculares (entre 67,5º y 112,5º), oblicuas (entre 22,5º y 67,5º y entre 112,5º y 157,5º). La orientación de las fibras en cada área fue expresada en porcentaje, usando la siguiente fórmula: orientación de las fibras de colágeno en cada una de las 9 áreas = número de áreas con una angulación específica x 100/44.
ANÁLISIS CON SEM DE LOS PILARES TRANSEPITELIALES
Para el estudio de la presencia de tejido blando remanente y/o microorganismos en la superficie de los pilares transepiteliales, usarmos el SEM (Oxford Instruments INCA 300 EDX System, Abringdon, Oxfordshire, Reino Unido), y las imágenes fueron capturadas usando el software Semafore (Semafore, JEOL, Tokyo, Japón).
Cada pilar transepitelial, fue lavado dos veces con una solución tampón fosfato, deshidratados en soluciones alcohólicas ascendentes, y permaneciendo durante 24 horas en una cabina de flujo laminar para conseguir su secado evitando posibles contaminaciones. Usamos portamuestras de silicona para depositarlos en las pletinas, de forma que se permita una pulverización óptima de oro, en las cuatro caras de cada uno de los pilares.
Las imágenes fueron obtenidas a 15 KeV por recolección de electrones retrodispersos (RER), para obtener un contraste entre la superficie de titanio (número atómico alto y señal de RER elevada) y los restos biológicos (número atómico bajo y señal de RER reducida). Para cuantiar la presencia de tejido biológico remanente en los pilares, utilizamos dos ROIs cuadrados de 150 μm x 150 μm, y determinamos: la presencia de placa (la superficie del pilar colonizada por biofilm se observa en un color gris oscuro apariencia micro-agrietada), titanio (en un color gris claro), y tejido (células o tejido blando remanente adherido a la superficie de titanio en forma de mono o multicapa, y que se ve en un color de gris medio a gris oscuro).
PROTOCOLO DE CARGA PROTÉTICA
Posteriormente se procedió a la colocación de un nuevo pilar recto estético convencional con la colocación de tapa de cicatrización sobre el pilar. Se dejó este pilar un mes más (hasta los 3 meses) para permitir la cicatrización y completar la osteointegración. En este momento los pacientes recibieron la carga prostodóncica siguiendo protocolos estándares de rehabilitación metal-cerámica. La prótesis fue colocada atornillada, tomando las impresiones a los 3 meses y colocada antes de los 4 meses siguiendo la recomendación del fabricante. La prótesis fue atornillada, sobre el pilar colocado tras la exéresis del donut, atornillada a 25 N.
SEGUIMIENTO CLÍNICO Y RADIOLÓGICO
- Visita 1: Realización de historia clínica y pruebas diagnósticas complementarias.
- Visita 2: Cirugía. Se realizó la recogida de variables clínicas en el momento de la cirugía: índice de sangrado, profundidad de sondaje media global.
En el momento de colocar el implante:
Se realizó una radiografía periapical digital con técnica paralela: nivel óseo radiológico basal (pérdida ósea basal).
VARIABLES CLÍNICAS: ESTABILIDAD DEL PILAR (OSTELL).
Se evaluaron parámetros clínicos y radiológicos y se realizó la toma del tejido periimplantario y colocación del pilar slim nuevo
Se evaluarán parámetros clínicos y radiológicos y se realizará la toma de impresiones.
Evaluación ósea de pérdida ósea marginal (MBL) y clínica definitiva
RESULTADOS
Los resultados preliminares obtenidos indican que los pilares transepiteliales con gemoetría axial cóncava tipo PS o pilares slim producen menor inflamación, mayor revascularización, y un mejor sellado biológico periimplantario que los pilares transepitelieles con gemotría axial recta. Sin embargo, son necesarios futuros ensayos clínicos que avalen los resultados obtenidos con nuestro estudio.















