Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO  Similares en Google
Similares en Google
Compartir
Archivos de la Sociedad Española de Oftalmología
versión impresa ISSN 0365-6691
Arch Soc Esp Oftalmol vol.78 no.8 ago. 2003
ARTÍCULO ORIGINAL
OPTIMIZACIÓN DE UNA INTERVENCIÓN DE CIRUGÍA LASIK
INDIVIDUALIZADA. MODELO ÓPTICO DE TRAZADO
DE RAYOS
OPTIMIZATION OF AN INDIVIDUALIZED LASIK SURGERY.
GEOMETRIC RAY TRACING MODEL
ORTIZ D1, SAIZ JM2, GONZÁLEZ F2, VELARDE JI3,
FERNÁNDEZ DEL COTERO JN4, MORENO F2
| RESUMEN Objetivo: Desarrollar un método objetivo de cálculo que proporcione un plan quirúrgico personalizado para conseguir la emetropía y la máxima agudeza visual tras la intervención. Palabras clave: Agudeza visual, LASIK, trazado de rayos, ablación personalizada.
| SUMMARY Purpose: To develop an objective calculation method that is able to provide a customized surgical correction that allows the patient to reach the emmetropia and the maximum visual acuity after the surgery. Key words: Visual acuity, LASIK, ray tracing, customized ablation.
|
Recibido: 31/12/01. Aceptado: 19/8/03.
Universidad de Cantabria. Instituto Cántabro de Oftalmología. Clínica Cotero. Santander. España.
1 Licenciado en Ciencias Físicas.
2 Doctor en Ciencias Físicas.
3 Licenciado en Medicina.
4 Doctor en Medicina.
Comunicación presentada parcialmente en el LXXVII Congreso de la S.E.O. (Barcelona 2001).
Correspondencia:
Dolores Ortiz Márquez
Grupo de Óptica. Dpto. Física Aplicada
Facultad de Ciencias
C/. Avda. de los Castros, s/n
39005 Santander
España
INTRODUCCIÓN
La cirugía refractiva está adquiriendo una importancia creciente a partir de la de la generalización de la técnica laser in situ keratomileusis (LASIK) y su mejora con lo que se conoce como ablaciones personalizadas (1,2). El perfeccionamiento de las técnicas quirúrgicas y de los algoritmos desarrollados empíricamente (nomogramas) (3,4) lleva a resultados que permiten altas expectativas de éxito para los pacientes, tanto por prescindir de corrección tras la cirugía como por alcanzar una mejor calidad visual. Más recientemente, también se relaciona el tallado personalizado con los límites alcanzables en la calidad visual, o «supervisión» (5-7), entendida en términos de agudeza visuales superiores a la unidad y no cómo «visión de águila».
La tendencia actual es evitar en lo posible el uso de estos nomogramas empíricos, basados en la experiencia del cirujano, reduciendo el período de aprendizaje previo al uso de una determinada herramienta. Por tanto, se plantea la necesidad de encontrar métodos que lleven a obtener nomogramas objetivos e individualizados para cada caso.
Con la introducción de nuevas medidas oculares y los avances técnicos en las pruebas clínicas (topografía, paquimetría y biometría) la caracterización del ojo como sistema óptico será más precisa, y por tanto, los cálculos basados en la Óptica Geométrica irán ganando fiabilidad. Cada vez más estos cálculos pueden ser utilizados como herramientas a la hora de obtener estimaciones objetivas sobre ojos individuales.
Teniendo en cuenta un estudio previo (8) en el que se desarrollaba un modelo físico del sistema visual que permitía relacionar la agudeza visual con parámetros ópticos del sistema ocular como aumento lateral y tamaño de mancha imagen, se pretende desarrollar aquí un método objetivo de cálculo que proporciona para cada paciente un plan quirúrgico personalizado que le permita conseguir tanto la emetropía como la mejor agudeza visual tras la intervención. Para ello, se plantea responder a dos preguntas: ¿qué valores del aumento lateral y del tamaño de la mancha imagen proporcionan para cada ojo una agudeza visual máxima (entendiendo por máxima mayor que 1)? Y consiguientemente, ¿qué radio se debe tallar en la cara anterior de la córnea para obtener estos valores ideales de aumento y tamaño de mancha imagen?
SUJETOS, MATERIAL Y MÉTODOS
a) Pacientes y cirugía
Se estudiaron un total de 187 ojos miopes o con astigmatismo miópico compuesto operados mediante técnica LASIK. La edad media fue 32 D.S. 8 años (en un rango de 19 a 66 años). El equivalente esférico medio fue –6,1 D.S. 3.8 D (en un rango de –0,75 a –19 D).
Los controles establecidos fueron antes de la cirugía: agudeza visual sin corrección, agudeza visual con corrección sin y bajo cicloplejía. Después de la cirugía: agudeza visual sin corrección, agudeza visual con corrección bajo cicloplejía. Se tomaron como referencia el mejor de los resultados observados en cada caso, realizando las medidas en escala decimal a distancia de 5 metros.
La evaluación prequirúrgica consistió en un examen oftalmológico completo, que incluyó la topografía corneal, la paquimetría y la biometría.
La medida del espesor corneal central se realizó mediante un paquímetro Topcon SP-2000P (Topcon, Tokio, Japón), obteniéndose la media de tres medidas realizadas en el punto de fijación. Para estudiar la curvatura corneal se empleó el topógrafo Humphrey Atlas Eclipse 992 (Humphrey, Dublín, CA), con el que se obtuvieron los valores correspondientes al astigmatismo corneal y el radio central entre otros. En el caso de portadores de lentillas, se realizó después de un mínimo de 14 días sin usarlas en el caso de las blandas y de hasta 30 días en el caso de las duras, o hasta su normalización en el caso de presencia de moldeado corneal. La medida de las longitudes y espesores de los distintos medios oculares se realizó con un biómetro Ocuscan de la marca Alcon (Alcon, Ft. Worth, TX), tomando 10 medidas e imponiendo una desviación media entre ellas de 0,1 mm como máximo.
Todas las intervenciones LASIK fueron realizadas por el mismo cirujano usando un microqueratomo manual Moria LSK-one (Anthony, Francia). Se empleó el Láser Excimer Nidek EC-5000 (Gamagori, Japón), con un sofware versión 2.23 que utiliza una técnica de barrido y una frecuencia de repetición de 30Hz y una energía de 120 mJ. Posee un dispositivo ocular de seguimiento que permite la compensación de los movimientos oculares y el centrado.
El diámetro máximo de las zonas ópticas utilizadas estuvo en un rango que va desde 5 hasta 6 mm, y para las zonas de transición desde 6 hasta 7,5 mm.
Previamente a la cirugía (10 minutos antes) se instiló tetracaina tópica (Colircusí Anestésico 0,5%. Alcon Cusí S.A. El Masnou, Barcelona) al 0,5% cada 5 minutos. Los ojos fueron preparados con povidona yodada al 5% (Betadine).
En el postoperatorio, se incluyó diclofenaco tópico 4 veces al día durante 7 días y tobramicina (Tobrex, Alcon-Cusi, Barcelona, España) 4 veces al día durante 7 días, aconsejando uso de lágrima artificial de manera frecuente durante las 4 primeras semanas.
Las pruebas se realizaron antes de la intervención y 1 día, 1 semana y 1, 3, 6 y 12 meses después de la cirugía. En el estudio se utilizaron las medidas tomadas al mes de la intervención.
A la hora de valorar el resultado de las cirugías se consideró como intervención «satisfactoria», aquella cuyo equivalente esférico postquirúrgico esté comprendido en el rango (0, +0,5) D; mientras que se consideraron intervenciones «no-satisfactorias» las que no cumplen esta condición.
b) Cálculos
Tomando como base el modelo de ojo teórico completo de Le Grand (9) y a partir de todos los datos medidos directa o indirectamente en las diferentes pruebas clínicas, se determinaron los radios de curvatura de todas las superficies refractivas y los espesores de cada medio hasta llegar a la retina. De esta forma se realizó una caracterización completa de cada ojo. El radio posterior corneal se calculó a partir de la potencia total, el radio anterior y el espesor de la córnea, considerando la córnea como una lente gruesa con un índice de refracción n = 1,3771 y situada entre el aire (n = 1) y el humor acuoso (n = 1,3374). Los radios de curvatura del cristalino se determinan a partir de dos condiciones: i) los parámetros oculares de cada ojo y su corrección refractiva (una gafa a 12 mm de distancia al vértice) producirán una imagen situada en el plano retineano; y ii) un factor de forma predeterminado, Rcr1 / Rcr2 = –1,7, donde Rcr1 y Rcr2 son los radios de la primera y segunda superficie del cristalino respectivamente. Es importante comentar aquí que el comportamiento de todos los resultados mostrados en este trabajo es muy poco sensible a variaciones en la razón de aspecto escogida.
Para calcular el tamaño de la mancha imagen en la retina, cuyo diámetro denotaremos por d, se realiza un trazado de 9 rayos a lo largo de todas las superficies oculares hasta impactar en la retina. Se consideran rayos procedentes de un punto situado a 5 metros, que inciden a distintas alturas sobre el eje del ojo hasta un valor máximo marcado por el tamaño pupilar. Se han repetido los cálculos para tres diámetros pupilares: 2,5, 3,5 y 4,5 mm y para cada caso se toman rayos de distintas aperturas (altura respecto al eje). La distancia medida en la retina transversalmente al eje óptico del sistema es diferente para cada rayo trazado, de forma que se obtiene un «diagrama de impactos» sobre ésta [también conocido como círculo de confusión o point-spread function (10) (PSF)]. Por otro lado, el aumento lateral, β, se define como el cociente de tamaños entre imagen y objeto y se calcula como el cociente 1/PD, siendo P la potencia total del ojo y D la distancia a la que está situado el objeto, en este caso D = 5 m.
Una vez calculados β y d, se determina la agudeza visual, AV, del paciente teniendo en cuenta la relación ya encontrada en un estudio previo (8) y que expresada con los coeficientes ajustados en dicho trabajo es:
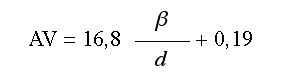
Mediante un programa informático desarrollado por nosotros mismos, se simula el efecto de la intervención LASIK sobre la córnea, para lo que se realiza una variación automatizada del radio corneal anterior y el espesor corneal en función de la zona óptica utilizada (11).
c) Estudio de la validez de nuestro método
A la hora de valorar la fiabilidad de nuestro método para predecir el resultado de una cirugía, se van a utilizar parámetros similares a los que se utilizan en las pruebas de diagnóstico de enfermedades. Se define como:
• Sensibilidad: probabilidad de que una prueba clasifique correctamente los «enfermos», que en este caso serían las intervenciones «no-satisfactorias».
• Especificidad: probabilidad de que una prueba clasifique correctamente una intervención satisfactoria («sanos»).
• Valor predictivo positivo: probabilidad de que una prueba de detectar los enfermos (intervenciones no-satisfactorias) cuando da un resultado positivo.
• Valor predictivo negativo: probabilidad que tiene una prueba de detectar sanos (intervenciones satisfactorias) cuando da un resultado negativo.
Como resultado global se obtiene la eficiencia total del método que sería la probabilidad que tiene una prueba de acertar en su predicción.
RESULTADOS
Para cada uno de los ojos analizados, se ha estudiado la variación de la agudeza visual sin corrección frente al radio corneal anterior para distintos diámetros pupilares (2,5, 3,5 y 4,5 mm; ver fig. 1). Se ha determinado el Intervalo Óptimo (IO), definido como el rango de radios corneales que proporcionan a cada uno de los ojos una agudeza visual mayor que 1. Como se puede observar en la figura 1, el IO es más amplio a medida que disminuye el diámetro pupilar. Se ha considerado para todos los casos un diámetro pupilar de 3,5 mm, por ser el valor estándar en las condiciones de medida en las que se trabaja (alta iluminación y contraste unidad).
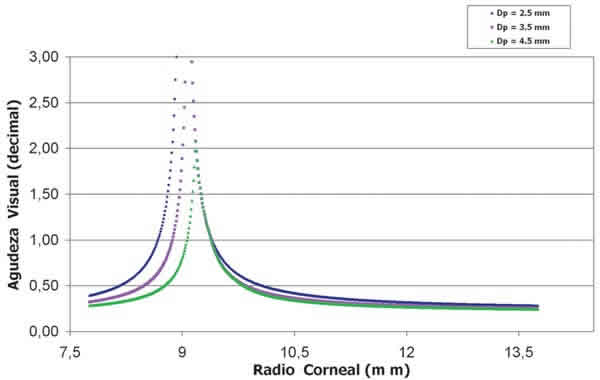
Fig. 1. Simulación del efecto de la intervención LASIK en la variación de la agudeza visual sin corrección
(en escala decimal) frente al radio corneal anterior para un tamaño pupilar de 2,5, 3,5 y 4,5 mm.
Con el fin de comprobar la fiabilidad del método que hemos elaborado, se ha realizado un estudio comparativo con resultados obtenidos mediante el uso de un nomograma convencional. Los radios corneales tallados sobre estos ojos se acercan en distinto grado a los valores de los intervalos óptimos que se han calculado para cada ojo. Si situamos el radio tallado medido al mes de la intervención junto al intervalo calculado, se pudo ver que siempre se sitúa dentro o en las inmediaciones del intervalo. Con el fin de estudiar el conjunto de las intervenciones, se agruparon estas posiciones relativas de los radios sobre un intervalo genérico, de forma que podemos construir histogramas sobre los que analizar la distribución de posiciones relativas al intervalo calculado. Para observar la eficiencia del cálculo, se agruparon en dos histogramas: uno correspondiente a intervenciones «satisfactorias» (fig. 2) y otro correspondiente a intervenciones «no-satisfactorias» (fig. 3). Una eficiencia absoluta del método supondría que el éxito de la intervención correspondería a un radio corneal posquirúrgico perteneciente al IO y el fracaso a un radio fuera del IO. Una falta de eficiencia supondría que ambos histogramas fueran iguales, lo cual haría irrelevante la posición en el IO.

Fig. 2. Histograma de la distribución en el intervalo óptimo de los radios corneales anteriores reales, medidos
al mes de la intervención para las intervenciones satisfactorias (120 ojos).

Fig. 3. Histograma de la distribución en el intervalo óptimo de los radios corneales anteriores reales, medidos
al mes de la intervención para las intervenciones no satisfactorias (47 ojos).
Sobre los resultados de las cirugía reales y su posición relativa en el IO, se ha realizado un estudio de validez obteniéndose los siguientes resultados:
i) 60% (112 ojos) de «satisfactoria» + radio corneal post-quirúrgico dentro del IO = Éxito predictivo. El paciente prescinde de corrección y presenta una agudeza visual máxima. Especifidad = 93,3%.
ii) 16,5% (31 ojos) de «no-satisfactoria» + radio corneal post-quirúrgico fuera del IO = Éxito predictivo. El paciente necesita corrección postoperatoria. Sensibilidad = 46,3%.
iii) 4% (8 ojos) de «satisfactoria» + radio corneal post-quirúrgico fuera del IO = Fracaso predictivo. Valor predictivo positivo = 79,5%.
iv) 19,5% (36 ojos) de «no-satisfactoria» + radio corneal post-quirúrgico dentro del IO = Fracaso predictivo. Valor predictivo negativo = 75,7%.
Los casos i) y ii) corresponden a un pronóstico acertado, sumando un 76,5% de eficiencia total de nuestro método.
Como ya se ha comentado, otro aspecto que proporciona nuestro modelo es el referido a la optimización de la agudeza visual de los pacientes tras la cirugía. Al comparar la agudeza visual postquirúrgica con corrección de aquellas intervenciones satisfactorias cuyo radio final pertenece al IO con la agudeza visual de aquella en las que el radio quedó fuera del IO (fig. 4), se observa que el 80% de los ojos correspondientes al primer grupo tienen una agudeza visual superior a 0,9 mientras que en el otro caso sólo hay un 60% dentro de este grupo.

Fig. 4. Comparación de la agudeza visual postoperatoria para las intervenciones óptimas (112 ojos) y
no-óptimas (8 ojos). Se representan los casos divididos en tres grupos de agudeza visual: i) menor de 0,4; ii)
entre 0,5-0,8 y iii) mayor de 0,8.
DISCUSIÓN
En este estudio se propone un método objetivo de cálculo para optimizar intervenciones LASIK. Para ello, se ha utilizado una estimación objetiva de la agudeza visual en términos del aumento lateral y el tamaño de la mancha imagen de un punto. Tomando un modelo de ojo teórico completo individualizado similar al de Le Grand y simulando la intervención mediante un programa informático de trazado de rayos, se ha determinado el radio óptimo de tallado corneal. Este radio es el que proporcionaría a cada ojo individual, no sólo el poder prescindir de corrección tras la cirugía, sino además alcanzar la mejor agudeza visual (5,6).
Se ha comprobado el método mediante una comparación retrospectiva sobre 187 ojos intervenidos con anterioridad. Dicha comparación nos permite estimar la eficacia del modelo en la predicción del resultado de una intervención en un 76,5%. Este resultado podemos considerarlo más que aceptable, si se tiene en cuenta la fuerte exigencia que implica la condición de intervención satisfactoria, las fuentes de error y los diversos factores no incluidos en el modelo [asfericidad corneal (12), variación del radio corneal posterior tras la cirugía (13,14), otras alteraciones concurrentes en cada caso, etc.]. Como fuentes de error se tienen: 1) diámetro pupilar fijo de 3,5 mm para todos los ojos, 2) imprecisión en las medidas, y 3) la dependencia entre agudeza visual, aumento y tamaño de mancha, usada como base del cálculo, tiene un coeficiente de regresión de 0,7 con los datos reales. A pesar de todo esto, y de la sencillez que hemos querido mantener en todos los elementos de este modelo, se deduce de la comparación que la utilización de nuestro método permitiría mejorar los resultados obtenidos por el cirujano en cuanto a intervenciones satisfactorias, cifrado en un 64,2% (120 ojos).
Como aplicación práctica del estudio, el método propuesto, actualmente implementado en un programa informático (15), puede proporcionar a los cirujanos un plan quirúrgico objetivo individual como punto de partida a corregir según su experiencia, de acuerdo con los factores y variables que concurran. Puede servir incluso para abandonar nomogramas empíricos, si el cirujano comprueba que se mejora la eficacia. Por último, merece la pena comentar que un estudio de trazado de rayos similar a éste que incluyese las topografías reales y criterios de medida sobre un mancha imagen irregular, sería enteramente análogo a los estudios realizados sobre frente de onda (aberrometría) (16-18).
AGRADECIMIENTOS
Los autores agradecen a: Enrique Vélez, Paula García-Antón, Jose I. Velarde y Luis de Valentín-Gamazo de la Clínica Cotero su colaboración en la realización de este trabajo.
BIBLIOGRAFÍA
1. Panagopoulou Si, Pallikaris IG. Wavefront customized ablation with the WASCA Asclepion workstation. J Refract Surg 2001; 17: S608-S612. [ Links ]
2. Knorz MC, Neuhann T. Treatment of myopia and myopic astigmatism by customized laser in situ keratomileusis based on corneal topography. Ophthalmology 2000; 11: 2072-2076. [ Links ]
3. Ditzen K, Handzel A, Pieger S. Laser in situ keratomileusis nomogram development. J Refract Surg 1999; 15: S197-S201. [ Links ]
4. Vinciguerra P, Epstein D, Azzolini M, Radice P, Sborgia M. Algorithm to correct hyperopic astigmatism with NIDEK EC-5000 excimer laser. J Refract Surg 1999; 15: S186-S187. [ Links ]
5. MacRae S. Supernormal vision, hypervision and customized corneal ablation. J Cataract Refract Surg 2000; 26:154-157. [ Links ]
6. Liang J, Williams DR, Miller DT. Supernormal vision and high-resolution retinal imaging through adaptative optics. J Opt Soc Am A 1997; 14: 2884-2892. [ Links ]
7. Zhu L, Bartsch DU, Freeman WR, Sun PC, Fainman Y. Modeling human eye aberrations and their compensation for high-resolution retinal imaging. Optom Vis Sci 1998; 75: 827-839. [ Links ]
8. Fernández del Cotero JN, Moreno F, Ortiz D, Vélez E, González F, Saiz JM et al. Geometric ray tracing analysis of visual acuity after laser in situ keratomileusis. J Refract Surg 2001; 17: 305-309. [ Links ]
9. Yves Le Grand. Óptica Fisiológica. 3.ª Ed. Madrid Amigos de las Escuelas de Óptica; 1991; Tomo I: 57-69. [ Links ]
10. Losada MA, Navarro R. Point spread function of the human eye obtained by a dual double pass method. Pure and Applied Optics 1998; 7: 7-13. [ Links ]
11. Schwiegerling J, Snyder RW. Custom photorefractive keratectomy ablations for the correction of spherical and cylindrical refractive error and higher-order aberration. J Opt Soc Am A 1998; 15: 2572-2579. [ Links ]
12. Lotmar W. Theoretical eye model with aspherics. J Opt Soc Am A 1971; 61: 1522-1529. [ Links ]
13. Wang Z, Chen J, Yang B. Posterior corneal surface topographic changes after laser in situ keratomileusis are related to residual corneal bed thickness. Ophthalmology 1999; 106: 406-409. [ Links ]
14. Naroo SA, Charman WN. Changes in posterior corneal curvature after photorefractive keratectomy. J Cataract Refract Surg 2000; 26: 872-878. [ Links ]
15. Programa de diseño de una intervención personalizada de cirugía refractiva (LASIK). Registro: M-3239/02. Fecha: 17/4/02. Hora: 12:22:10.
16. Moreno-Barriuso E, Lloves JM, Marcos S, Navarro R, Llorente L. Ocular aberrations before and after myopic corneal refractive surgery: LASIK-induced changes measured with laser ray tracing. Invest Ophthalmol Vis Sci 2001; 42: 1396-1403. [ Links ]
17. MacRae SM. Customized and low spherical aberration corneal ablation design. J Refract Surg 1999; 2: S246-S248. [ Links ]
18. Liang J, Williams DR. Aberrations and retinal image quality of the normal human eye. J Opt Soc Am A 1997; 14: 2873-2883. [ Links ]














