Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO  Similares en Google
Similares en Google
Compartir
Archivos de la Sociedad Española de Oftalmología
versión impresa ISSN 0365-6691
Arch Soc Esp Oftalmol vol.79 no.6 jun. 2004
ARTÍCULO ORIGINAL
ESTRÉS OXIDATIVO EN UN MODELO DE RETINOPATÍA
DIABÉTICA EXPERIMENTAL: TRATAMIENTO CON ANTIOXIDANTES
OXIDATIVE STRESS IN A MODEL FOR EXPERIMENTAL
DIABETIC RETINOPATHY: TREATMENT WITH ANTIOXIDANTS
MIRANDA M1, MURIACH M2, JOHNSEN S3, BOSCH-MORELL F1, ARAIZ J4, ROMÁ J5,
ROMERO FJ4
| RESUMEN Propósito: La retinopatía diabética es la primera causa de ceguera en países desarrollados, aunque lo mejor para prevenir las complicaciones es un adecuado control glucémico, este no siempre se puede conseguir. Por tanto, es necesario el uso de terapias coadyuvantes que ayuden a prevenir o retrasar la aparición de complicaciones propias de la diabetes. Se han estudiado los cambios bioquímicos y funcionales que ocurren en la retina de ratones diabéticos, y la capacidad del ebselen y la luteína, dos antioxidantes de corregir estos efectos, comparándolos con la terapia insulínica. Palabras clave: Diabetes, ratón, ebselen, luteína, estrés oxidativo, electrorretinograma, antioxidantes. | SUMMARY Purpose: Diabetic retinopathy is the primary cause of blindness in developed countries, and though strict glycemic control is desirable to prevent complications, this is not always achievable. Thus, adjunctive therapies are needed to help in preventing or delaying the onset of diabetic complications. We have studied the biochemical and functional changes in the retina of diabetic mice, and the ability of ebselen and lutein, two antioxidants, to reverse these effects, using as a comparison the effect of insulin therapy. Key words: Diabetes, mouse, ebselen, lutein, oxidative stress, electroretinogram, antioxidants.
|
Recibido: 6/11/03. Aceptado: 11/6/04.
Universidad Cardenal Herrera-CEU y Fundación Oftalmológica del Mediterráneo.
1 Doctora en Farmacia.
2 Licenciada en Ciencia y Tecnología de los Alimentos.
3 Licenciada en Biología.
4 Doctor en Medicina.
5 Doctor en Biología.
Proyecto subvencionado PM99-0177 Dirección General de la Enseñanza, 99/0568 Fondo de Investigación Sanitaria, PRUCHO2/22
(Universidad Cardenal Herrera-CEU). PI 0317/10 FIS.
Correspondencia:
Francisco Javier Romero Gómez
Universidad Cardenal Herrera-CEU
Avda. Seminario, s/n
46113 Moncada (Valencia)
España
INTRODUCCIÓN
La retinopatía diabética es la causa de ceguera más frecuente en países industrializados. Después de 20 años de diabetes, prácticamente todos los pacientes con diabetes tipo 1 y más del 60% de los pacientes con diabetes tipo 2 tienen algún grado de retinopatía (1).
Aunque los cambios vasculares que ocurren en la retinopatía diabética se conocen bien (2), se sabe mucho menos sobre los cambios bioquímicos y neurológicos. Se cree que la hiperglucemia crónica es el defecto subyacente, ya que hay relación entre control de la glucemia a largo plazo y desarrollo de la retinopatía diabética (3). Pero los diabéticos presentan otras anormalidades metabólicas que podrían tener importancia en el desarrollo de la retinopatía diabética, como una mayor producción de radicales libres.
Se define el estrés oxidativo como una situación de desequilibrio entre agentes oxidantes y antioxidantes en favor de los primeros (4). Hay datos que indican que en la diabetes el estrés oxidativo parece estar causado tanto por un aumento en la producción de radicales libres como por una disminución en los sistemas de defensa antioxidante (5). Los radicales libres son capaces de producir daño en distintos tejidos y contribuir al establecimiento de las complicaciones tardías de la diabetes. Se abre una nueva vía de tratamientos adyuvantes: el uso de antioxidantes para evitar estas complicaciones.
Algunos estudios demuestran el aumento de productos derivados de la acción de radicales libres, en suero u otros componentes sanguíneos en la diabetes (6). La GPx está disminuida en neuropatía diabética experimental en ratones tratados con aloxana 7-21 días después de la inducción de diabetes (7). El ácido lipoico se ha usado en el tratamiento de la neuropatía diabética tanto en modelos animales como humanos (8-9). Otros estudios demuestran que el tratamiento con vitamina E tiene efectos beneficiosos en la protección frente a complicaciones vasculares de pacientes diabéticos (10). Se ha sugerido (11) que uno de los factores de riesgo que explica la mayor tasa de enfermedad coronaria en pacientes diabéticos tipo 2 es el aumento en el estrés oxidativo.
Puesto que la importancia del estrés oxidativo en la neuropatía diabética ha sido puesta de manifiesto en nuestro laboratorio por la disminución de la actividad GPx en nervio ciático de ratones (7), nuestro propósito fue confirmar el papel del estrés oxidativo en la retinopatía diabética, mediante la determinación de productos de la peroxidación lipídica y ensayar el tratamiento con dos antioxidantes: Ebselén (PZ-51), un antioxidante sintético y Luteina, un antioxidante natural (fig. 1).

Fig. 1. Estructura química del ebselen y la luteína.
El ebselen es un compuesto selenoorgánico biológicamente activo con propiedades antiinflamatorias, y actividad inhibitoria cicloxigenasa y lipoxigenasa (12). Posee actividad GPx like y se ha documentado su efecto como «scavenger» de peroxinitritos (13). La luteína es un carotenoide que se encuentra en vegetales y frutas y comparte con el ebselen su capacidad de reaccionar con peroxinitrito (14). Se investiga el papel de este antioxidante en enfermedades como degeneración macular asociada a la edad, cataratas, enfermedades del corazón o cáncer.
MATERIALES Y MÉTODOS
Se usaron 42 ratones albino machos (6 por grupo), que fueron hechos diabéticos con una dosis de aloxana de 200 mg aloxana/kg peso (66 mg/ml en buffer citrato-fosfato 0,1 M, pH 4,5). Los animales fueron tratados conforme a las normas de ARVO. A los ratones control se les inyectó el mismo volumen de tampón. Se consideran diabéticos a los ratones cuyos niveles de glucemia son mayores que 16 mM, 4 días después del tratamiento con aloxana. Un grupo de ratones diabéticos fue tratado con insulina los días 4, 5 y 6. El tratamiento con luteina y ebselen (100 mg/kg) se administró por vía oral los tres últimos días del experimento. Los animales se mantuvieron en condiciones de luz/oscuridad (12/12 h) con alimento y agua «ad libitum» y se sacrificaron a los 7 días del inicio del experimento. Inmediatamente después del sacrificio se enuclearon ambos ojos y se extrajo el cristalino. Ambos ojos se homogenizaron en tampón fosfato potásico 0,2 M pH 7.
Para la determinación de la glucemia y hemoglobina glicosilada (HbA1c) se utilizaron dos test disponibles comercialmente de Boehringer Mannheim y Biosystems.
Determinación de proteínas. Según el procedimiento descrito por Lowry et al con las modificaciones de Peterson (15).
Medición del MDA. Se utilizó una modificación del método de Richard et al (16), empleando un equipo de cromatografía de alta resolución (Kontron Instruments).
Medición de la actividad GPx. Según el método de Lawrence et al (17).
Realización del ERG. Se realiza a ratones anestesiados con ketamina (100 mg/ kg peso) y azepromazina (2,5 mg/ kg peso), adaptados a la oscuridad. Se administra colirio anestésico y midriático. Se utilizó un electrodo activo de tipo lente corneal, un electrodo de referencia en la frente y un electrodo de masa en la cola del ratón. Los estímulos empleados son flashes con una duración máxima de 5 ms (average 4; range 100 intensidad 1 (0,06 x 22 lumen sec/ft2). Se coloca delante del flash blanco estándar un filtro de 2,5 unidades logarítmicas de densidad óptica. Entre los disparos de flash hay un intervalo de 2 segundos. La banda pasante del amplificador y preamplificador se establece en 3-50 Hz. Los registros se recogen en un equipo informático MacLab (Castle Hill, Australia).
Análisis estadístico. Los datos se expresan como media + desviación estándar. Se usó el análisis de la varianza (ANOVA) y la t-Student para datos no apareados.
RESULTADOS
En la tabla I se muestran los valores de peso, glucemia y HbA1c de los grupos de ratones objeto de estudio. Después de una semana de la inducción de diabetes, se observa un aumento significativo de los niveles de glucosa en sangre. Este aumento en la glucemia se corrige de forma significativa con el tratamiento con insulina, aunque los valores de glucemia en el grupo diabético tratado con insulina no se igualan totalmente a los del grupo control son valores menores a 16 mM, límite marcado para considerarlos diabéticos. La insulina también consigue disminuir el porcentaje de HbA1c en el grupo diabético. El tratamiento con ebselen o con luteína no afecta significativamente a los valores de glucemia plasmática o HbA1c tanto en animales control como diabéticos.
Los valores de MDA en suero (fig. 2) aumentan significativamente en los ratones diabéticos respecto al grupo control. La administración de insulina disminuyó estos valores igualándolos prácticamente a los valores control. El tratamiento con cualquiera de los dos antioxidantes también consigue disminuir el MDA sérico.
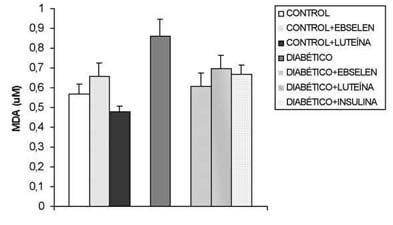
Fig. 2. Estudio de las concentraciones de MDA (µM) sérico (n=42)
en los distintos grupos de ratones. *: p<0,05 vs control, vs control+ebselen,
vs control+luteína; **: p<0,05 vs diabético, vs diabético+ebselen, vs diabético+luteína.
Los datos de actividad GPx en homogenado de ojo sin cristalino, de los que un 97% corresponde a la retina (18), se muestran en la figura 3. La actividad GPx está disminuida en retina de animales diabéticos. El tratamiento de los animales diabéticos con luteína o ebselen, aumentó la actividad GPx hasta igularla a los valores control. El tratamiento con insulina aumenta también la actividad GPx, pero en menor medida.

Fig. 3. Estudio de la actividad glutationperoxidasa (nmoles/mg prot x min) en homogenado
de ojo sin cristalino el día 7 después de la inducción de diabetes (n=40). *: p<0,01 vs control,
vs control+ebselen, vs control+luteína; **: p<0,01 vs diabético,
vs diabético+ebselen, vs diabético+luteína.
La figura 4 muestra el registro típico de un ERG de un ratón control y otro diabético. En la figura 5 se observa los valores medios de las amplitudes máximas del ERG. La amplitud del ERG en los animales diabéticos disminuye significativamente tan sólo siete días después de la inducción de la diabetes. Tanto el tratamiento con ebselen, luteína o insulina consiguen restaurar esta reducción en la amplitud del ERG.

Fig. 4. Ejemplo de un electrorretinograma en ratón control y otro de ratón diabético.

Fig. 5. Amplitud (media±desviación estándar) de la onda b del electrorretinograma
de los ratones en distintas condiciones experimentales el día séptimo del experimento.
*: p<0,01 vs control, control+ebselen, control+luteína;
**: p<0,05 vs diabético, diabético+ebselen, diabético+luteína.
DISCUSIÓN
Los cambios que observamos en el peso corporal, glucemia y porcentaje de HbA1c en ratones del grupo diabético son característicos de esta enfermedad. El tratamiento con insulina es capaz de corregir los valores de glucemia en los animales diabéticos, como previamente se había documentado (19). El tratamiento vía oral con ebselen o con luteína, usando aceite de oliva como vehículo, no afecta a la glucemia en estas condiciones experimentales. Los niveles de HbA1c no se recuperan totalmente con insulina y no se igualan a los valores control; pero, los valores de HbA1c pueden no disminuir durante 2-4 semanas después de la disminución de la glucosa sanguínea (20).
La Aloxana es una molécula muy reactiva que rápidamente se transforma en ácido dialúrico. Su acción tóxica es selectiva sobre las células b de los islotes de Langerhans del páncreas y produce mínima toxicidad en otros tejidos. La transformación de Aloxana en ácido dialúrico consume O2 y produce H2O2 (21). Se podría pensar que los cambios observados en los parámetros bioquímicos en este trabajo sean debidos al metabolismo de la Aloxana. Podemos afirmar que esta suposición no es cierta porque en cada serie de experimentos hay animales que habiendo recibido una dosis de Aloxana no desarrollan diabetes, y en ellos estos parámetros oxidativos son comparables a los del grupo control. Por otro lado, los cambios observados se corrigen con el tratamiento con insulina, hecho que confirma que la causa de estos trastornos es la propia diabetes.
En este trabajo se encontraron mayores concentraciones de MDA en el suero de animales diabéticos, tan sólo siete días después del inicio de la hiperglucemia. El aumento en las concentraciones de MDA sérico en la diabetes es un hecho bien contrastado en la bibliografía (22) y confirma la importancia de la peroxidación lipídica en la diabetes. Hay un consenso general (23), acerca de que las determinaciones de MDA por HPLC son marcadores efectivos de la implicación del estrés oxidativo en una condición patológica y son útiles para evaluar los efectos de tratamientos antioxidantes. Los datos aquí presentados concuerdan con otros que encuentran una normalización (24) de los niveles de MDA séricos después del adecuado control glucémico. El tratamiento con ebselen o con luteína también reduce los niveles de MDA en suero de los animales diabéticos hasta valores similares a los control, a pesar de la hiperglucemia.
La actividad GPx está disminuida en homogenado de ojo sin cristalino 7 días después del inicio de la diabetes. En nuestro laboratorio se había demostrado que la actividad GPx disminuye en la retina de rata en uveitis (25), en nervio ciático de rata con neuropatía alcohólica periférica (26) y en neuropatía diabética experimental (7). La disminución en la actividad GPx puede ser debida tanto a su degradación mediada por radicales libres como a los efectos inhibitorios de los productos de peroxidación lipídica generadas durante este proceso. Por otro lado, existen mayores evidencias de que la neurodegeneración retiniana es uno de los fenómenos tempranos de la diabetes (27). El cambio más dramático que se produce de manera precoz en la retina neurosensorial de ratas diabéticas es el aumento de la frecuencia de la apoptosis, sobre todo en células ganglionares. La apoptosis de células nerviosas se ha relacionado con la formación de peroxinitrito (28). Así, el uso de Ebselén, agente con actividad GPx-like y «scavenger» de peroxinitrito (29), o de luteína, otro «scavenger» de peroxinitrito parece lo más adecuado para el tratamiento de las alteraciones diabéticas en este trabajo. Se han demostrado cambios electroretinográficos en pacientes diabéticos sin lesiones vasculares y que estas anormalidades se originan en las capas ganglionares y capa nuclear interna (30). Otros autores demostraron el efecto beneficioso del bimoclomol en los signos precoces de retinopatía en el ERG de ratas diabéticas, y, se entiende como precoz uno o dos meses después del tratamiento de las ratas con estreptozotocina (31).
Considerando la capacidad de penetración del ebselén (25) y la luteína (32) a través de la barrera hematorretiniana, su baja toxicidad en animales y las limitaciones de la terapia hipoglucémica y el hecho de que un estricto control metabólico no es capaz de normalizar el ERG en pacientes diabéticos insulin-dependientes, los resultados presentados permiten proponer al ebselen o la luteína como tratamiento coadyuvante de elección en el tratamiento de pacientes diabéticos.
BIBLIOGRAFÍA
1. Aiello LP, Gardner TW, King GL, Blankenship G, Cavallerano JD, Ferris FL 3rd et al. Diabetic retinopathy. Diabetes Care 1998; 21: 143-156. [ Links ]
2. Cogan DG, Toussaint D, Kuwabara T. Retinal vascular patterns. IV. Diabetic retinopathy. Arch Ophthalmol 1961; 66: 366-378. [ Links ]
3. The effect of intensive diabetes treatment on the progression of diabetic retinopathy in insulin-dependent diabetes mellitus. The Diabetes Control and Complications Trial. Arch Ophthalmol 1995; 113: 36-51. [ Links ]
4. Sies H. Oxidative stress: introductory remarks. In: Sies H. Oxidative Stress Academic Press. London: Elsevier Science & Tecnology Books; 1985; 1-8. [ Links ]
5. Giugliano D, Ceriello A, Paolisso G. Diabetes mellitus, hypertension, and cardiovascular disease: which role for oxidative stress? Metabolism 1995; 44: 363-368. [ Links ]
6. Inouye M, Mio T, Sumino K. Glycated hemoglobin and lipid peroxidation in erythrocytes of diabetic patients. Metabolism 1999; 48: 205-209. [ Links ]
7. Hermenegildo C, Raya A, Roma J, Romero FJ. Decreased glutathione peroxidase activity in sciatic nerve of alloxan-induced diabetic mice and its correlation with blood glucose levels. Neurochem Res 1993; 18: 893-896. [ Links ]
8. Ziegler D, Gries FA. Alpha-lipoic acid in the treatment of diabetic peripheral and cardiac autonomic neuropathy. Diabetes 1997; 46: S62-S66. [ Links ]
9. Maritim AC, Sanders RA, Watkins JB 3rd. Effects of alpha-lipoic acid on biomarkers of oxidative stress in streptozotocin-induced diabetic rats. J Nutr Biochem 2003; 14: 288-294. [ Links ]
10. Karasu C, Ozansoy G, Bozkurt O, Erdogan D, Omeroglu S. Antioxidant and triglyceride-lowering effects of vitamin E associated with the prevention of abnormalities in the reactivity and morphology of aorta from streptozotocin-diabetic rats. Antioxidants in Diabetes-Induced Complications (ADIC) Study Group. Metabolism 1997; 46: 872-879. [ Links ]
11. Haffner SM. Clinical relevance of the oxidative stress concept. Metabolism 2000; 49: 30-34. [ Links ]
12. Wendel A, Tiegs G. A novel biologically active seleno-organic compound-VI. Protection by ebselen (PZ 51) against galactosamine/endotoxin-induced hepatitis in mice. Biochem Pharmacol 1986; 35: 2115-2118. [ Links ]
13. Sies H, Sharov VS, Klotz LO, Briviba K. Glutathione peroxidase protects against peroxynitrite-mediated oxidations. A new function for selenoproteins as peroxynitrite reductase. J Biol Chem 1997; 272: 27812-27817. [ Links ]
14. Panasenko OM, Sharov VS, Briviba K, Sies H. Interaction of peroxynitrite with carotenoids in human low density lipoproteins. Arch Biochem Biophys 2000; 373: 302-305. [ Links ]
15. Peterson GL. A simplification of the protein assay method of Lowry et al. which is more generally applicable. Anal Biochem 1977; 83: 346-356. [ Links ]
16. Richard MJ, Guiraud P, Meo J, Favier A. High-performance liquid chromatographic separation of malondialdehyde-thiobarbituric acid adduct in biological materials (plasma and human cells) using a commercially available reagent. J Chromatogr 1992; 577: 9-18. [ Links ]
17. Lawrence RA, Parkhill LK, Burk RF. Hepatic cytosolic non selenium-dependent glutathione peroxidase activity: its nature and the effect of selenium deficiency. J Nutr 1978; 108: 981-987. [ Links ]
18. Doly M, Droy-Lefaix MT, Braquet P. Oxidative stress in diabetic retina. EXS 1992; 62: 299-307. [ Links ]
19. Romero FJ, Martínez-Blasco A, Bosch-Morell F, Marin N, Trenor C, Roma J. Glycemic control and not protein kinase C inhibition prevents the early decrease of glutathione peroxidase activity in peripheral nerve of diabetic mice. J Peripher Nerv Syst 1999; 4: 231-235. [ Links ]
20. Wallach J. Interpretación Clínica de las Pruebas de Laboratorio. III Edición. Barcelona: Masson, S.A. 1998; 702. [ Links ]
21. Lenzen S, Munday R. Thiol-group reactivity, hidrophilicity and stability of alloxan, its reduction products and its N-methyl derivatives and a comparison with ninhydrin. Biochem Pharmacol 1991; 42: 1385-1391. [ Links ]
22. Hartnett ME, Stratton RD, Browne RW, Rosner BA, Lanham RJ, Armstrong D. Serum markers of oxidative stress and severity of diabetic retinopathy. Diabetes Care 2000; 23: 234-240. [ Links ]
23. Halliwell B. Oxidative stress markers in human disease: application to diabetes and to evaluation of the effects of antioxidants. In: Packer L, Rosen P, Tritschler HJ, King GL, Azzi A. Antioxidants in Diabetes Management. New York: Marcel Dekker INC; 2000; 33-52. [ Links ]
24. Sharma A, Kharb S, Chugh SN, Kakkar R, Singh GP. Evaluation of oxidative stress before and after control of glycemia and after vitamin E supplementation in diabetic patients. Metabolism 2000; 49: 160-162. [ Links ]
25. Bosch-Morell F, Roma J, Puertas FJ, Marin N, Diaz-Llopis M, Romero FJ. Efficacy of the antioxidant ebselen in experimental uveitis. Free Radic Biol Med 1999; 27: 388-391. [ Links ]
26. Bosch-Morell F, Martínez-Soriano F, Colell A, Fernandez-Checa JC, Romero FJ. Chronic ethanol feeding induces cellular antioxidants decrease and oxidative stress in rat peripheral nerves. Effect of S-adenosyl-L-methionine and N-acetyl-L-cysteine. Free Radic Biol Med 1998; 25: 365-368. [ Links ]
27. Barber AJ, Lieth E, Khin SA, Antonetti DA, Buchanan AG, Gardner TW. Neural apoptosis in the retina during experimental and human diabetes. Early onset and effect of insulin. J Clin Invest 1998; 102: 783-791. [ Links ]
28. Lieth E, Gardner TW, Barber AJ, Antonetti DA, Penn State Retina Research Group. Retinal neurodegeneration: early pathology in diabetes. Clin Exp Ophthalmol 2000; 28: 3-8. [ Links ]
29. Sies H. Ebselen. Methods Enzymol 1995; 252: 341-342. [ Links ]
30. Parisi V, Uccioli L, Monticone G, Parisi L, Manni G, Ippoliti D, et al. Electrophysiological assessment of visual function in IDDM patients. Electroencephalogr Clin Neurophysiol 1997; 104: 171-179. [ Links ]
31. Biro K, Jednakovits A, Kukorelli T, Hegedus E, Koranyi L. Bimoclomol (BRLP-42) ameliorates peripheral neuropathy in streptozotocin-induced diabetic rats. Brain Res Bull 1997; 44: 259-263. [ Links ]
32. Bone RA, Landrum JT, Guerra LH, Ruiz CA. Lutein and zeaxanthin dietary supplements raise macular pigment density and serum concentrations of these carotenoids in humans. J Nutr 2003; 133: 992-998. [ Links ]















